2024年1月1日
リンパ球の抗原に対する反応や、嗅覚細胞の臭い物質に対する反応は、それぞれの細胞が一種類の受容体を発現しているため、反応の特異性が保証される。この実現には複雑な分子メカニズムが必要になる。
熊本大学にいた頃に私たちが関わったB細胞で言うと、まずVDJ再構成により始まるmRNAを用いた他のV領域の染色体再構成が起こり、それ以上の再構成が起こらなくなる。これと同時に、翻訳された抗体分子を用いて増殖に必要な IL-7受容体の発現をoffにし、またRAG遺伝子をoffにすることで、一個の抗体分子が発現した細胞がそれ以上再構成を行えないようにしている。
一方嗅覚細胞では嗅覚受容体(OR)が同じ染色体に乗っているわけではないので、遺伝子再構成は使えない。そのため、一つのOR遺伝子のプロモーターだけに、エンハンサーがリクルートされるという離れ業が行われ、さらに一つの受容体が発現すると、他のOR遺伝子とエンハンサーのアクセスがOffになることがわかっている。ただ両方の染色体で2000個もあるOR遺伝子を相手に、本当にうまくいくのか、詳細は不明だ。
今日紹介するコロンビア大学からの論文は、一個のOR遺伝子発現までの過程を、single cell 解析や、様々な遺伝子改変マウスを用いて解析し、OR遺伝子同士の競争の中からランダムに一つのOR遺伝子が選ばれると、転写されたmRNAにより他のOR遺伝子のチャンスをOffにする過程を明らかにした、著者らの執念が伝わってくる、元旦に紹介するに値する素晴らしい研究で、12月20日 Nature にオンライン掲載された。タイトルは「RNA-mediated symmetry breaking enables singular olfactory receptor choice(RNAによる対称性の破綻が一つの嗅覚受容体選択を可能にする)」だ。
OR 遺伝子は両方の染色体で2000個もあり、発生過程で一つの遺伝子が選ばれる過程を調べるには single cell analysis が必須になる。この研究でも、核内での遺伝子同士の距離を調べるDip-CやHi-Cと呼ばれる技術を single cell に適用するという大変な実験を繰り返している。Single cell なので結果が yes or no とクリアに得られない技術的問題を、様々な方法を組みあわせて克服し、発生過程でOR遺伝子発現に関わる60個あまりのエンハンサーが核内でいくつかのクラスターを形成し、そのうちの一つがOR遺伝子にバイ・チャンスでリクルートされると、最終的に他のOR遺伝子とエンハンサークラスターの相互作用が抑制されることを確認する。これまでも指摘されてきたことだが、single cell level で証明するとするために、まさに圧巻の実験が行われている。
次に、OR遺伝子同士のエンハンサークラスターを巡っての競争に終止符を打つ要因として、まず成功したOR遺伝子由来mRNAが他のOR遺伝子のアクセスを抑制する可能性について、今度はマウスレベルの遺伝子改変を用いて証明している。
一つの方法は、一度勝利が決まったOR遺伝子の発現を、他のOR遺伝子mRNAを強く発現させることで抑制する実験を行い、特に完全に勝者の決定していない時期では、勝者を覆せることを、2色の蛍光色素をOR遺伝子に導入したマウスを用いて示している。
さらに、蛋白質の翻訳が出来ないように遺伝子改変したOR遺伝子を強く転写させると、蛋白質は出来なくても他のOR遺伝子とエンハンサークラスターの相互作用を抑えられることを示して、この抑制がmRNAにより行われることを明らかにしている。
面白いのは、こうして確立したOR遺伝子の勝利も、OR蛋白質の発現がないと長持ちしない点だ。メカニズムは明確ではないが、リンパ球と同じようにRNAと発現蛋白質の二重スイッチにより、一つの細胞、一つの受容体の原則を守っていることがわかる。
以上が結果で、ここまでやるかという研究に感心する。ただ、それでもまだ現象論で、最終メカニズムについてはまだ研究が必要だ。しかしこれほど細部にわたる研究を知ると、私の好きな建築家ミース・ファン・デア・ローエの、「細部に神は宿る」という言葉を実感する。そんなことで、年賀代わりに彼のベルリンある自宅の写真をペーストする。
2023年12月31日
今年も大晦日を迎えた。世界ではとどまることのない憎しみの応酬が続き、我が国では法を平気で破る無頼の輩の巣窟に成り下がった立法府が放置されたままの大晦日だが、生命科学の進展を振り返ると、昨日紹介した生成AIの波を始め、新しい年へと続く多くの興奮があった。これについては、21日 YouTube で今年の生命科学の一押しについて紹介しているので(https://www.youtube.com/watch?v=7MCKvmWCEgI )是非ご覧いただきたいが、大晦日の今日は、この時私の一押しとして紹介した論文を再掲しておく。
私の印象に残った進展は2つで、一つは5月8日に紹介した、頭の中で考えていることを非侵襲的に fMRI で解読することに成功したテキサス大学からの論文で、fMRI 一人16時間という大変な実験だが、漫画を見て頭に浮かんだ文章をかなりの正確さで解読できるところまで来たのは驚きだ。また、解読にChatGPTの原点であるGPT-1を用いている点も、実際の脳とAIを組みあわせる研究という新しい方向性を示している様に思えた。
もう一つの一押しが、新しい発想に基づくK-Ras阻害剤の開発だ。HPでは8月19日、スローンケッタリング研究所から発表された、K-Ras のポケットを化合物で塞ぐのではなく、イムノフィリンと呼ばれるシャペロン様蛋白質を K-Rasnと結合させて阻害する方法を紹介した。蛋白質同士の結合なので、変異に関わらず阻害でき、耐性がでにくい。
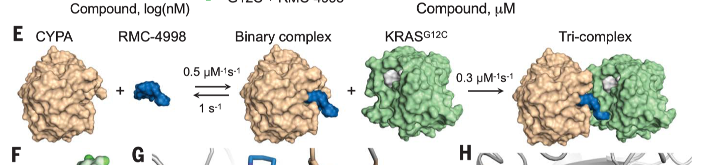
今日、これに加えて紹介したいのは我が国の中外製薬の研究所から10月号の米国化学会雑誌に発表された論文で、既に第一相の試験まで進んでいる、変異の種類を問わない K-Ras阻害剤の開発だ。このHPでは原則として我が国からの論文は他のメディアでも紹介されるからと、紹介してこなかったが、この研究は新しい発想の創薬である点、さらに開発までの過程が詳しく書かれている点、そして K-Ras にとどまらず、新しい阻害剤開発につながる点で素晴らしい論文で、遅まきながらではあるが大晦日の今日紹介することにした。
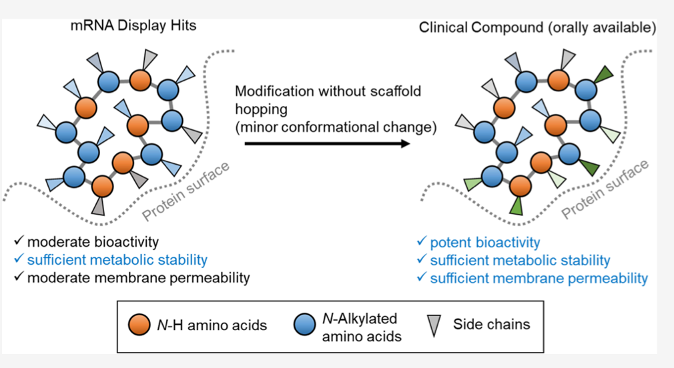
この研究は、真菌から分離された環状ペプチドでできた免疫抑制剤サイクロスポリンが、経口投与可能で、細胞内に到達して働くことにヒントを得て、環状ペプチドが薬剤として利用できる条件検討から始めている。これまでもペプチドを用いた創薬は行われてきたが、この研究の特徴はまず薬剤として使うための条件検討、すなわち創薬基盤の構築から始めている点で、感心する。
553ペプチドについてまず薬剤としての利用可能性を調べると、8−12アミノ酸からなるペプチドで、一定の脂肪への親和性を持ち、天然にはないN-アルキル化アミノ酸を備えた環状ペプチドであれば細胞内に到達すること、またこの条件を満たすペプチドの多くは経口投与可能で、血中濃度を維持できることを明らかにしている。詳細はすっ飛ばしているが、この辺の実験と記述は圧巻で、創薬への意志とは何かがよくわかる。役所の意向に忖度して枕詞のように創薬の可能性に触れている多くの申請書がいかに薄っぺらかが、この論文を読めばよくわかる。文科省、厚生省、AMEDのメンバーには是非一読を勧めたい。
さて、薬剤利用可能性の条件が整うと、今度は環状ペプチド合成のための様々な条件設定が待っているが、これも省略する。この結果、異なるmRNA配列に合わせて、様々な修飾アミノ酸がランダムに取り込まれ、薬剤利用可能な環状ペプチドを大規模に合成したライブラリーができる。そしてこの基盤が創薬に使えるか、最初の試金石としてこれまで創薬のチャレンジをはねのけてきた K-Ras を選んだのもさすがだ。
スクリーニングの結果 AP8784ヒット環状ペプチドを特定し、SOS結合部位に広く結合していることを確認している。その後、C末のアミノ酸のN-アルキルパターンを変化させて脂肪への親和性や K-Ras結合性がさらに高まるよう変化させ、ついにLUNA18という経口可能で、正常の K-Ras を含むほとんどの K-Ras変異を抑制し、移植ガンの増殖を完全に抑えることを確認している。実際、有効濃度が30pMというのは素晴らしい。
正常K-Ras も抑えるので、少し心配になるが、サルを含む様々な動物での投与実験の後、10月の時点で第1相の臨床治験に入っているという。
これまで論文上では Ras阻害剤研究で我が国の存在感はほとんどなかったが、一躍トップに躍り出た感じだ。しかも新しい発想で素晴らしい。素人ながら考えると、小分子化合物と異なり、環状ペプチドが”べたっ”とつくことで Ra sの可塑性を押さえ込んでいる様に思える。先に紹介したスローンケッタリング研究所の基盤と比べても遜色ない。是非第3相までスムースに進むことを願う。
このように、来年はK-Ras制御によるガン治療の本当の元年になることを祈って、年越しを過ごそうと思う。
2023年12月30日
今年は大規模言語モデル(LLM)の様々な分野へ導入した論文がトップジャーナルに溢れるようになる元年と言えるかも知れない。一般の方ににとってLLMは、ChatGPTのようなテキストを学習させたモデルを指すのだと思うが、元々ノンリニアーな情報を扱う生物学では、早くから様々な目的でLLMの導入が進んでいるが、最も普及しているのが蛋白質の構造予測もでるαフォールドだろう。
過去の経験は未来の予測に重要だが、これまでの予測はデータをなんとか法則に落とし込んで、その法則を未来に適用してきた。これに対しLLMでは、過去のデータを自然にコンテクスト化して、そこから最も確率の高い結果を導き出す。まさに生物情報に合致したモデルと言えるが、これと似ているのが気象現象だ。
今日紹介するGoogleの2つの研究所からの論文は、3700万パラメーターを持つニューラルネットを用いて、地球規模で過去の気象データを学習したモデルが、スーパーコンピュータを用いた気象予想より正確な予測を行えることを示した研究で、12月23日 Science に掲載された。タイトルは「Learning skillful medium-range global weather forecasting(地球規模の中期天気予想を可能にするモデル)」だ。
ノーベル賞を受賞した真鍋博士により気候モデリングによる予測が始まったが、現在は多くのデータをスーパーコンピュータで計算する方向に進んでいる。この研究では、これに対し、小さな領域の気象データを世界地図の上にマップして学習させることで、スーパーコンピュータ以上の予測性能が可能ではとチャレンジしている。
実際には世界を100万ポイントに分け、地表でのデータとともに、上空の気象データなどが、地球を取り巻く仮想ネット上のノードに集約するようにデータを処理し、これをトランスフォーマーに学習させている。
マイナス6時間、0時間のデータを読み込み、プラス6時間の予測と実際の結果を示すことで、一種のマスク事前学習を行い、最終的なGraphCastモデルを作成している。
驚くのは、このモデルが4千万程度のパラメーターのニューラルネットワークで処理できる点だ。ChatGPTが1700億パラメーター、研究室レベルで使えるGPT2が15億パラメーターであることと比べると、ほとんどパソコンレベルと言って良い。
それなのに、日常の予測では中期予測センターHRESを凌駕する。さらに、台風やサイクロンと言った異常気象、さらには熱波や寒波のような異常気温の予測についても10日後までの中期予測では圧倒的に予測精度が高い。
以上が結果で、専門でないのでずいぶん省略したが、LLMのパワーを思い知る。計算に基づく方法と比べると、LLMの宿命で予測の確率を出すことが難しいが、これも可能になるモデルがすぐに出てくる気がする。
このようにLLMは、ノンリニアな現象が溢れる我々の世界を読み解くすごい力になる。それをGoogleは完全に理解し、次から次へと新しいモデルとして実現している。GhatGPTで揺れた一年だったが、蓋を開けたらαFoldに続き、MedPalmからGraphCastまで、トップジャーナルだけで見てもGoogle一人勝ちの印象が強い。大きく後れをとった我が国では、遠い背中を追うのではなく、新しい発想でチャレンジする若者が必要だと思う。
2023年12月29日
生きている限り私たちの細胞はどこかで増殖して新しい細胞を供給する必要がある。この時DNA複製が行われるが、細胞の特徴に応じて決められる数万カ所の複製開始点から複製が行われる。この複製開始点はDNA配列だけで決まるのではなく、クロマチンの構造や、ゲノムの3次元構造、さらに転写の状態など様々な要因で決まるため、特定の細胞の複製開始点を決めるためには、常に開始点からの複製を調べる機能的アッセイが必須になる。
このためか、複製開始点を総合的に調べる研究にお目にかかる機会は少ないが、今日紹介するミュンヘン・ヘルムフォルツ研究所からの論文は、受精から胚盤胞が形成されるまでに複製開始点がどのように変化するかを調べた研究で、何でもトライすることの重要性を教えてくれる研究だ。タイトルは「Emergence of replication timing during early mammalian development(発生時における複製タイミング)」だ。
この研究では single cell level のDNA配列決定で、複製開始点では同じ配列が増加することを利用して複製開始点を決め、また複製された配列の長さから複製が開始したタイミングが早いか遅いかも決めている。
通常分化した細胞では、複製開始点やタイミングはほぼ決まっているが、発生初期にはかなり多様性がある。さらに、発生に伴って、早い複製開始点と遅い複製開始点は変化し、20%の開始点で複製タイミングが変わる。
この原因を探ることで、複製開始点を決める要因が明らかになる。最初、母親、父親由来の染色体で差があるかを調べているが、明確に開始点の差があるわけではない。そして、発生過程でこの変化を調べていくと、発生が進むとともに、開始点やその開始時期が決まっていくことが明らかになる。
この発生に伴う開始点活性決定の要因を探ると、8細胞期からヒストンの H3K36 のメチル化が関連することを明らかにする。おそらくこれは新しい発見で、恒常的遺伝子発現と開始点の関係が成立していくことを示している。
そのほか、転写との関係でも、胎児側の転写が始まるタイミングを捉えて、RNAポリメラーゼ自体が複製開始点決定や開始時機に影響することを示しており面白い。
さらに、LADと呼ばれる核内の転写を調節する構造と、複製開始点の開始タイミングを丹念に調べて、発生に伴い染色体の3次元構造が決まるのに伴い、開始点の活性も決められていくことを示している。
他にも様々な結果が示されているが、基本は転写のプログラムに合わせて、複製開始点が決められていく過程がよくわかる研究だと思う。いずれにせよ、開始点活性はダイナミックに決まっており、今後幹細胞やガン、そして老化を考える時、開始点についての理解が極めて重要であることがよくわかる。
2023年12月28日
ステロイド剤や免疫抑制剤以外に治療法がなかった重症のアトピー性皮膚炎も Th2 型アレルギーに関わるサイトカインシグナルを標的にする JAK1 阻害剤や、IL4 / IL13 抗体が利用できるようになってからは、少なくとも症状レベルでは制御可能な病気になった。
今日紹介するマウントサイナイ医科大学からの論文は、早期からアトピーを発症する遺伝的アトピー患者さんが持つ JAK1 の活性化型変異(JAK-gof)マウスに導入した時、皮膚病変と比べると肺の Th2 型アレルギー喘息が全く起こらないことに気づき、この原因を突き止めた研究で、12月20日 Cell にオンライン掲載された。タイトルは「Sensory neurons promote immune homeostasis in the lung(肺では感覚神経が免疫ホメオスターシスを維持している)」だ。
JAK1 分子の634番目のアラニンがアスパラギン酸に変異した患者さんでは、強いアトピー性皮膚炎や喘息、そして Th2vアレルギーに特徴的な好酸球増殖が現れる。この患者さんを詳しく調べると、皮膚症状に比して肺症状は軽いことに気づき、この原因を探るため同じ変異を導入したマウスを作成している。
このマウスで皮膚と肺の組織を調べると、リンパ球の浸潤や組織の炎症性変化が肺ではほとんど見られないことが明らかになる。そこで、血液細胞移植を行いアレルギー反応を誘導すると、正常マウスで誘導する肺のアレルギー反応が、JAK1-gof を持つマウスに正常マウス血液を移植した場合全く起こらないことを発見する。すなわち、JAK1 が活性化されている肺では、免疫反応が抑えられている。
この肺特異的免疫抑制に関わる細胞を探索して、最終的に肺を支配する迷走感覚神経で TRPV1 発現細胞が JAK1 を発現し、免疫抑制に関わることを、神経細胞を除去する実験により発見する。
JAK1 は皮膚を支配する感覚神経にも発現しているが、かゆみの原因になると考えられ、JAK1 阻害は良い効果があると考えられているが、迷走神経で JAK1 を除去するとアレルギー症状が悪化するので、同じ JAK1 を発現する感覚神経でも皮膚と肺では機能が異なることを明らかにする。
最後に、肺の迷走感覚神経で免疫反応が抑えられるメカニズムを探り、CGRPβ などの神経ペプチドを介して Th2 アレルギー反応が抑制されることを明らかにしている。
結果は以上で、この研究は Th2 型アレルギーが皮膚と肺で異なるメカニズムに依っていることの一端を説明する重要な研究だと思う。実際、感覚神経が JAK1 を発現して、皮膚ではかゆみに関わり、肺では免疫を抑えるなど、まさに事実は小説より奇なりと言える。このようなメカニズムを抑えることで、完全な Th2 型アレルギーの治療が可能になるのかも知れない。
2023年12月27日
水に溶けない脂肪を細胞から細胞へと運搬するためにはコンテナーに詰め込む必要があり、このコンテナーに入った脂肪が LDL とか HDL として一般に知られている。勿論、食べた脂肪を吸収するときも同じで、胆汁で水との相性を高めた上で、リパーゼにより自由脂肪酸、グリセロール、コレステロール、などに分解され、取り込まれた腸上皮の中でもう一度トリグリセライドと再合成され、大きなコンテナーに入ったカイロミクロンとして血中に供給される。食後血清が白濁するのはこのせいだ。
今日紹介するケルン大学遺伝学研究所からの論文は、腸上皮のカイロミクロン形成がミトコンドリア異常症で傷害されていることを明らかにした論文で、12月20日 Nature にオンライン掲載された。タイトルは「Mitochondrial dysfunction abrogates dietary lipid processing in enterocytes(ミトコンドリア異常症により腸上皮細胞での脂肪処理が傷害される)」だ。
実を言うと、私が臨床医としての生活をやめてドイツに留学した先がまさにケルン大学遺伝学研究所で、分子生物学創生記に活躍したデルブリュックのために設立された研究所だ。
さて、この研究ではミトコンドリア症の患者さんがしばしば消化器症状を訴えることに注目し、ミトコンドリア機能が低下の腸上皮機能への影響を調べている。
腸上皮特異的に、ミトコンドリアの酸化的リン酸化に必要な分子合成が傷害される変異を導入すると、小腸は短くなるし、腸上皮の合成がほとんど止まって、マウスは2-3週間で死亡する。ただ、その時の腸上皮を組織学的に調べると、細胞内に脂肪の貯まった小胞が形成され、脂肪細胞と同じように小胞にはペリリピンが結合していることを明らかにする。おそらく、細胞の増殖などの異常は、エネルギー代謝自体の大きな変化の問題だが、このような脂肪が貯まった小胞が出来ることがミトコンドリア症の消化器症状の原因になると想定して、研究を進めている。
そこで、マウスの成長後、酸化的リン酸化に関わる分子をノックアウトできるマウスを用いて調べると、処理後5日ぐらいでゴルジ体が断片化されるとともに、脂肪を含む小胞が細胞内に形成され、7日目には大きな脂肪貯留が出来ることを明らかにする。
次にエサの中にアイソトープラベルした脂肪酸を加えて追跡すると、通常はカイロミクロンとして全身に供給されるのに、ほとんど腸上皮内にとどまってしまうことがわかった。また、脂肪を含まない食事を与えると、この症状は改善されることも示している。
以上の結果から、ミトコンドリアの機能が最も影響するのは、ゴルジ体の維持、特に大量の脂肪を処理するための維持で、この維持に必要なエネルギーが低下すると、カイロミクロン形成が傷害されることになる。
この実験系は、普通なら死亡に至る強い変異を誘導しているので、一般のミトコンドリア病に当てはまるかどうかはわからないが、ミトコンドリア病の消化管症状をこの視点で見直すことは重要だと思う。
2023年12月26日
神経ネットワークの形成は地球上に全く新しい情報を可能にする大きなイベントだった。最近の大規模言語モデルの成功を見ていると、ニューラルネットワークの可能性は全て規模の問題ではないかと思ってしまう。これをそのまま当てはめると、人間とサルの違いは、ニューラルネットの規模の問題と言うことになる。これは一面正しいのだが、規模を大きくするとき電力をいくらでも使える人工知能と違い、使えるエネルギーが限られている我々では、ニューラルネットを大規模にする過程でエネルギー節約のための様々な分子機構を進化させる必要がある。この進化過程を明らかにするため、人間やホモサピエンス特異的な神経活動調節分子の探索が行われており、このHPでも面白い研究は必ず取り上げることにしている。
今日紹介するベルギーのVIB-KULeuven脳研究所からの論文は、人間だけで興奮神経軸索起始部にだけ発現する分子を特定し、これが神経興奮を抑える役割があることを示した面白い論文で、12月21日 Cell にオンライン掲載された。タイトルは「LRRC37B is a human modifier of voltage-gated sodium channels and axon excitability in cortical neurons(LRRC37B分子は電位依存性ナトリウムチャンネルの調節因子で皮質ニューロンの興奮性を抑える)」だ。
この研究では哺乳動物から現れ、サル、人間へと進化する過程で遺伝子重複で新たな遺伝子が発生し、人間と類人猿のみに存在する LRRC37B分子に着目し研究を始めている。そして、人間とチンパンジーの配列の違いにより、人間だけで皮質神経軸索起始部で発現し、神経興奮を抑えることを明らかにしている。
この抑制メカニズムを続いて解析し、2種類の機構で神経のナトリウムチャンネルの機能を抑制することを示している。
興奮神経やシャンデリア細胞から分泌されるFGF13Aと結合して、FGF13Aの神経軸索起始部での濃度を高め、FGF13Aが本来持っているNav1.6電位依存性ナトリウムチャンネルを抑える。
電位依存性ナトリウムチャンネルを調節するSCN1Bの結合して、おそらく活動を抑制する。
ことを明らかにしてる。
そして最後に生理学的に人間皮質ニューロンの興奮を、LRRC37B陽性、及び陰性神経で比較し、LRRC37Bを発現することで興奮性が低下していることを明らかにしている。
以上が結果で、勝手な想像だが、ひょっとしたらこのような機構により、シナプスの結合性をニューラルネットで変化させると同時に、神経興奮を抑えることで、電気代を節約しているかも知れない。このような研究の先に、おそらく人工知能のエネルギー消費を抑えた新しいニューラルネットが可能になるのだろう。
2023年12月25日
人間での免疫トレランスが、胸腺での自己反応性リンパ球の除去と、制御T細胞(Treg)による自己免疫抑制により維持されていることは、これらの過程が傷害される2種類の突然変異の存在から明らかになっている。一つは胸腺での自己抗原の提示がうまくいかない(すなわち胸腺動物園が出来ない)AIRE遺伝子の変異で、もう一つは Treg の機能が傷害される FoxP3遺伝子の突然変異だ。
今日紹介するスタンフォード大学からの論文は、 FoxP3 の突然変異による immunodysregulation polyendocrinopathy enteropathy X linked syndrome (IPEX) と言う極めて長い名前の病気の患者さんの詳しい解析を通して、ノックアウトマウスの解析からも明らかにならなかった FoxP3 の機能を明らかにした研究で12月20日 Science Translational Medicine にオンライン掲載された。タイトルは「Identification of unstable regulatory and autoreactive effector T cells that are expanded in patients with FOXP3 mutations( FoxP3変異を持つ患者さんで、制御及び自己反応性エフェクターへの分化が不安定な集団が増加している)」だ。
FoxP3 はX染色体上にあり、ほとんどの IPEX患者さんは男性で、早い時期から全身の自己免疫反応が起こる。面白いのは、キャリアーの女性では、X染色体不活化から考えると FoxP3変異T細胞も存在するはずだが、免疫学的異常はほとんど見られない点だ。さらに、これまで Treg を特定するマーカーを使った測定では、Treg の減少が明確でないことも理解しがたい点だった。
この問題に、末梢血の解析だけで迫るのは簡単ではない。この研究では、これまで明らかになっていた患者さんの解析結果から、FoxP3 により Treg の分化が障害されるのではなく、刺激を受けた後の Tregの機能分化が不安定化しているのではと当たりをつけて研究を進めている。
すると、Treg に特徴的な DNA のメチル化が Treg だけでなく、 エフェクターT細胞(Teff)にも見られることを発見する。そして、single cell RNAsequencing を用いて、Treg から抗原刺激により分化した記憶Treg の抑制機能が失われたのが、IPEXで見られる Treg のメチル化パターンを持つ Teff であることを確認する。
繰り返すと、FoxP3機能がないと、Treg が刺激されメモリーへと分化するとき、Treg の機能を発揮するサイトカインを安定的に維持できず、代わりに IL13 や IL17 と言った炎症サイトカインを分泌する Teff に分化してしまうことがわかった。
これ確認するために、IPEX患者さんの Treg とTreg由来と考えられる Teff の抗原受容体を調べると、同じクローンから由来して、自己免疫反応性の抗原受容体の発現が高まっていることが明らかになった。
一方で、FoxP3 が欠損した Treg が存在すると考えられる母親で全く症状が認められないことから、正常の Treg が存在すれば、由来を問わず自己免疫性 Teff を抑えることができることを示している。
以上、FoxP3 が Treg のアイデンティティーを守っている重要な転写因子であることが明らかになり、ますます Treg の重要性が認識される研究だと思う。
2023年12月24日
自閉症スペクトラム(ASD)の症状発生に腸内細菌叢が関与していることは、いくつかの細菌叢移植治験から示されているが、安全に子供の細菌叢移植を行える施設は限られている。代わりに期待されるのがプロバイオで、特にマウスのASDモデル実験から、有名なロイテリ菌がASDの社会性を回復させることが示されてきた。
今日紹介するイタリアのローマ大学とスタンフォード大学の共同論文は、100人のASDへのロイテリ菌タブレットの効果を調べた無作為化偽二重盲験治験の結果で、12月18日 Cell Host & Microbiome にオンライン掲載された。タイトルは「Precision microbial intervention improves social behavior but not autism severity: A pilot double-blind randomized placebo-controlled trial(細菌叢への厳密な介入は社会行動を改善するが自閉症の程度には影響しない:試験的無作為化二重盲験治験)」だ。
この研究では100人の平均6歳のASD児を集め、最終的に57名を無作為化して、2系統のロイテリ菌を含むタブレット、あるいは偽薬タブレットを6ヶ月服用させ、ASD症状や、免疫、細菌叢について調べている。
6ヶ月も服用するとしっかりロイテリ菌は腸内に居着くのではと思うが、便中のロイテリ菌の割合は多い人で0.02%で、ほとんどは検出が難しいレベルにとどまっている。プロバイオで投与する菌がホストで持続することの難しさがよくわかる。
それでも社会的コミュニケーション及び社会的モティベーションについては、治療効果が明確に現れていることが確認され、二重盲検治験でこれまで動物で観察されてきたことが人間にも当てはまることが確認された。
一方、ASDの症状からみる重症度指標や、免疫細胞、サイトカインなどにはロイテリ菌の影響は全くない。また、ASD児によく見られる消化器症状についても、ロイテリ菌でも改善できない。
実際、便中の細菌叢への影響を調べると、個々の被験者で細菌叢の変化が見られることもあるが、何か決まった方向への変化が見られると言うことはない。従って、これまで言われてきたようにロイテリ菌自体が持つ効果をこの治験では検出していると考えられる。
この治験に使われたタブレットは2種類のロイテリ菌が含まれているので、最後にそれぞれの菌についてマウスモデルを用いて調べると、PTA6475と呼ばれる菌だけに効果が見られた。おそらく、2系統の差を調べることで効果の原因を突き止めることが出来る可能性がある。
結果は以上で、同じような研究は、今年3月に16人という少ない対象者ながら米国で行われており、やはり社会性の改善が確認されている。この時は、人数が少なすぎるので本当か少し心配だが、今回のように人数が増えてくると、ロイテリ菌は安全な自閉症治療の一つとして推奨されるようになるのではないだろうか。
2023年12月23日
今日の4時からZoomで今年の生命科学を振り返ることにしている(https://aasj.jp/news/seminar/23522 )。ただ各雑誌が選んだ内容を見てみると、今年はちょっと物足りないかなと思ったので、Nature、Scienceの記事を紹介した後は、私が読んだ中から今年の注目を紹介する予定にしている。
今年の創薬分野で私が注目したのは、新しいメカニズムのRas阻害剤が開発され始めたことだ。これについてはZoomで詳しく述べようと思っているが、今日紹介するスペイン・バルセロナ科学技術研究所からの論文は、K-ras分子に1-2アミノ酸変換が起こる変異を導入して、主にRaf蛋白質との結合を丁寧に調べ、Ras分子機能阻害や機能亢進に関わる部位と、その生物物理学的特性を調べた力作で、12月20日 Nature にオンライン掲載された。タイトルは「The energetic and allosteric landscape for KRAS inhibition(K-ras阻害のエネルギー的、アロステリック的構造マッピング)」だ。
この研究ではRas遺伝子にランダムに切れ目を入れ作成した、26000種類以上の変異ライブラリーから合成されるRas蛋白質とRafの結合反応を protein fragment complement assay(RasとRafが結合すると機能的蛋白質が形成され、細胞が増殖したり蛍光を発することでRasとRafの結合定数が計算できる)定量している。
こうして2241種類のアミノ酸置換がRaf結合性の低下を示すが、この多くは変異によりRas蛋白質自体が3次元構造を取れず分解されてしまうためで、残りがRaf結合に影響する変異と特定できる。
こうして得られるRaf結合マップから、Rasの機能的構造を描いていくと、これまで構造解析だけではわからなかった新しいポケット構造、そしてRasの構造変異により遠隔部位の構造を変化させるアロステリック効果マップを作ることが出来る。また、Rafだけでなく、他のRas結合分子との結合定数の変化も一部の構造について計算し、Ras分子構造の機能的解剖マップを完成させている。
このマップから得られる結論をまとめると、
K-Rasには多くの阻害的アロステリック変化を起こす部位が存在し、これらは新しい創薬ターゲットになる。
ほとんどのアロステリック阻害部位は、Rafだけでなく他の分子との結合も阻害する。
他の分子との結合部以内にはより多くのアロステリック阻害部位が存在する。
これら部位の変異の種類でK-Ras分子と他のパートナーの結合阻害の特異性が決まる。
K-Rasには4種類のポケットを特定できるが、アロステリック阻害活性はアロステリックな効果が高い。
以上のことは、K-Ras分子標的薬の開発をもう一度新しい方向から見直すことが十分可能であることを示している。
この論文を読んで思い出すのは、紹介しなかったが今年10月中外製薬の研究所からJournal of American Chemical Societyに掲載された環状ペプチドを用いた創薬プラットフォームと、これを使った新しいK-Ras阻害剤の開発だ。
最終的に開発されたLUNA18は経口投与で2-4割が血中に入り、なんとサブナノモルレベルでほとんどの変異K-Rasを阻害する。これについては、今日の今年を振り返るで日本の可能性として是非取り上げたい。いずれにせよ、現在使われているRas阻害剤を越える薬剤が続々出てくる時代を迎えそうだ。