2019年2月19日
ほとんど関係がありそうにない単語が、あたかも関係しているかのように掲げられていると、ついついその理由を知りたくなる。論文のタイトルとしては、人の目を惹く意味で使いたくなる戦略だが、読んで種明かしがわかると、そんなことかと、内容はそれほどでもないことが多い。
今日紹介するマサチューセッツ総合病院からの論文は、タイトルに睡眠、造血、動脈硬化と、一見関係なさそうな単語が並んでおり、かって造血を研究していた私にとっては、この例の典型論文だと思った。タイトルは「Sleep modulates haematopoiesis and protects against atherosclerosis(睡眠が造血を変化させ動脈硬化を予防する)」だ。
この研究の発端は、動脈硬化になりやすいApoeノックアウトマウスの眠りを妨げて、眠りが途切れ途切れになるようにしたマウスでは動脈硬化巣が大きくなり、そこに単球やマクロファージが異常に集まっているという発見だ。そして、骨髄でKit陽性Sca1陽性の未熟血液細胞の増殖が亢進していることを発見する。すなわち、睡眠が断片化されると、造血が上昇することになる。もちろん造血が上昇して、単球やマクロファージの合成が増えると、動脈硬化も悪化することも理解できる。睡眠、造血、動脈硬化の3題話が出来上がった。
ただこれだけでは論文としては弱い。そこでこの変化をきたす分子メカニズムを求め、著者らがHypocretinと呼ぶ視床から分泌される分子の発現が低下することを明らかにしている。hypocretinという分子は私には馴染みが無いが、幸い括弧付きでorexinのことだとわかる。Orexinは筑波大学の柳沢さんが最初摂食行動を調節する脳内ホルモンとして発見した分子だ。その後、ナルコレプシーとの関係で、現在では睡眠を調節するホルモンとしての方が注目されている。こんなこともあって、私の紹介文では自分に馴染みのあるオレキシンという名前を使う。
さて、オレキシンの視床での発現は睡眠が断片化されると低下する。このことから、著者らは造血がオレキシンの低下により起こるのではと考え、オレキシンノックアウトマウスを調べると、末梢血、脾臓、骨髄での単球や好中球の増殖が亢進し、未熟幹細胞の数も増加している。このことから、眠りが妨げられておこる白血球増植の亢進はオレキシンの分泌が低下するからだと結論している。そして、この結果動脈硬化巣に白血球が集まり、硬化層が大きくなる。ただ、問題もある。すなわち一般的なコロニー法で単球の増殖を調べる時に、オレキシンを加えても何の変化もない。オレキシンが造血細胞に直接働いているわけではなさそうだ。
そこでオレキシン受容体の発現をとっかかりに分子メカニズムを探索し、最終的に少し複雑な以下のような結論にたどり着いている。すなわち、好中球の前駆細胞だけがオレキシン受容体を発現しており、この細胞のマクロファージ増殖因子の合成がオレキシンにより抑えられている。このため、睡眠が妨げられ、オレキシンが低下すると、好中球前駆細胞のマクロファージ増殖因子の分泌が高まり、その結果周りの未熟幹細胞からマクロファージまでの細胞が増殖するというシナリオだ。このために、マクロファージ増殖因子ノックアウトマウスの骨髄細胞をオレキシン受容体ノックアウトマウスに移植する実験を行なっている。実験としては論理的だし、データも悪くないのだが、話が複雑でなぜかしっくりこない。一つは、本当に生理的意味のある話か、本当に睡眠と動脈硬化を結びつける話なのかが腑に落ちない。
おそらくノックアウトマウスを集めて、あまりにも特殊な実験になっているからだろう。オレキシンが作られなかったり、あるいは抗体で機能が抑制されておこるナルコレプシーの患者さんを見つけることがそれほど難しいことではないので、オレキシン低下がヒトでも好中球増多症につながるのか、まずこの点から調べて、ヒトでも同じシナリオが当てはまることを示してもらわないと、このモヤモヤ感は消えない。
2019年2月18日
様々な組織の発ガンにrasの変異が関わっていることはよくわかっているが、ras自体を標的にした治療法の開発はうまくいっていない。多くの研究者がチャレンジを諦める中で、それでもこのコラムで繰り返し紹介したように、様々な角度からrasを制御するための研究を続ける研究者は世界にまだまだ存在する。今日紹介するボストン大学と中国廈門大学からの論文は、変異型N-rasの上流で働くキナーゼを特定して新しいメラノーマの治療標的可能性を示した研究で2月21日号のCellに掲載された。タイトルは「Pharmacological Targeting of STK19 Inhibits Oncogenic NRAS-Driven Melanomagenesis(発ガン性N-rasによるメラノーマ形成をSTK19を標的にした薬剤で阻害する)」だ。
これまでもファルネシル化などrasを活性化する上流過程を標的にする治療法の開発が試みられてきたが、この研究ではメラノーマに絞って、このドライバーになっている変異型N-rasの活性をさらに上流で調節しているリン酸化酵素を探すという、最初から決め打ちの、一種の一か八かを狙う研究だ。すなわち、活性化型N-rasを導入した細胞株の増殖を抑制するリン酸化酵素をsiRNAスクリーニングで探索し、STK19を発見している。要するに結果良ければ全て良しで、あとはこのSTK19がN-rasの活性にどう働き、ガン治療の標的になれるかを調べれば良い。
結果を箇条書きにすると、
STK19はN-rasの89番目のserineをリン酸化し、これがないとN-rasのガンのドライバー活性が低下する。 メラノーマの一部ではSTK19の89番目のアミノ酸に変異が起こっており、変異型STK19を導入した色素細胞株の増殖は促進される。 変異型N-rasと変異型STK19が合わさると、色素細胞の増殖が高まり、メラノーマが発生する。 施設に備わった化合物ライブラリーをスクリーニングし、STK19の機能を抑制するZT-12-037を特定した。この化合物は、N-rasのリン酸化を抑制する。 メラノーマを移植する実験で、ガンの増殖を抑制することができる。 以上が結果で、STK19は少なくともN-rasをドライバーとするメラノーマに効果を示す可能性を示唆する結果だ。他のrasについての効果、あるいはN-rasが活性化した他のガンについての効果はわからないが(なぜ実験を行わないのかよくわからない)、N-rasについて、機能をさらに上流で調節する分子を見つけたことは、私には新しい発見だった。あとは極めてオーソドックスな手法の研究で、STK19の発見が結局この研究の全てだとよくわかる。おそらく中国厦門大学が中心の研究だと思うが、阻害活性のある化合物まで到達するところは、実力があることをうかがわせる。ただ、発見された化合物の活性は効果はあっても、実用範囲とは思えない。おそらくプロのメディシナルケミストによる至適化が必要だろう。しかし、決め打ちでも果敢にrasにチャレンジする中国の層の厚さが感じられる論文だった。
2019年2月17日
筋肉を支配する運動神経が徐々に死んで麻痺が進行する、現在まで治療法がない病気ALSのほとんどは特別な遺伝的要因なしに起こってくるが、遺伝的に要因がはっきりしたALSもある。その中で最も多いのがchromosome 9 open reading frame 72 (C9orf72)と呼ばれる、まだ機能が完全に確定していない分子のイントロンにある6塩基繰り返し配列が増大するALSで、家族性がない場合もこの遺伝子の変異を認めることがある。ただ、このように遺伝的原因がわかっていても、なぜ運動神経死が起こるのかのメカニズムについてはなかなか納得いく説明が示されてこなかった。
今日紹介するメイヨークリニックからの論文はC9orf72にこだわらずに、この病気の原因と考えられる繰り返し配列だけに焦点を当てたマウスモデルを用いて神経死のメカニズムに迫った研究で2月15日号のScienceに掲載された。タイトルは「Heterochromatin
anomalies and double-stranded RNA accumulation underlie C9orf72 poly(PR)
toxicity (ヘテロクロマチンの異常と二重鎖RNAの蓄積がC9orf72polyPRの毒性の背景にある)」だ。
この遺伝子変異により多様な異常が起こることが想像されているが、この研究が成功した理由は、ともかくGGGGCCの繰り返し配列からできるプロリン、アルギニンのポリペプチド(PR-P)の効果に焦点を絞ったことと、このタンパク質をGFPで蛍光標識して、この分子が細胞のどこに存在するか、細胞学的、生化学的に追跡できるようにした点だ。
蛍光標識した繰り返し配列をアデノウイルスで新生児脳に注射すると、毒性が強く6割のマウスは死んでしまうが、残ったマウスでは進行的な神経細胞死が進むことを確認して、これがC9orf72変異によるALSや前頭側頭型認知症(FTD)モデルとして使える事を示した上で、この繰り返し配列の機能を詳しく調べている。
膨大なデータなので、詳細は割愛して、結論だけを述べる。
この繰り返し配列(PR-P)だけで、ALSやFTDの病態のほとんどを説明できる。 PR-Pは染色体構造が閉鎖したヘテロクロマチンに特異的に結合する。 この結果核膜直下に限定してい転写を抑制するマトリックスが核内部にまで侵入し、転写される遺伝子が大きく再構成される。 PR-PによりヘテロクロマチンをまとめているHP1aが分解される。 この結果ヘテロクロマちんにより抑えられていた繰り返し配列の転写が促進し、細胞毒性のある二重鎖RNAが大量に合成される。 が主な結果と言える。
PR-Pの標的がヘテロクロマチンであることを発見したことがこの研究の全てだが、その結果としては結局様々な過程の引き金が引かれ、それが組み合わさって細胞死が起こるという結論になってしまう。この中では、細胞障害性を持つ二重鎖RNAの合成が一番病態に近いところにあるプロセスだが、とはいえALSでもう一つ重要なRNA蓄積として知られているTDP-43との関連も含めて、より多くの新しい問題が出てきたと言っていいだろう。ALSを理解することがいかに難しいか、よくわかる論文だと思う。
2019年2月16日
昨日に続いて今日も軽めのダイエットメニューで行こうかと考えている。と言っても、まじめに調査が行われているとは言え、酒の飲み方に差があるのか、あるいはアルコールとしてみればワインもビールも同じなのかといった、少しふざけたような問題ではなく、もう少し重要な問題で、ダイエットで体重を落としたいとき、朝食を抜いたほうがいいのかどうかを問うた研究だ。
肥満に対するダイエット療法について書かれた多くの提言では、カロリーを減らしたいからと言って朝食を抜くのは逆効果とされているようだ。その理由は2つあり、一つは朝食を抜くことで、他の時に余分に食べてしまうという問題と、朝食を抜いて活動性が低下することでカロリー消費が落ちて逆に太るという問題だ。
今日紹介するオーストラリア モナーシュ大学からの論文は、公式な提言にも書かれているこのドグマにチャレンジした論文で、誰もが当たり前と思っていることに対するチャレンジをサポートし続けているBritish Medical Journal にオンライン掲載された。タイトルは「Effect of breakfast on weight and energy intake: systematic review and meta-analysis of randomised controlled trials (体重とエネルギー摂取に対する朝食の効果:無作為化試験についての包括的再調査とメタアナリシス)」だ。
ダイエットでも朝食を抜くなという提言も、全く根拠なく行われたわけではなく、これを裏付ける論文は存在している。この研究は、自分で調査したのではなく、これまでの論文を見直したメタアナリシスだが、著者らはドグマを裏付ける論文の多くが朝食をとるかどうかを自己の判断に任せた観察研究であることに気がつき、これだと「朝食は必要」と考える人の方が、提言に従い生活態度が最初からダイエット向きにできているため、ダイエットに成功したのではと考えた。そこで1990年から昨年1月までに発表された600を越すダイエットと朝食について記載がある論文を集め、この中から朝食をとる群ととらない群を無作為化して調べた信頼の置ける論文を12編選んでいる。この中には熊本県立大学から2017年に発表された朝食とエネルギー摂取について調べた論文も含まれている。
このようなメタアナリシスは、選んだ論文の結果を信頼できるかどうか厳密に吟味する必要がある。論文では、これについて詳しく述べているが、この点については割愛して結果についてのみ紹介する。
無作為化していることから、長期間の調査は難しく、最も長い調査で16週間だ。もちろん全ての調査で、朝食を食べるということははっきり自覚されるため、偽薬を用いると言った盲検はできないという限定がある。したがって、調査の趣旨に被験者が賛成して協力したりすると結果が狂う心配はある。ただ、この条件で行われたほぼ全ての研究で、朝食を抜くと、抜かない人よりも体重を落とすことができ、また1日のエネルギー消費も低下するという結果だ。
論文によっては、代償的に朝食以外で食べすぎないか、あるいは活動性が落ちるかなど、血液のさまざまなマーカーを使って調べている場合もあるが、これも杞憂で、結局ダイエットに対する提言として書かれているドグマは全て削除すべきと強い結論で終わっている。
もちろんこの話は成人での話で、成長期の若者は全く対象でないことは強調しておく。わが国でもブラウザーのトップに来るサイトでの提言は「朝食は抜くな」だが、さてこの論争の結末はどうなるのだろう。
2019年2月15日
少し一般の人には理解しづらい論文が続いたので、今日はとびっきり簡単な論文を紹介することにする。ドイツ ブッパータール大学小児科からの論文で2月8日号のAmerican Journal of Clinical Nutritionに掲載された。タイトルは「Grape or grain but never the twain? A randomized controlled multiarm matched-triplet crossover trial of beer and wine (ブドウでも麦でもいいが、しかしチャンポンはだめ?ビールとワインの様々な組み合わせを試す無作為化試験)」だ。
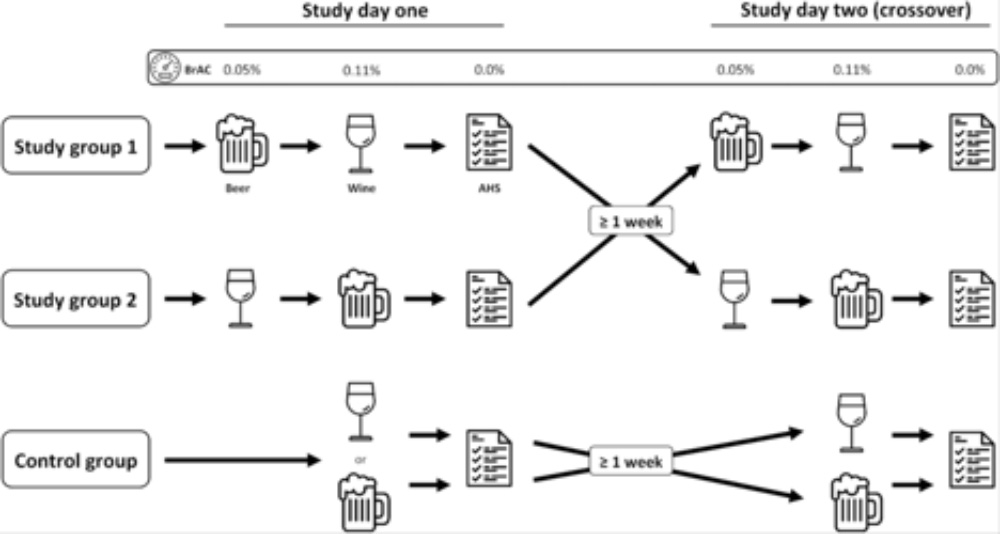
この論文はヨーロッパの古い知恵として言い伝えられてきた「Grape or grain but never twain(ワインでもビールでもどちらでもいいが、チャンポンはダメ)という言葉をそのままタイトルに使った論文で、タイトル通りビールだけ、ワインだけ、ビールからワイン、ワインからビールという4種類の組み合わせでアルコールを十分酔うまで(呼気のアルコール濃度が0.11%)飲んで、次の日に8種類の症状(喉の渇き、倦怠感、頭いた、フラフラする、吐き気、胃痛、頻脈、食欲不振)について自己診断を行ってもらって、二日酔いになっているかどうかを調べている。さらに、タイトルのCross overから分かるように、ワインからビールを試した人は、1週間後ビールからワインというように、飲み方をスイッチする。同じように、ビールだけの人は、次の実験ではワインだけに変わる。これにより、特にワインだけに問題がある人などが結果に大きく影響しないようにしている(この論文はフリーアクセスなので、著者が実験の概要として使っている図を以下に掲載しておく)。
さて結論だが、詳しい説明は全て省く。結局上のどのような条件で飲んだとしても、次の日の二日酔いの強さは同じだったという結果で、古くからある知恵とは全く異なる結果になっている。わたしのような酒好きにとってのメッセージは、「飲むときには細々考えず、気分に合わせて酒を楽しめばいい」という結論になる。
もちろんいくつか問題もある。最終的に各グループの母数が28-31人になってしまっており、よほどの差がないと有意差が出にくくなっている。また、呼気のアルコール濃度を指標にしているが、実際には約5時間かけてビール1.4リットル、ワイン600ccを飲んでおり、ヨーロッパ人で酒に強い人なら普通にこなしてしまう量で、確かに各グループでのデータのばらつきが多い。したがって、もっと違った飲み方も同時に比べることをしないと、最終結論は出ないように思う。
とはいえ、著者には失礼だがなんとも馬鹿げた研究目的と、270人ものボランティアを募り、厳密な医療統計に基づく研究を行なっている研究手法の真面目さとのアンバランスがこの論文の最も面白い点だろう。イグ・ノーベル賞狙いではないかとすら勘ぐってしまう。アクナレッジメントをみたが、さすがにこの研究に助成金は出ていないようだ。また期待通り、論文の最後はCheers(乾杯)で締めくくっている。
2019年2月14日
エクササイズによりアルツハイマー病の発症を予防したり、あるいは病気の進行を遅らせる可能性があることは以前から指摘されている。しかし最近の研究では、発病してしまうと1週間に一回程度の運動では、ほとんど進行を遅らせることができないことも示唆されている。どちらが正しいとしても、この問題に関しては、臨床例の観察を行なった疫学研究しかなく、運動が効果があるとしても、その分子メカニズムに迫ることは難しいと考えられていた。
ところがブラジル・リオデジャネイロ大学、米国コロンビア大学、そしてカナダ西オンタリオ大学の共同チームが1月号のNature Medicineに発表した論文は、運動により誘導されアルツハイマー病の神経シナプス結合を改善させる分子を特定した点で画期的な研究だ。タイトルは「Exercise-linked FNDC5/irisin rescues synaptic plasticity and memory
defects in Alzheimer’s models (運動と連動するFNDC5/irisinがアルツハイマー病のシナプスの可塑性と記憶を回復させる)」だ。
これまでの研究で運動すると筋肉に発現しているFNDC分子が切断され、細胞外ドメインのirisinが血中に分泌されることが知られていた。著者らは、アルツハイマー病(AD)に運動が効果があるなら、このirisinがその原因ではないかと着想し、FNDCに対する抗体を用いて、筋肉だけではなくADの主要な病巣である海馬でも強くFNDCが発現してirisinを分泌していることを確認する。
次に進行したAD、初期のAD、そして正常の海馬でのirisin量を調べ、進行性ADで著明に低下していること、また脳脊髄液中のirisinがADで低下していることを明らかにする。面白いのは、正常の人では脳脊髄液中のirisinは年齢とともに上昇するが、ADになるとこの上昇が全くないか、少し低下する点だ。すなわち、正常では年齢に応じた脳の変化をirisinが抑えているような印象がある。
そこでマウスモデルを用いて、脳細胞のFNDCをノックダウンする実験を行い、脳内でのFNDC合成がなくなると、海馬のシナプスの可塑性が低下するとともに物体認識の記憶が低下することを明らかにする。
次にirisinが低下しているADマウスにirisinを投与することで記憶が回復するかどうかを調べ、期待通りシナプスの可塑性と物体認識記憶が元に戻ることを突き止めた。また、アデノウイルスを脳に注射する方法でもシナプスの可塑性を回復させることができる。この回復したマウスの脳組織を取り出して活動を調べると、興奮の低下が大きく改善されることも示している。すなわち、irisinの低下はADの記憶症状をかなり説明することができる。
次に、では脳内で合成されるirisinだけでなく、筋肉で合成されるirisinもこのようなアミロイドによる記憶低下を防ぐことができるのか調べるために、末梢からirisinをコードするアデノウイルスベクターを注射する実験を行い、末梢で合成されたirisinが脳内に移行して記憶を戻す作用があることを明らかにしている。そして最後に、ネズミを一日1時間水泳させてアミロイドによる記憶低下を抑えられるか調べ、運動により分泌されるirisinでも十分記憶力低下を抑える効果があることを示している。生化学的には、irisinはcAMP-PKA-CREBシグナル、すなわち記憶のシグナルを活性化し、irisinの作用が直接細胞に働いてシナプス可塑性を保ち、神経細胞を保護していることも明らかにされている。
irisinが人間のADで低下している以外は、まだまだ動物実験の段階で、人間もirisin投与が同じようにADに効くかを確かめる研究は必要だが、これが正しいとすると、irisinはアルツハイマー病の薬剤として使うことができるし、またしっかりした運動プロトコルを行える初期なら、記憶力低下をエクササイズで防ぐことすら出来ることになる。本当だとすると、かなり大きな貢献だと思う。
2019年2月13日
1月25日このコラムでCRISPR/Cas9を遺伝子を切断して編集する目的で使う場合、目的の場所だけでなく、関係のない場所も切断されるため、ある意味で生命を傷つけるのと同じことで、受精卵をこのような危険に晒すことは犯罪だと述べた(http://aasj.jp/news/watch/9597 )。しかしだからと言って、研究者は手をこまねいている訳ではない。目的の箇所だけに働くCasを求めて様々な努力を重ねている。
現在この課題の克服は2つの方向から行われている(勿論それぞれは排他的ではないため、両方が組み合わせられることもある)。一つの方向は、現在あるCasシステムの特異性を上げる方法で、この代表が今最も注目されている若手研究者David Leuだろう(http://aasj.jp/news/watch/8205 )。これに対し、進化の結果生まれた多様性を信じ、自然に存在する細菌の中により使いやすいシステムがないかを探索するのがもう一つの方向で、これを追求しているのがCRISPR/Casシステムを発見した一人Doudnaさんだ。
今日紹介する論文はこのDoudnaさんの研究室からの論文で地下水に生息するバクテリアから発見された全く新種のCasXについての研究でNatureにオンライン出版された。タイトルは「CasX enzymes comprise a distinct family of RNA-guided genome editors (CasX酵素はこれまで発見されたのとは全く別のRNAにガイドされたゲノム編集分子)」だ。
この研究では最初地下水のメタゲノム解析からその存在が予想されたCasXを持っているDeltaproteobacteriaとPlanctomycetesからCasX遺伝子を分離、それぞれの遺伝子編集活性を分子構造も含めて徹底的に解析している。
このCasXは20merのRNAと相補的配列を持つ2本鎖DNAを、PAM部位から12−14bp離れた場所でガイドRNAと結合しない方のDNA鎖を、さらにそこから10bp離れた場所でガイドRNAと結合している方のDNA鎖を切断する。この結果、10bpのオーバーハングをそれぞれ5‘端にもつ2本のDNA鎖が生成する。このシステムを用いて大腸菌や哺乳動物の細胞株のゲノムをノックアウトする実験を行うと、Cas9に近い効率でノックアウトが起こることが確認される。
そこで、ガイドRNA、標的DNA、CasXが結合した状態の3次元分子構造をクライオ電顕で解析し、CasXのガイドRNAの様々な部位との結合領域、DNA切断活性部位、RNAに結合している側のDNAと結合する部位、反対側と結合する部位などを特定している。
この結果、
ガイドRNAと結合することでCasXの構造が安定化し、ゲノム状の標的を探し始める。すなわちCasXだけではDNA切断活性がない。 CasXのRNAの結合していないDNAに結合する領域からDNAがほどき始められ、そこに切断活性を持つ領域がリクルートされ、切断が入る。 次に、RNAと結合している側のDNAと結合する部位によりRNA-DNAの結合部位が折りたたまれて切断酵素領域に接触し、切断される。 という順番で、両方のDNA鎖が切断される。
このように、少し効率は落ちても、一定の順序に従う分子間の相互作用が起こって初めて、DNAの切断がそれぞれの鎖の別々の場所で起こることから、同じ場所で2本蜡を切断してしまうCas9と比べて標的特異性はかなり高いと想像される。もちろん、今後標的以外の場所が切断される可能性については徹底的に調べられると思うが、CasXはさらに安全性の高い遺伝子編集を可能にしてくれると期待が持てる。
しかしDoudnaさんの研究は応用問題だけでなく、このシステムの多様性など面白い話がいつも満載だ。
2019年2月12日
私たちの体の中の細胞の大きさは極めて多様で、神経細胞ならメートルレベルの軸索を持つものもあるし、卵子に至っては肉眼でなんとか観察できる大きさになる。また試験管内で細胞を飼っていると、分裂が一定の数を超え老化が始まると細胞も大きくなる。
今日紹介するマサチューセッツ工科大学からの論文は、細胞が巨大化することで起こる細胞機能の異常のメカニズムを主に酵母を使って研究したオーソドックスな研究で3月7日掲載予定のCellに掲載された。タイトルは(Excessive Cell Growth Causes Cytoplasm Dilution And Contributes to Senescence(細胞が大きくなりすぎると細胞質が希釈され、老化を促進する))だ。
この研究は、酵母の細胞周期を止めた後、細胞の代謝をそのまま維持すると出来てくる巨大な酵母細胞が、ある一定の大きさ以上になると細胞周期抑制を解除しても細胞周期が戻らないという現象のメカニズムを明らかにしようとしている。酵母でこの現象が完全に細胞の大きさに依存していることは、細胞周期と細胞の代謝を同時に止めると、巨大化は起こらず、元のサイクルに速やかに戻ることができることからわかる。
面白そうな課題だが、蓋を開けてみるとなんとなく当たり前の話で終わったような気がする。細胞周期が再開しないということは、各チェックポイントでの様々な分子の活性化が、細胞が大きくなるほど遅れるためだが、予想通りこれはサイクリンなどの細胞周期のドライバー分子の転写の効率が落ちることによる結果だ。この原因は細胞が大きくなりすぎて、転写や翻訳が追いつかず、細胞質や核内のタンパク質やRNAの濃度が低下することが主原因で、その結果細胞ストレスプログラムのスイッチが入って細胞が増殖できなくなるという話だ。ただ、酵母でも2倍体で遺伝子量が2倍ある場合は、転写の速度の低下が遺伝子の数でカバーされるため異常が起こりにくい。従って、転写の標的になる遺伝子が薄まる結果、異常が起こることになる。
結局メカニズムについてはここまでで終わっており、要するに細胞の中身が薄まってしまってタンパク質やRNAの濃度が30%程度低下し、これが細胞のストレスになるという極めて現象的な話だ。
これだけではちょっとCellの論文としては寂しいので、これと同じことが細胞の老化により大きくなった酵母でも起こること、ヒトの線維芽細胞でも細胞の大きさを2倍にすると、細胞質内の濃度が下がり、同じ異常が起こることを示している。確かに細胞質内の濃度を測るといった普通実験されていない問題を扱う時にナノ粒子の拡散を使うなど、プロの仕事という感じもあるが、やはり内容から考えると、合わせ技一本とはいかなかったと思う。
あまり考えたこともなかった問題で、ひょっとしたら酵母の研究をやっているプロにとってはすごい話が潜んでいるのかもしれないが、個人的には「あ、そんなこともあるな」「Cellによく掲載できたな」で終わった論文だった。こんな日もある。
2019年2月11日
PU1と言われても、血液細胞分化の知識がないと、どんな分子なのほとんど聞いた事もないのではと思う。幸い私自身は血液細胞分化に関わっていたため、PU1がマクロファージやB細胞の分化決定に大事な分子であることを知っているし、またこの分子を研究している何人かの人とも付き合いがあった。しかし現役時代を含めて今まで、この分子が線維芽細胞の活性化に深く関わっているなど想像だにしなかった。
今日紹介するドイツ・エアランゲン大学からの論文は、PU1の線維芽細胞での機能を明らかにし、PU1=血液学と思っていた血液学者をアッと言わせた論文で1月30日Natureにオンライン掲載された。タイトルは「PU.1 controls fibroblast polarization and tissue fibrosis (PU1は線維芽細胞の分極化と組織の繊維化を調節する)」だ。
この研究ではまず皮膚バイオプシー標本の遺伝子発現に関するデータベースを調べ、組織の線維化が進行している線維芽細胞が特異的に発現している転写因子を探索し、PU1が最も発現の上昇しているという意外な事実を発見する。そして、様々な線維化が進行している疾患の組織を調べ、確かに線維化の進行とPU1の発現が一致していることを発見している。
次に、PU1を線維芽細胞でノックアウトすると線維化が起こらないことをヒトの細胞および、マウスの個体レベルで確認し、確かにPU1が線維化を決める重要な分子であることを証明している。また、過剰発現させた細胞を用いて、関節膜上の線維化モデルで調べると、炎症性の線維芽細胞にスウィッチを入れて線維化を誘導することができる。
線維化は炎症の後起こることがわかっているが、炎症を誘導するサイトカインはPU1の維持には関わっても、新しく誘導することはできない。これは、PU1遺伝子が転写抑制型のヒストン(H3Kme3,H3K27me3)と結合しており、これを外すと分化が誘導される。ただ、この分化を誘導する因子については特定できていない。一方、炎症サイトカインによってPU1の発現が維持する仕組みについては、PU1のRNAを分解するマイクロRNAの一つmiR-155が抑制される結果であることを示している。
転写因子の機能を阻害する化合物を見つけることは通常難しいのだが、幸いPU1に関しては比較的特異的に機能を抑える化合物が存在し、この研究ではこのDB1076を用いて、細胞レベル、および個体レベルで線維化を抑制する事を証明し、線維化を防ぐ新しい分子標的として使えることを示している。
結果は以上で、PU1がマクロファージの分化に必須の分子である以上、副作用も考えながら臨床試験を行っていく必要があるだろう。この論文ではPU1とネットワークを形成している他の転写因子についても述べており、医学にとって最も難しかった線維化の抑制もそろそろ視野に入ってきたことがよくわかった。
2019年2月10日
この内容でセット
神経芽腫は小児で最も多い固形腫瘍で、名前の通り未熟な神経細胞の腫瘍だ。この病気は、身体中に転移があっても急に癌が消えてしまうという劇的なケースを含み、多くの場合自然治癒する。ところが、n-Mycガン遺伝子が増幅したり高い発現を示しているケースでは、治療が難しく様々な治療法が開発された結果、死亡率は低下しているとはいえ、3年目の生存率が65%前後とまだまだ低い。
今日紹介するオーストラリア・ローリーガンセンターからの論文は649人の神経芽腫のバイオバンクとコホートデータを用いて、直接阻害剤を見つけるのが困難なn-Mycに代わる治療標的を探した研究で1月30日のScience Translational Medicineに掲載された。タイトルは「Inhibition of polyamine synthesis and uptake reduces tumor progression and prolongs survival in mouse models of neuroblastoma (ポリアミン合成と吸収の阻害によりマウス神経芽腫モデルで生存期間を延長し癌の進行を抑えることができる)」だ。
ポリアミンは細胞の増殖に必須の分子で、乳児の成長には欠かせない。このポリアミンが、ガンの増殖にも重要な働きをしており治療標的になる可能性が最近注目されており、ポリアミン合成経路の酵素ODC1の阻害剤が神経芽腫を含む様々なガンを抑えることができるか、治験が進んでいる。ただ、ポリアミンは外部からも吸収できるので、両方を抑制してガン細胞のポリアミン供給を断つ治療法の開発が必要になる。
この研究は、このアイデアの可能性を確かめることを目的としている。まず、ポリアミン合成に関わる遺伝子発現が高いガンほど経過が悪いことを明らかにし、ポリアミン合成経路が治療標的になりうることを確認している。
次にポリアミン利用のもう一つの経路外部からの吸収に関わる分子を探索し、SLC3A2と呼ばれる分子が神経芽腫で働く唯一の吸収システムであることを示している。
そして、これらポリアミン合成経路に関わる分子や吸収に関わるトランスポーター分子とn-Mycとの関わりを調べ、ほとんどの分子がn-Mycの活性が高まることで上昇してくることを明らかにしている。このことは、n-Mycを直接阻害できなくとも、ポリアミン代謝を標的にすることでmycの効果を半減させられる可能性を示唆しており、最後にポリアミン合成に関わるODC1阻害剤と、ポリアミンの吸収に関わるSLC3A2の阻害剤を、n-Mycを過剰発現させたマウス神経芽腫モデルを用いて試している。
結果は期待通りで、それぞれ単独ではあまり効果がないが、両方組み合わせると、他の薬剤と併用しなくてもガンを抑制する一定の効果が認められる。さらにより臨床に即した設定を試す意味で、現在行われている化学療法に細胞内のポリアミンを低下させる2剤を組み合わせると、大きな効果を得ることができる。
以上の結果から、ODC1阻害のみでは、吸収が上昇すると効果がないため、合成と吸収の両方を抑える治療法が行われるべきで、現在行われている他の治療と合わせることで、さらに高い効果を得られるということが結論される。
あとはこの結果をどう新しい治療のプロトコルにまとめるかだが、なかなか製薬が手を出さない小児のガンについてこのような治療法開発が進んでいることは勇気付けられる。