膜上に設置した穴をDNAが動くときに、電流の変化を感知して塩基の種類を判断してDNA塩基配列を決定するナノポアシークエンサーは、エラー率など様々な問題はあるが、その携帯性、簡便性、スピード、さらにディスポーザブルという面で大きなシークエンサーが使えない感染症の現場での利用価値が高まっているように感じる。
今日紹介するデルフト大学からの論文は、同じナノポアシークエンサーを用いてペプチドも読むことができる可能性を示した論文で、現実性はともかく、面白いチャレンジだと思う。タイトルは「Multiple rereads of single proteins at single–amino acid resolution using nanopores(ナノポアを用いて1アミノ酸レベルの解像度で一分子タンパク質を解読する)」で、11月4日Scienceにオンライン掲載された。
要するにナノポアを用いて電流の変化を見る方法で、アミノ酸配列も読めることを示すのが目的だが、そのままアミノ酸をナノポアに加えても何も起こらない。というのも、ナノポアでは穴に入ったDNAを少しづつ動かすためにDNA上を動くヘリカーゼなどのモータータンパク質が必要で、アミノ酸ではこれが働かない(https://www.nature.com/articles/s41598-019-41488-4/figures/1)。
この問題を、このグループは読みたいペプチドを配列の決まったDNAと結合させ、DNAを動かすことでタンパク質の動きを作る方法を着想している。これはあくまでもアミノ酸を判別すると言うことを確かめるだけの研究なので、つないだアミノ酸はアスパラギン酸とグルタミン酸が並んだ単純な配列のペプチドにしてある。
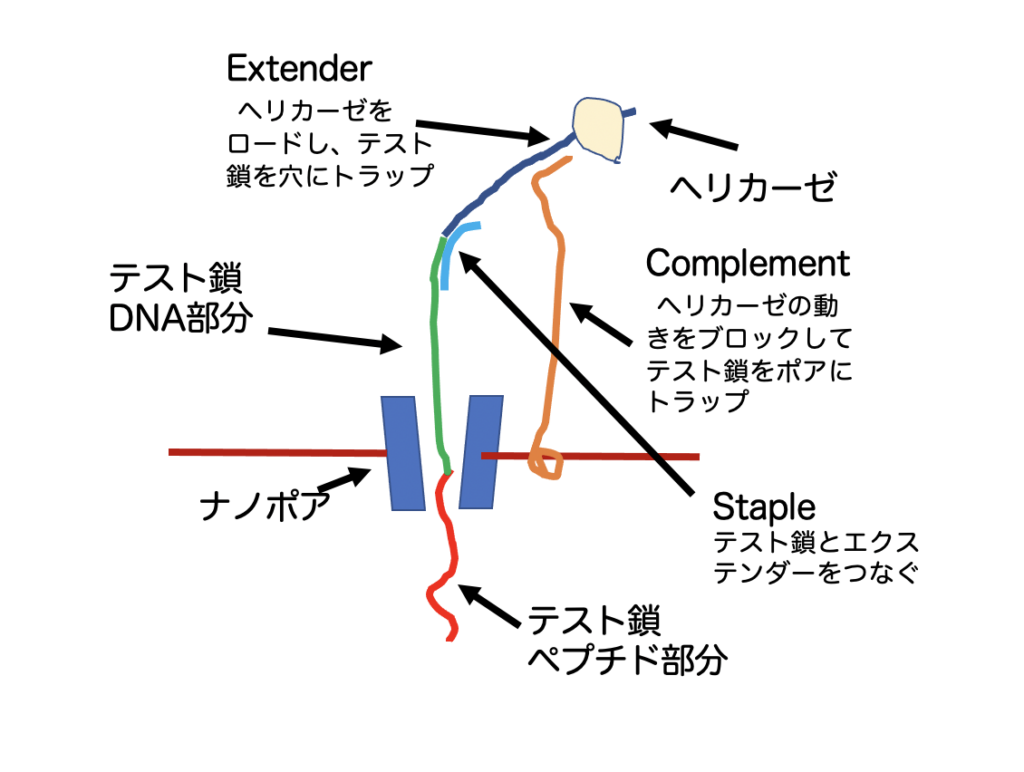
モータータンパクには一本鎖DNAを動かすヘリカーゼHel308を選びDNA部分を滑らせることでアミノ酸を動かせて配列を読むという仕掛けだが、これだけではもちろん足りず、図に示す仕掛けを組み込んでいる。DNA-ペプチド鎖(テスト鎖)をHel308にロードし、さらにナノポアを通すために、テスト鎖にExtenderと呼ぶDNA鎖を、テスト鎖、extender部分に相補的なDNA(Staple)を用いて結合させている。この複合鎖をExtender と相補的部分を持つComplementと呼んでいる、膜から突き出た一本鎖DNAでトラップする。この相補的二重鎖により、ロードされたヘリカーゼは動きを止め、穴にペプチド部分から侵入したテスト鎖が一種宙ぶらりんの状態になる。
このあと、ComplementとStapleの相補的部分を外してやると、ヘリカーゼはExtender とともにナノポアと結合し、挿入されたテスト鎖をDNA部分を用いて引っ張り上げる。このときの電流変化で核酸配列とともに、アミノ酸による電流変化が観察できるという寸法だ。
方法論文なので、図も入れて十分説明できたと思うが、結果はアミノ酸配列により規則的電流変化が見られることが確認され、アスパラギン酸とグルタミンの中に紛れ込ませた、グリシンやトリプトファンを正確に検出できることを示している。また、この変化は基本的にアミノ酸とナノポアの相互作用によるナノポアの変化に起因していることも調べている。
さらに検出の信頼性を示す目的で、同じテスト鎖を、同じナノポアで2回読める工夫をして、同じナノポアであれば、同じ変化が再現されることも確かめている。
以上が結果で、まだまだ実用化とまでは行かないが、1分子アミノ酸配列解読が可能になれば、それがもたらす可能性は計り知れない。



このグループは読みたいペプチドを配列の決まったDNAと結合させ、DNAを動かすことでタンパク質の動きを作る方法を着想している。
Imp:
日経サイエンス(2021年12月号)『ワクチンや抗体医薬を自由に設計する』⇒
アミノ酸新時代の到来か??
天然の蛋白質は石器時代の“加工した石”のような物になるかもしれない。
人工蛋白質=ナノマシンを自由に設計可能な時代の必需品!?