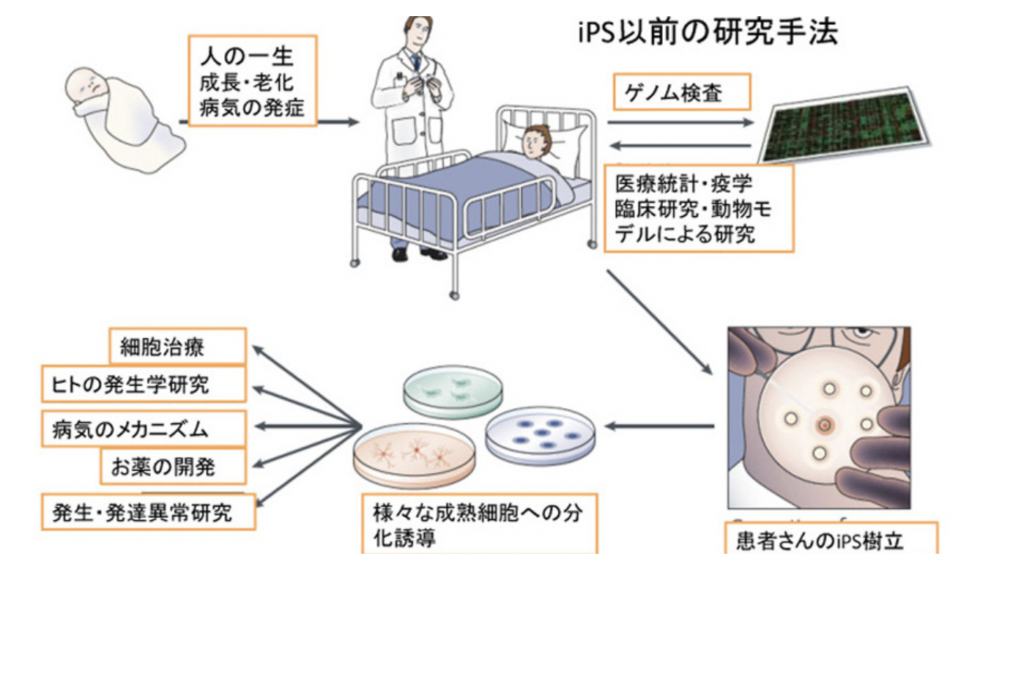
iPSが約束したこと
図は山中さんのヒトiPS樹立成功の論文が発表された時、月刊誌Nature Review Molecular Cell Biologyに依頼され、米国の1型糖尿病財団の人たちと書いた総説( Nishikawa et al The promise of human induced pluripotent stem cells for research and therapy(研究や治療に向けたヒトiPSの約束)Nature Review Molecular Cell Biology 9:725, 2008)を日本語に直して転載した図だ。iPSのおかげで、これまで難しかったヒトの細胞が自由に利用できるようになり、ヒトに関して様々な研究が可能になったことを紹介してる。しかし実を言うと、この時私の頭にあったのは、ほとんどが心臓・腎臓・血液といった身体の病気で、脳発達についてはあまりにも複雑すぎて、iPSの出番はないだろうと思っていた。
自閉症を細胞レベルで研究できる?
自閉症は人間の最も高次な脳の多様性として捉えることが出来るが、その背景には必ず多くの分子の非典型的行動があり、それをベースに細胞レベル、発生レベル、脳構造レベル、神経ネットワークレベルと、非典型性が拡大した結果生まれる多様性だ。このため、最終的に症状として表れた行動と、その行動を支配する神経ネットワークの非典型性の関連を現象的には明らかに出来ても、はっきりとした因果関係を示すのは簡単でない。症状に最も近い神経ネットワークですらこの状態なので、細胞レベル、さらには分子レベルとなると、因果性をはっきりさせることなど、夢のまた夢に近い。
しかし、どんな複雑な組織構築も個々の細胞の性質を反映して形成されている。従ってどんなに複雑な精神症状でも、分子、細胞、組織と何とか統合的に理解しようと、研究者は膨大な努力を払っている。この時、iPS由来の脳細胞が使えれば、分子レベルと組織や発生をつなぐ研究が、普通は使うことができない生きた脳細胞を使って研究できる。
米国ソーク研究所の長期的視野での研究
自閉症に限らず、高次の精神疾患の細胞レベルの解析にiPSを積極的に使っているのがソーク研究所のFred Gageのグループで、創意に満ちた面白い研究を続けている。私が2008年の総説を書いていた頃、Gage達は、1)類人猿のiPSを樹立して、人間とサルの神経機能の違いを研究する、2)統合失調症をはじめとする高次精神疾患のiPSを用いて、病気の分子生物学的、細胞学的背景を明らかにする、と壮大な計画を建てて研究を始めていた。その時私は、「iPSは樹立できても、そう簡単に高次脳機能の理解に進むとは思えない」と見ていたが、その後10年を経ると、両方のプロジェクトで多くの成果が上がりつつあり、未来が見える優れた研究グループであることがよくわかった。
iPSを用いた自閉症研究
今日紹介したい論文は、このCageらがiPSを用いて自閉症を解析した研究で、実に様々な問題が扱われており、iPSを用いた細胞レベルの研究でもこれだけのことが可能なのかと感心した(Schafer et al, Pathological priming causes developmental gene network heterochronicity in autistic subject-derived neurons(自閉症では文化のタイミングの異常で発生のネットワークの時間の同期生が失われる)Nature Neuroscience 22:243, 2019)。
すでに私のブログでも2回紹介したが(2017,6.11&2017,2,18) 一部のASD患者さんはMRIを用いて生後1年までに診断が可能だ。すなわち脳の一部の体積の増大を指標に診断ができる。この研究はこの早期に診断された患者さんを追跡するプロジェクトへの参加者の中から、脳の構造変化がハッキリと見られ、ASD発症を発症した8人からiPSを作成している。
精神症状だけに基づいてASDの患者さんからiPSを樹立するのではなく、発生過程での構造異常が確認された症例のiPSを使うことで、より細胞レベルの関与がわかりやすいようにした素晴らしい計画だと思う。
最初に調べたのは、脳神経細胞が出来るまでの発生過程に異常があるかどうかで、樹立したiPSを大脳皮質神経細胞へ分化させる過程での遺伝子の発現を正常と比べ、ASDの神経分化に時間的・質的ずれがあるかどうか調べている。
すこし専門的になるが、iPSをまず全ての神経系細胞に分化できる神経幹細胞(NSC)を誘導し、この細胞を起点に「ヨーイ・ドン」で分化を誘導し、14日間観察を続けている。この期間に分化してくる神経細胞だけを取り出して遺伝子発現を調べ、正常iPSとASD・iPSからの分化を比べている。
実験自体はあまりに膨大なので詳細を省くが、このiPS、NSC,そして分化細胞へと進む過程で、分化開始直後に発現量がすこし落ちてから、その後徐々に発現が上昇するパターンを示す一群の分子(TM1遺伝子群と呼んでいる)だけが、ASD神経分化課程でつねに発現量が高いことを見いだしている。
と言われても、一般の人には何が何だかよくわからないと思う。ただASDで異常が見つかる分子群には、例えば軸索伸長必要な遺伝子など神経の分化に関わる分子が多く、しかもこの変化に一致して、培養中の神経細胞が長い足を伸ばし、試験管内で複雑なネットワークを造ることから、神経ネットワーク形成がASDのiPSでは確かに変化していることがわかる。また、同じようなASD特異的変化は、神経細胞を立体培養して形成させた、小さな脳組織でも認められることを確認している。
治療可能性を探る
これだけでも面白いのだが、Gage たちは発見した現象の背景にある分子レベルの原因を発見するための努力を惜しまない。この結果、彼らが急に発現が変化することを発見したTM1遺伝子群の中から、発生上の変化に関わるキーとなる変異分子FBX03を特定している。そして、FBX03を正常NSCに導入すると、正常細胞の分化のタイミングが変わり軸索伸長能力が高いASD型に変化することを明らかにする。
さらに、Gage たちは治療可能性を探ろうと努力する。NSCから分化細胞への過程でASDの異常が現れるとすると、NSCをすっ飛ばしてiPSから直接分化神経細胞を誘導すればASD型の異常は起こらないはずだと着想し、この可能性を調べている。結果は期待通りで、iPSから直接分化したASDの神経細胞は、ASDの異常は見られなかった。
最後に、ASDでおこる異常分化誘導の前後で染色体の状態を調べ、ASDで見られた異常の多くがエピジェネティックと呼ばれている、遺伝子の使い方の変化によることを明らかにしている。
かなり専門的でわかりにくい話だと思うが、以上の結果をもう一度まとめると、ASDでは神経幹細胞から分化が始まる早い段階で、スウィッチが入って分化に関わる特定の遺伝子群で染色体の抑制が緩み、これらの遺伝子の発現量が上昇する。その結果、神経細胞の突起が長くなりすぎるなど発生異常が起こり、脳の構造変化が誘導されるというシナリオが示された。そしてこの異常シグナルをスキップできれば、ASD型の細胞変化は起こらない。またこの変化の鍵となる遺伝子FXOB3なども特定され、今後治療標的として研究が進むと期待できる。
広く深い知識に裏付けられ、これでもか、これでもかと実験が行われている研究だが、最も重要なメッセージは、やる気になればiPSで、複雑な過程の解析が可能であることが示された点だ。
GageはiPSを用いた細胞治療の実用化で世界をリードする神戸の高橋政代さん、京都の高橋淳さんの先生でもある。この二人を育てたことを足して考えれば、Gageの神経疾患治療への貢献度は他を寄せ付けないように思える。


