2022年6月19日
1日途切れてしまったが、集中掲載最終回となる第5弾は、自閉症の科学でこれまで何度も紹介してきたゲノム研究を、総合的にまとめてくれたとさえ言える、カリフォルニア大学サンディエゴ校からの論文を紹介する。タイトルは「A phenotypic spectrum of autism is attributable to the combined effects of rare variants, polygenic risk and sex(自閉症の形質のスペクトラムはレアバリアント、多遺伝子リスク、そして性差に帰せられる)」で、6月2日 Nature Genetics にオンライン掲載された。
これまで「自閉症の科学」でもっとも多く扱ってきた分野は、おそらくゲノム研究分野ではないかと思う。というのも自閉症スペクトラム(ASD)を構成するゲノムの多様性を目の当たりにすると、ASDを単純に正常/異常と分けるのではなく、人間の脳の膨大な多様性のなかの一群としてとらえるべきだという、neurodiversity (神経多様性)の考えをはっきりと実感できるからだ。
このコーナーを読んできていただいた皆さんの頭の中には、レアバリアント、コモンバリアントという言葉が、少なくとも単語としては刻み込まれているのではないだろうか。ここでもう一度簡単に解説しておこう。
私たちのゲノムは30億塩基対からできており、どの場所で変異が起こってもいいが、集団で見ると無秩序に配列変異がおこるわけではない。私たちが生きるためには、約2万個の遺伝子の機能を支えるための決まった配列が存在し、またそれ以外の部分でも、変異が入ると生命に関わる箇所は無数に存在しているため、集団の中でそんな変異が見つかることはほとんどない。このような生命機能に関わる変異をレアバリアントと呼んでいる。
一般的に遺伝子病と呼ばれている変異はほとんどがレアバリアントのことだ。そして、レアバリアントの中には、極めて低い頻度とはいえ集団の中で、ほそぼそと遺伝的に受け継がれている変異と、生殖細胞の発生から個体の発生初期に新しく発生した変異(デノボ変異と呼ばれる)に分かれる。ASDの場合、このようなレアバリアントは脳の発生過程に影響することで、ASD発症に大きな影響力があると考えられている。
一方、生命機能に強い影響はないが、変異により一定の形質変化が起こり、例えば病気のリスクになるような変異がある。レアバリアントと比べると、命に関わる程度が少ないので、集団の中に一定の頻度で遺伝的にい受け継がれ、コモンバリアントと呼ばれている。このようなコモンバリアントは、必ずしも病気のリスクに連結するのではなく、例えば顔貌の違いや、身長、そして性格や身体能力などの差につながっている。この意味で、コモンバリアントは、個人の特異性の源といっていい。
ASDのゲノム研究が始まった当初は、検出の容易なコモンバリアントの探索が行われ、予想を超える数のASDと連関するコモンバリアントが発見された。もちろんどの病気でも、その発症に関わるコモンバリアントは複数個存在する。例えば、コロナウイルス感染重症化についての報告を見ると、20近いコモンバリアントが特定されている。しかし、ASDと相関するコモンバリアントは、200近く存在することが明らかにり、数の上で別格であることがわかった。すなわち、コモンバリアントからASDを眺めると、ASDは極めて多様な、しかし小さな変化の組み合わせからなる、まさに neurodiversity の状態であることがわかる。
その後、解析されたASDの数が万の単位になり、さらにエクソームや全ゲノム配列解析が集まってくると、先に述べたレアバリアントも発見されはじめ、これまで紹介したように、現在ではASDと相関するレアバリアントがリストできている。また、期待通りコモンバリアントと比べると、レアバリアントとASDとの相関は強いことも明らかになってきた。
この研究は、これまで集まった3万人規模のASDとの相関が確認されたレアバリアント、コモンバリアントを集め、レアバリアントもデノボの変異と、それ以外に分けて分類し、それぞれのASD発症への寄与度を計算した研究だ。その意味で、これまでのゲノム研究の一つの集大成と考えられる論文だと言える。
結果は、これまでの研究から想定されていた結論と同じだ。
まず、個々のバリアントについてその寄与度を調べると、どのタイプでもデノボ変異の寄与度は大きい。そしてレアバリアントの中には集団の中で維持出来ているものもあるが、ASDで遺伝性のレアバリアントが関与する程度は低い。すなわちほとんどのレアバリアントが集団内で選択除去されているからだと言える。このことは、ASDの多くでは、遺伝と言うより、個人に特有の新しい変異が寄与していることを示している。例を挙げると、レット症候群やFOPなども、ほとんどがデノボの変異だが、これと同じと考えてもらっていい。
ただ、レット症候群と大きく異なるのは、一つのレアバリアントだけで発症しない点だ。個々のコモンバリアントの寄与度は低いが、集まってくることでASD発症に重要な役割を演じている。トータルで見ると、レアバリアントとコモンバリアントは同じ程度にASDに関与している。すなわち、ASDはコモンバリアントとレアバリアントが組み合わさっていることがわかる。すなわち、一つのコップに2種類の水を注いでいっぱいになった状態と同じだ。このため、レアバリアントの寄与が大きい場合、必要なコモンバリアントの寄与度は減る。
これを裏付けるもっと面白い例が男女差で見られる。女性では必要なレアバリアントも、コモンバリアントの組みあわせも、男性より遙かに多い。すなわち女性を、ASD発症まで満たすために多くの変異が必要なコップに例えることが出来る(変異を多い少ないと表現しているが、単純な数ではなく個々の変異の寄与度の和と考えて欲しい)。
このようにそれぞれの変異を分類しておくと、個々の症状に対するそれぞれの寄与度も計算できる。例えばASDに見られる運動の連携障害はデノボの変異と強く関わっているが、コモンバリアントの寄与はほとんどない。一方、社会性を測るSocial Communication Questionaireテストでは、コモンバリアントの寄与の方がデノボの変異より大きい。
さらに、コモンバリアントと異なり、デノボの変異の寄与度は、出産時の両親の年齢と強く相関していることも、これまで示されてきたとおりで、生殖細胞の形成過程の変異が、ASD発症に大きく関わることが確認された。
残念ながら、これまでの多くの研究をひとまとめにしたと言うだけで、新しい発見があったわけではない。しかし、前回紹介した構造の変異も含めて、ASDをコモンな違いと、レアな違いに分けて考えていく必要性がうまくまとめられており、大変参考になる論文だった。
これまで紹介した論文も含めて、この論文を再度まとめると、
自閉症は、性差も含めて様々な遺伝子の多型や変異が集まって形成される。 この点からASDの遺伝性を説明することは出来るが、それでもASD特異的変化を強く誘導する変異は、個体が生まれる過程で発生したデノボの変異によるところが大きい。 男女差と変異の関係から、変異が集まって発症するまでの過程で、それぞれ個人の器のキャパシティーが大きく影響していることがわかる。このことから、このキャパシティーを変化させる方法を開発することが、今後の重要な課題になる。 症状に関しても、コモンバリアントの寄与が大きいものと、レアバリアントの寄与が大きいものに分かれるので、この点を考慮した対策も今後の課題になる。 以上、5回にわたって、様々な論文を紹介したが、参考になれば幸いです。
2022年6月17日
2006年、英国University College Londonの研究者が、ロンドンのタクシードライバーの海馬灰白質が、同じ路線を繰り返し走るバスドライバーと比べて大きいと言う面白い論文を報告した。灰白質は神経細胞の数に相当するので、この結果は鍛えれば海馬の神経細胞は増やせられるのではと、大きく報道された。
ロンドンのタクシードライバーは資格基準が最も厳しいとされているが、この結果は解剖学的変化をある程度脳の機能と相関させられることを示している。
このことから、MRIを用いて微妙な脳構造の違いを特定し、ASDの早期診断が可能かを調べる研究が続けられており、論文ウォッチでも以下の2論文を紹介している。
ただ、これらの研究はASDを典型児から区別することだけを目的としていた。
しかし、ASDはスペクトラムと呼ばれるように極めて多様だ。またゲノム研究からも、典型児にも一定の頻度で見られる、一種の性格を反映すると考えられる頻度の高い多型(コモンバリアント)と、ASD発症の後押しになっているような、ASD特異的と言ってもいい稀な多型(レアバリアント)が混じっていることが示唆されている。すなわち、ASDの理解には、ASD特異的な変化と、ASD内の多様性に対応した変化を分けて調べることが望ましい。
今日紹介するボストンカレッジからの論文は、ASDのMRIデーータベースを用いて構造解析データを機械学習させるとき、contrastive learning(対照学習)を用いることで、ASDに関わる脳構造の特徴と、ASD内での多様性を区別して特定できることを示した研究で、6月3日Nature Neuroscienceに掲載された。
機械学習の話なので、ほとんどの議論が、ASD全体で共有される特徴と、ASDの間に見られる多様性を区別して捉えるためには、対照学習が遥かに優れていることの証明に費やされている(対照学習については是非自分で調べてほしいが、写真などの違いを自動的に比較し、似ている程度で分類していく機械学習法ぐらいに理解してもらえれば良い)。実際、対照学習法を用いて区別したASD特異的変化は、MRI撮影に使ったスキャナーの差にほとんど影響されないが、ASD間に見られる多様性の一部を説明できることを示している。すなわち、どこで検査したかはASDの診断には影響しないが、ASD間の多様性の原因になることは頭に入れておく必要がある。
一方、ASDの診断に使われる様々な指標は、全てASD特異的変化と強く相関するが、ASD内の多様性とは関係しないことも明らかになっている。すなわち、長年磨き上げられてきた信頼できる診断基準と、ASD特異的変化の関係を今後研究することの重要性がわかる。
ASD特異的差を除いた後の、ASD間で多様性が見られる脳領域は、かなり広い範囲に及んでおり、個々の領域の変化の意味と他の症状との関連については全く議論されていない。ただ、予想通り、ASD特異的な差と異なり、それぞれの領域の変化は、連続的で、どこまでが病的でどこまでが正常と線は引きにくいことが示されている。
以上が結果で、要するに対照学習により、ASD診断に関わる脳構造の変化と、個人間の変異を分けることができるということが結論で、ここで示された現象の意義については、全て今後の研究に投げているように思う。とはいえ、個人的には性格とオーバーラップする脳構造の多様性がなんとか抽出できるようになったことは、私たちのASD理解に新しい視点を与えてくれたと期待して、少し難しい論文だが、紹介する。
2022年6月16日
今日の論文紹介は、実験的科学というより、単純なアンケート調査と思って欲しい。
私は臨床に全く携わっていないので、現在日本で自閉症あるいは自閉症スペクトラム(ASD)の診断がどのように行われ、診断後どのような医療を受けられているのかは正確に把握できていない。ただ、早く診断されると、様々な公的な支援は受けやすいだろうし、同じ問題を抱える人たちとのコミュニティーも形成しやすい。一方で、我が国でも依然として差別や無理解があるため、ASDを理由に様々なストレスを受ける心配があり、このことが診断を受けるのを遅らせる要因になると思う。
今日紹介するニューヨーク大学からの論文は、この問題を「自分が自閉症であることを早く知った方がよかったか、できるだけ遅く知った方がよかったか」という質問を、大学で学ぶASDの学生にぶつけた調査結果で、4月11日のAutism にオンライン出版された。タイトルは「Does learning you are autistic at a younger age lead to better adult outcomes?:A participatory exploration of the perspectives of autistic university students(「自分が自閉症であることを若い時に知った方が、その後の人生で良い結果をもたらすと思いますか?」について自閉症の大学生への参加型調査)」だ。
これは自由参加の研究なので、参考にはなっても科学的に結論を出せる研究ではない。しかし、これまであまり問われてこなかった問題をとりあえず聞いてみたと言う点で、今後の研究にや役立つように思う。
実際には次の3つの質問を、現在大学で学ぶASD学生に質問して78人から回答を得た小規模調査だ。また、大学生と言っても、18歳から54歳までの年齢層が混じっている。
調査では
自分が自閉症であることをいつ最初に知りましたか? 自閉症であることをどのように知りましたか? 自閉症であると聞いたときどのように感じましたか? の三つの質問に答えてもらっている。
まず1番目の質問については、16−19歳が最も多く、あとは5歳までから15歳まで大体同じ割合で自閉症認知時期が分布している。米国でも診断が遅れることも多いことがよくわかる。
そして、認知時期とその後の生活の質を計算すると、基本的には早く知ったほうが、あとの生活の質が高まることがわかる。おそらく、様々な公的支援や、ASDコミュニティーにアクセスできることによる支援などが大きな要因だろう。
一方で、初めて知ったとき、それをポジティブに受け止められるかに関しては、成人に近づくほどポジティブに受け止められ、思春期以前ではどうしてもネガティブに受け止めてしまう傾向が見られている。
結果は以上で、総合的には早く診断して様々な支援を行うことが良いと言う結論になるのだろうが、心の問題などについては、まだまだ調べる必要があると思う。いずれにせよ、まず思いついた疑問を調べたという段階だが、間違いなく重要な課題を掘り起こしていると思う。このような問題は、国ごとに状況が異なるので、是非我が国でも調べて欲しいと思う。
2022年6月15日
集中紹介2回目は、3月10日「論文ウォッチ」で既に紹介している論文だが(https://aasj.jp/news/watch/19224 )、遺伝的に起こった自閉症スペクトラム(ASD)症状を、行動学的に克服する方法にチャレンジしている点で、もう一度取り上げ、できるだけわかりやすく解説したい。
自閉症の科学はすでに50回を越しているが、遺伝的背景を探る論文が多かったように思う。ちょうど病気のゲノム研究が急速に進む時期と重なっており、また結論が出やすいということが、ゲノム研究がトップジャーナルに掲載され易かった要因だと思う。しかし、遺伝的要因があると結論して、後は遺伝子治療に任せると治療を諦めるのでは、本末転倒になる。遺伝的背景を分かった上で、遺伝と行動との間を結ぶメカニズムを解析し、その上で遺伝的背景を克服できる治療法を開発するのが医学の務めのはずだ。
その意味で今回もう一度取り上げるスイスバーゼルにあるミーシャー研究所のグループが5月4日発行のNeuronに発表した論文は(下図)は、動物モデルとはいえ、遺伝的な縛りを克服するための行動学的方法を探ったという点で、大変重要だと思う。
研究では、Shank3と呼ばれる遺伝子が欠損したマウスを用いている。このマウスは、新しい体験に戸惑い、そこから逃避するため自己反復行動を示すという点で、ASDの症状を再現しているとモデルとして、これまで多くの研究に用いられている。
実際の実験は、あまりに専門的になるので、実験の詳細は省いて、結果だけをわかりやすく解説してみる。
繰り返すが、研究の目的は、ASDモデルの行動異常を脳科学的に解析し、この異常を克服できる方法を開発することだ。
まず徹底的に行動解析を行っている。その結果、ASDモデルマウスは、新しい経験からいつも逃避しているのではなく、新しい経験が、前に経験したセッティングに似ている場合のみに、異常行動を示すことを明らかにする。すなわち、新しい経験と記憶された経験が同じかどうか比べられる場合だけ、その差に囚われてしまって、新しい経験を避けて自己反復運動に落ちることを明らかにしている。
例を挙げてさらに説明してみよう。例えば、椅子とベッドがある寝室に初めて入ったとすると、ASDモデルマウスも、正常マウスも行動は変わらない。また、この経験を記憶したあと、次にキッチンに入っても両者の行動に変化はない。ところが、最初の寝室を記憶したあと、寝室にベッドと、椅子の代わりに棚が置かれた部屋に入ると、正常マウスは棚に興味を示すのだが、ASDモデルマウスは、棚を避けて、ベッドの上で自己反復行動に陥る。
このように行動異常が特定できると、次は脳回路の解析になる。今回解明された脳回路について誤解を恐れず、極めて単純化して説明すると次のようになる。
新しい経験についての記憶が成立するとき、前頭葉での記憶回路だけでなく、これがドーパミン回路と連結することで、記憶が安定化し、新たな経験を脳にきざみこむのだが、ASDモデルマウスではこの時分泌されるドーパミンの量が普通より強く、その結果最初の経験の記憶の影響力が高まってしまう。そのため、次の時にそれと似た経験をし、最初の記憶が強く蘇ると、この時の記憶と同じでないことにこだわって、自己反復的な行動に陥ると言う説明だ。
実際、最初の記憶が成立するとき、ドーパミン分泌を抑えてやると、ASDモデルマウスでも行動は正常化し、自己反復行動はなくなる。また新しい経験をするとき、刻み込まれた記憶からドーパミンが分泌される線状体への回路を抑えてやると、同じように行動は正常化する。まだまだわかりにくいかもしれないが、要するに異常に強い記憶が形成されてしまって、それに縛られてしまうことがASDモデルマウスの行動異常の背景にあると言っていいだろう。
薬理的な治療実験で、ドーパミン分泌抑制や、前頭葉から線状体への回路遮断で行動が正常化することが示されたが、このような治療法を人間で行うことは難しい。
この研究の素晴らしさは、薬理的な実験で終わらずに、人間でも実現可能な方法をマウスモデルで探っている点だ。単純な体験の記憶が強く刻み付けられることを防ぐため、新しい体験を複雑で多様なセッテイング(例えば様々な遊具が同じ場所に置かれていて、自由に体験できるような)で行わせ、一つの対象に記憶が固定されないようにすると、行動異常はほぼ解消されることを示している。
他にも、最初の体験時に、馴染みの床敷きの匂いを加えておくだけで、記憶が強まりすぎることを防げることも示している。
これを人間に置き換えると、いつもできるだけ様々な刺激が同時に存在する豊かな環境で育て、そこには常に馴染みの匂いや音がそっと寄り添うようにすることで、新しい体験から逃避する行動を防ぐことができるという方策が示された。
脳は可塑的なので、遺伝的縛りがあっても決して諦めるなと言うことを、見事に動物を使って示した重要な研究だと思う。
2022年6月14日
だいぶ間が開いてしまったが、自閉症の科学として紹介したい論文が溜まってきたので、連続で紹介したいと思っている。
最初は、6月2日 Nature Medicine にオンライン掲載された、炎症性腸疾患(IBD)と自閉症の関係について調べた英国ブリストル大学からの論文だ。
多くの方は「IBDと自閉症?どんな関係があるの?」とその取り合わせを不思議に思われるのではと思う。ところが、両者の関係はこれまで何度も議論の的になっており、なんと捏造スキャンダルまで発生しているのだ。
1998年臨床のトップジャーナルThe Lancet に、麻疹ワクチン接種により、回腸の炎症性疾患と自閉症が合併して誘導されるとする論文が発表された。しかも記者会見まで行いこの論文が大々的に宣伝された結果、当時英国で麻疹ワクチン拒否がおこり、接種率が5割に低下、その結果多くの児童が麻疹にかかり、死者が出た。
これだけなら、リスクとベネフィット問題で終わるのだが、その後一人のジャーナリストの執念により、この論文が全くの捏造であることが明らかになり、12年を経てThe Lancetもようやく論文を取り下げることになる。
おそらく自閉症と炎症性腸疾患が簡単に結び付けられる要因の一つは、自閉症児に慢性の便秘や下痢が高頻度に見られること(https://aasj.jp/news/watch/6791 )だが、これ以外にも統計的解析から、自閉症児は典型児より5割多くクローン病になりやすく、潰瘍性大腸炎に至ってはほぼ2倍なりやすいという報告が発表されている。
この原因については、自閉症に関わる遺伝子の中にIBD発症とリンケージする遺伝子があるとする考え方と、母親の持つIBD(当然子供も同じゲノムを受け継ぐが)が、妊娠期から授乳期にかけての子供の発達に影響を及して、独立に子供の自閉症発症を助けるという考えが提唱されてきた。ただ、どうしても調べる対象の数が少なく、はっきりとした結論を得るまでには至っていない。
これに対し、自閉症についての情報も含まれている、現在得られる最も大規模なデータベースを駆使してこの問題を解こうとしたのが、今日紹介する英国ブリストル大学からの論文で、6月2日Nature Medicine に掲載された(下図)。
この研究では自閉症の、1)自閉症の親がIBDと診断される頻度、2)IBDと自閉症と相関するゲノム多形のリンケージ、3)母親のIBD発症に相関する遺伝子多形と、子供の自閉症発症に関わる遺伝子多形の相関、などが調べられている。2)、3)は、要するにIBD と自閉症に関わる共通の遺伝子があるかについての検討と言っていいだろう。
スウェーデン人大規模家族調査、50万人UK バイオバンク、AVON大規模親子コホートなどのビッグデータをもとに、私も理解が難しいビッグデータ処理法を用いた研究なので、詳細は全てすっ飛ばして、結論だけをまとめると、
親のIBD、特に母親がIBDと診断される場合、子供に自閉症が発症する率はオッズ比で1.32倍で、明らかな相関がある。 一方、自閉症とIBDのリスク遺伝子が、リンケージや相関している可能性はほとんどない。 となる。すなわち、ゲノムから見た時IBDと自閉症は全く独立した状態だが、しかし母親のIBDは妊娠中、あるいは乳児期の幼児の脳発達に影響する可能性が高いという結論だ。
おそらくIBDに限らず、妊娠中の母親の炎症は胎児の脳発達に影響すると考えられるので、妊娠を希望する場合は、歯周病も含めできるだけ炎症の元を遮断する必要がある。
2022年2月23日
現在まで、FDAにより認可された自閉症スペクトラムに対する薬剤は存在しない。ただ、様々な症状を抑えるために例えばrisperidoneやaripiprazoleなどが使われることもあるが、副作用も強く、未成年への投与は難しいことが多い。
これに対し、最近注目されているのが便移植による治療だ。ASD児の腸内細菌叢をマウスに移植すると、社会行動や反復行動異常が出現するという結果をよりどころにしており、期待できる結果も報告されている。
ただ便移植治療の問題は、薬剤と違って何を投与しているのかについての明確な指標が無く、結果は運任せになってしまう点だ。もし、便移植の効果のメカニズムがはっきりすれば、この過程に関わる分子を標的にすることで、より科学的治療方法が可能になると期待される。
このゴールを目指して多くの研究が進んでいるが、今日紹介するカリフォルニア工科大学からの論文は、ASDの腸内細菌叢が行動に及ぼす影響の分子メカニズムを明らかにし、それを標的にした治療法を開発し、ASDに対する治験研究にまでこぎつけた点で、トップランナーといっていいのではと思い、自閉症の科学52として取り上げることにした。
このグループが明らかにした、腸内細菌叢により不安神経行動が現れるメカニズムについては以前紹介したが(https://aasj.jp/news/watch/19079 )、次のようにまとめられる。
1)ASDでは4エチルフェノール(4EP)が腸内細菌叢により多く合成され、それが肝臓を通る間に硫化され4EPSへと変換され、血中4EPS濃度が上昇する。
2)4EPや4EPSはオリゴデンドロサイトの成熟を妨げ、神経のミエリン形成が抑制され、脳内の結合性が低下する。
3)この変化が特に不安神経症に強く表れる。不安神経症は、オリゴデンドロサイトの成熟を促進するclemastine fumarateにより改善する。
以上の結果は、1)オリゴデンドロサイトの成熟、及び2)腸内での4EPの合成、がASD治療の標的になり得ることを示している。
clemastine fumarateは抗ヒスタミン剤として使用されており、ASDに対する治療薬として治験研究へ進むためのハードルは低いが、米国の治験サイトを調べる限りまだ治験には至っていないようだ。トライする価値はあるように思える。
今日紹介したい論文では、もう一つの標的、腸内細菌により合成される4EPを腸内で吸着するために新しく開発された吸着剤を服用することで、不安神経行動や反復行動とともに、ASDの一般評価指標も改善することを示した、期待を抱かせる論文だ。
タイトルにあるように、この治験で使われたのは、食品から発生する毒物を吸着して安全性を守る目的で使われるsequestrant(金属キレート剤)AB-2004で、これを経口で服用することで腸内で発生する4EPを吸着し、便と一緒に排出しようという戦略だ。
まず4EPを合成する細菌叢により不安行動が誘導される系で、AB-2004が血中4EPSを低下させ、期待通り不安行動を抑えることを確認し、安全性とともに有効性を調べるI/II相臨床治験に進んでいる。
様々な指標でASDと確定された、平均12-17歳の男女30人ををリクルート、徐々に服用量を増やしながら、8週間AB-2004を服用させ、まず安全性、そしてASD臨床診断指標の改善や、不安神経行動の改善が見られるのかについて調べている。
結果は素晴らしい。まず、服用が原因と言える様々な副作用は確かに見られるが、いずれも軽度で、最終的に97.5%が計画通り治験を終えてることが出来ている。
次に、AB-2004を投与すると腸内で4EPを吸着して、体内への吸収をブロックでき、最終的に血中の4EPSを約1/3程度に抑えることが確認された。ただ、服用をやめると血中濃度は元に戻る。
次に、マウスで確認されている不安神経行動の改善、さらに刺激に対する過敏性について調べると、両方ともはっきりと改善が見られた。面白いことに、不安神経行動については、AB-2004の服用をやめても、低い状態が続いた。
加えて、社会反応指標(SRS)や異常行動チェックリスト(ABC)でも、著しいとは言えないが一定の改善が見られている。
さらに、機能的MRIを用いて領域間の結合性を調べると、扁桃体と前帯状皮質の結合性が上がっている。これは、4EPSによるオリゴデンドロサイトの成熟抑制と、それに続く神経結合性の低下が、一定程度防げていることを示し、期待できる結果だ。
以上、結果はおそらく期待以上にすばらしく、この結果に基づいて次の治験段階が既に進行しているように思える。勿論今回のデータだけから、無作為化し偽薬を使うた第三相の試験がうまくいく保証はない。しかし、メカニズムから治療まで、論理は一貫しており、また血中4EPSを抑えることは確認されているので、うまくいく可能性も十分期待できる。とすると、FDAが承認する最初のASD治療薬になる可能性は高い。
調べてみると、この治験を進める会社、Axial Therapeuticsには投資が集まっているようで、開発は順調に進んでいるのだろう。不安行動が消えるだけでもいいので、是非成功して欲しい。
2022年2月16日
自閉症の科学50で紹介したように、解剖学的にも組織学的にも、脳にほとんど変化が見られない自閉症スペクトラム(ASD)も、よく調べるとシナプス抑制機能を持つ介在ニューロンの数が減少しており、これが神経興奮が起こりやすい状態の原因で、例えば振幅の短い脳波(γ波)の上昇や、同時的な神経興奮(ひどい場合はてんかん)を起こしている可能性が指摘されている(https://aasj.jp/news/autism-science/18807 )。
このことは、ASDの理解に、介在ニューロン発生過程の理解が欠かせないことを示しているが、興奮ニューロンと比べると介在ニューロンの発生についてはわからないことが多い。幸い、2月に入ってから介在ニューロンの発生に関わる優れた論文を論文ウォッチで3編も紹介した。そこで、これら3編の論文をもう少しわかりやすくして、まとめて説明することにした。また、このまとめについては明日(2月17日)4時から岡崎さんとYouTubeで詳しく解説する予定にしているので、是非聞いていただきたい(https://www.youtube.com/watch?v=a2s2uRRN0r8 )。
わかりやすく説明すると言ったものの、どうしても専門論文の紹介なので、その内容を十分楽しむためには基礎知識が必要になる。まず最低限の知識として、興奮ニューロンと介在ニューロンの発生の差について図を使って確認しておこう。
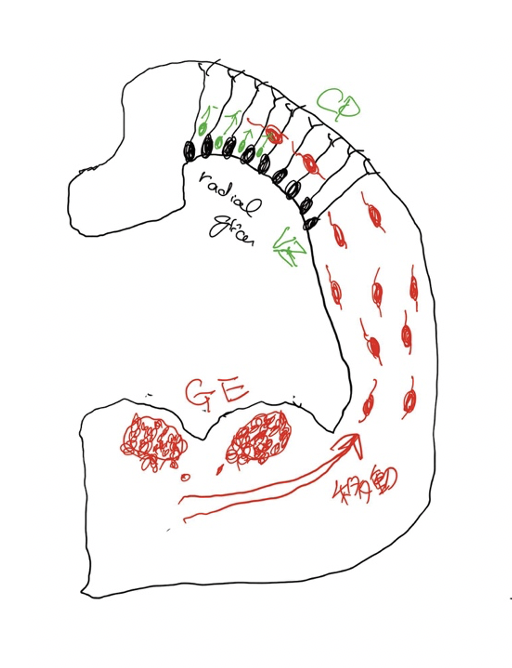
ganglionic eminence(GE)と介在ニューロン このつたない図は、発達中の脳を輪切りにしたものだ。図の上部は最も新しく進化してきた新皮質と呼ばれる部分に相当し、ここに存在する神経細胞(黒で描いている)がラディアルグリア細胞(RG)で、脳皮質を形成する主役だ。この細胞は増殖を続けて皮質神経を生産する幹細胞の働きがあり、皮質興奮ニューロンは全てRGに由来している。RGは皮質の脳室側から皮質側まで突起を伸ばしており、分化を始めた神経のレールの役割も果たし、皮質の神経層を形成する。
中間部の旧皮質に続いて、腹側に存在するのがganglion eminence(GE)で、脳室に飛び出しているのでeminence(突起)と名付けられ、外側(LGE)と内側(MGE)、およびこの図には示していない尾側(CGE)に分けられる。介在ニューロンはこのGEで増殖分化し脳全体へ移動して分布する。さらに、誕生後も一定期間介在ニューロンのリクルートが続くことが知られている。
実験動物では、これらの過程はよく研究されているのだが、人間の発生については様々な制限がありわかっていないことが多い。と言うのも、様々な細胞が混在する組織の中で未分化な介在ニューロンを特定することが困難なためだ。
この問題を、MGEで増殖する未熟介在ニューロンを特定する分子マーカーを用いて解決し、14週から39週までの人間の胎児脳内で介在ニューロンが増殖分化する様子を詳しく観察したのが1月28日にScienceに発表されたカリフォルニア大学サンフランシスコ校からの論文だ。
このような研究が可能なのは、死亡した胎児脳組織の利用が許されているからで、LGEとMGEでは異なる介在ニューロンが造られていること、そしてMGEでは未熟な介在ニューロンの幹細胞が細胞塊を形成して細胞を作り続け、この塊を離れた細胞が分化を始めて脳内に移動する様子が克明に記述されている。
重要なのは、周りの組織の密接な指示に従って増殖・分化する興奮ニューロンと異なり、未熟介在ニューロンは細胞集塊形成が始まると独自に増殖環境が出来る点で、この塊から離れることで、自動的に細胞分化と移動が始まるシステムができあがっている。
このことは、未熟介在ニューロンを生きた幹細胞のマウス胎児脳へ移植する実験で、明確に示すことが出来る。ヒト胎児組織から未熟介在ニューロンを取り出し、胎児脳に移植すると、移植されたマウスが生まれてからも1年以上生き残り、生後90日目まではマウスの脳内で増殖し続けることが示されている。さらに、マウス脳内でも増殖細胞の塊から離れた細胞が分化し移動することも観察できる。
この発見は、ASDでの介在ニューロン機能を調べる将来の研究にとって重要だ。もしASDで介在ニューロンの発生に変化があるとすると、未熟な介在ニューロンさえ手に入れば、その変化を細胞レベルで研究できる可能性が生まれた。個体を分子レベルで研究するためには、細胞レベルの実験系が欠かせない。
この研究ではヒト細胞のマウス脳への移植が方法として用いられたが、試験管内オルガノイド培養(脳組織と似た立体培養)を用い、介在ニューロン発生をて再現することも可能だ。このことを示すのが、つぎに紹介するオーストリア科学アカデミー研究所からの論文だ。
最初の論文では、正常発生でも、未熟介在ニューロンはあたかもガンのように自律的に増殖していることが示された。これは発生過程と発ガン過程が紙一重であることを教えてくれる。2番目の論文は、mTOR と呼ばれる細胞内代謝の核になる分子の活性が上昇することで、介在ニューロンのもつ自律的増殖能力の抑制が効かなくなり、結節性硬化症として知られる多発する良性腫瘍が生まれることを示した重要な貢献だ。
結節性硬化症とは、mTORの機能を調節するTSC遺伝子が片方の染色体から失われることで、胎児や乳児の全身に様々な良性腫瘍が発生する遺伝病だ。脳内では上衣下巨細胞性星細胞腫(舌を噛みそうな専門用語なので気にしないで読み飛ばして)と呼ばれるグリア腫瘍とともに、皮質内に結節が発生する。患者さんは腫瘍だけでなく、ASD症状やてんかんを発症することが知られており、結節性硬化症でも介在ニューロンの発生異常が背景にあるのではと疑われていた。腫瘍形成については、TSC遺伝子の機能が失われることで腫瘍が発生する典型的ガン抑制遺伝子欠損による腫瘍で、TSCの発現が低下し、mTORが過剰に活性化することで、腫瘍が発生すると考えられている。
この研究の目的は、まず結節性硬化症でおこる皮質内結節(Cortical Tuber)を試験管内で再現することだ。この目的のために、著者らはTSC2遺伝子が半分欠損している2人の患者さん由来iPSを樹立。オルガノイド培養法を用いてiPSから脳組織を誘導し、患者さんと同じ皮質内結節が形成されるか調べている。このとき患者さんのiPS細胞の遺伝子変異を、クリスパー遺伝子改変技術を用いて正常化し、コントロールとして用いている。これにより、遺伝的に多様な人間とはいえ、一つの遺伝子だけに着目してその機能を調べることができる。
結果だが、培養開始後90日目まで、TSC2欠損の影響はほとんど見られないが、オルガノイドの成熟が徐々に進み110日目になると、TSC欠損グループでは結節性の増殖が高まることが明らかになった。さらに結節の細胞の性質を詳しく見てみると、ほぼ全てが先の論文で紹介した3つのGEのうち尾側GE(CGE)で増殖する未熟介在ニューロン(CLIP)に対応することが明らかになった。すなわち、介在ニューロンが皮質に移動しても増殖を続けることで皮質内結節が発生する。
正常の介在ニューロンが元々高い増殖力を有することはすでに見た。しかしこのように高い増殖力があっても皮質内結節は発生しない。なのに、mTORの活性を抑えるTSCの発現が半分になるだけで皮質内結節が100%起こってしまうのかについては次のように説明される。
未熟介在ニューロンでは増殖に必要な高いmTOR活性を維持するため、もともとTSCの発現が低く抑えられている。すなわち、腫瘍と紙一重の状況にある。そこに片方の染色体のTSCが欠損してしまうと、CLIPのmTOR発現はさらに高いレベルに変化し、腫瘍性結節が形成されることになるわけだ。
以上、これまで謎の多かった結節性硬化症の皮質内結節の由来が明らかにされ、これがCGE由来介在ニューロン発生過程異常として理解できるようになったことは、ASDの理解にも重要なヒントになる。
まず結節性硬化症の患者さんで、皮質内結節とともにてんかんやASDが高発することは、ASDが介在ニューロンの発生異常に起因することを示している。 患者さんではmTORの活性がさらに高まった結果、脳内で作られる未熟介在ニューロンの数は増えていると思われるのに、生まれてきた患者さんでは、てんかんのように介在ニューロンの活性低下が起こっている。すなわち、いくら未熟介在ニューロンの数が増えても、正常分化が起こらないと介在神経欠乏になる。 TSC欠損の影響は他の介在ニューロンに見られてもいいのに、CGE由来介在ニューロンだけで異常が見られることは、介在ニューロンの発生過程が多様であることを示しており、ASDを理解する上でも、介在ニューロン分化の多様性を頭に置いておく必要がある。 ただ、試験管内の実験系がそのまま人間のASD発生過程を反映できるかはまだまだ分からない。これらを裏付けるかのような研究が、最後に紹介したいハーバード大学からの研究だ。
欠損すると巨頭症の様な脳の発生異常とともにASDを併発することが知られている3種類の遺伝子、SUV420H1、ARID1B、CHD8に着目し、これら遺伝子欠損に見られる共通の障害を脳のオルガノイド培養を用いて調べた研究で、2月10日Natureにオンライン掲載された。
この研究が注目した3種類の遺伝子は、遺伝子発現を調節するクロマチンの調節に関わる遺伝子で、TSCのように直接細胞増殖に関わる遺伝子ではない。しかし、欠損すると巨頭症などの発生障害とともにASDを発症する。すなわち、ASDを発症させる共通の発生異常が起こると考えられる。
研究の目的は、ASDにつながる共通の発生異常を再現し、メカニズムを解析することだ。このために、それぞれの遺伝子を、同じiPS細胞株で欠損させ、欠損細胞の脳オルガノイド培養を行い、そこで見られる異常を調べている。
人間の脳のオルガノイド培養と簡単に述べているが、この研究でもなんと6ヶ月以上、人間の胎児発生と同じぐらいの時間をかけた培養で、大変な努力だ。
詳細は省いて結論だけを述べると、
3種類の遺伝子が関わる過程は異なってはいるが、最終的にはオルガノイドの中のGABA抑制性細胞の比率を増加させる点で共通している。 オルガノイド内の抑制性ニューロン増加を反映して、オルガノイド中の興奮神経の活動が抑制される。 この結果も、ASDに介在ニューロン発生異常が存在するという点では共通だが、少なくともオルガノイドの中では、介在ニューロン優性の現象、すなわちニューロンの興奮抑制が起こっているという点で、以前このHPで紹介した(https://aasj.jp/news/autism-science/18807 )、ASD児の脳を典型児と比べると、抑制性ニューロンの数が低下しており、脳が過興奮の状態にあるとする結論と異なっている。
詳しくは調べていないが、SUV420H1変異の児童でもてんかんを発症することが知られており、時間がたつと抑制ニューロン優性から、欠乏へと変化する可能性はある。
また介在ニューロンの過剰、欠乏の両方で同じASDやてんかん症状が出ると考えることもできる。実際、MECP2遺伝子の欠損(Rett症候群)と過剰のMECP2重複症は、ともにASDとてんかんを示す。 このように、発生過程と、実際の患者さんでの脳までにはまだまだわからないことは多い。しかし抑制性介在ニューロンはASDの重要な標的細胞として確立したことは確かだ。
2022年1月16日
(この記事は、1月9日論文ウォッチで紹介したものに加筆してよりわかりやすくし、自閉症の科学50として再掲したものです。)
典型人と比べたとき、自閉症スペクトラム(ASD)では脳ネットワークに何か共通のの違いがあることは疑う人はいない(共通の違いという点が重要!個別に見れば脳ネットワークは一人一人違っている)。
ASDはスペクトラムと称されているように、多様性が高く、神経多様性概念が拡がるきっかけになった。また、遺伝要因や個人の変異を調べるゲノム研究でも多様性が明らかで、多くの頻度の高い遺伝子多型とともに、希な変異も発症に関わる、多様な状態であることもわかっている。
このような多様性にもかかわらず、ASDには、社会性、言語能力、行動などで共通の症状が存在している。すなわち、このような症状の元になる脳回路の変化が存在する。にもかかわらず、現在まで「これが典型児との違いです」と病理学的に明確な変化が示されたことは全くない。
ただ最近になって、典型児と比べたときASDではGABA作動性の抑制性介在神経の数や活性に違いがあるのではと言う証拠が示されるようになってきた。
注1) GABA作動性抑制性介在神経は、短い範囲をカバー(神経軸索の長さが短い)するニューロンで、GABAを神経伝達因子として用いて、シナプス興奮を抑える役割を持つ。これにより、神経興奮と抑制のバランスが維持される。発現している分子(パルブアルブミンとソマトスタチン)の差で2種類に分けられる。
幸い最近、ASDと介在神経についてまとめた総説がシカゴのノースウェスタン大学から発表されたの図1)。まずこれにもとづいて、ASDの介在神経異常についてまとめ、その後で新しい論文を紹介してみよう。
ASD死後解剖例の解析から、解剖学的にはほとんど異常は認められないが、パルボアルブミン(PV)陽性介在神経の低下が見られる。 ASD様の症状を発症する遺伝子欠損マウスモデルでも、介在神経数の低下が見られる。 遺伝子多型解析でASDとの相関が認められる多くの遺伝子が、介在神経とその発生途上で発現が見られる。 MECP2遺伝子欠損によって起こるRett症候群などでは、介在神経機能低下による、脳領域の過興奮(時にてんかん)や、同期的興奮が見られる。 介在神経が強く関与する振幅の短いγ波がASDでは上昇し、感覚異常やコミュニケーション異常に関わっている。 以上がまとめで、ASDに見られる感覚異常とGABA作動性介在ニューロンがつながってきたことは、薬理学的治療の可能性まで視野に入る重要な進歩だと期待されている。
このHPでも、脳内には到達しないGABAシナプス刺激剤を投与すると、モデルASDマウスの感覚異常が改善され、ASD様症状が抑えられることを明らかにした論文(https://aasj.jp/news/autism-science/11245 )や、細菌叢がASDの症状に関わるのもGABA作動性の抑制神経の活動が低下しているためである可能性を示す論文を紹介してきた(https://aasj.jp/news/watch/10310 )。
今日紹介する英国キングズカレッジからの論文は(図2)、ASDのGABA 作動性抑制神経と、感覚異常に注目し、治療可能性まで示した重要な研究で、1月5日号のScience Translational Medicineに掲載された。タイトルは「GABA B receptor modulation of viual sensory processing in adults with and without autism spectrum disorder(ASDおよび正常成人の視覚処理はGABA B受容体により変化させられる)」で、「自閉症の科学50」として紹介する。
この研究を紹介する前に、Spatial Suppressionと、プロトンMRSと呼ばれる脳内分子測定法について少し解説する必要がある。
注2)Spatial suppression:図3に示すように、 コントラストの差や、背景と対象物のパターンの類似性などにより、対象物の見え方が異なる。このように、背景や対象物を変化させて、同じ対象物でも見づらくなることを、spatial suppressionと呼んでいる。不思議なことに、ASD児ではspatial suppressionにあまり影響されないことが知られている。
注3)プロトンMRS:正直、原理については私も理解できていないが、特定の場所に含まれる分子を、組織を傷害すること無く核磁気共鳴を用いて測定する方法で、代謝や神経伝達物質の測定に用いられる。この研究では視覚野でのGABAの量を測定している 。
例えば対象物のコントラストを下げたり、逆に背景のコントラストを落としたりしてspatial suppressionにより視覚認識を邪魔すると、典型人の認識力はsuppressionが高いほど当然低下する。ところが、ASDの人では、このような低下があまり認められないことが知られていた。
この研究の目的は、ASDでspatial suppressionが低下することを確認することと、GABA作動性ニューロンの活動低下が相関しているか調べることだ。このため、実験では典型人、ASDを3群に分け、1群は何もしない、2群は少ない量のGABAシナプス刺激剤、そして3群に高量の刺激剤を服用してもらい、spatial suppressionテストを行ったときの脳波を記録、視覚認識が低下するかどうかを調べている。
この実験により、
1)典型人でspatial suppressionによる視覚認識低下がGABA刺激で改善するのか、
2) ASDで予想されるspatial suppressionの感受性低下がGABA刺激で改善するのか、
について答えることができると期待される。
結果だが期待通りで、GABA刺激剤を投与していない場合、典型人ではspatial suppression が高めると、視覚野での脳波の変化をキャッチできるが、ASDではこの変化が見られない。すなわち、ASDの視覚認識は、spatial suppressionに影響されない。
ところが、高い濃度のGABAを刺激する薬剤を投与したグループでは、この反応パターンが逆転し、ASDではspatial suppressionに強く影響を受けるようになるのに、典型人ではspatial suppressionの影響が消える。
解釈は難しいが、この結果はGABA刺激の量が、spatial suppression の程度を調節していることをはっきりと示している。すなわち、ASDでも典型人と同じレベルにGABA刺激を高めてやると、視覚の認識異常が正常化することがわかる。
典型人で同じ量のGABA刺激剤を服用すると、spatial suppressionが見られなくなるのは、おそらく刺激が過剰になると回路がうまく働かないことを示しているのだろう。すなわち、介在ニューロンの一定レベルの活動が、spatial suppressionには重要で、GABA量が低くても、高くてもうまく働かないが、ASDではこのレベルが低いと結論できる。
このようにGABAの量によりspatial suppressionが調節されていることを確認した後、プロトンMRS技術を用いて、spatial suppression課題を行っているときの、視覚野でのGABA濃度を測定している。結果は完全に期待通りで、spatial suppressionによる脳波の変化と、GABA濃度の間には強い相関が見られる。そして、ASDでは、GABA濃度の上昇が見られない。
以上の結果から、ASDの視覚感覚異常には、GABA抑制性神経の活動の低下が深く関わることが証明されたと思う。以前紹介したように、マウスモデルでは体性感覚野異常にGABA作動精神系が関割ることが示されており((https://aasj.jp/news/autism-science/11245 )、おそらくほとんどの感覚で抑制性介在神経異常がASDで見られると考えて言いように思える。
脳内のGABAレベルを上げることが可能かどうか私には判断できないが、 細菌叢への介入を通して、GABA作動性の抑制神経の活動を正常化する可能性を示す論文も存在している(https://aasj.jp/news/watch/10310 )。その意味で、GABAを標的にした様々な治療法開発も視野に入ってきたのではと期待している。
正月早々、面白い論文を2編も紹介でき、満足している。
2022年1月14日
(この文章は、1月8日論文ウォッチで紹介したものを、解説を加えて自閉症の科学として再掲載した文章です。)
久しぶりに自閉症の科学として紹介したいと思った二編の論文を、新年早々見つけることができた。すでに論文ウォッチとして1月8、9日連続して紹介したが、おそらく理解しづらい点も多いと思うので、自閉症の科学として、できるだけわかりやすく書き直すことにした。
最初の論文は、Mothereseと呼ばれる、お母さんが幼児に話しかける時に使う心のこもった呼びかけに対する、自閉症スペクトラム(ASD)幼児の反応を脳科学的、行動学的に調べた、カリフォルニア大学サンディエゴ校からの論文だ。1月3日Nature Human Behaviourにオンライン掲載され、タイトルは「Neural responses to affective speechi, including motherese, map onto clinical and social eye tracking profiles in toddlers with ASD(Mothereseを含む気持ちのこもった言葉に対する神経反応は、自閉症幼児のアイトラッキングによる臨床的、社会的反応と対応している)」だ。
最近のASDに関する論文では、神経多様性の観点から、ASDと正常グループと分けることはせず、典型グループとASDグループと分けるようになっている。ここでもこの表現を踏襲する。 注)まずタイトルにあるmothereseから説明しよう。Mothereseはあらゆる文化で見ることができる、幼児に話しかける時、自然に使ってしまう、ゆっくりしたテンポで、抑揚のついた、うわずった声の独特の話し方のことを指す。そう聞けば誰でもどんな話し方か思い当たるのではないだろうか。これは幼児への話しかけに使われるのだが、大人が聞いても、ほっとするし、実際脳の反応も異なることが報告されている。
もし感情と言葉が合体したMothereseの脳への影響が普通の言葉と違うとすると、他人とのコミュニケーションが苦手な自閉症スペクトラム(ASD)の子供では、Mothereseに対する反応も、典型児とは異なっている可能性がある。この可能性を、脳の機能的MRI(fMRI)と、視線を追いかけるアイトラッカーを用いた行動記録から調べたのがこの研究だ。
注)fMRIは、活動している脳領域の血流が上昇することを利用して、脳の活動を調べる方法。言葉の場合、読んだり聞いたりしているとき、あるいは言葉を使って書いたり話したりしているとき、いずれも、脳のどこが活動しているかがわかる。測定時に頭を固定する必要があるため、じっとできる大人では起きているときに測定することができるが、それが難しい幼児では通常睡眠時に測定する。睡眠中でも、音を聞くと脳は反応し、fMRIで記録することができる。
この研究ではまず、
比較的淡々とした文章、 少し心を込めた文章、 Motherese文、 を女性に読んでもらったテープを作成し、これらを聞かせたときの印象や脳の反応を調べている。
それぞれの語り方を成人に聞かせると、成人もMothereseを聞いたときに最も気持ちがこもった印象を持つことを確かめている。すなわち、それぞれの語り方にこもった感情の違いを感じることが出来る。
ところが、3種類の語り方を聞かせたときの典型成人と幼児の脳(言語に関わる領域)の反応をfMRIで調べると、それぞれの語りかけに対する言語領域の反応はほとんど変わらない。ちょっと不思議な気がするが、感情と言語とを別々に処理していると解釈できる。
ところが、2歳前後の典型児およびASD児の睡眠中に同じテープを聴かせ、典型児とASD児の言語領域の反応の違いを調べてみると、ASDの幼児では全ての語り方に対する言語野の反応が低下している。
以上の結果は、感情がこもったMonthereseですら、言葉に対してASDの子供の言語領域がうまく反応してくれないことを示しており、ASDの幼児には感情を込めて話しかければいいという単純な話が通らないことを示している。睡眠中の実験であることを考えると、生まれついて語りかけられる言葉に対する反応に問題がある可能性が高い。
とは言え、典型児ですら言語領域の反応はばらついている。そこで、個々の児童の言語領域の反応と、Vinelandと呼ばれるコミュニケーションや、社会性を評価する指標の相関を調べてみると、典型児でも、個々人のレベルでは特に左側の言語領域の反応が、個人の社会性や言語能力と相関していることがわかった。
そこで、ASD児でも、それぞれの話しかけに対する行動学的な差がないかを調べるため、テープが聞こえる方向に視線を向け、固定するかどうかについてアイトラッカー(視線の変化を記録できる装置)を使って調べると、典型児ではMothereseの方により強い関心を示すのに、驚くことにASD児では、他の語り方に比べてMonthereseに対する反応がさらに低下していることがわかった。すなわち感情がこもっている言葉と他の言葉を区別できているのに、感情がこもっている方を嫌っている印象がある。
このように、個々人の行動を調べていくと、期待したように典型児ではMothereseに対する関心が高いことがわかったので、Mothereseに関心を示す程度を指標化して、fMRIの反応の違いと相関させてみると、これまでのテストでは感情と相関しないように見えた言語領域、特に左側の反応が、典型児でも相関を示すことが分かった。ところが、このような相関はASD児では全く認められない。
以上の結果から、平均値で比べると感情と言語に対する反応が相関しないように見える典型児でも、個々人を比較すると、ある程度の相関が見られることがわかる。しかし、ASDではMothereseを嫌っているように見えるが、それが脳の言語に対する反応とはっきり相関しない。
そこで最後に、fMRIでの脳の反応、言語能力や社会性について調べた指標、アイトラッカーによるMothereseへの関心、など様々な要因を統合できるSNF-Louvainアルゴリズムを用いて個々人を分類すると、典型児からASD児までを4群に分けることが出来、それぞれの群は、この研究で調べた様々な指標をうまく反映できていることを明らかにしている。
結果は以上で、正直私にとっても理解しづらい論文だという印象が強かった。ましてや、一般の方がそれぞれの結果をすっと飲み込むのはさらに難しいはずだ。しかし、読み終わってからじっと考えてみるといくつか重要なポイントが浮かんでくる。
まず、問題はあるにせよ2歳時点で、典型児とASDをかなり正確に分離する方法が見つかったこと。将来医学的な介入を考えるとすると、早ければ早いほど介入が成功する可能性は高い。 典型児では、Mothereseのように感情がこもった言葉でも、言語領域の反応は、感情が抑えられた言葉に対する反応と変わりが無い。すなわち、言語野の反応は感情とは無関係に反応する。 アイトラッカーを用いた関心の高さを指標にすると、典型児は言葉にこめられた感情を感知することが出来る。これがあらゆる文化でMothereseが存在する基盤になっている。 しかし、この感情が言語にかぶさって来ることを、ASD児は嫌っている。従って、単純に愛情を持って話せばASD児とコミュニケーションを図れると考える根拠はない。 眠っているときに言葉に対する反応がASD児で低下していることは、ASD児の脳が生まれたときから持っている、典型児との違いであることを示している。 かなりわかりにくい論文だが、ASD児、特に幼児の理解という点では様々なヒントが得られるような気がする。
次回は、ASDと抑制性神経細胞について考える。
2021年6月4日
自閉症のゲノム研究最終回は、自閉症との関連で最近注目が集まっているTandem Repeat(TR: 縦列反復)の話を取りあげる。専門家でなければ、TRと聞いてもピンとこないのが普通だ。 しかし、TRによって起こる病気、特にCAGといった3塩基の繰り返し数が増大して起こるいくつかの病気の名前については耳にしたことがあるのではないだろうか。最も有名なのはハンチントン病(以前はハンチントン舞踏病とも呼ばれていた)で、おそらく耳にしたことのある人は多いと思う。他にも、このHPで何度か紹介している、自閉症症状を伴うFragile X症候群も、TRが病気の原因になっている。
ハンチントン病の場合、ハンチンティンと呼ばれる分子をコードする遺伝子の中にあるCAG(グルタミンのコード)が繰り返すTRのCAGリピートの数が上昇し、グルタミンがつながったポリグルタミンが細胞内に発現して神経毒性を発揮することで、神経細胞が変性することが知られている。一方、Fragile XはCGGが繰り返すTRのリピート数が増大することで、その領域がメチル化され遺伝子がオフになってしまい病気が起こる。(https://aasj.jp/news/watch/8091 )
他にも様々なタイプのTRが存在し、メカニズムは異なるが、細胞や組織の機能を障害し、知られているだけでも50種類以上の病気に関わることが明らかになっている。ただ、Fragile Xを除くと、これまでTRと自閉症との明確な関わりが疑われたことはなかった。
しかし、TRは発生過程でリピートが増減することで、これまで議論してきたde novoの変異に相当する変異を誘発できる。しかも完全なde novoの変異と異なり、リピート数が増減する結果として病気が起こる場合でも、その基盤になるTR自体は親から受け継ぐことから、兄弟姉妹で発症がみられ遺伝性があるように見えても、両親は正常といった、遺伝性の特定が難しかった変異を説明することができる。
そして何よりも、Fragile XのようにTRがエピジェネティックな過程を介して病気を発症させる場合、あらかじめリスクのあるTRを特定して、リピート数の変化やエピジェネティックな変化を抑制し、病気を抑えることも将来可能になると考えられる。(エピジェネティックについての説明はFragile X 記事を参照してください:https://aasj.jp/news/watch/8091 )
このように自閉症に関わるTRを特定する重要性ははっきりしていたが、実は私たちのゲノムの半分はこのような繰り返し配列から構成されているため、病気と関係すると推定できるTRを発見することは簡単ではなかった。
この困難にチャレンジして、自閉症に関わるTRが存在するかもしれない可能性を示したのが、昨年10月、および今年1月に、それぞれカナダのトロント大学、およびカリフォルニア大学サンディエゴ校から発表された論文だ。
これらの研究が可能になったのは、多くの自閉症のゲノム解析が進んだこと、そして自閉症と相関があることをはっきりと指摘できるTRを発見する情報処理法が開発されたことによるが、詳細は省く(事実、論文の大半は方法の妥当性についてのデータで占められており、私のような素人では判断できない困難が想像できる)。
結論は両方の論文とも同じなので、カリフォルニア大学の論文についてのみ紹介するが、
1)25種類の遺伝子に自閉症児のみにみられるTRを特定することができた。
2)25種類のうちの半分の遺伝子では、自閉症との関わりがあるde novoの突然変異が既に特定されている。すなわち、TRは確かに自閉症に関わるde novoの変異と同じ作用を持つ。
3)TRはこれまで遺伝性が明確でなかったASDの1.6%の原因と考えられる。
4)これらはすべて頻度の低い、いわゆるレア変異に相当する。
ある程度知識がないと、なかなか理解しづらい話だと思うが、ASDゲノムを調べるための新しい方法が加えられたと考えて欲しい。今後それぞれのTRについて、ゲノム研究2で紹介したような、機能を調べる研究が必要で、ぜひその上で、予防や治療手段の開発が可能になればと期待している。
以上、4回にわたって最近急速に進み始めたASDのゲノム研究を紹介した。生殖細胞の形成過程、あるいは発生過程でまれに起こるde novoの変異を知ることが、ASD発症メカニズムを理解するために欠かせないこと、そのため多くのASDの人が参加する、大規模ゲノム研究が着々と進んでいることを理解してもらえれば、この記事を書く目的は十分果たせたと思う。