2020年1月27日
今日の話も一般の人には少し難しいかもしれないが、なるべくわかりやすく説明するのでお付き合い願いたい。
私たちのNPOで患者さんの団体の支援経験が最も長いのは藤本理事で、各団体に属しておられる患者さん一人一人についても本当によくフォローしている。あるとき彼から、日本だったか外国だったか、FOPの患者さんが2人おられる家族の話を聞き、驚いた。全身に骨ができてしまう病気FOPは山本育海さんを通して私たちも接点がある病気だが、通常の遺伝疾患ではなく、その証拠に両親には同じ遺伝変異は存在しない。おそらく父親の精子(理論的には母親の卵子も除外できないが)が作られる過程で新たな変異が起こることで発生する病気だ。従ってランダムな変異が独立に起こったとすると、2人の患者さんが一つの家族に発生することは奇跡に近い。またそう思うからこそ、患者さんのご両親から「もう一人子供が欲しいのだが同じ病気にならないだろうか?」と聞かれた時、全く心配せず妊娠していいですよと答えていた。
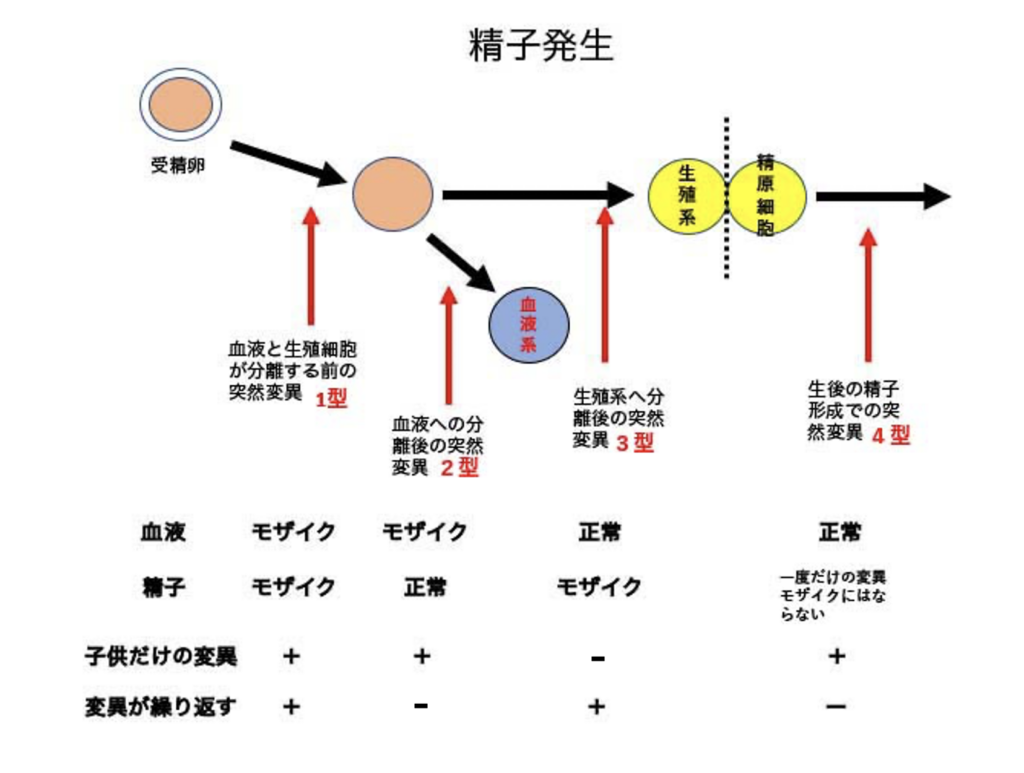
ただ、この様な奇跡が起こる可能性が一つ存在する。それは、生殖細胞が発生する過程の比較的早い時期に突然変異が発生し、正常の生殖細胞(精子や卵子)と変異を持った生殖細胞が一定の比率でずっと体内で維持される場合だ。この様な状態をモザイクというが、同じことは他の臓器でも見られる(図1)。
毎日作り続けられる精子の場合、生まれた後の精巣で起こる精子形成過程で変異が起こって、その精子で受精した変異を持つ子供が生まれることがあるが(図では4型)、この場合は一回きりの変異でモザイクとして変異が維持されることはないので同じ変異を持つ子供が同じお父さんから生まれることはまずないと言っていい。一方、発生過程で精子を作る元の細胞(精原細胞と呼ばれる)ができるとき変異が起こると、発生段階のいつ起こったかによって様々な割合の変異細胞を持つモザイクになる(発生過程の早期に怒るほどモザイク率も上がる)。こうなると同じ変異を持った子供が、一定の確率で同じお父さんから生まれることになる。
藤本さんから聞いたFOPの子供さんが2人同じ両親から生まれたということは、卵子か精子の発生過程で変異を持つ細胞がモザイクになってしまったと考えることができる。この場合、卵子を調べるのは難しいが、毎日作られる精子なら子供が繰り返してFOPになる確率を計算することはできる。
今日紹介したいと思っている論文は、自閉症を例にこの変異精子のモザイク状態の関与を調べた研究で、Nature Medicine1月号に掲載された。モザイク状態自体は自閉症に限らないが、ぜひこの機会に「自閉症の科学」として学んでもらいたいと取り上げた。
自閉症が遺伝的背景を持つことはもはや異論がないと思うが、これまで例として見てきたFOPのように一つの遺伝子で病気が決まるのではなく、ほとんどの場合多くの遺伝子の機能の小さな変化が集まって形成される状態と見ることができ、極端に言ってしまうと性格の一つとすら考えられる。これら遺伝子の多くは両親から受け継いだものだが、FOPと同じで、自閉症児には存在し、両親には存在しない新しい変異が10−30%のケースで存在し、自閉症発症過程で最後の後押しとなっているのではないかと考えられている。
この子供だけに見られる新しい変異が、実際には両親の生殖細胞のモザイク変異から由来する可能性を調べるためには、これまで両親の血液細胞のDNA解析が使われてきた。血液細胞と生殖細胞が別れる前に変異が発生すると、この変異モザイクは血液にも生殖細胞にも維持されることから(図で言うと1型)、この場合血液細胞を調べるだけで十分モザイク度を算定できる。実際、自閉症の場合子供だけに存在すると考えられる変異の3.8%が、実際には両親のどちらかでモザイク変異として末梢血細胞で維持されていることが、血液のDNA検査から明らかにされた。さらに面白いのは、兄弟に同じ変異が見られる場合、なんと両親の血液のモザイク変異として検出される確率が57%に跳ね上がることがわかった。
実際、両親には存在しない変異が同じ兄弟に生じる確率は限りなく0に近い。しかし同じ変異が複数の子供に見られ、しかも両親には存在しない場合は、100%両親の生殖細胞がモザイクになっていると考えていい。
ではなぜ血液のモザイクとの一致が57%にとどまるのか?これは発生過程のいつ変異が起こったのかの違いで、血液がモザイクになっていても精子や卵子がモザイクになっていない場合、あるいは逆も存在するためで(図で変異が起こる時期として示している)、血液にはなく精子にある型(3型)の場合は、血液検査ではモザイクが見落とされる。そのため実際に変異を持った子供が生まれるリスクを正確に判定するためには、生殖細胞で検討することが必要だ。
今日紹介する研究は、6人の自閉症児とその家族の参加を得て、子供だけに見られる変異をまずリストして、これらの変異がお父さんの精子、あるいは血液でモザイクとして存在しているかを調べた研究だ。
この論文の結論は自閉症には限らないので、一般的な話としてまとめ直してみると次のようになる。
子供に見られる新しい遺伝変異の2.5%が父親の精子や血液のモザイクとして検出できる。
血液と精子を比べると、両方の組織でモザイクになる場合が多いが、精子だけで見られる変異(3型)も多い。従って、血液細胞でのモザイク検出だけでなく、精子のDNA解析を行うことが、変異を持つ子供の発生リスクを算定するために重要。
ということになる。
結論としては、もし変異を持つ子供が生まれた時、これが一回きりの変異か(4型)、それともお父さんの精巣で変異を持った精子が作り続けられているのか(1型と3型)は、精子のDNA検査で可能だという話になる。
では自閉症スペクトラムを持つ家族でこのお父さんの精子の検査がどれほど意味があるかと考えると、まだまだ専門的すぎて、誰もが調べられるという検査ではない。しかし、両親にはなくて、子供にだけ存在する遺伝子変異の中には、両親の生殖細胞の中にモザイクとして維持されているものがあることを知っていてもいいのではないかと紹介した。
2019年12月28日
自閉症スペクトラム(ASD)児が発熱すると一過性に、症状(特に社会性に関わる症状)が改善することが報告されていた。おそらく経験されている両親や医師の方には「そうそう!」と頷かれるかもしれないが、私も含めて多くの人は、本当にそんなことがあるのか疑問に思うのが普通だ。
ところが、コーネル大学、コロンビア大学、そしてカリフォルニア大学サンフランシスコ校が集まって、本当にこのような現象があるのかシモン財団データベースにに登録しているASD児について調べ、確かに発熱でASDの症状が一過性に改善する事を示した研究が昨年1月、Autism Researchに掲載された(Autism Res 2018, 11:175-184)。
研究では4歳から18歳までのASD児を持つ2156家族に「ASDの症状が発熱で改善したと思ったことはあるか?」と質問したところ、驚くことに362家族(17%)が「確かに改善したことがある」と答えた。
どのような症状が改善したのかさらに聞いたところ、コミュニケーション能力と答えた人が166人、気分や行動と答えた両親が199人に上った。
次に、発熱の影響があったASD児と影響のなかったASD児を比べ、症状の違いを調べると、完全に有意差があるとは言えないものの、症状の重いASDほど改善が見られる傾向が見られた。例えば、適応性が悪く、行動異常が強い子供ほど発熱による症状の改善が見られる。一方、遺伝的な影響についても調べているが、特別の関連は認めていない。
以上の結果から、確かに発熱がASD児の症状の改善につながることがあること、そして症状の重い児童ほど発熱により症状改善が見られる確率が高いことが確認された。
一過性でも症状改善が見られるというこの結果は、治療法開発という観点からは勇気付けられる結果だ。ただ、この研究結果だけでは、なかなか糸口はつかめなかった。
ところが先週、マサチューセッツ工科大学の研究グループが、ASDの発熱と社会行動を研究できるモデル動物システムを開発し、減少の背景にあるメカニズムを探った論文を発表した(Reed et al, IL-17a promotes sociability in mouse models of neurodevelopmental disorders (神経発生異常モデルマウスの社会性をIL17aが促進する), Nature, 2019: https://doi.org/10.1038/s41586-019-1843-6 )。
発熱を誘導するといった研究を人間で行うことはできない。そこで、モデル動物が必要になる。このグループは、何種類かの遺伝的ASDモデルマウス(一つの遺伝子の変異によりASD症状を示すマウス)を使っている。マウスで社会行動を調べる様々な方法が開発されているが(例えば他のマウスと一緒にいる時間を測る)、遺伝的な変異だけでは症状がはっきりしないことが多い。そこで、このグループは妊娠時に炎症が起こるとASDが発症しやすいという現象を動物モデルで再現する方法を組み合わせ、背景の遺伝的要因は問わず、ほとんどのASDモデルで社会行動の低下を誘導することに成功している。
こうしてできた社会行動低下モデルマウスを用いて、次は発熱の影響を調べることになる。発熱誘導には感染症と同じ状態を誘導する方法と、発熱中枢を刺激する方法があるが、この研究ではまず感染で発熱する状態を再現するため、バクテリアの発熱誘導物質をマウスに投与する実験を行なっている。結果は期待通りで、LPSと呼ばれるバクテリア膜のポリサッカライドを投与された自閉症モデルマウスで社会性の回復が見られる。ところが、神経刺激のみで発熱だけを誘導すると、全く回復は見られない。すなわち発熱というより、炎症が社会性の回復に関わることが示された。
ここまでわかると、炎症時に分泌され社会性を回復させる分子を特定するのは現在の技術があれば難しくない。様々な探索を行い、最もパワフルな炎症物質の一つIL17aを注射することで社会性が回復することを示している。
結果は以上だが、もう少しわかりやすいようにこの研究の意義をまとめてみると、
人間で見つかった現象(発熱すると社会性が改善する場合がある)を研究するための動物モデルが見つかった。 IL-17は強い炎症性サイトカインなのでむやみに注射するわけにはいかないが、脳だけでこの回路を刺激する方法がわかれば、少なくとも社会性については改善できる可能性がわかる。 IL-17a受容体陽性神経細胞という細胞レベルのヒントが見つかったことで、新しい介入手段の開発が期待できる。 研究というと、基礎から始めて、臨床に進むと思いがちだが、このように臨床的観察から始めて、動物に進むことも重要で、今後も基礎と臨床がうまく連携して、ASDの社会性を回復させる方法の開発を期待する。
2019年12月9日
今日は久しぶりにゲノム解析の話を取り上げる。少し難しいかなとは思うが、ASDやADHDを病気ではなく、脳の多様性として捉える時のカギになる分野で、まだまだ研究は始まったばかりだ。その意味で、多くの読者が無理してもフォローして欲しいなと願っていいる。
今日紹介したい論文(Autism spectrum disorder and attention deficit hyperactivity disorder have a similar burden of rare protein-truncating variants, Nature Neuroscience, 2019: https://doi.org/10.1038/s41593-019-0527-8 ) 自分の小学校時代を思い返すと、「じっとするのが苦手、思ったことを口にする、整理整頓が苦手で、忘れ物が多い」という、注意欠如/多動症(ADHD)ともいえる性格を持っていた。担任の先生も心配したのか、一度だけだが学校の指示で児童相談所で診察を受けた覚えがある。今ならADHDと診断がついていたと思うが、幸い学業や学校での生活には全く問題を感じておらず、その後いくつかの症状は治ることなく続いて今に至っている。
実際、現在ADHDの発症頻度は5%を超えていると言われており、普通にみられる性格のタイプと言ってもいい。あまりに普通で境がはっきりしないためか、ASDについては多くのゲノム研究が発表され、100を超す遺伝子多型が発見されている一方、ADHDに関連する遺伝子多型の解析は遅れていた。しかし、一卵性双生児を用いた研究からADHDの一致率は高く、精密な多型解析の必要性は高い。また、片方がASDと診断されたケースで、もう片方がADHDと診断されることも多く、両者の状態の遺伝的背景に何らかの共通性があるのではと考えられてきた。
これらの問題を解決しようと、デンマーク・オーフス大学と、ハーバード大学を中心とする国際グループは、各国の多型解析データベースを統合してASD、ADHDの遺伝子多型解析を行い、今年相次いでNature Geneticsに発表した。詳細は省くが、ADHDも多くの遺伝領域の多型が重なり合った結果生まれる神経多様性の一つの状態であることが確認され、またADHDと診断される高いリスクに関わる多型も12種類特定された。しかし期待に反して、こうしてリストされた高いリスク遺伝子多型の中にはASDの多型とオーバーラップするものはほとんど存在しなかった。
ただ、これまで疾患のリスクに関連するとして特定されてきたほとんどの遺伝子多型は、タンパク質に翻訳されない部分(イントロン)に見られる多型で、特定の一つの多型を取り出してその意味を調べても、その意味はほとんどわからずじまいで終わることが多い。そのため、2種類の病気の遺伝背景を知ろうと思うと、多くの小さな変異を積み重ねた結果を計算して関係を推測する必要があり、まだまだ時間がかかると思われる。
そこで著者らは、小さな遺伝的変化を基礎にした遺伝子多型の研究から少し離れて、タンパク質の大きさが変化するような稀な変異に絞って、ASDとAHDHで調べたのが3番目の論文だ。一部の明確な遺伝子変異が原因のASDと異なり、ほとんどのASDでは、まずタンパク質の大きな構造変化を伴うような変異は存在しないと考えられてきた。このグループは、よく調べればそんな変異も見つかるのではと、何千人もの血液サンプルから、タンパク質に翻訳される部分を全て解読して、大きな変異を探索した。
詳細は省いて結論だけをまとめると、
典型児と比べると、ASDもADHDもこのような稀な変異が見られる頻度は高い。 ASDとADHDでリストされる変異遺伝子にはほとんど差がなく、稀で大きなタンパク質の構造変異に限ればASDもADHDもほぼ同じ。 もっとも多くのケースに見られたのが、神経発生時の細胞骨格の形成に必要なMAP1A遺伝子の変異で、ASDやADHDに神経発生時の変化が関わる可能性が示された。 となる。「視点を変えれば、ADSとADHDは高い遺伝的共通性を持っている。おそらく、タンパク質の構造変化を伴う様々な遺伝子の変異の上に、小さな遺伝的変化が積み重なって特徴的な症状が形成される」が結論だろう。
これまでタンパク質に翻訳される遺伝変化が原因で起こるASDのケースは、稀とはいえ知られている(例えばレット症候群)。これらの遺伝子変異ほど高い決定性はないとはいえ、今回トップ15にリストされたASD,ADHD両方に見られる変異も、神経細胞機能に何らかの影響を及している可能性がある。とすると、それぞれの分子の機能を丹念に調べることで、ASDやADHDの新しい理解へと進展するような予感がする。
「だからなんなの?」と言われそうだが、タンパク質の構造が変化する変異は研究が易しい。その意味で、私はこの研究の重要性は大きいと感じている。おそらく、理系の学生さんにとっても難しい内容かもしれないが、今後もできるだけASDのゲノム研究の進展は紹介していくつもりだ。
2019年11月30日
今月も自閉症スペクトラム(ASD)に関する多くの論文を読んできたのですが、これは重要だと思える論文を見つけることができませんでした。そこで、ASD児を持つ多くの親がおそらく共通に感じていると思われる、睡眠障害を取り上げ、自閉症の治療を目指す米国の団体Autism Speaksが作成した眠りにかんするガイドラインを紹介することにしました。
ASD児の多くは睡眠障害を抱えている
2015年に発行されたSeminars in Pediatric Neurologyに掲載されたZimmermanの総説を読むと(Vol22, Pages 113-125: http://dx.doi.org/10.1016/j.spen.2015.03.006 )、ASDの子供を持つ両親のなんと50-80%が、子供の睡眠異常に気づいていることを報告しています。症状ですが、「寝つきが悪く、就寝中なんども起きるので、睡眠時間が短くなる」とまとめられます。
なぜ睡眠障害がおこるのか、様々な仮説に基づいた研究が行われていますが、はっきりしたことはまだまだよくわかっていないと言っていいでしょう。原因がわからないということは、根本的治療はまだ開発できていないということです。このため、現在行えるのは症状に合わせた治療法だけです。例えば米国では重症の子供に対して、睡眠サイクルに関わる脳内物質メラトニンを睡眠前に投与することが行われていますが、おそらくメラトニンが買えない我が国では、薬物を使う治療は一般的ではないと思います。
しかし、睡眠時間が足りないことは、ASDの症状に影響するという報告があります 。
今年の10月に発表された台湾での6832人の調査研究によると、ゴール達成のために自分の行動や周りの状況を判断し、適切な行動を選ぶ時に必要な実行能力 が、睡眠不足により障害されることが示されています(Tsai et al, Psychological Medicine 2019: https://doi.org/10.1017/ S0033291719003271)。
また、比較的症状の軽い7-13歳のASD児についての調査ですが、英国ヨーク大学のグループは、脳波を測る装置を睡眠中に装着してもらって(通常のASD児では寝ている時にこのような検査を行うことは簡単ではありません)睡眠の状態を測るとともに、聞き言葉を判断する検査を行い、ASDの症状の中でも、睡眠、特にREM睡眠の量が言葉の学習効果と相関することを示しています(Victoria et al, Journal of Speech, language, and hearing research 2019: http://eprints.whiterose.ac.uk/149777/ )。
このように、ASDの子供の睡眠時間を少しでも延ばすことは本当に重要です。言い換えると、睡眠が不足することでよりASDの症状が重くなる心配があるのです。ではどうすれば睡眠時間を伸ばせるのでしょうか?もちろん簡単なことではないのですが、家庭でできる方法についてAutism Speaksはうまくまとめてくれているので、以下にまとめてみます。
図1ASD児の睡眠を改善する方法についてAutism Speaksから発行されているパンフレット
1、快適に眠れる環境をつくる
寒すぎず、暑すぎず、外の光がカーテンなどで遮られた、暗い部屋(すこしは薄明かりはあるほうがいい)。 ASD児はちょっとした音の変化に敏感なだけでなく、普通なら睡眠を誘うwhite noiseにも敏感なので、兄弟からも離れた静かな部屋で睡眠できるのが望ましい。 パジャマを着た時の感触も睡眠に影響するので、タイトなパジャマがいいのかルーズなパジャマかなどいろいろ試してみる。 2、決まった時間に寝起きする習慣をつける
まず、寝る時間と起きる時間をできるだけ守る習慣をつける。そして、寝る前はなるべく身体的な興奮を避け、テレビやゲームをやめて、寝る準備を15-30分かけておこなうようにする(例えば1歳児では15分ぐらい、もう少し大きくなると30分ぐらい。ただあまりに長すぎると逆効果で、準備に1時間もかけるのは間違い)。
3、寝るための準備についてのコツ
パジャマを着る、トイレをすます、手を洗う、歯を磨く、水を飲む、本を読み聞かせる、ベッドに入ると言った寝るまでのセットを決めて、毎日その順番を変えずに、静かに行う習慣をつける。
この時、トイレや手洗いの後のセットは全て寝室で行うようにする。
この順番を絵に描いて部屋に貼って子供にもわかってもらうとより有効。
それぞれの行動の中でどうしても子供が興奮しやすい行動がある場合は、その行動を寝る準備のセットから切り離す方がいい。
4、寝起きの時間を決めることの重要性
決まった時間に寝て、また起きることは大変重要。しかし、子供が成長すると寝る時間は遅くなっていく。しかし、出来るだけ寝起きの時間が1時間以上遅くならないように教える。
子供の習慣にあわせて、親も同じようにできる限り規則正しい生活をおくるよう心がけるのも重要。
昼寝をする場合も、できるだけ決まった時間に取るように心がけ、また可能なら昼寝も同じ寝室で行う。
昼寝の場合は4時までには起こす。十分成長して昼寝が必要なくなったら、昼寝は逆に夜の寝つきを妨げるので避けた方がいい。
規則正しい睡眠にとって、食事の時間が一定していることも重要。夜遅い時間のおやつなどはできるだけ避けるが、炭水化物の多いスナックなどは眠りを誘う効果があるので、ほどほどに使うことはよい。
5、子供が一人で寝られるよう辛抱強く教える
大人も子供も睡眠中に何回も目が覚める。そんな時、普通はまた寝入ってしまうが、一人で寝られない子供は、その度に誰かを頼ることになる。その意味でも、自分一人で寝られるよう教えることは大事。
ではどのように教えればいいのか?
添い寝が必要な子供の場合、自分で寝る習慣がつくには何週間もかかる。まずは添い寝をする時、横に寝るだけでなく、ベッドに座る時間を設けるなど、少しづつパターンを変えてみる。それが成功したら、次は添い寝をやめてベッドの横に椅子を置いて見守るようにする。この間、話しかけたり、見つめたりする時間を減らしながら、椅子を徐々にベッドから離していく。これで様子を見ながら、最初から部屋にいない日を増やしていく。
途中で子供に呼ばれても、部屋にいる時間をできるだけ短くするよう心がける。夜中に起きた場合も、同じようにふるまう。
図2 一人で寝る習慣をつける時に使うクーポン(Autism Speaksのパンフレットより) 成長した子供の場合、就寝中に両親に何かしてもらう時には、図のようなクーポンを使うのも一案。寝る前にこのクーポンを何枚か渡して、夜中に親を呼んだり、抱いてもらったり、親に頼った場合は親にクーポンを返すようにさせる。もしクーポンを使わなかったら、朝に褒美が貰えるようにして、徐々にクーポンを使わず一人で寝る習慣をつける (このようなクーポンも使ったASD児の睡眠プログラムの効果を確かめる、科学的な臨床治験がカナダで進められています(Papadopoulos et al, BMJ Open 2019: doi:10.1136/ bmjopen-2019-029767 )。
6、日中も夜の睡眠を考えて行動する。
睡眠に最も効果が高い行動は日中の運動で、もし学校では運動が足りないと感じたら、家に帰った後も運動するよう指導する。ただ、就寝前の運動は興奮して逆効果になるので、少なくとも身体的運動は睡眠の2−3時間前にはやめるよう教える。
コーヒーやお茶だけでなく、ソーダやチョコレートにもカフェインが入っており、食べた後3−5時間効果を発揮するので、夜はカフェイン入りの食べ物は口にしないよう指導する。
7、兄弟姉妹への影響
一般的に、規則正しい生活を一緒に続けることは、典型児の兄弟姉妹にとってもいい影響がある。また、ASD児の兄弟のために何ができるのか一緒に考えさせることも重要で、できるだけ多くの時間を一緒に過ごした上で、それぞれが就寝しやすい環境を探ることが重要。
以上、私なりに脚色して書いています。同じことが日本の住環境で十分可能かどうか、様々な工夫が必要だと思いますが、ぜひ参考にして自分の家族用のプログラムを作ってください。オリジナルの文章はAutism Speaksのホームページよりダウンロードできます(https://www.autismspeaks.org/tool-kit/atnair-p-strategies-improve-sleep-children-autism )。英語もわかりやすく書かれていますので、Google翻訳なども使いながらぜひ読んで欲しいと思っています。
2019年10月12日
自閉症スペクトラム(ASD)は、今後間違いなく多くの介入手段が生まれ、社会でも脳の多様性を受け入れるバリアフリー化が進むと期待しているし、そうあらねばならない。これは薬剤の開発にとどまらない。例えばタブレットの開発はASDの人たちのコミュニケーションをよりスムースにした。そして今後最も期待されるのが、脳ネットワークがまだ固まっていない発達期に介入するための治療やツールの開発だ。また、遺伝的変異によるASDでは、この時期に遺伝子治療を行うことも期待できる。いずれにせよ、このために最も重要なのができるだけ早い時期にASDを診断することで、このための様々な方法をこれまでも紹介してきた(例えば瞳孔反射を用いる診断法 http://aasj.jp/news/autism-science/11042 )。
同じ目的で現在最も利用されているのがM-CHATと呼ばれる23項目のチェックリストで、日本語版も作られ 早期診断に一定の効果があるとされている。ただ、このチェックリストの本家本元の米国でも、その診断的有用性についての完全な検証はできていなかったようだ。
これに対してフィラデルフィア小児病院を中心に集まったグループはM-CHAT電子版の診断的有効性を2万人レベルの18-24ヶ月児を対象に行ったコホート研究から調べPediatrics10月号に発表したので、紹介する。
この研究では、M-CHATで要注意と診断された幼児を4年以上にわたって観察を続け、最終的にASDとして診断されるまでフォローし、M-CHATの有効性を調べている点だ。
結論的から言うと、「M-CHATは自閉症の早期診断に重要で、医師の目を自閉症の可能性へ導くことができる。」とまとめられるだろう。
もちろんM-CHATはASDの可能性のある子どもをスクリーニングするのに有用だが、決して診断ツールではない。実際、18-24ヶ月までにスクリーニングすると、実に39%の子供が要注意と診断される。ただそのうちの11%が4年のうちにASDと診断される。すなわち、ほとんどが最終的に問題なしと診断されるが、しっかりとフォローが行われることで、M-CHATスクリーニングをしない場合と比べると、実に診断を7ヶ月早く決めることができる。また、ASD診断を見落とす可能性は低く、M-CHATでの要注意児は92%のASD診断児をカバーしている。
この研究では、例えば低所得層で、非白人ではM-CHATの有効性が低下するなどさらに詳しい解析が示されているが、これらは割愛していいだろう。重要なのは、M-CHATで要注意児をピックアップした後のフォローアップ体制で、ピックアップされる子供が39%近いとなると、児童相談所などでは対処しきれないだろう。その意味で、町の小児科医が積極的に参加するフォローアップネットワークを我が国でも確立し、早期診断が実際の治療に結びつく時代に備える必要があると思う。当然そのための経済的支援も重要だ。ぜひネットワークづくりに早急に取り組んでほしい。
2019年8月30日
少し執筆上の不自由を感じたので、Yahoo Newsに記事を書くのをやめることにした。そのため、書きためた自閉症の科学記事のAASJホームページへの引越しなどに手間取って、新しい論文を紹介するのが遅れていた。ようやく新しいHPの体制が整ったので、8月読んだ中では最も重要だと思う論文を最初に紹介したいと思う(Orefice et al, Targeting Peripheral Somatosensory Neurons to Improve Tactile-Related Phenotypes in ASD Models(抹消の体性感覚を標的にする治療はASDモデルの触覚に関わる症状を改善する)Cell 178, 867-886, 2019)。
自閉症スペクトラム(ASD)を、発達段階の外部との接触、特に様々な感覚器を通しての接触の異常として理解する考え方があり、実際ASDの人達の手記を読むと、十分説得力がある考え方だ。
この論文の著者らもこの考えに立っているが、普通は中枢神経系の状態と考えるASDを、すべて末梢神経の異常として捉えられないかという更に大胆な仮説を立て実験を行なっている。
まず、ASD様の症状を示すマウス遺伝子変異モデルを用いて、同じ変異を末梢神経だけに限局した時どうなるかを調べ、中枢神経は全く正常でも、末梢神経でShank3やMECP2などの遺伝子が欠損すると、同じ様にASD症状を示すことを示している。
さらにこの逆の実験、すなわち遺伝子変異マウスの末梢神経だけに正常遺伝子を発現させる実験を行い、ASD症状が改善することを示している。
これらの遺伝子変異はGABA受容体の興奮性を低下させることが知られている。このGABAを神経伝達に使う神経は、抑制性神経と呼ばれており、感覚器の場合、感覚神経の興奮を抑制する働きがある。すなわち、GABA受容体の興奮が低下すると、感覚神経が逆に過敏になる。
そこで、著者らは脳には到達しないが、GABA受容体の興奮を高める薬剤を使って、感覚神経の過敏性を発達期に抑える実験を行い、末梢神経の興奮レベルを正常化させると、ASD症状が抑えられることを明らかにした。
以上の結果は、ASDの多くの症状が、末梢神経の興奮レベルの変化に起因しており、これを脳には影響のない薬剤で正常化させることができるという画期的な可能性を示している。すでに薬剤も特定されていることから、安全に臨床応用をするめるためには、どの様な体制が必要なのか、速やかな論議が進むことを期待する。
また、人間のASDを末梢神経異常の観点から比べる研究が加速して欲しいと思う。中枢系よりはるかに治療可能性がある。この研究でモデルにつかわれたMECP2遺伝子変異は、欠損症と過剰症の2タイプが存在するので、両者を比べる研究から重要なヒントが得られる予感がする。期待したい。
(この論文は重要なのでYoutubeで解説することを計画している)
2019年8月25日
自閉症スペクトラム(ASD)は、極めて複雑で人間ならではの状態で、だからこそ神経多様性として捉えられようとしている。しかし、ASD研究、特に薬剤の開発や脳機能の解析研究には動物モデルが欠かせない。もちろんこの様な複雑な神経多様性を動物で再現するのはむずかしいため、遺伝的原因で発症するASDと同じ遺伝子を改変した動物を用い、人と動物モデルで共通に見られる症状を探し出して、研究を行なっているのが現状だ。
動物モデルを作る時重要なのは、神経機能に直接関わる分子、例えばシナプスの神経伝達に関わる分子の変異を利用することだ。これにより、比較的単純な(それでも超複雑なのだが)経路に絞ってASDの症状との関係を研究することができる。この様なタイプの変異で比較的頻度が高いのがグルタミン酸受容体が形成される時の基質となるSHANK3遺伝子が片方の染色体で機能を失う変異で、Phelan-McDermid症候群と呼ばれている。自閉症様症状だけでなく、筋力低下、睡眠障害、様々な程度の知能発達障害を示すが、同じ様な症状は多くの遺伝性発達障害でもみられる。
自閉症スペクトラム(ASD)全体から見ると、遺伝的な発達障害は一部に過ぎないが、原因となる機能分子がわかっているという意味で、遺伝的ASDは疾患メカニズムの研究に欠かせない。しかしほとんどのモデル動物は遺伝子改変がしやすいネズミでとどまっていた。たしかにSHANK3欠損マウスは社会性や学習異常を示すが、しかし人間と異なりヘテロではほとんど症状がないため、もっとヒトに近いモデル動物が求められていた。
昨年、クリスパー遺伝子操作を行ったクリスパー遺伝子操作受精卵を移植、出産させたとして中国の研究が一躍注目を浴びたが、これからもわかる様に中国はこの技術の利用の幅広さでは世界一といってもいい。
そしてついに、深セン市先端科学研究所の研究グループはSHANK3遺伝子変異サルを作成し、よりヒトに近い自閉症モデルとして使えることを示して先月Natureに発表した(Zhou et al, Atypical behaviour
and connectivity in SHANK3-mutant macaques(SHANK3変異を持つカニクイザルは非典型的行動と神経結合の異常を示す)Nature 570, 326,2019)。
この研究では受精卵のSHANK3遺伝子のエクソン21にCRISPR/Cas9を用いて機能欠損変異を導入し、最終的に5匹のSHANK3変異サルを得ている。それぞれゲノムレベルで起こっている変異は多様で、2匹は異なる変異をもつ2本の染色体が集まる複合ホモ接合体になっていた(あまり言葉を気にする必要はなくようするに遺伝子機能が完全に欠損したサルと考えればいい)。さらに、2匹のサルから精子を採取し、同じ様にSHANK3変異のヘテロ個体を繰り返して作れることも示している。すなわち、金はかかるが、ASHNK3モデルサルを欲しいだけ作れる体制が整った。
さて、症状だが、個体ごとにみられる多様な症状と、全ての個体で共通に存在する症状がある。例えば活動性は全ての個体で低下しており、睡眠障害、特に寝るまでに時間がかかる点は共通している。
社会性を様々な指標で調べると、サルになると正常でもかなり多様な行動を示す。しかし変異サルになると、全ての検査項目で一様に社会性が低下することがわかった。
また筋肉の低緊張もヒトと同じで一様にみられることから、ヒトのPhelan-McDermid症候群にかなり近いと結論できる。
サルでのモデルを用いると、マウスではほとんど不可能な視線を追いかける実験も行える。この結果、視線が落ち着かないという特徴が一様に存在することがわかった。同じ様な症状はASDでは一般的に指摘されているが、SHANK3変異によるASDでは調べられていないので、ヒトでも調べる必要があるだろう。
最後にテンソルMRIで各領域間の結合性を調べ、感情やモチベーションに関わる領域と前頭葉や運動野との結合が低下していることを示している。一方、やはりヒトで指摘されている様に、各領域の内部での神経結合性は高まっている。
以上が結果で、まだ始まったばかりだが、ヒトの症例をかなり反映したモデルができたと言えるだろう。また、サルで初めて見つかる症状も存在することから、今後詳しい解析が進めばそのままヒトの症例へフィードバックできる可能性がある。
なかでも最も期待されるのが、発達過程の解析、そして薬剤などによる介入実験だ。例えば以前紹介した様に 、マウスSHANK3変異を用いた研究でロイテリ菌が社会性を改善させる効果を持つことが示されている。ぜひ、サルを用いて組織レベルの変化まで詳しく調べ、新しい介入法の開発につなげて欲しい。
2019年8月25日
脆弱性X症候群
脆弱X症候群(Fragile X症候群:FXS)とは舌をかみそうな名前で、名前を見ただけでは何のことかわからないと思うが、我が国の難病情報センターのサイトによると少なくとも5000人(遺伝子検査を行えばおそらくもっと多くの)患者さんがおられる。様々な身体症状が認められるが、最も重要なのが知能障害と自閉症で、まだ完全に機能がわからないFMR1遺伝子の機能が低下することにより発送する遺伝病だ。
遺伝子変異の分子生物学的解析は進んでおり、遺伝子内に存在するCGGと塩基が繰り返す配列の数が増加することで、遺伝子の機能が失われることで起こる。このような3塩基リピート病の多くは、沈殿しやすいタンパク質ができて細胞が変性することが多いが、FXSの場合は、遺伝子内のCGGリピート配列がメチル化されて遺伝子の転写が抑えられることが原因であることがわかっている。
私のブログで紹介したように 、一旦できたメチル化を遺伝子治療ではずすことでFXSを治すことができる。すなわち、遺伝子治療による根本治療の可能性が示されている。
一般治療薬による脳神経ネットワークへの介入
このような遺伝子治療は将来の切り札にはなっても、まだまだ開発に時間がかかる。そこで、FMR1遺伝子欠損で症状が出るプロセスを解析して、FMR1欠損の影響を受けて変化している様々な治療標的を探す試みも行われ、現在多くの薬剤が治験段階にある。その中の一つが、高脂血症に用いられるロバスタチンで、マウスモデルでシナプスの変化を正常化できることがわかり、現在8歳から55歳までのFXSの治験が進んでいる。
しかしFXSが3歳ぐらいから発症することを考えると、できるだけ早い時点で治療を行ってみたいと思うのは当然だ。とはいえ、発達期の子供の薬物治療はハードルが高く、治験を始めるには動物を用いたしっかりした前臨床研究が必要になる。
今日紹介するエジンバラ大学からの論文は高脂血症の治療に使われるロバスタチンを、脳の発達が進む早い時期に投与すれば、根本的な治療が可能になる可能性を示したラットを用いた前臨床研究でScience Translational Medicineに掲載された(Asiminas
et al, Sustained correction of associative learning deficits after brief, early
treatment in a rat model of Fragile X Syndrome (ラットFXSモデルを早い時期に短期に治療することで連合学習を長期にわたって正常化できる), Science Translational Medicine 11:eaao0498, 2019)。
FXSは通常3歳ぐらいで知能異常や自閉症が発見される。したがって動物モデルで実験するとき(この研究ではラット)、生後4週ぐらいで完成する行動を特定し、その機能に対する薬剤の効果を調べる必要がある。この研究ではラットで生後4-6週から発達してくる連合記憶機能(複数の感覚入力を連合させて初めて成立する、場所と対象認識機能(例えばどこでその獲物に出会った)や、場所と文脈を組み合わせた対象の認識機能(どこでどんな時に出会った)などの学習機能を指す)が、FXSモデルラットでは選択的に抑えられることを確認する。
つぎに、ロバスタチンを生後5週目から餌に混ぜて投与し連合学習能を調べると、ほぼ完全に回復していることを確認する。しかも、こうして正常化した機能は、ロバスタチンをやめた後も長く維持される。
さらにロバスタチン投与したラットの脳の生理機能についても調べ、ロバスタチンがFXSで認められる海馬のタンパク質合成の上昇をおさえ、前頭前皮質の興奮の長期増強の異常を正常化できることも示している。
結果はこれだけだが、ロバスタチンという既存薬を発達期に投与することで、遺伝的欠損があっても神経ネットワークを長期間回復させられる可能性を示した重要な貢献だと思う。
同じように、FXSではロバスタチン以外にも、メトフォルミン、アルバコルフェンなど異なるメカニズムの薬剤の治験が進んでいる。すなわち遺伝子変異があっても、既存薬で治療できる可能性がある。
個人的意見だが、安全性が確認された薬剤については、発達期の子供で慎重に治験を進めてもいい時期に来たように思う。治験を進めるための条件について早期に議論されることを期待する。というのも、FXSでの経験は、他の原因による自閉症や知能障害の既存薬剤による早期介入治療の開発に直接つながる可能性は大きく、期待は大きい。
2019年8月25日
自閉症スペクトラム(ASD)治療薬の可能性が示された
このブログでも、ASDの症状を軽減する薬剤、例えばオキシトシンについて紹介してきた。他にも、自閉症様症状を示す遺伝病では、さまざまな薬剤の臨床治験が進んでいる。しかし、米国のFDAが認可したASD治療薬はまだ存在しない。ところが先週、ASDの幾つかの症状が改善することを示した科学的な手法に基づく臨床治験論文がScience
Translational Medicineに相次いで発表された。FDAもこの結果に注目して、特別に審査することを決めたほどの重要な展開だと思うので、緊急に紹介することを決めた。ただ、論文を読んでみると、背景にあるメカニズムについてはかなり高度の知識が要求される。そのため、少し努力してもらうことを前提としてブログを書くが、エッセンスだけを知りたい人のために、最後に簡単なまとめを残すので、ほとんど読み飛ばしてもらっていい。
バソプレシンとオキシトシン
ASDに対する薬剤というとオキシトシンと思い浮かべる人も多いと思うが、実際にはバソプレシンとセットにして理解しておく必要がある。バソプレシンは抗利尿ホルモンとしての作用がよく知られるが、実際にはオキシトシンと同じで、脳内で分泌され、社会性などの調節に関わることが知られている。ともに、9個のアミノ酸からできるペプチドで、何と2個のアミノ酸以外は全て同じで(図を参照)、分子の構造も極めてよく似ている。
バソプレシンには3種類、オキシトシンには1種類の受容体が神経細胞への作用の入り口になっている。しかし、バソプレシンは弱くではあってもオキシトシン受容体に結合できるし、また逆も起こる。このため、オキシトシンが実際にどの細胞を刺激しているかを完全に特定することが出来ない。すなわち、オキシトシンを投与した時オキシトシン受容体細胞だけが活性化するわけではなく、両者が複雑な相互作用を行うため、それぞれの影響は複雑な相互作用の総和として現れる。すなわち、因果性をはっきりさせることが大変難しい。
バソプレシンはASDの社会性を回復させる
さて今日最初に紹介するスタンフォード大学からの論文は、6歳から12歳のASD児童に鼻粘膜からバソプレシンを4週間続けて投与することで、ASDの様々な社会症状が軽減することを示した臨床治験研究だ(Parker et al, A randomized placebo-controlled pilot trial shows that
intranasal vasopressin improves social deficits in children with autism(バソプレシンの無作為化盲検法による小規模治験は自閉症の児童に対して効果を示した)Science Translational Medicine 11: eaau7356, 201)。
30人の6-12歳のASD児童を無作為化して、バソプレシンを含む経鼻薬あるいは偽薬を含む経鼻薬を毎日投与、4週間目に様々な指標での症状改善を調べている。詳細は全て省くが、社会性、反復行動、過度の不安など全てではっきりとした改善が認められ、また心配される血管や腎臓の副作用もないという素晴らしい結果だ。示されたデータを見ると、素人の私でも改善がはっきりしているのがわかる。
この治験では利尿や血圧への影響を考えて、中程度の用量を用いているが、不思議なことに血中のバソプレシンがもともと高い子供ほど改善の程度が強い。この結果は、ASDの児童ではもともとバソプレシンの分泌量が低く、その結果血中濃度の低い子供では投与した量では足りないのかも知れない。
なぜバソプレシンの治験がこれまで進んでいなかったか考えてみると、正常人にバソプレシンを投与すると、特にバソプレシン受容体の一つV1aRを介して、不安や恐怖が高まることが知られていたためで、もし同じことがASDの子供に起こると、逆効果になる。しかしこの論文は、ASDの子供についていえば、これは全く杞憂であったことを意味しており、実際不安に対する自己防衛とも言える反復行動や、不安症状もバソプレシン投与で軽減している。是非大規模治験を早く進めてほしい。
バソプレシン受容体V1aRの阻害剤も自閉症症状を改善させる
今日紹介したいもう一つの論文は製薬会社ホフマン・ラ・ロッシュの研究所からの論文で、今度はV1aR受容体の機能を抑制すると、大人のASDの症状を改善できる可能性を示した臨床治験だ(Bologani et al, A phase 2 clinical trial of a vasopressin V1a
receptor antagonist shows improved adaptive behaviors in men with autism
spectrum disorder(バソプレシン受容体V1aの阻害剤はASDの大人の適応行動を改善した)Science Translational
Medicine11: eaat7838, 2019)。
先の論文ではバソプレシン自体がASDに効果があるといい、この論文ではバソプレシン受容体の抑制がASDに効果があるというのは、矛盾するように思えるが、最初述べたように反応する受容体が複雑なため、このような結果自体はある程度理解することができることを最初に断って、治験の結果だけを紹介する。
このVa1R阻害剤は、内服できるという最大のメリットがある。先に述べたように、正常人でバソプレシン投与が不安症状を高めるという結果に基づき、V1aR受容体を抑えると不安を抑えられるのではと期待して開発が進められた。
この治験も無作為化し偽薬も用い、患者さんには何が処方されているかわからなくなっている。対象は大人のASDに限っており、A1aR1は当然抗利尿作用などもあるので、確かに最初から児童について調べるのは難しいと思う。実際には偽薬あるいは3種類の異なる用量を服用させ、12週目に様々な指標で効果を確かめている。
結果だが、付き添いの人の印象に基づく改善度(最も厳しい指標)で見ると4mgまで全く効果がないが10mgでは効果が少しみられている。この結果に基づき、計画通りの効果が見られなかったと結論しているが、しかし社会性やコミュニケーション能力の検査では、服用量に応じて改善がはっきり見られている。副作用では不思議なことに、最も多い10mgを投与した群より、偽薬群のほうが頻度が高いという結果で、おそらく長期の使用も問題ないだろうと結論している。
まとめ
科学的な手法に基づく臨床治験(第2相)で効果がはっきりしたASDの治療法が初めて報告された。現在オキシトシンの治験がどのような状況か把握していないが、バソプレシンや受容体阻害剤が有望な薬剤として登場したのは、私にとっても意外だった。しかし、ASDの人たちにとっては、科学的な効果が確認された薬剤があることが重要で、その意味では大きな前進だと思う。今後大規模治験、対象を変えた治験など、多くの臨床治験が進むことが期待され、実際FDAなども本腰を入れて支援する構えだ。時間はかかると思うが、進展については逐一紹介するつもりなので、乞うご期待。
2019年8月25日
ウイリアムズ症候群とは?
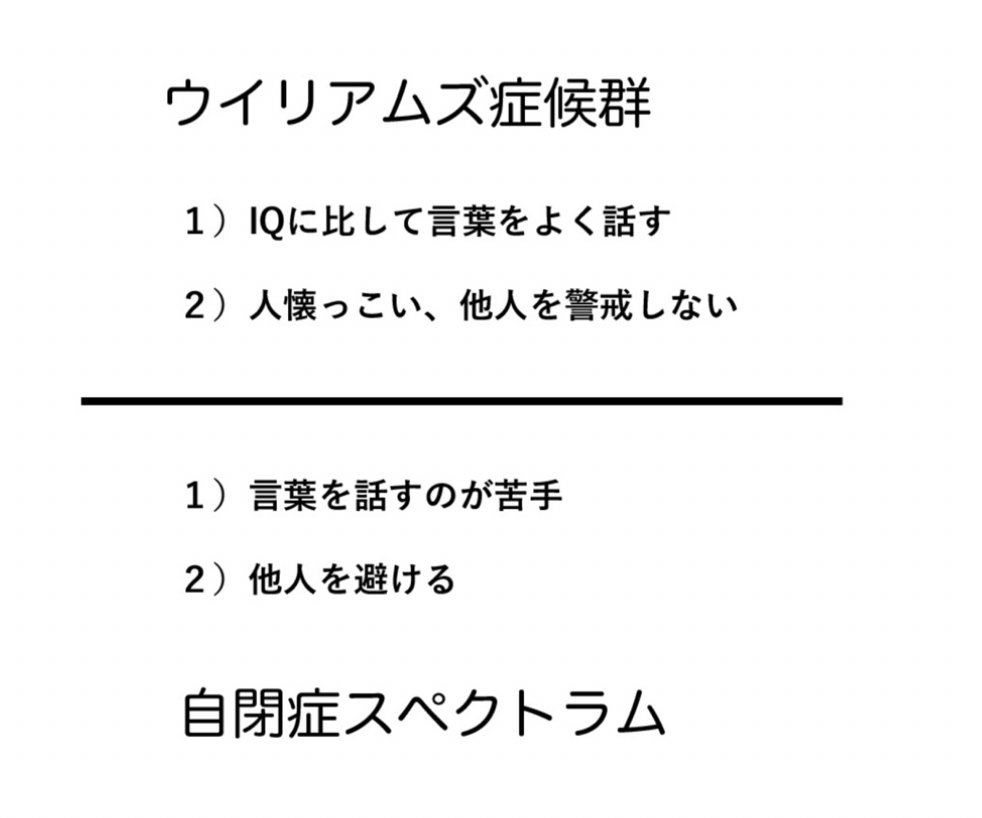
まずほとんどの読者は、ウイリアムズ症候群について聞いたこともないと思う。しかし発症メカニズムも全く異なっているのに、なぜかウイリアムズ症候群は自閉症スペクトラム(ASD)と対比して語られることが多い。この理由は、両者が社会性という点で全く逆の症状を示すからだ。
ウイリアムズ症候群(WS)の原因はよくわかっており、7番染色体の一部が大きく欠損することで起こる遺伝病だ。欠損する領域には、26種類の遺伝子が存在しており、知能だけでなく、実際には様々な身体の発達障害をがおこる。ただWSが注目される最大の理由は、知能発達の遅れにも関わらず(IQの低下がある)、言葉を話す能力が極めて高い。そして「天使のように愛くるしい」と形容される人懐っこさを示し、初めての人でも不安を持つことなく近づく社交性を同時に持っている。
これに対し、ASDは知能発達は正常でも、言葉を話すのが苦手で、他の人と接するのを極度に嫌う。すなわち、WSとは真逆の症状を示す。
この結果から、話し言葉の能力には、他の人と交流したいというモチベーション、すなわち社会性が重要な要因であることが想像される。このため、ASDとWSから言語と社会性の関係が理解できるのではと研究が続けられている。
犬はウイリアムズ症候群?
一部の遺伝的ケースを除いて、多くの遺伝子が複雑に絡み合うASDと違って、WSでははっきりと同じ領域の遺伝子欠損が認められる遺伝病だ。ただWSでは最大26種類もの遺伝子が欠損するため、どの遺伝子が社会性に関わるのか絞り込む作業が必要だ。最近の多くの症例の解析から、社会性にはGtf2遺伝子が重要な働きをしていることがわかってきた。すなわち、大きな欠損があってもGtf2i遺伝子が残る場合は、社交性の変化は見られない、あるいは欠損でもGtf2i遺伝子が欠損した場合だけ、社交性が高まることがわかってきた。
更に驚いたのは、2017年プリンストン大学のグループが、オオカミとペットとして飼われるようになった犬の遺伝子を比べ、なんと犬ではGtf2iを含むWS領域に構造的な変異が起こっていることを発見した(von Holt et al, Science Advances 3:e1700398, 2017)。すなわち、オオカミを飼いならして、人になつく様に犬をペット化する過程で、このWSに関わる遺伝子の発現が意図せず変化させたという、嘘のようなしかし納得の話だ。
Gtf2i遺伝子の機能をマウスで調べる
このように、高い社交性に関わる遺伝子が特定されてくると、その遺伝子を操作する動物実験が可能になる。神経細胞だけでGtf2i遺伝子を欠損させたマウスを用いて、マサチューセッツ工科大学のグループは、WSのメカニズムを調べNature Neuroscience4月号に掲載した(Barak et al,
Neuronal deletion of Gtf2i, associated with Williams syndrome, causes
behavioral and myelin alterations rescuable by a remyelinating drug (ウイリアムズ症候群に関わるGtf2iの神経細胞特異的ノックアウトは再ミエリン化薬剤で治療可能な行動とミエリンの変化の原因)Nature Neuroscience 22: 700, 2019)。
この研究では前頭葉の興奮ニューロン特異的にGtf2i遺伝子をノックアウトしたマウス(cKOs)を作成し、WSと比べながら調べ、以下のような結果を得ている(少し説明が専門的になるので読み飛ばしてもらえればいい)。
WSでは大脳皮質の縮小が見られるが、Gtf2iを神経で欠損させても同じような皮質の現象が見られる。 WSは高い社交性と、不安の欠如が見られるが、cKOsの行動解析でも、同じように、他のマウスに対する高い社交性と不安行動の低下が見られる。 cKOsの遺伝子発現を調べると、なんと低下する遺伝子の7割がミエリン合成に関わる分子で、実際脳のミエリンの厚さが低下して、神経伝達速度が低下していることがわかった。そこで、WSの脳の遺伝子発現とミエリンを調べると、cKOsと似たミエリン厚の低下と、ミエリン関連遺伝子の発現低下が見られた。 カリウムチャンネルをブロックして神経伝達機能を高めるアミノピリディンを投与すると、運動機能が正常化し、さらに社会性が高いという変化も正常化する。 オリゴデンドロサイトの分化を誘導しミエリン形成を高めることが知られており、現在はアレルギー症状改善に用いられるクレマスチンを投与すると、ミエリンの厚みが増し、社会性も元に戻る。 Gtf2iを片方の染色体のみ欠損させた、よりWSに近いモデルマウスでもWSと同じような症状とミエリン形成異常が起こる。 要するに、WSの精神発達障害のかなりの部分はGft2i遺伝子の欠損で説明でき、しかも薬剤による治療可能性があることを示した画期的研究だと思う。特に運動障害も正常化することから、社交性や不安感状の欠如のみならず、多くの症状を改善できるかもしれない。
また、WSを調べることで、分子、神経ネットワーク、社会性などの行動を結ぶメカニズムを理解することが可能になる。こうして得られた知識は、間違いなく裏返しの症状を示すASDの理解と治療にも役立つと期待している。