ゲノム科学
ゲノムを考える
2015年5月15日
序:ゲノムは情報
今はその気になれば全ての生物のゲノム解読が可能で、順を追って全ての種のゲノムを明らかにする国際プロジェクトが進んでいる。また個人レベルの進化研究も、ゲノムプロジェクトのおかげで大きく進展した。事実これまで30話にわたって紹介した論文のほとんどは、ゲノム解読を最も重要な研究手段として使っている。例えば昨年8月に第13話で紹介した何十羽のカラスのゲノムを比べる研究が行われる日が来るなど、私が大学を卒業した時には想像できなかった。誰もが同じ理解を共有していると思い込み、日常深い考えもなく頻繁に使っている「ゲノム」という言葉も、改めてその意味はなにか?と問われると答えるのは簡単ではない。そこで、30話を終えたところで少し立ち止まって、ゲノムとは何かについて何回かに分けて整理することにした。
いうまでもなくゲノムとは個々の細胞の中にあるDNA全体が代表している何かだ。DNA自体は物質の総称で、4種類の異なる塩基を持つヌクレチドがつながった巨大分子と定義することができる。しかし、ゲノムが持つ意味はこの物質性とは全く別のところにある。例えばゲノムは、我々が遺伝子と呼ぶものに対応する部分を持つが、遺伝子という言葉は、それがコードしている特定のペプチドや機能的RNAと対応して初めて意味を持つ。ヘモグロビンの遺伝子、ケラチンの遺伝子という具合だ。しかし、遺伝子=DNAではない。普通ヘモグロビンのDNAとは言わない(そう呼ぶ場合はDNAを遺伝子と同義に使っている)。これはDNAが物質で、遺伝子が機能をさす言葉だからだ。逆に言うと、遺伝子という概念には核酸という物質性は含まれる必要はないが(PC上に遺伝子を保存できる)、それが参照する分子の概念は必ず含まれる。ここでとりあえず遺伝子という言葉を、「DNAを媒体とする、特定の分子を参照する情報」と定義しておこう。
では情報としてのゲノムの性質を次に考えてみよう。遺伝子が情報として働くことを可能にしているのが、DNAの持つ情報媒体としての性質、即ち異なる塩基を持つ4種類のヌクレオチドが様々な配列で並ぶポリマーを作り、この並び方のパターンで無限のモノやコトを参照できるという性質だ。この情報は一定の法則にしたがって、実際の機能分子へと変換され生命を支える。また、AはT、CはGと相補的に対応することで自らの複製、伝達、転写が可能になる。見れば見るほど完璧な情報媒体だ。しかし、このDNAが持つ情報媒体としての完璧性が、ゲノムの理解を難しくしている。ゲノムの概念に何が含まれているか見てみよう。まずタンパクや機能的RNAへと転換される遺伝子が存在する。加えて、遺伝子発現制御やスプライシング制御など ‘コト’についての情報も同じようにA,T,C,Gの配列で表現されている。ただ問題は、核酸の並びにモノや機能を対応させられない配列、その機能や意味が全くわからない配列が、対応が付いている配列の何倍も存在している。この理解できない配列を情報と考えていいのか?存在しないのと同じと無視していいのか?これが決められない以上はゲノムも理解できない。繰り返すが情報媒体としてDNAは完璧だ。そのためDNAには必ず情報が存在すると思ってしまう。このことは文字と比べてみるとよくわかる。最初から文字は言語という情報の媒体として生まれてきた。従って、文字があるとそこに必ず情報があると私たちは確信する。だからこそ、初めて見たシュメール人の楔形文字も解読できると確信した。しかし例えばアルファベットをランダムに並べることは簡単で、いくら文字の並びが目の前にあったとしても情報を担っているかどうかはわからない。DNAも文字と同じで、その機能は情報をコードする媒体だ。このため、DNAには情報が必ず担われていると思ってしまう。しかし意味のない単語からわかるように情報媒体を使っても情報でない例はいくらもある。では文字と同じように、意味が理解できない配列は情報ではいと無視すればいいだろうか?実はそう簡単ではない。今回は短く触れるだけにするが、ゲノムには言語と異なるさらに厄介な問題がある。即ち情報の出し手がいないという問題だ。言語の場合、情報には必ず出し手と受け手が存在する。一方、ゲノム上の情報には出し手はいない。シャノンの情報理論を見ると、出し手がいるということで100%正確な情報がまず存在することが前提になっている。即ち何が情報で、何が情報でないかは最初から決まっている。一方、ゲノム上の核酸配列は、何が情報で、何が情報でないか最初からは決まっていなかった。というより、そもそもゲノムには情報としての出し手がいない。誤解を恐れずいうとDNAという情報媒体は自ら新しい情報を生み出せるという性質を持つ。このため、今私たちが情報でないと判断した部分も、将来情報化できるポテンシャルを持っている。さらに一つのゲノムが新しい情報を生みだすのに一部の部分だけが関わるわけではなく、ゲノム全体が様々な形で新しい情報の誕生に影響を及ぼしている可能性がある。即ち、部分と全体が常に一体化していて、分けることができないという生物の特徴的関係が、ゲノムレベルにも存在するようだ。従って、ゲノムは部分として様々な情報をコードするだけでなく、全体として新しい情報の誕生や消滅に関わっている可能性が高い。このようなゲノムの性質は、出し手のはっきりしたシャノン情報理論でゲノムを捉えることが難しいことを意味している。このように、情報としてゲノムが持つ数々の問題がある。これから「ゲノムを考える」で、この問題をもう少し深く掘り下げながら、ゲノム理解を妨げている問題を整理したいと思っている。
「ゲノムを考える」導入部、第一回の結論は「ゲノムは情報」だ。このことを示した面白い論文を一つ紹介して31話を終わる。山梨大学教授の若山さんがCDB(理化学研究所 発生・再生科学総合研究センター)在籍時に行った仕事だ。昨年は小保方問題の渦中の人になってしまった若山さんのライフワークは絶滅種、あるいは絶滅危惧種をクローン技術で復活させることだ。この模擬実験として、若山さんは16年フリーザーの中に捨てられていたマウスの死体の細胞から核を取り出し、核を抜き取った未受精卵に移植した。無論16年経っていると言ってもひょっとして生きた細胞が残っているかもしれない。核移植に使った細胞が全部死んでいることを確かめるため、フローサイトメーターで100万以上の細胞を調べても生きた細胞を見つけることができなかった。このように完全に死んでいることを確認した細胞から核を取り出し、卵に移植すると高い確率で胚発生が始まり、その胚から多能性幹細胞株(ES細胞)を樹立することができた。さらに、このES細胞株をマウス胚盤胞に移植して発生させると生殖細胞に分化し、ついに死んだ細胞の核から生きたマウスを作成することに成功した。若山さん自身は論文の中でこの結果をもっぱら技術的進歩として議論しているが、私にとってはゲノムが情報であることの最も明確な証明に見える。すなわちゲノムの完全性は細胞の生き死にに関わらず維持されている。情報の完全性に、生命というシステムは必要ない。情報を実験的に扱うときは、物質として扱えばいい。この実験系なら、削ったり、足したり、再編成したゲノムからクローンを作ることで、ゲノム情報の全体と部分の関係を問い直す実験ができるかもしれない。
[ 西川 伸一 ]
ゲノムの解剖学
2015年6月2日
31話でゲノムは情報だと結論した。では私たちのゲノムがどんな要素からできているのか、まず解剖学から始めよう。実際にはミトコンドリアにもゲノムはあるのだが、話を簡単にするために核内のゲノムに限る。一部の細胞(例えば赤血球)を除いて、私たちの細胞の全てに核があるが、ゲノムはこの核内にあるDNA総体が表現している情報だ。核内には46本に分かれたDNAが存在し、ヒストンをはじめとする多くのタンパク質と結合して、コンパクトに折りたたまれ、染色体を形成している(図1)。この染色体一本一本の基本的構造は同じなので、ここからはゲノムが一本の染色体からできているかのように話を進める。
図1 ヒトのゲノムは核の中に46本の染色体に分かれたDNA。
ヒトのゲノム全体は、約30億個のヌクレオチドが連なった高分子で、ヌクレオチドの持つ4種類の塩基の組み合わせが媒体となって全ての情報が書かれている。ゲノム内の情報がコードする最も重要なものが、細胞という化学反応系を形成・維持するための基本分子であるたんぱく質で、これに対応するゲノム部分をcoding DNAと呼んでいる。何をcodingと呼ぶかは定義の問題なので、ここではタンパク質まで翻訳される遺伝子をcodingDNAと呼ぶ。ただこのcoding DNAに対応する遺伝子はヒトで22000程度しかなく、全ゲノムに占める割合は1.5%もない。少数の例外を除いて、個々のたんぱく質をコードする遺伝子はエクソンと呼ばれる小さな部分に別れて存在している。一度RNAに転写されてから、たんぱく質の情報に関わらない部分を除去した一本のmRNAへとつなぎ合わせた後翻訳される。このエクソンとエクソンの間にある配列をイントロンと呼ぶ。遺伝子が情報としての機能を発揮するためには、他にも遺伝子を正しい場所からRNAに転写するための様々な指令情報が必要だ。このほとんどは、エクソンの外、すなわちイントロンや遺伝子から様々な距離で離れたnon-coding領域に存在している。これからわかるのは(図2)、たんぱく質という「モノ」に対する情報(エクソン)と、モノの情報を書き出すための様々な標識、すなわち「コト」に対する情報から一つのcoding単位ができていることだ。
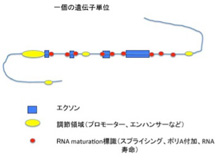
図2 coding遺伝子単位の概略。調節領域の指令で遺伝子が転写されると、RNA maturation に関わる標識により、イントロンが除去された一本のmRNAが形成される。
「モノ」「コト」両方の情報を含めると、coding単位がゲノムに占める割合はずっと大きくなるが、逆にその正確なサイズは測定しにくくなる。なぜなら、「コト」に必要な情報が、ゲノムのどこからどこまで必要かを正確に算定できないからだ(これは次回に議論する)。さらに、同じ遺伝子領域に逆向きに異なる遺伝子が並んでいることもある。したがって、正確にcoding遺伝子セットが占めるゲノム上の割合を算定することは難しい。
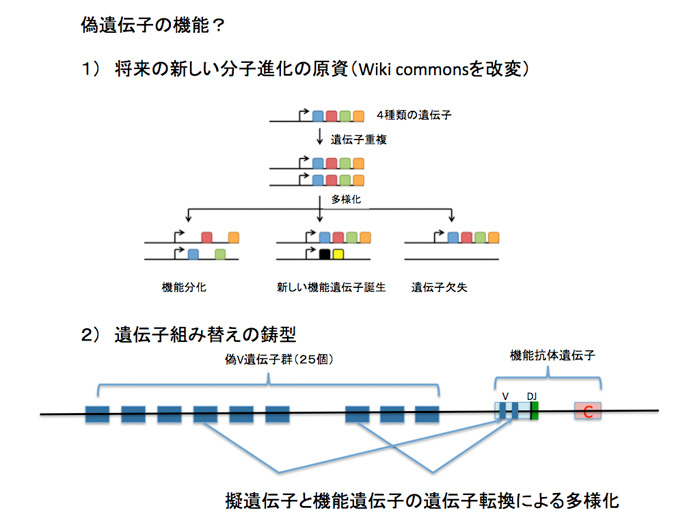
次にcodingとは言えないが、構造的には遺伝子と呼べる単位が存在している。ただ、正常な遺伝子とは異なり、そのまま翻訳されタンパク質ができることはない。そのため、偽遺伝子と呼ばれている。ヒトでは偽遺伝子と考えられる部分がなんと1万以上も存在している。進化の過程では、coding遺伝子が重複を繰り返して多様性を拡大するのをよく見ることができる。このように重複した遺伝子に変異が導入されて機能がなくなると偽遺伝子と呼ばれるようになる。偽遺伝子が最も多いのは嗅覚受容体で、ヒトでは400の機能的遺伝子に対してなんと600もの偽遺伝子が存在している。ただ、偽遺伝子だからなんの役割もないと決め付けることはできない。成り立ちから考えても、偽遺伝子といえども、構造的には遺伝子と同じだ。しかも、機能していないことから、変異が蓄積されやすく、新しい機能を持った遺伝子を作るという目的にはうってつけの材料だ(例えば第21話参照)。この意味で、遠い将来、新しい機能を持つ分子の資源としての役割を担っているということができる(図3)。また、ニワトリの免疫グロブリン遺伝子で見られるように、機能的抗体遺伝子と遺伝子転換により部分の交換を行うことで抗体の多様性を生みだすための鋳型として働いている場合もある。このように、ゲノム各領域を、それが必要とされる時間スケールを変えて見ることは、ゲノム理解について重要で、これについても次回以降議論する予定だ。
DNAにコード可能な生体機能分子はタンパクだけではない。これまで多くの機能を持つRNA分子が知られている。リボゾームRNAやトランスファーRNAなどのタンパク翻訳に関わるRNAはその代表的なものだが、他にもスプライシングやRNA編集などのRNA成熟、DNA合成、遺伝子制御、トランスポゾン制御など、多岐にわたる機能を持つRNAが知られている。機能の詳細は省いて図にまとめておくが、機能的RNAはゲノムの4%ぐらいを占めていると考えられている。これらを一つ一つ紹介するつもりはないが、この中のnoncodingRNAは、DNAが持つもう一つの顔を示していると考えており、これも次回以降議論する。

図4 様々な機能的RNA このリストは機能的RNAの一部。
ここまで主に転写される部分について見てきたが、ゲノムには多くの転写されない場所が存在する。例えば、染色体のヘテロクロマチンと呼ばれる場所に存在する繰り返し配列の集合は、全ゲノムのおおよそ6%を占めている。分裂時に染色体を引っ張る微小管の結合部位である動原体が結合するために使われているセントロメアや、分裂時に染色体が削られて重要な遺伝子が消失するのを防いでいるテロメアなどは、転写はされなくてもゲノムの複製や維持に必須の領域であることがわかっている。しかし、ヘテロクロマチンを形成する他の多くの繰り返し配列は、機能がよくわかっていない。実際、ヘテロクロマチンとそれに対応する繰り返し配列は、種を越えてひろく存在しているが、その配列自身は保存されていない。他にも、超可変ミニサテライト(hypervariable minisatellites)と呼ばれる、ユークロマチンに存在する繰り返し配列も存在する。
ヒトゲノムの解読結果を見た時の一番大きな驚きは、トランスポゾンに由来する配列が全ゲノムの5割近くを占めていたという事実だ(図5)。トランスポゾンとは、基本的には細胞の中で染色体から染色体へ伝搬できる遺伝子単位を指し、図に示すようにLINE, SINE, LTR—トランスポゾン(レトロビールス型)、そしてDNAトランスポゾンに分類されている。
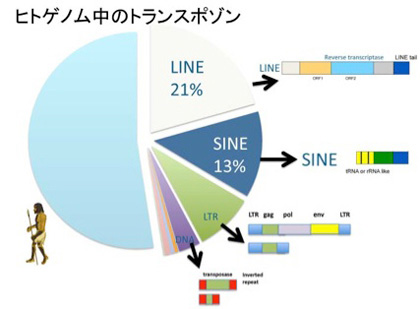
図5 ヒトゲノム中に見られるトランスポゾンの種類とゲノム上の割合。
これらはレトロトランスポゾンと、DNAトランスポゾンに大別され、レトロトランスポゾンはレトロウイルスと同じように、ゲノムからはRNAとして読み出され、そのRNAが逆転写酵素でDNAに転写されたあとゲノムに挿入されることで伝搬する。完全型のレトロトランスポゾンは、従って逆転写酵素をコードしている。逆転写酵素を持たない不完全型レトロトランスポゾンの場合は、完全型のトランスポゾンが発現する逆転写酵素を利用することで伝播が可能だが、基本的には伝搬能力を失っていると見たほうがいいだろう。RNAとしてゲノムからそのまま転写されるレトロトランスポゾンと異なり、DNA型トランスポゾンは自らを正確にゲノムから切り出し、また他の箇所に挿入するためのトランスポゼースと呼ばれる酵素をコードしている。多くの種では、完全なトランスポゼースを持ったトランスポゾンがゲノム中に存在しているが、ヒトゲノム中に存在しているほぼすべてのトランスポゾンは、トランスポゼースの活性を失っている。従ってトランスポゾンの活性を失った化石といえる。
今回は話を進めるための基礎知識として、ゲノムの構造要素の概略を述べた。こうしてヒトゲノムを解剖していくと、こじつけもあるが、おおよそ6割の配列になんらかの意味を対応させることができる。ただ意味や機能が想像だにできない部分が4割近く存在する。また私たちのゲノムのほぼ9割をトランスポゾンか、意味のわからない配列が占め、これらの塩基配列に何か積極的な意味があるようには思えない。このため、ジャンクDNAと呼ばれたりしている。ただ、意味が無いのか、理解できないだけなのか、9割を占めるジャンクについて考えることが必要だ。もちろん種によって、この構造は多様で、ジャンク配列のゲノムに対する割合も大きく違う。次回からは、ゲノムを構造化することで新しい情報が生まれるようすを見ながら、さらにゲノムの理解を進めてみたい。
[ 西川 伸一 ]
構造としてのゲノム
2015年6月15日
ここまで、ゲノムが細胞の生き死にに左右されない(言って見ればPCが止まっていてもメモリーは残るようなもの)情報であることを見てきた。しかし、ゲノムに組み込まれた情報が全てATCG塩基配列で表現されていると考えると、大きな間違いを犯すように思う。すでに見たように、翻訳されるたんぱく質をコードする情報自身は塩基配列で表現されているが、ゲノム上に全くランダムに存在するのではなく、適当な長さのエクソンに分かれ、それを転写するための様々な指令情報が組み合わさった単位として存在している。すなわち、一定の構造をとっている。「何を今更?」と言わずに続いて聞いてほしい。この転写を調節する時に使われる様々な「コト」についての指令標識は塩基配列として表現されるが、それ以外にも情報化されていることがある。例えばイントロンの長さ、エンハンサーの位置などは、ゲノム上の構造として表現されるものだ。もしイントロンの長さが遺伝子の転写に重要な役割があるとすると、全く意味がわからない塩基配列も情報として意味を持つ可能性がある。我々のゲノムのかなりの部分が、情報として具体的な何かに全く対応していないジャンクと呼ばれるDNA配列だと述べたが、これも塩基配列で表現できる情報としてみると意味がわからないからジャンクと呼んでいるだけで、構造としてゲノムを見た時重要な役割を持つのかもしれない?そこで、まずゲノムが構造化されることで生まれる塩基配列とは違った情報の可能性について見ていこう。
1、遺伝子の秩序立った配置:Hox遺伝子の衝撃
ゲノムが構造化されることで、DNAが新しい情報媒体になることを我々が最も実感したのは、頭から尻尾まで、体の各体節のプランを決めているHox遺伝子のゲノム上の構造が明らかにされた時ではないだろうか(この遺伝子の変異で触覚が足に変わったショウジョウバエについては既に第6話で述べた)。急速に進む様々な種のゲノム解析から、ほぼ全ての動物種で、何個ものHox遺伝子が小さな領域にクラスターを作って集まっていることがわかってきた。図1に示すように、現在ではこのクラスター内のHox遺伝子を5’から順にHox1,Hox2….Hox13と名付けている。
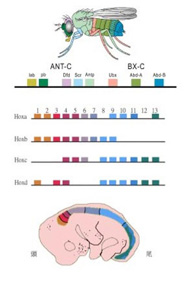
図1ショウジョウバエと哺乳動物のHox遺伝子構成と、その発現。体軸に沿った発現のパターンが、遺伝子の構成と対応している。この対応関係はcollinealityと呼ばれている。
脊椎動物より未熟な動物ではこのクラスターは一つしかないが、脊椎動物では重複により別々の染色体に4つのHox遺伝子クラスターが存在する。驚くべきことに、体の体制が完成した胎児期にHox遺伝子の発現を調べると、ショウジョウバエも、マウスでも図1に示すようにゲノムに並んだ順番、すなわちHox1からHox13まで順番にそって、頭部から尾部へHox遺伝子が発現している。このゲノム上の遺伝子の配置と、頭部から尾部への発現場所の対応性はcollinealityと呼ばれ、左右相称動物では広く保存されており、このHox遺伝子の決まった配置を維持することの重要性を示している。
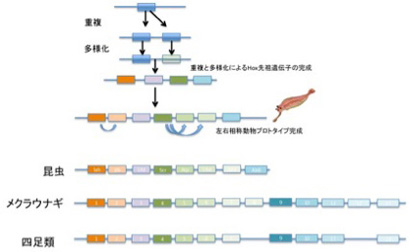
図2 Hox遺伝子クラスターの進化。四足類ではHoxAからHoxDまでの4クラスターが存在するが、便宜的にこの図ではHoxAクラスターで代表させている。
次に、図2に従ってHox遺伝子クラスターの進化過程を見てみよう。第一段階では遺伝子重複によりまず4種類のHox遺伝子が並んだクラスターが形成される。こうして生まれたゲノム上のHox遺伝子クラスターは、次の左右相称動物の進化過程で原型が完成し、各Hox遺伝子の塩基配列だけでなく、配置そのものが情報として体の前後の体制の形態形成に利用されるようになる。その後それぞれの動物の体制に合わせてHox遺伝子の数は増減し、また配置も変化しているが、基本的には各遺伝子の配置は前後軸に合わせて構造化されたまま維持される。この事実を見ると、遺伝子の配置という構造が塩基配列とは異なる情報をゲノムの中に持ち込んでいるのがわかる。構造やデザインが機能を持ち、情報になることは生物の世界では当たり前だ。当然ゲノムも形質と同じように、特定のデザインの下に構造化されることで新しい情報を持っても不思議はない。例えばHox遺伝子の塩基配列はそのままで、順序が狂うことで新しい体の体制が生まれたとしよう(例えば尾が長くなる)。もしこの結果生まれた形質が自然選択されたとすると、この時選ばれた変異は塩基配列の変異ではなく、遺伝子の配置、すなわち構造の変異が情報として選択されたことになる。あるいはまたHox遺伝子間の距離が一定に保たれることが重要だとすると、その距離を埋めているのは特定の配列というより、ATCGを積み重ねて一定の長さを実現できるDNA の物理的性質によっていると言える。すなわち、塩基配列が問題ではなく、構造が問題になっている。重要なことは、構造化により生まれる情報も、子孫に伝える時は塩基配列情報として複製される点だ。複製だけを見ていると塩基配列だけが情報だと勘違いするが、このように伝達時には塩基配列情報として、機能発揮時には構造情報として働くゲノム部分があることを無視してゲノムは考えられない。
2、ヌクレオソーム
染色体を見ると、塩基配列とは無関係にDNAを基材とする構造が形成されている。これもDNAが持つ構造化能力の例だ。具体的に見てみよう。図3に示すようにDNAは4種類のヒストンが集まった8量体に巻きつくヌクレオソームという構造を取っているが、ヒストンとDNAの結合には原則として特異的な遺伝子配列は必要ない。
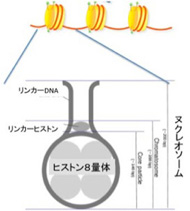
図3 ヌクレオソーム単位の構造。一つのヌクレオソームには200bpのDNAが巻きついている。
<引用>
上図:http://commons.wikimedia.org/wiki/File:Nucleosome_structure_and_subunits.svg
下図:http://commons.wikimedia.org/wiki/File:Pioneer_Factor_rearrange_the_nucleosome.jpg
これまでヌクレオソーム構造は、長いDNAを核内にコンパクトにたたむために進化してきたと考えられてきた。しかし、遺伝子の大きさが4Mbしかない古細菌類の一部がヌクレオソームをもつことが発見され、今では転写を効率化するために進化してきたと考えるようになっている。実際、古細菌、真核生物の両方で、転写開始点のほぼ全てがヒストンに巻きついていないリンカーDNA部位に存在している。すなわち、ヌクレオソームは高々200bpの長さのDNAからなる小さな単位で、構造も単純なため複雑な情報を持つことはないが、ゲノム内の最小構造単位として、転写開始場所を構造的に指示するために進化してきたようだ。
ヌクレオソームの出現は、その後の生物情報の可能性を一変させ、最終的に人間の言語獲得にまで至る道を決定付けたと思っているが、このことはまたいつか議論しよう。ともかくヌクレオソーム構造獲得のおかげで、このコアヒストン構造をさらに修飾してゲノムの使い方を決めるエピジェネティック機構が進化し、ゲノムにさらに複雑な構造化を導入することを可能にした。実際先にあげたHox遺伝子の配置はこの新しい機構を巧みに取り込んでいる。体の節、すなわち体節を形成する中胚葉では最初HoxA遺伝子クラスターは全てH3ヒストンの27番目のリジンがメチル基で修飾されており、これによりHoxクラスター全体の遺伝子の発現が抑えられている。即ち、ヒストンの修飾により転写に必要な分子が近づけない領域を構造的に保証している。この抑制型ヒストンは発生が進み前方から体節が発生する時には、前側のHox遺伝子領域から外れ、体の体制に合わせてHoxクラスターが発現できるための重要なメカニズムになっている。最終的に、体幹部では後ろ側のHox遺伝子が存在する領域は抑制型ヒストンが維持されるため、後ろ側のHox遺伝子は発現できない。一方、体の後方ではほとんどの領域から抑制型ヒストンが外される。このようにHoxクラスターの配置が体の位置と対応しているおかげで、Hoxクラスターの発現調節を大まかに区域化することが可能になり、体の複雑なプランを指示することが可能になっている。ただ、H3K27のメチル化を介するゲノムの区域化は特殊な例で、普通はH3の4番目のリジンがメチル化したH3K4me3と、9番目のリジンがメチル化したH3K9me3が引き金となって、染色体構造をそれぞれユークロマチンと呼ばれる開いた状態と、ヘテロクロマチンと呼ばれる閉じた状態に構造化することが、最も普通に見られる転写活性の区域化のやり方だ。この構造化はDNA自体のメチル化も含め様々な分子が関わる複雑な過程で、マトリックスとしての ゲノムを考える時に議論したい。また、生命誌ジャーナルでもクロマチンについて国立遺伝研究所の広瀬さん、前島さんに解説をいただいているので、是非参照いただきたい
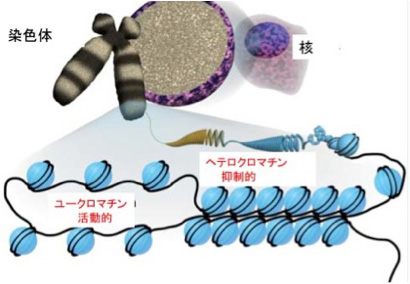
図4 クロマチン構造。染色体を見ると、ヌクレオソームの密度が高い場所(ヘテロクロマチン)と、低い場所(ユークロマチン)を区別することができる。この密度も、ヒストンの異なるメチル化を引き金にゲノムが構造化された現れで、ヘテロクロマチン領域での転写は抑制されている。
引用<Sha, K. and Boyer, L. A. The chromatin signature of pluripotent cells (May 31, 2009), StemBook, ed. The Stem Cell Research Community, StemBook, doi/10.3824/stembook.1.45.1. http://www.stembook.org/node/585>
今回は、ヌクレオソームを基盤として、ゲノムを構造化する重要な機構がエピジェネティックス機構だという結論で止めておく。ただ、ヌクレオソームやエピジェネティック機構の進化は実際にはHoxクラスターの進化より先に起こっている。したがって、エピジェネティック機構というゲノム構造化を可能にする機構をさらにうまく利用する方法の一つとして、Hoxクラスターのような新たな構造化が加わってきたと考えるのが正しい。次回は、ヌクレオソームより大きなゲノムの構造単位、topology associating domaiから話を続ける。
[ 西川 伸一 ]
ゲノムの構造単位
2015年7月1日
1、topology associating domain (TAD)
最近、遺伝子の組織や発生時期特異的な発現調節の基本構造単位としてtopology associating domain(TAD)と呼ばれる領域に注目が集まっている。ヒトゲノムには約2000のTADが存在すると考えられているが、TADの存在が広く認められるようになったのはつい最近のことだ。TAD概念の確立には、核内で位相的に接して存在しているゲノム領域を特定するchromosome conformation captureと呼ばれる方法の開発が大きく寄与している。一つのTADは平均500kb—1Mb程度の大きさで、その中に1個から複数の細胞特異的、あるいは発生時期特異的に働くcoding遺伝子と、その発現調節(エンハンサー)領域を含む長いDNA単位が大きな塊を作って核内に存在していると考えられる。図1はPopeらの論文(Nature, 515:402, 2014)から拝借したTADのイメージ図だが、それぞれのTAD単位を構成するDNAが、分離した毛糸玉のようにまとまって核内に存在していることが表現されている。なぜこのような構造化が必要なのか?これについては、遺伝子発現の時期や場所を決めている調節ユニットを一つの塊として構造化する必要に答えたのがTADではないかと考えられている。
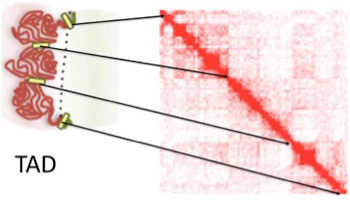
図1 TADの概念図と、HiCヒートマップ:説明は本文参照
実際、HiCと呼ばれるChromosome conformation capture法を用いて、どの領域がどの領域と隣接していかを調べると、遺伝子やエンハンサーの相互作用がTAD内に制限されていることがわかる。図1のヒートマップはHiCの結果をマッピングしたもので、各領域がコンタクトしている確率が高いほど赤くなるよう示されている。核という狭い3次元空間では、原理的に各領域はどの領域とも近接することは可能だが、実際にはTAD内にある領域は同じTAD内の領域と相互作用する確率が高い。TAD内部の塩基配列は特に保存されているわけではないが、各TADの間には、種間でよく保存された、CTCF分子の結合配列、house keeping遺伝子、tRNA遺伝子、そしてSINEトランスポゾンなどが集まった境界領域が存在している。最近の研究から、この境界が、一つのTAD内のエンハンサーの効果が、隣接したTADに影響を及ぼさないよう制限するインシュレーターの働きをしているのではと考えられるようになってきた。私たちの体は何百種類もの細胞から出来ており、それぞれの細胞ごとに働いている遺伝子は違っている。とはいえ、それぞれの細胞分化に必要な遺伝子群を、分化ステージや細胞系列に合わせて狭い領域にまとめることは難しい。このため全く異なる細胞で発現する遺伝子が隣接して存在することはゲノムでは普通に見られる。従って、一つのTADの発現が、隣のTADにある遺伝子の発現に影響を及ぼさないよう構造化されていることは重要だ。次に、これをより具体的に示した2編の論文を紹介しよう。
論文1:TADによるHox遺伝子制御(Andrey et al, Science 340, 1234167, 2013)
TADによるゲノム構造化の重要性が強く認識されたのもまたHox遺伝子の研究からだった。HoxDクラスターは腕と指両方の発生に関わっているが、例えばHoxD10のマウス発生時の発現を経時的に調べると、図2に示すように、四肢発生の初期段階で前腕の形態形成に関わっていたHoxDクラスターが(図2:青色で示した部位)、時間とともに今度は指の形態形成に関わるようになるのがわかる(図2:茶色で示した部位)。同じHoxクラスターがほとんど同じ発生時期と場所で異なる構造の発生に順番に関わることを可能にするメカニズムを追求していたスイスのDubouleらは、HoxDクラスターが2つの隣接するTADの境界に存在することを見出した(図2)。
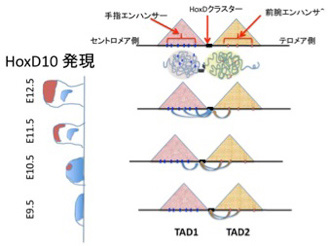
図2 Andrey et al, Science 340, 1234167,
2013 論文解説図。
HoxDクラスター内の遺伝子が、前腕から手指へと発現が移動するのに呼応して発現を調節するエンハンサーも、TAD2のエンハンサーから、TAD1内のエンハンサーに移行する。
さらに、それぞれのTADに存在するエンハンサーの活性を調べると、テロメア側のTADには前腕での発現に関わるエンハンサーが、セントロメア側のTADには手指で発現するエンハンサーが集中していることをつきとめた。この結果からDubouleたちは、HoxDクラスターの全ては最初テロメア側のTADの支配を受け前腕形成に関わっているが、発生が進むと一部がセントロメア側のTADの影響を受けるようになり、徐々に支配されるTADをシフトさせることで、前腕と手指の発生に連続的に関わることを示した。すなわち、もともと構造化されているHoxクラスターに、TADという遺伝子調節単位構造が絡むことで、発生時のHoxD遺伝子発現の複雑なパターンが実現していることを示した。
論文2:TAD境界領域の機能(Lupianez et al, Cell 161, 1012, 2015)
Dubouleの研究からTADが構造化されたエンハンサーの供給単位になっていることがわかるが、TAD同士が影響し合わないよう機能的に分離されているかどうかはこの実験からはわからない。最近ドイツベルリンから、遺伝子領域の大きな欠失、反転、重複によりTADの境界が崩壊すると、TAD内のエンハンサー領域の影響が隣接するTADに拡大して、その結果発生異常が起こることを示す重要な論文が発表された。TAD間の境界の機能を教えてくれる研究なので、図3を用いて紹介しよう。
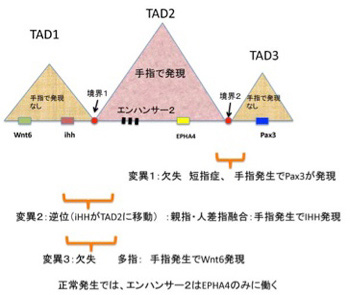
図3 Lupianez et al, Cell 161, 1012, 2015 論文の解説図:説明は本文参照
この研究では手指の発生異常に関わる変異が集中するヒト第2染色体の約2Mbの大きさの領域に注目して、まずそれぞれの奇形がどのような変異から起こっているのか調べている。図3に示すように、この領域には3つのTADが存在し、それぞれのTADには様々な組織の発生に関わる増殖因子や転写因子をコードする遺伝子が存在していることが分かった。これら遺伝子のうち、手指発生で発現が見られるのはTAD2に存在するEPHA4(ephrinに対する受容体)だけで、TAD1,TAD3にある遺伝子は手指には発現しない。このことから、手指発生時に遺伝子発現を誘導するエンハンサーの効果がTAD2内の遺伝子のみに限局されていることがわかる。次に、手指発生異常をおこす遺伝子変異を解析すると、境界2として示した領域が大きく欠損する変異では指が短くなる短指症が、境界1を含む領域の逆位が起こると、親指と人差し指の融合(F-syndrome)が、同じく境界1を含む部分の欠損では多指症が発症することが分かった。同じ変異を今度はマウスゲノムに導入して、人間とほぼ同一の手指発症異常をマウスで再現できることを確かめ、それ以降の実験はマウスで行っている。マウス手指発生過程でTAD1,TAD3に存在する3種類の遺伝子の発現を調べると、境界2がなくなるとTAD2エンハンサー活性がPax3遺伝子に及び、手指発生でこの遺伝子が間違って発現してしまう。同じように、境界1が変異を起こすと、手指発生時にIHHやWnt6の間違った発現が見られることが分かった(図3)。この結果は、核という極めて狭い領域に閉じ込められ3次元的に絡み合ったDNA上の遺伝子が一定の時と場所で正確に発現するために、TAD間の境界が重要な機能を持っていることを示している。しかし、この境界がなぜTAD外のエンハンサーの影響を食い止められるかについてはよくわかっていない。おそらく、さらに大きなレベルの、ゲノム構造化と関わるのではと考えられるが、これについては次回に紹介しよう。TADを説明するため、今回は手指発生に関わる遺伝子の発現についての研究した2つの論文を紹介した。最後に少し余談になるが、手指の発生異常についての詳しい研究を最初に行ったフランス人Maupertuis(図4)を紹介して今稿を終わりたい。

図4 Maupertuis肖像(wikipediaより)
Maupertuisは、地球が縦にひしゃげた偏円であることを証明するためフランス科学アカデミーがペルーとラップランドの2カ所で観測を行った際のラップランド隊を率いた業績で有名になった物理学者・数学者だが、ビュフォンとともにフランス自然史を支える中心人物でもあった。彼はデカルトの機械論とそれを支持する前生説に反対し、後生説的有機体論展開の必要性を唱えた。1744年プロシア皇帝フリードリッヒ2世に強く請われてMaupertuisはプロシア王立科学アカデミーの会長に就任する。例えてみれば、日本学術会議の議長に中国や韓国から人を招くのと同じことで、待ち構えていたベルリン科学会の大きな抵抗にあうが、王室の後ろ盾と数学者オイラーの助けを借りて様々な改革を断行した。動物発生についてのMaupertuisの考えは、ライプニッツのモナド(単子)の概念に近い粒子が後生的に構造化されるというものだった。当時最も有力な説だったデカルトの機械論に基づく前生説を論破する根拠を探していた時、ベルリンで4世代にわたって多指症が維持されているRuhe家を知る。同じ形態異常が一族の母親からも、父親からも子孫に伝えることができることは前生説を否定する現象だとして詳しい研究を残している。ゲノム構造化単位TAD の意義を明らかにする記念すべき論文が、手指発生異常研究で最も長い歴史を持つベルリンからの論文であることを知り、Maupertuisを思い出し、深い感慨にかられた。
[ 西川 伸一 ]
核によるゲノムの構造化
2015年7月15日
A対T、 C対Gの結合をベースにした2重らせん状の分子構造と、4塩基の並びで表現できる情報の無限性を考えると、DNAほど情報媒体として優れた物質はちょっと思いつかない。この線状に並んだ塩基対が持つ情報としての可能性に圧倒され、塩基配列を線状のコードとしてだけ見てしまうと、ゲノムが2次元、3次元と構造化されていることを忘れがちになる。しかし、遺伝子の配置、ヌクレオソーム形成、クロマチン構造、そしてtopology associating domains(TAD)と見てくると、ゲノムが1次元の配列情報だけでなく、構造化することで新たな情報を担えることを理解してもらえたのではないだろうか。ただ、構造化はこれだけにとどまらない。ミトコンドリアDNAを除くと我々のゲノムの全ては核の中に折りたたまれて存在している。今回はゲノムが収納されている核の構造とゲノムの関係について見てみたい。
クリエーティブコモンズに登録されている画像をchromosomal paintingで検索すると、Robert MayerらがBMC Cell Biology 6:44, 2005に発表した論文を見つけることができる。以前私の研究室に在籍していたTimm Schroeder君も著者に加わっているのを発見し、意外な出会いに喜んだが、この論文では染色体の核内の位置がランダムに決まっているわけではなく、細胞の種類に応じて特定の位置に収まっていることを示した論文だ(図1)。この写真に見るような染色体の核内での位置はクロモゾームテリトリーと呼ばれている。
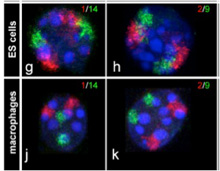
図1ES細胞(上図)とマクロファージ(下図)の1番と14番(左図)、あるいは2番、9番(右図)染色体をin situ hybridizationにより染めだしている。(Mayer et al, BMC Cell Biology 6:44, 2005)
図1は各染色体が、細胞の種類に応じて異なるクロモゾームテリトリーを形成していることを教えてくれる。すなわち、全体(核)が部分(染色体)の単純な集まりではなく、部分(染色体)が全体(核)によっても組織化される生命特有の特徴が、核と染色体の関係にも言えることを示している。もちろんクロモゾームテリトリーが染色体の位置を完全に決めているわけではない。細胞が分化して特定の遺伝子の発現が必要になると、その遺伝子が位置する領域はクロモゾームテリトリーから飛び出してくることも知られている。例えば、これまで幾度も登場したHoxD遺伝子の核内の位置をFISHと呼ばれる方法で調べた研究では、ES細胞分化に伴いクロモゾームテリトリー内に収まっていたHoxDがクロモゾームテリトリーから外れて存在することがわかっている(Morey et al, Development 134:909, 2007)。核全体から見たときの、このようなゲノム構造化を調節する仕組みはよくわかっていないが、他のゲノム領域と同様、次世代シークエンサーの開発により、核内に存在する構造とゲノムとの関係を直接調べることが可能になった結果、この分野は大きく進展しつつある。単純に見える核も複雑な構造を持ち、核酸以外にも多くの分子がこの構造を支えている。したがって、核によるゲノムの構造化についての研究は、ゲノムがコンタクトしている分子や構造の数だけ存在することになる。これではきりがないので、ここでは研究が進んでいるlamina associated domain(LAD)とnucleolus associated domain (NAD)について簡単に見ておこう。
・LAD(lamina associated domains)
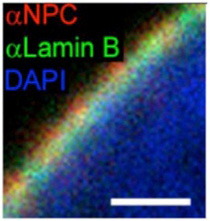
図2 核膜直下の構築。青く染まるのは核酸、赤く染まるのは核膜孔。ここではLaminBを示しているが、核膜直下はLaminA,
LaminBが寄り合わさったラミナにより裏打ちされている。
(Wiki Commonsより)
電子顕微鏡を用いた核の解析から、核膜直下にはヘテロクロマチン構造が多いことは古くから知られており、このことから核膜直下に位置する遺伝子の発現は抑制されているのではないかと想像されていた。核膜はLaminA,Bを主成分とするラミナに裏打ちされている(図2)。ラミナとコンタクトしているDNAを標識するDNA adenine methyltransferase identifyication(DamID)と呼ばれる方法が開発され、これによってマップされる領域をlamina associated domain (LAD)と呼んでいる。DamIDは哺乳動物には存在しないアデニンメチル化酵素を利用して特定のタンパクと接する DNAをメチル化標識する方法だ。LADを検出するときはラミナの主成分であるLaminB1にアデニンメチル化酵素を融合させた遺伝子を細胞に導入、この細胞のラミナとコンタクトを持つDNAのアデニンをメチル化させる。哺乳動物のDNAにはメチル化アデニンが全く存在していないため、この細胞のゲノム中のアデニンがメチル化された領域を特定することで、LADを定義することができる(図3)。
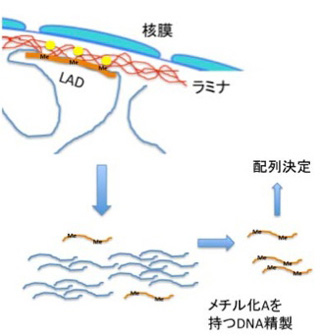
図3 LAD決定のためのDamID法。DamIDとLaminB1のキメラ遺伝子を作成して細胞に導入する(黄色の丸印)。DamIDの作用によりラミナとコンタクトしているゲノム領域のアデニンがメチル化される。これを抗体で精製して配列を決める。
これにより、ヒトやマウスでは0.1−10Mbの大きさのLADが1300程度存在し、全ゲノムの4割を占めることが分かった。LADはcoding遺伝子が少ない領域が濃縮されており、75%程度は細胞の種類を問わず保存されている。逆に言うと、残りの25%は細胞種に応じてLADだったり、なかったりしておりで、LADが発生によりダイナミックに変化する構造であることを意味している。LADに存在する領域に結合するヒストンの構造などと比較する研究から、LAD内の遺伝子は一般的に抑制されていると考えられている。最近の研究で、TADと領域が重なっている場合があること、あるいはCTCF (CCCTC-binding factor,抑制性の転写因子)がLADの境界に結合していることなどが明らかになり、両方の構造化はメカニズムを共有していることが想定されている。しかしLADの研究は始まったばかりで、TADやクロモゾームテリトリー、あるいは次に取り上げるNADとの関係や、ラミナとコンタクトをとるメカニズム、あるいは発生過程でダイナミックに組織化されるメカニズムなど、まだまだ研究が必要だ。とりあえずこれまで分かっていることを単純化して、図4にTAD,LADの関係が細胞分化で変化する様子を示しておく。
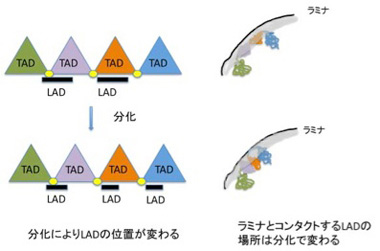
図4 細胞分化時にはLADの位置が変化することでTADの活動を変化させる。一般的にTADの境界はLADとオーバーラップすることが多い。LADの影響を受けるTADはより強くラミナの影響を受ける。
・Nucleolus associated domain (NAD)
核小体はリボゾームRNAが転写され、リボゾームが形成される核内の一種の構造物だ。この構造とコンタクトしているゲノム領域を網羅的に調べる研究も行われ、NADと呼ばれている(図5)。
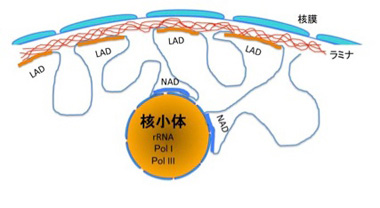
図5 LADとNADの位置関係。NADは核小体とともに精製されるゲノム領域を指す。
NAD領域の特定は、核小体と共に精製されてくるDNAを採取し、次世代シークエンサーで調べることで行われる。従来、核小体にはRNAポリメラーゼのうち、Pol I, Pol IIIが選択的に存在していることが分かっていたが、NAD領域にも、Pol I, Pol IIIによって転写される遺伝子が濃縮していた。このことから、確かに核小体の構造と密接に関わっているDNAが濃縮されていることがわかる。ゲノム全体の40%近くを占めるLADと比べると、NAD領域ははるかに小さく、ゲノム全体の5%に満たない。もっともはっきりしたNADの特徴は、染色体分配や細胞分裂時に重要な細胞小器官である中心体近くの繰り返し配列(次回紹介する)が濃縮されていることだ。実際染色体上にNADをマップすると、中心体と接した領域にNADが存在するのがわかる。このように、NADもランダムに決められているのではなく、どの領域が核小体とコンタクトするのかも一定のルールで制御されていることが理解できる。ヒトHeLa細胞のNAD内には1300近くの遺伝子があるが、NAD内にある遺伝子の全般的傾向としては、LADと同じで、遺伝子密度の低い領域が濃縮されていると言っていい。またNADに結合しているヒストンの修飾を調べると、H3K4me3やH3K27me3などの抑制性のヒストンが濃縮されており、LADと同じようにこの領域の遺伝子発現は抑制的に支配されているといえる。NADに存在する遺伝子で最も特徴的なのは嗅覚遺伝子だが、ほとんどの細胞で発現が抑制されている嗅覚受容体遺伝子が濃縮されていることも、NADが遺伝子を抑制するための構造化の一つであることを示唆している。一方、ヘテロクロマチン構造により抑制されているトランスポゾンは、特に領域を限らず均一に分離している。NADも研究が始まったばかりで、今説明した現象の分子メカニズムはほとんど分かっておらず、今後の研究が必要だ。
3回にわたって、遺伝子の配置、ヌクレオソーム、TAD, LAD,NAD,そしてクロモゾームテリトリーと、ゲノムが様々なレベルで構造化されており、構造化されることで、おなじ塩基配列でも転写される情報とは違った情報を生み出すことも見てきた。また、LAD, NAD,そしてクロモゾームテリトリーのように核の構造との相互作用により決まるケースでは、部分が全体を構成し、全体が部分を組織化するという生命特有の性質を見ることができる。この生命特有の部分と全体、原因と結果問題は、進化過程を通してしか説明がつかないが、幸いそれぞれの構造は進化の異なる段階で誕生したことが、これら構造の系統学からわかる。この意味で、ゲノムを様々なレベルで構造化し、新しい情報を開拓してきた進化過程の研究は重要分野になる気がする。
[ 西川 伸一 ]
構造部材としてのセントロメアDNA
2015年8月3日
ここまでゲノムには、転写して利用される情報だけでなく、構造(あるいは順序、位置など)としての情報も含まれていることを示してきた。今回は構造としての情報を考える最終回として、例えば家の柱や壁のような構造部材としてDNAが使われている場合について見てみよう。
すでにゲノムの一部はヘテロクロマチンという構造を取り、他の部分と比べてコンパクトに折りたたまれ転写が抑えられていることを紹介した。ただゲノムの中には常にヘテロクロマチン状態をとる領域と、細胞や分化段階に応じてヘテロクロマチン構造から解放され、転写が可能になる領域の2種類が存在する。常にヘテロクロマチン構造をとっているゲノム部位を調べていくと、全く遺伝子が存在しない大きな領域が見つかる。この領域のうち代表的なものが、セントロメアとテロメアで、共に真核生物の細胞分裂時に重要な働きをする。ここでは、セントロメアに焦点を当てて見てみよう。
まずセントロメアとは何か。真核細胞はDNAの倍加後、2つの細胞に分裂する。その時、細胞の中心に並んだ染色体を両方の細胞へと正確に分配する(図1)。
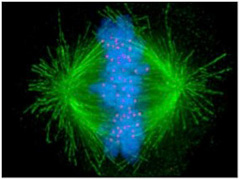
図1 細胞分裂中期。中央に並んだ染色体に微小管が結合して染色体を分離しようとしている。緑色蛍光は微小管、青色蛍光は染色体、赤い蛍光は動原体を染めてある。動原体は染色体セントロメアと微小管を結合させる構造である。(Wiki Commonsより)
この時、2つの細胞に別れた中心体から放射する紡錘糸(微小管)はキネトコア(動原体)を介して染色体と結合し、細胞分裂の経過とともに染色体を両方の細胞へと引っ張り込む。この動原体と染色体の結合の中心になっているのがセントロメアと呼ばれる場所のヌクレオソームだ。他の部位のヌクレオソームと比べると、セントロメアのヌクレオソームにはcenH3と名付けられた特殊なヒストンが存在している。このcenH3は動原体を構成する分子と結合して染色体と紡錘糸を結びつける役割を持っている。cenH3が普通のH3と置き換わって存在しヘテロクロマチン構造をセントロメアと呼んでいる(図2)。
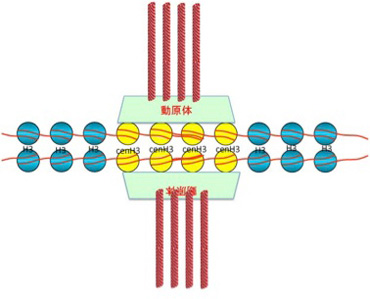
図2 セントロメアの構造。セントロメアではヒストンH3の一部がcenH3に置き換わっている(この図は私が徹底的に単純化しており、実際には様々な割合でcenH3が置き換わっている)。このcenH3に動原体を構成する多くの分子が結合し、微小管と染色体を結合している。
私たちヒトの細胞ではセントロメアの数は染色体に一カ所あるだけだが、この様式は全ての生物に共通というわけではなく、例えば線虫では一つの染色体上に何カ所も形成される(図3)
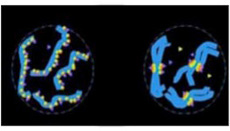
図3 線虫とヒト染色体のセントロメアの位置をcenH3染色で示している。ヒトでは染色体中央に一箇所のセントロメアがあるが、線虫では一本の染色体に複数のセントロメアが存在する。
動原体は分裂が終わると消失する。したがって、分裂ごとに同じ場所にセントロメアが再構成される必要がある。即ち、cenH3とヘテロクロマチン型ヒストンが特定の領域のDNAと結合し特殊なヌクレオソームを構成する必要がある。この決まった場所に繰り返しセントロメアが形成されるメカニズムは完全にわかっているわけではない。最初、酵母を用いた研究では、セントロメアには一定の塩基配列が存在することが示され、セントロメア型ヌクレオソームは特定の塩基配列にガイドされて形成されると考えられた。しかし、ゲノムプロジェクトが進むことでセントロメアに特有の遺伝子配列があるという考えは揺らぐ。例えば、ヒトのセントロメアには171bpの長さのαサテライト配列と呼ばれる配列が繰り返しており、最も長い場合で5Mbにわたって存在している。マウスでも同じようなサテライト配列の繰り返し構造が存在することから、サテライト配列の繰り返し構造がセントロメア型ヌクレオソームをガイドする構造であると考えられた。しかし、馬の染色体の中にはこのような繰り返し配列が全く存在しない染色体が存在する。cenH3をリクルートするゲノム側の条件を理解することは一筋縄ではいかないことがわかった。いずれにせよ、セントロメアやテロメアはそれ自体何かをコードしているわけでもなく、また周りの遺伝子を構造化しているわけでもない。セントロメア領域から、様々な蛋白分子と共同して純粋に染色体の構造部材として働いているゲノム部分があることを理解していただいたのではないだろうか。
さて、染色体の構造部材としてのセントロメアはペリセントロメアと呼ばれるやはりヘテロクロマチン構造をもつ領域に挟まれている。ペリセントロメアは染色体が分離する際、染色体同士を結合しているコヒーシンと呼ばれる分子が最後まで残って結合している場所だ。このおかげで染色体が娘細胞に分配される時、最後に動原体部分が外れ、完全な染色体を分配することができている。この意味で、ゲノムのペリセントロメア領域もゲノムを支える構造部材と考えることができる。では、ゲノムのペリセントロメア領域をヘテロクロマチン化するための条件とはなんだろう?興味深いことに、セントロメアやテロメアと異なり、ペリセントロメアにはLINE,SINEを含む様々な繰り返し配列とともに、染色体の他の場所から転座してきた普通の遺伝子領域も見つかっている。したがって、繰り返し配列が存在するからヘテロクロマチン構造が生まれるのではなく、この領域自体が飛び込んできた遺伝子をヘテロクロマチン構造に変換する力があることを示している。このメカニズムについてはゲノムとRNAの関係という枠組みで次回に考えるが、飛び込んだ遺伝子をヘテロクロマチン化することで構造部分を拡大できる巧妙な仕組みが可能になっている。この観点に立つと、私たちゲノムの半分を占めるトランスポゾンの一部は構造部材として使われている可能性もある。というのも、ほとんどのトランスポゾンにヘテロクロマチン構造を取らせる仕組みを私たちは有している。この意味で(これは私の戯言だが)トランスポゾンは構造部材を新たに調達するにはうってつけの材料に思える。
3回にわたってゲノムが構造化されること自体新しい情報を生むことを見てきた。構造部材としてのDNAまでが情報と呼べるのは、構造も、材料も、コードも全て同じDNAを媒体とする線状の情報に置き換え、子孫に伝えるからだ。最初ただの物質でしかなかったDNAが様々なモノやコトと対応できる情報に転換する。最初DNAがコードとして何と対応付けられていたのかは21世紀重要な問題だ。これは私の戯言だが、おそらく最初に対応付けられたのはアミノ酸の並びではないような気がする。というのも、この対応関係はRNA,tRNAを必要として、あまりにも複雑だ。とすると、今セントロメアでみられるような部材としてのDNAと蛋白の関係と、DNA,RNAの関係が最初は別々に存在していたと考えたほうがわかりやすい。次回はこの問題を横目で睨みながら、ヘテロクロマチン転換のメカニズムから初めて、DNAとRNAの関係について考えてみたい。
[ 西川 伸一 ]
DNAとRNA
2015年8月17日
DNAとRNAと聞くとすぐセントラルドグマ、すなわちDNA〜RNA〜ペプチド(タンパク)と続く情報から実体への流れを想像する。しかし、太古の昔、地球上で核酸が情報の媒体として使われ始めたとき、セントラルドグマに定式化されているDNA,RNA, タンパクの間の美しい関係があったとは考えにくい。DNAは地球上に物質として生まれた時点から、複製によって正確に伝えるという点ではすでに情報媒体としての条件を満たしている。ただ、最初から塩基配列のコードとアミノ酸が対応していたとは、神でも想定しない限りまず信じられない。すでに見てきたように、DNAはタンパク質のコード以外にも様々な情報を表現し、それを安定に子孫に伝えることができる。言い換えるとDNAはこれらゲノムの持つ全ての機能を最初に複製可能にした物質だったように思える。DNAが作り出す構造と、タンパクやRNAが、コードとは無関係に相互作用できることは現存のヌクレオソームを見れば明らかだ。一方、RNAとなるとさらに多様な構造を取り得ることがわかっている。実際RNAだけから特定の酵素活性を持つ構造を作ることが可能で、最初の生命体はRNAでできていたと考える人もいる。ただ生命がRNAから始まったという主張に完全に同意できないのは、複製という点でRNAが様々な問題を抱えているからだ。私自身は、まず物理化学法則に従って太古の昔にDNA,RNA,タンパク質が独立してランダムに生まれ、それが何か関わりあい続けるうちに突然情報体系への大転換を遂げたように思える。最近進んだノンコーディングRNA(ncRNA)の研究から、ncRNAがDNAやタンパクと直接関わりあって染色体構造を変化させているのを知ると、この過程に太古の3者の関係の名残が反映されているのではと妄想を巡らせてしまう。そこで、最後にこの妄想に付き合ってもらうためにncRNAが誘導するヘテロクロマチン化について見ておこう。
細胞が発現する全てのRNAを特定しようと試みたFANTOMやENCODEプロジェクトが終わって、全ゲノムの8割にも及ぶ領域が転写されているという事実が発表された時、私たちは何かの間違いではないかと驚いた。しかし前回紹介した、ヘテロクロマチン構造により固く閉ざされたゲノム領域であるセントロメアやペリセントロメア領域ですら転写されていることがわかり、低いレベルなら、クロマチンの構造とは無関係にゲノムのほとんどが転写されていることが認められるようになっている。ヒトセントロメアには174bの繰り返し配列からなるマイナーサテライト配列が、サテライトII,IIIを含む大きなメージャーサテライト配列からなるペリセントロメアに挟まれているが、この二つのサテライト配列もノンコーディングRNA(ncRNA)として、転写されている(図1)。
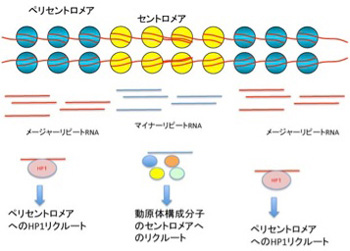
図1 セントロメア、ペリセントロメアからncRNAが転写され、それが自らのヘテロクロマチン構造形成をガイドする。
これまでの研究で、このncRNAがセントロメア、ペリセントロメアのヘテロクロマチン構造に重要であることが明らかになっている。例えば、マイナーサテライト配列から転写されるRNAはセントロメアにcenH3をリクルートするとともに、CENP-Cを含む様々な動原体の構成分子をこのヌクレオソームに結合させる機能を担っている。すなわち、セントロメアからRNAが転写されないと、正常のセントロメア・動原体の形成ができない。同じように、ペリセントロメアのメージャーサテライト配列から転写されたncRNAは、ヘテロクロマチン転換を誘導するタンパクHP1(ヘテロクロマチンプロテイン1)をペリセントロメアにリクルートし、ヘテロクロマチン構造を形成する。このようにそれぞれの領域の特異的なクロマチン構造を形成し維持するためには、低いレベルでRNAが転写されていることが必要だ。では、クロマチン構造を調節しているのは必ずその領域のゲノムから転写されるRNAだろうか?答えはNoで、様々なRNAがヘテロクロマチン誘導に使われていることがわかっている。最も大掛かりで典型的な例がX染色体不活化(XCI)なので次に見てみよう。
ゲノムからあまり間違うことなく予想できることの筆頭は男女の区別だ。男性はXY、女性はXXが人間の性染色体で、この差が男女を決めている。ただこの方式には一つ問題がある。すなわち男性にはXが1本に対して、女性は2本という数の差だ。というのもXには常染色体とおなじように生命維持に必須の遺伝子が存在するため、何もしないとX染色体上の遺伝子の発現量は女性が2倍になる。多くの遺伝子は発現に2倍の差があっても問題ないが、中には発現を男女一定に保っておく必要のある遺伝子もある。私たち哺乳動物はこの課題に、女性の片方のX染色体をすべて不活性化することで答えている。この不活化にはX染色体の不活化センターと呼ばれる部位に存在するXist遺伝子が主役を演じている。Xist遺伝子は8個のエクソンからなり、普通の遺伝子とおなじようにスプライシングを受けた後、polyAも普通に付加される(図2)。
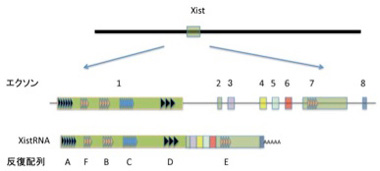
図2 X染色体のX染色体不活化センターに存在するXist領域は、発生過程で片側の染色体だけで転写が始まり、転写されたXistは普通の遺伝子と同じように8個のエクソンを持ち、転写後スプライシングされ、ポリAが添加されるが、核外には移動しない。
Xist RNAが他の遺伝子由来の RNAと異なる点は、RNAが核外に移動することはなく、従って翻訳もされない。転写が片方のX染色体だけに限られ、またもう一方のX染色体に結合しない巧妙な仕組みについて理解は進んでいるが、全て割愛して、とりあえずXist遺伝子から転写されたRNAは片方のX染色体全体を覆っていると理解してもらおう(図3)。
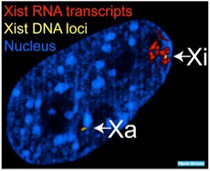
図3 メスの細胞では、片方の染色体だけがXistによりカバーされている。黄色で示されているのはXist領域で、両方の染色体に存在するが、XistRNAは染色体全体に広がっている。
(Wiki commonsより)
先に紹介したセントロメアや、ペリセントロメアはその場所から転写されたRNAがホスト領域と結合するが、このXistは17kbの領域からだけ転写されるncRNAが染色体全体に結合する。したがって、Xist-RNAはDNAと塩基配列の相補性で結合するのではなく、Xist-RNA内に存在する繰り返し配列Cによりヌクレオソーム自体に結合することがわかっている(図2)。また、X染色体を覆うといっても実際にXistは2000個ぐらいしか発現していないことがわかっており、おそらくX染色体に飛び飛びに結合して、その場所からヘテロクロマチン構造を拡大していくのだろうと想像されている。実際Xistには遺伝子のサイレンシングやヒストンのメチル化に関わる分子をリクルートする繰り返し配列が何種類も存在しており、図2に示したrepeatAは遺伝子のサイレンシング、repeat F, Bはヒストン修飾に関わる分子、そしてrepeat CがXistがクロマチンと結合するのを媒介することがわかっている。このように、DNAとタンパク、ncRNAとタンパクがそれぞれ複合体を形成し、さらにこの両者が働き合うことで、ヘテロクロマチン構造が形成されていくのがわかる。この3者の相互作用には塩基配列コードは必要ない。
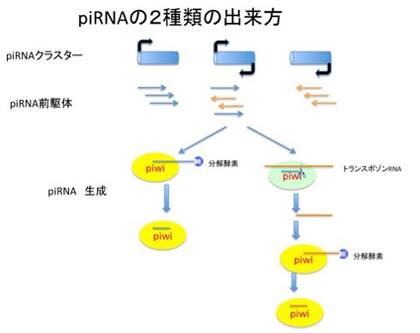
図4PiwiRNAの形成と機能
私たちのゲノムの5割はトランスポゾンで占められているが、最後にゲノムに飛び込んできたトランスポゾンをヘテロクロマチン化するメカニズムを担うPIWIタンパクとpiRNAについて見てみよう。海綿から人間まですべての動物に存在して、植物には存在しない遺伝子の一つがPIWI分子で、トランスポゾンの活動を抑える細胞レベルの防御反応の主役になっている。この時に働くRNAがPiwi interacting RNA (piRNA)で、のちに述べるようにこれは遺伝子の機能を抑制するための様々な分子を標的DNAやRNAにガイドする役目がある。このpiRNAは主に生殖細胞に発現している25-26のヌクレオチドからなる小さなRNAで、その種類は千種以上存在すると考えられ、2種類の方法で作られる(図4)。最初の方法は、ゲノム中に存在する200−数百kbのpiRNAクラスターと呼ばれる領域から転写される長いRNAがPiwi分子と結合して、短い機能的な長さに切り整えられることで作られる。このpiRNAクラスターには様々なトランスポゾンに実際に存在する領域が集められており、一種のトランスポゾンのカタログのような領域だ。従ってこのカタログ領域から転写されPiwi分子により処理されてできるpiRNAはトランスポゾン領域と相補的に結合することができる。このカタログのおかげで、ほとんどのトランスポゾンの配列を認識して、遺伝子発現を抑えるための機能分子をその領域へガイドすることができる。piRNAは、このクラスター外のトランスポゾンが活性化され転写が始まったRNAからも作ることができる。この時、トランスポゾン転写産物は、すでにその細胞に存在している相補的なpiRNAとpiwi分子上で会合し、トランスポゾンからの転写産物を短くカットする。こうして出来た短いRNAはPiwi分子上でさらに処理を受け、新しいpiRNAに変換される。どちらの方法でも、出来てきたpiRNAは様々なレトロトランスポゾンと相補的なガイドRNAとして働くことができる。
さてこうしてできたpiRNAとPiwi分子複合体は、piRNAによりガイドされてきた領域のヌクレオソームをヘテロクロマチン型に転換することができる。この場合、標的の情報はこれまで経験したトランスポゾン配列のライブラリーとしてpiRNAクラスターに記録してある。また、今活動しているトランスポゾン由来のRNAもpiRNAに変換してガイドに使うことで、トランスポゾンと他の領域を区別し、トランスポゾンだけをヘテロクロマチン化するのに関わっている。
以上の3つの例から、ncRNAが特定の遺伝子部位の染色体構造を決めるために重要な働きを演じているが、その形成方法と作用機序については多様性が大きいことがわかってもらえたのではないだろうか。さらにpiwiとpiRNAのペアには、ヘテロクロマチン化だけではなく、RNAによりガイドされて直接トランスポゾンのDNAをメチル化し、すでに転写されてしまったトランスポゾンRNAに結合してそれを分解する働きがあることがわかっている。この意味でpiRNAは、多様な武器をトランスポゾン攻撃に集中してその活動を抑える最前線の兵士のようだ。おそらく専門知識のある読者は、piwiとpiRNAの説明を見て、原核生物や古細菌に見られる外来遺伝子の侵入に対する防御機構、CRISPER/Cas9システムを思い出したのではないだろうか。次回は単細胞動物へとさかのぼってセントラルドグマとは異なるDNAとRNAの相互作用について調べてみよう。
[ 西川 伸一 ]
ゲノムの自己
2015年9月1日
塩基配列が何を意味しているかわからないという理由だけでジャンクと名付けていた領域の中で、機能が明らかになって大ブレークしたのがクリスパーだろう。最初大腸菌ゲノムの中の不思議な繰り返し配列として見つかった配列(まさに当時はジャンク配列)が、実際には大腸菌に感染する様々なウィルスやプラスミドの断片であることがわかり、クリスパー上流にあるCas遺伝子群とともに、外来DNAを自己のゲノムから区別して抑制する一種の免疫システムを形成していることが明らかになった(図1)。
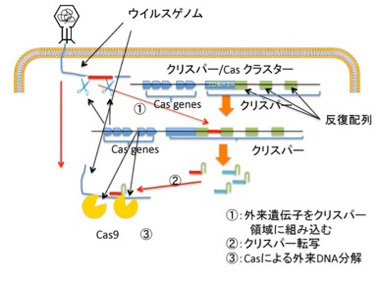
図1 外来遺伝子への免疫システムとしてのクリスパー/Casシステム
説明は本文参照。
外来の遺伝子が侵入すると、その一部を切りとって、クリスパー領域に組み込むことで、侵入記録を遺伝子ライブラリーとして記憶(図1①)、次の侵入に備えるという免疫の仕組みだ。こうして形成された外来遺伝子のライブラリーは、Cas9と結合するRNAリピート領域と一体となったガイドRNAとして転写され、次に相補的外来遺伝子が侵入してくると、その遺伝子とハイブリダイズしてCas9を侵入遺伝子へと導き(図1②)、これを切断、分解する(図1③)。この最後の反応を利用して開発されたのが、遺伝子改変技術を根本的に改革したゲノムの配列特異的編集法で、今や医学応用を含めあらゆる生命科学分野で大ブレークしている。
さて外来遺伝子をライブラリーとしてゲノムの中に保持し、そこから転写されたRNAを標的遺伝子の抑制に使うという本来のクリスパーシステムを理解すると、まさに前回紹介したPiwi/piRNAとよく似た系だとわかるはずだ。まずどちらも自己と他を区別するための記憶として、外来遺伝子配列を特定の領域に蓄積し、それを自己ゲノムと他を区別するのに使っている。これも最初は機能がわからずジャンク配列とされていた。この例から、他のジャンク配列もまだまだ思わぬ機能が明らかになる可能性がある。進化では、役に立たないと決めつける方がいつも間違っていることが多い。
さて、クリスパーやPiwi/piRNAの例から再認識刺されるのは、情報としての自己のゲノムは、他のDNA情報に常に開かれていることだ。いつでも他のゲノムは自分のゲノムの中に侵入してくる。このため常に自己の情報と他の情報を区別して、自己の情報だけを守る仕組みが生命誕生後の早い時期から存在している。驚くべきことに、この機構を拝借して逆にホストのゲノムを分解する能力を獲得したしたたかなウイルスすら存在している。このphageウイルスは幾つかのCas遺伝子と侵入したバクテリアが持つ防御最前線で戦う分子PLE遺伝子をアタックできるクリスパー配列を持っている。すなわち、本来バクテリアがウイルスゲノムの侵入を守るセットを使って、ウイルス抵抗性に関わる遺伝子を攻撃して自らを守っている。生命誕生は、自己と他という関係の誕生でもある。自己のゲノムを他から区別する仕組みはこのように、ウイルスを含むあらゆる生物へと拡大する宿命にある。
クリスパーからわかるように、ncRNA(non-coding RNA)はあらゆる生物で機能しており、生命誕生初期から、あるいはそれ以前からこのようなDNAとRNAの関係があったことをうかがわせる。しかし、なかでもゾウリムシやテトラヒメナのような繊毛虫類でのncRNAの大胆な使い方には驚かされる。最後に、テトラヒメでncRNAがどのように使われているか見てみよう。ただその前に、これまで紹介しなかったsiRNA(small interfering RNA)について、piRNAと比較しながら簡単に紹介しておく。Piwi分子の結合するpiRNAは、piRNAクラスターか活性化されたトランスポゾン由来だが、どちらも転写された一本鎖RNAだ。ただ、様々な方法でできてきた2本鎖RNAからも同じような遺伝子抑制性のRNAを形成することができ、siRNAとよばれている(図2)。
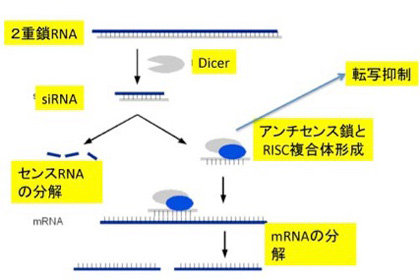
図2 siRNAの形成と作用:Wikiコモンズから改変
この系では、2本鎖RNAはDicerと呼ばれる分子で決まった長さに切断された後、piwi分子の代わりに、RISCと呼ばれる分子にロードされる。このアンチセンスRNAとRISCの複合体は、このRNAをガイドとして、外来RNAの分解や、標的遺伝子のヘテロクロマチン化に関わっている。ガイドに利用するRNAが最初2本鎖である点がpiRNAと異なるが、共にトランスポゾンの活動を抑制するメカニズムだ。この2つのメカニズムを頭に入れておいて、次に繊毛虫類の一つ、テトラヒメナを例に驚くべき精巧なncRNAの利用法を見てみよう。これから述べる話のほとんどはウィーン・IMPに在籍するこの分野の第一人者、望月一史さんたちの総説を参考にしたことを断っておく。
さてゾウリムシやテトラヒメナは、一つの単細胞の中に大核と小核の2種類の核を持っており転写は大核からだけに限ることで、高い転写効率を達成している。以後は望月さんたちの研究しているテトラヒメナに限って見ていこう(図3)。
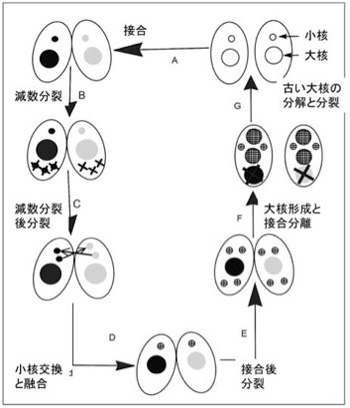
図3 テトラヒメナの接合による性生殖:説明は本文、Wikiコモンズ改変
さて栄養が豊富な環境では、テトラヒメナは分裂により増殖する。この時、大核も小核も同じように複製され、両方とも娘細胞に分配される。一方、栄養条件が悪くなると、2つのテトラヒメナが接合し二つの個体で遺伝情報の交換を行う。おそらく異なる個体のゲノムを合わせることで、厳しい環境に適応しやすくするための戦略と考えられる。しかしこの時、高等動物の減数分裂に当たる過程が小核だけで起こる。Wiki commonsからの図を参考にして接合過程を見てみよう。まず図の左上から、減数分裂により一倍体の小核を最終的に1個形成する(残りの小核は全て分解される)。次に小核が分裂して一つの細胞の中に2個の1倍体の小核ができる。この間、大核はそのままで転写を続け細胞を維持している。次に、それぞれの個体は小核を交換し合って、最終的に別々の個体由来の一倍体の小核が融合した2倍体の小核が生まれる。この小核はその後2回の分裂により4つの小核を作り、そのうち2つが新しい大核を形成するのに使われる。この小核から大核への転換時に、それまで転写をまかなっていた大核は分解する。こうして生まれた新しい2つの小核と2つの大核を持った個体が次に分裂することで、接合した結果できた新しい遺伝情報を持った一個の大核と一個の小核を持つ2つの個体が生まれるという複雑な過程だ。
なぜこれほど複雑な接合過程を持っているのか不思議だが、これは大核のゲノムと小核のゲノムが異なっていることに起因する。正確に言うと、小核中のゲノムには全域にわたって6000以上の0.5-30kbの遺伝子断片が挿入されていて、IES(internal eliminated sequence)とよばれている。IESもクリスパー・piRNAと同様にトランスポゾンや繰り返し配列から出来ており、これまでの定義ではジャンクと呼ばれる配列だ。しかし、IESは有性生殖の初期以外の時期において、小核からの転写を抑制する積極的役割を持っている。すなわち全てのジャンクはジャンクであることで機能を持つ。一方、小核から大核ができるとき、新しい大核内の全てのIES(=ジャンク)が正確に除去されないと、遺伝子の転写ができない。実際、大核にIESが残ってしまうとテトラヒメナが死んでしまうことがわかっている。これに加えて、大核のゲノムは250ぐらいの断片に分解され、それぞれは増幅されているおかげで、転写レベルを上げるよう改変されているが、この過程についてはここでは深追いしない。
ではどのようにしてIESは小核ゲノムから正確に除去されるのだろうか?ここにDicerやPiwiに似た分子と、小核から転写されるncRNAが一役買っている(図4)。まず新しい大核への転換が始まる前に小核全体が双方向性に転写され、ゲノム全域をカバーする2本鎖RNAが形成される。この2本鎖RNAはDicerに似た分子Dcl1pによって小さく断片化されncRNAになり細胞質へと移行し、piwiに相同な分子Twi1pに結合する。Twi1p上でガイドRNAだけを残してパッセンジャー鎖は除去される。こうして形成したガイドRNAを結合したTwi1pは大核に移行し、大核中のゲノムと比較され、大核中に存在する配列が全て除去される。この結果残るのはIESに対応するRNAをと結合したTwi1pだけになる。
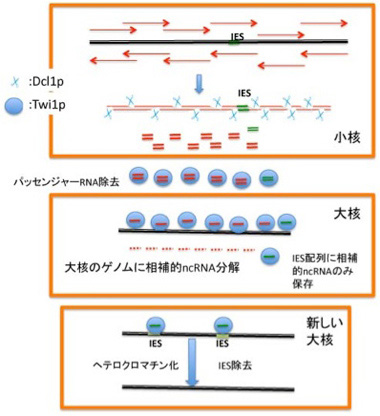
図4ncRNAを使った新しい大核形成時のIES除去機構:説明は本文
この選択が実際にどう起こっているのかは研究途上にあるようだが、大核のゲノムと相補的なRNAはゲノムDNAによりTwi1pから引き剥がされ、分解されると考えられている。メカニズムはともかく、これにより大核ゲノムと小核ゲノム間で引き算を行うことができ、結果として全てのIESに相当するncRNA をロードしたTwi1pが残る。次にこのTwi1p/ncRNAは新しく形成された大核に移行して、今度はIESに結合し、IESをヘテロクロマチン化する(H3K9, H3K27のメチル化)。このヘテロクロマチン化が標識となって、IES配列がゲノムから全て除去される。残念ながら、ヘテロクロマチン化された領域がどのようにゲノムから切り離されるかについての具体的なメカニズムについてはまだまだ明らかでない。しかし、テトラヒメナでは小核ゲノムからIESを大規模かつ正確に取り除く目的でncRNAが利用されることがわかる。
IESの多くがトランスポゾンを起源としていることを知ると、テトラヒメナではトランスポゾンが自己ゲノムを調節する機能ユニットとして積極的に活用されていることがわかる。テトラヒメナの2核構成も情報論から見ると面白い。一般的に情報理論は、伝えるためのコミュニケーション理論とオペレーションのためのコンピュータ理論に分かれる。ゲノムもそうで、子孫に伝える役割と、細胞のオペレーションとに役割を演じ分けている。問題はオペレーションのための情報は、伝えなければならない情報のほんの一部だということだ。そのため、真核生物はエピジェネティックな機構を進化させ、様々な方法でオペレーションに必要でないゲノム領域をオペレーションから隔離し、オペレーションの邪魔をしないよう抑制している。しかし、分裂のたびにエピジェネティック標識を正確に再構築するためには複雑な機構が必要になる。その代わりに、必要のない領域を全て除去した大核と小核に分けて、オペレーションと伝達を完全に分離してしまう戦略は、一見複雑に見えても、実は最も簡単で安心な戦略なのかもしれない。実際、テトラヒメナは普通、両方の核をただ単純に複製し続ける。そのとき、エピジェネティック状態を常に再構築しないで済むことの利点は計り知れないはずだ。このように情報のコミュニケーションとオペレーションを分離したテトラヒメナは驚くべき生物と言えるだろう。
これでゲノムの構造については終わり、次からはゲノムの働きについて考えていく。
[ 西川 伸一 ]
ゲノムの働き
2015年9月15日
ゲノムの解剖学に続いて、次はその働き方を見てみよう。前回紹介した、ゲノム情報を大核と小核に分けて使っているテトラヒメナは、ゲノムの働きを理解するための優れたモデル生物になっているので、これを参考にしながら見ていこう。
ゲノムの働きの第一は、複製を通して親と同じゲノム情報を子孫に伝えることだ。無生物と比べる時、生命が示す特徴の一つは複製(replication)だ。私たちの細胞のように有糸分裂で増殖する細胞の場合、細胞分裂時にほぼ正確に複製され、子孫細胞に分配されるものに、ゲノムと中心体がある。しかし、原核生物になると複製分配されるのはゲノムだけになる。生物全体を通して見たとき、複製されて子孫に伝達されるものは結局ゲノムしかない。このことから、ゲノムの働きは親と同じ状態を増殖させるためコピーして子孫に伝える情報としての働きがあることがわかる。
しかし正直に言うと、なぜ生物は分裂し、増殖しようとするのかについてはよくわからない。熱力学に逆らって、平衡に陥らないようにメタボリズムを維持するだけなら増殖は必要ない。実際、全く分裂しない赤血球は200日の寿命があるし、神経細胞のように数十年にわたって分裂なしに生き、新陳代謝も盛んな細胞は存在する。ただ、複製のない細胞システムはどれほど新陳代謝が維持できたとしても、環境が変化してしまえば物理的に滅びる。環境に適応し、さらには環境まで変えてしまえる可能性があるという点で、結局は複製能力を持つシステムだけが地球上で生物として存続できたのだろう。
一方複製自体に情報の複製は必要ない。例えばウイルスの被膜を考えてみよう。被膜形成に必要な幾つかの構成タンパクが必要なだけ調達できるなら、一定の大きさのウイルス被膜は自然に形成される。ここでもし被膜が物理的強度の問題で一定の大きさになると壊れると仮定しよう。不完全な被膜は、壊れた一部を核にしてもう一度完全な新しい被膜を形成できるだろう。すなわち、平衡から遠く離れた条件さえ満たせれば、形成、破壊、再形成を繰り返して増殖するウイルス被膜のような構造は十分考えることができる。同じように、例えば核のないプロトセルのような液胞が一定の大きさになると物理的にちぎれるとしよう。このちぎれる限界の細胞内成分の量と膜の強度(この時膜も自然に成長するとしておく)が物理的に決められておれば、情報はなくても一定サイズになると2個の液胞が作られ、またその液胞が分裂するというサイクル、すなわち複製サイクルを考えることは可能だ(実際そのような実験が行われている)。しかし実際には、何らかの情報がないと同じものを作り続けることは難しく、生成されるプロトセルの大きさも時間とともに大きくばらつくだろう。判を押したように同じ大きさのプロトセルを作り続けるためには、デザインや機能を指示できる情報が増殖には必要になる。
もちろん情報といっても、最初から核酸が情報媒体を担っていたと考える必要はない。例えばたんぱく質の構造を変化させるだけなら、プリオンのような例もある。しかし、増殖・生存に必要な情報を、核酸媒体を使って細胞の化学的オペレーションから完全に分けることに成功した私たちの先祖だけが結局地球上で生き残れた。この結果、現存する全ての自立生命は、DNAをゲノム情報の媒体として使っている。このように、ゲノムの働きの第一は、生物の増殖を支えることになる。
テトラヒメナにもどろう。テトラヒメナは単細胞生物で、通常は分裂により増殖する。このとき、大核も小核も同じように複製され、それぞれの娘細胞に分配される。では両方の核が複製されることはテトラヒメナの維持に必要なのだろうか。例えば、小核を除去したテトラヒメナは増殖が可能だろうか? 実験が行われたかどうか明らかではないが、おそらくかなりの期間分裂を続けることはできるだろう(原理的には無限に分裂していい)。実際、核を一つしか持たない真核生物の方がこの世には多く存在し、増殖を繰り返している。テトラヒメナの場合大核ではゲノムが200以上に断片化されているなど、特殊な構造を持っているため、大核は長い期間にわたって安定な複製を維持しにくいかもしれないが、基本的には小核がなくとも増殖は可能だろう。
では小核は何をしているのか?前回説明したように、小核は二つの個体の接合時に独自の活動を始める。まず減数分裂を行い1倍体の核を2個形成する。次に、同じように減数分裂によりできた他の個体からの1倍体の小核を交換し合い、最終的に融合する。この結果、異なる個体のゲノムを集めた2倍体の核が作られる。この小核からまず新しい大核と小核を作り直したあと、その後は通常の分裂増殖サイクルに戻る。
この複雑な過程から出来るのは2倍体の小核なのに、なぜこれほど面倒臭いことをしなければならないのか。テトラヒメナの小核の場合、新たに何千箇所もの挿入配列を取り除いて大核まで作らなければならない。なぜこんな複雑な仕組みが選ばれたのか?一つの可能性については前回述べた。ここまで複雑な接合の仕組みが維持されていることは、テトラヒメナにとって最も効率のいい方法なのだろう。
もともと異なる個体間でゲノム情報を交換し合い、ゲノムレベルの雑種を作ることは種の生存のために重要だ。もちろん逆もあるだろうが、一般的に多様な情報を持っている方が多様な環境に対応できる。もう一つ重要なのは、これにより有害な突然変異を元に戻したり、薄めたりできる。ゲノムでは接合だけが異なる個体の情報を一つの個体に統合することを可能にしている。接合だけではそれぞれのゲノムは独立したままで、いわば2人3脚ではあっても本当の融合ではない。しかし、次の減数分裂が起こるときには、染色体間で相同組み替えがおこる。すなわち染色体同士で部分の交換が行われ、異なるゲノム由来の情報が一つのゲノムに文字通り融合する。テトラヒメナでは、このゲノムの統合、交換、融合を通したゲノム情報の間のコミュニケーションを小核が専門的に行っている(前回の図参照)。一方、ほとんどの真核生物は、これを一つの核で行っている。
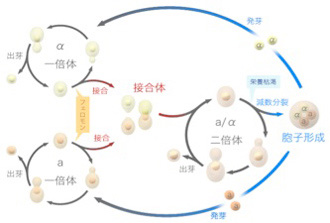
図1出芽酵母の減数分裂と接合。説明は本文(Wikicommonsより)
生物学ではこのゲノム間のコミュニケーションを「性」と定義している。ほとんどの真核生物ゲノムが共通に持つ働きだ(例外については最後に紹介する)。テトラヒメナの場合、個体全体が接合したままコミュニケーションが行われるが、より一般的な戦略は、コミュニケーション(接合)用の細胞が特別に分化し、その細胞同士で融合が起こる。またこの細胞を作る過程で減数分裂が起こり、ゲノムの交換と融合が可能になっている。例えば、出芽酵母では2倍体の分裂個体が減数分裂で1倍体の胞子を作り、この胞子が接合して2倍体の個体を作る(図1)。一方、生殖細胞が体細胞から分離した高等動物では、この減数分裂と接合は、生殖細胞系列の配偶子、例えば精子と卵子、植物では花粉や雌しべの役目になる。それぞれが分化し接合する方法は全く異なるが、全てで共通に行われているのは個体間のゲノム情報の交換だ。面白いのは分裂個体が減数分裂サイクルに入るのはほとんどの場合、外界の栄養状況が悪くなるなど逆境に晒された時だ。すなわち、逆境では他の個体と情報交換することで、自分にはない能力を取り込める可能性がある。この異なる個体間でゲノム情報を交換するコミュニケーション能力が、生存に負の作用を持つ突然変異を薄め、ゲノムの多様性を増大させてきた。まとめると、ゲノムの働きの第2は個体間でゲノム情報を交換することだ。
ゲノムの働きの第3は多様化して進化の原動力になることだが、この話題は次回に回す。今回は、2番目の働き、性、すなわちゲノム間のコミュニケーションを全く行わない生物のゲノムについて最後に紹介して終わる。2年前の8月Natureにワムシの一種belloid rotifer(Adineta vaga)ゲノムについての論文が掲載され、注目を浴びた(Nature, 500:453-457, 2013, 幸いこの論文はcommonsとして図の掲載が許されている)。注目を浴びた最大の理由は、このワムシに性別や、雌雄同体や、減数分裂の気配が全くないからだ。すなわち、異なるゲノム間の情報交換なしにワムシが何千万年も生きてこられた秘密がゲノムからわかると期待したからだ。期待通り、ワムシは2重人格とも言えるゲノム構造を持っていた。
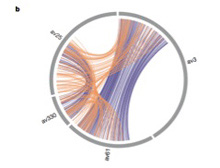
図2 ワムシゲノムに見られる対立関係にある遺伝子とオオノログ(ohnolog)な関係にある遺伝子のマップ。ワムシの遺伝子の多くは、相同性の高いペア遺伝子(青色で示す)、すでに多様化が進んだペア遺伝子の2種類を持っている。
Nature, 500:453-457, 2013より。
図2には、この論文の図2bをそのまま掲載したものだが、ここで青い線で結ばれているのが相同性の強い対立遺伝子に相当する遺伝子ペアで、一方オレンジの線で結ばれているのが故大野乾博士の名前に由来するOhnologous遺伝子ペアだ。Ohnologous遺伝子とは、全ゲノムの重複後にコピーされた遺伝子を失わずに保持している重複遺伝子で、独立に進化し多様化してきた。ここでavとあるのはワムシゲノムでアッセンブリが確定している領域と考えて貰えばいい。重要なことは、ワムシでは対立遺伝子といっても二倍体のゲノムが存在するわけではなく、一つのゲノムの中に対立遺伝子セットが組み込まれていることだ。さらに、ゲノム重複によるペアも独立に存在するという不思議な構造をとっている。ゲノムは情報交換なしに単独で分裂を続けると、変異が蓄積して維持が難しくなる。ゲノム間で情報を交換しあうことは、この問題の解決のために必要で、真核生物は性生殖を通してこれを行う。性のないワムシでも、やはり情報交換が必要で、対立遺伝子の代わりに、重複した遺伝子を同じゲノム上で維持し、その間で情報交換することで異常が蓄積しないようにしている(図3)。
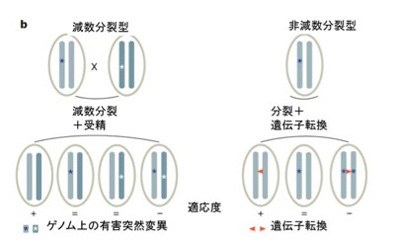
図3 有性生殖による異なるゲノム間情報交換と、分裂とゲノム内遺伝子転換による情報交換。Nature,
500:453-457, 2013,を改変
図3で示すように、この同一ゲノム内の相同遺伝子間の情報交換は、相同組み替えではなく、遺伝子転換で行われていると考えられている。相同遺伝子が同じゲノム上に散らばるワムシのようなゲノム構造が一旦できると、減数分裂、接合過程を介した情報交換はうまくいかないと考えられる。なぜなら、異なる個体の配偶子同士が接合したとしても、相同組み替えのための染色体のペアリングが正確に行えない。
この図からわかるように、同じゲノム上に存在していても、独立した対立遺伝子のペアを持つことで、ペアどうして相互に情報を交換して、有害な突然変異などを除去することが出来る。他にも、ゲノム内対立関係にある遺伝子と、それに対応するOhnologous遺伝子を比べると、相同性に大きな違いがあることから、相同組み替えがなくとも、遺伝子転換(gene conversion)メカニズムにより十分な多様性が得られることがわかる。
性生殖をやめたのが先か、ゲノム構造が特殊化したのが先かよくわからないが、結果的にワムシは有性生殖に頼らず、分裂に伴う遺伝子転換などの情報交換のみで多様化し、何千万年も生きることができている。面白おかしく考えると、ワムシは、普通なら異なる個体間に存在する対立遺伝子が一つのゲノムの中に統合されている2重人格者と言えるかもしれない。ただ、異なる個体間の情報交換をやめてワムシが何千万年も生きているからといって、性を通した個体間での情報交換が不必要かどうかはわからない。というのもワムシは普通の生物にはない不思議な性質をいくつも持っている。例えば、完全に乾燥しても水に触れれば生き返る。また放射線にも驚くべき抵抗性を示す。これほどの環境に対する耐性を獲得してしまえば、個体間の経験の差など取るに足らないのかもしれない。
[ 西川 伸一 ]
続・ゲノムの働き
2015年10月1日
昨年5月、第6話で紹介したようにダーウィンの進化論の柱の一つは、集団内で形質の多様化が自然に起こるとする考えだ。ゲノムやDNAはおろか、遺伝の法則についても何もわからなかった時代にダーウィンがこれを着想したことに驚く。一方自然選択の概念は、マルサスや、適者生存による社会進化を唱えたスペンサーの著作からわかるように、当時の社会的思想風潮の一つではなかったかと思う。ダーウィンも適者生存の法則を説明するより、自然に起こる形質の多様化についての説得がはるかに難しいと予想していたのだろう。「種の起源」を集団中に自発的に起こる多様化の話から始めている。しかし、ゲノムの理解が進んだ今日では、自然に起こるゲノムの多様化(突然変異)が形質の多様化の背景にあることを疑うものは誰もいない。逆に自然選択については、適者生存といった単純なものではなく、形質の自然選択によるゲノム変化の研究は複雑で挑戦的な分野だと考えられるようになっている(後にできる範囲で議論したい)。進化がゲノムを持つ生物に内在する機能である以上、生物の多様化を推進する原動力がゲノムの3番目の働きになる。
私たちのゲノムに変異が導入される方法は、点突然変異から全ゲノム重複まで、極めて多様だ。具体的には、1塩基置換、欠損、挿入による点突然変異、小さな配列の挿入・欠損・逆位、染色体を含む大きな領域の欠失、挿入、転座、重複などがあり、全てがゲノムの多様化に寄与する。これほど多様な方法があるとわかっていたらダーウィンも苦労せずに済んだだろう。もちろんこのような変異は理論的可能性というだけではなく、実際に一定の確率で起こっていることは、多くのゲノムデータが蓄積されてきた現代では当たり前のことになった。ヒトゲノムを比べてみると、一塩基置換による特定部位多形性、すなわちSNP(single nucleotide polymorphism)は一千万箇所、小さな領域の挿入、欠損、逆転による変異は10万箇所に上ることが知られている。大きな染色体の変異となると、さすがにヒトゲノムデータベース内に見つけることはほとんどできないが、染色体重複だと例えば21番染色体の重複によるダウン症は有名だ。さらにがん細胞を調べると、様々な大きなスケールの変異を目にすることができる。例えば小児ガンの一つ神経芽腫の多くは13番染色体の特定部分が欠損することが知られているが、1983年に13番染色体全てが一本欠損した神経芽腫が発見されている(Science 219, 973-975, 1983)。他にも、ガンの遺伝的原因として染色体転座と呼ばれる異なる染色体同士の結合が知られている。例えば、ほぼ全ての慢性骨髄性白血病細胞は9番染色体と22番染色体の一部が結合した新しいキメラ染色体が形成される。これにより、bcr分子とabl分子が結合したキメラ分子が生まれ、これが血液幹細胞の増殖を促進し、白血病を引き起こす。こうして獲得される増殖優位性も適者生存の一つの形と言えるだろう。このような転座がガンの引き金になっている例は数え切れない。
ゲノムの多様化を考える時ガンゲノムから学べるもう一つの重要な事は、細胞が増殖を続ける中で驚くほど多くの変異が蓄積して行く事だ。例えば多数の悪性黒色腫の全ゲノム解読を行った論文によると(Cell vol161, 1681, 2015)、それぞれのガンごとに1Mbあたり平均16.8個の何らかの変異が見つかる。ヒトゲノムを3Gと考えると、この数字の3000倍、すなわち約5万個の突然変異が、ガンに蓄積していることになる。そしてこの中に異常増殖や転移性などに関わる機能的変異が複数個存在している。本当に個体の形質の多様化が目に見える形で起こっているだろうかというダーウィンの心配は全く杞憂でしかない。私たちのゲノムは猛烈な勢いで多様化するようできているようだ。
では、これほど様々な方法でゲノムを多様化させる原動力は何か?一時世間を騒がせたガン研究の大御所Vogelsteinたちが発表した論文にこのヒントがあるように思う(Science, 347,78, 2015)。私たちの体にはガンになりやすい組織となりにくい組織がある。この論文は、組織ごとのガンの起こりやすさと、その組織を維持するために必要な幹細胞の増殖回数をプロットして、両者が見事に相関することを示した論文だ。例えばガンの発症の多い直腸は、組織の維持のため幹細胞が10の13乗回近く分裂しなければならない。一方、小腸は長いように見えても幹細胞全体の全分裂回数は大腸の50分の1で、ガンの起こる頻度は100分の1であるのと一致する。すなわち、ガンにかかりやすさは、ガンが発症する組織の維持に必要な幹細胞の分裂数に比例し、つまるところ分裂時に起こる全く確率論的な変異により決まっているとする結論だ。もちろん生活習慣要因もガンのかかりやすさを変化させるが、背景となる分裂との相関は変わらないとした。これに対し、あまりに単純化しているとの非難の声が上がったが、私にとっては当然のことに思えた。というのも、ゲノムの複製は最も変異リスクが高い過程であることがわかっているからだ。2013年、7000にのぼる異なるガンのエクソーム解析からガンでどのような突然変異が起こっているか調べたNatureの論文(502,258,2013)でも、様々なガン共通に見られる突然変異の種類(例えばCからTへの変異)は、DNA修復や複製時に起こることが明らかになっている。DNA修復というと、私たちは放射線や紫外線、あるいは様々な化学物質などによるDNA損傷に対処するためのメカニズムだと思ってしまう。確かに地球上で暮らす限り損傷を避けることができないため、損傷を受けてもすぐに修復するための複雑な仕組みを開発してきた。実際、タバコや紫外線で修復が追いつかないほど損傷を受けるとガンの発生は上昇する。また修復酵素の力が弱まると少し紫外線に当だけでガンになる確率が高まる。その例が色素性乾皮症で、皮膚ガンの発症率は正常の20倍以上に達する。しかし普通の生活で起こる放射線照射や化学物質暴露よりはるかに強い突然変異誘発要因が存在している。それがDNA複製だ。詳しくは述べないが、DNA複製は2本鎖がチャックで開いたり閉ったりするように連続的に起こるものではなく、3種類のポリメラーゼ(一つはプライマーゼとも呼ばれている)が関わる複雑な不連続過程だ。この解明には当時名古屋大学の故岡崎博士の貢献が大きく、複製された短い不連続なDNA鎖を彼の名をとって岡崎フラグメントと呼んでいる(サイエンティストライブラリー岡崎恒子夫人の記事で詳しい解説有り)。最近DNAの変異が岡崎フラグメントの5’ 端に集中しており、これが複製間違いの多いポリメラーゼαで複製される短いフラグメントが完全に除去されず残ってしまうためであることが報告された(Nature 518,502,2015)。さらにポリメラーゼの複製間違いを修復する酵素(ミスマッチ修復酵素)の機能低下が多くのガンの引き金になっていることも分かっており、この酵素が先天的に欠損した小児のガンでは、普通のガンの何十倍もの突然変異が蓄積している(Nature Genetics 47,257, 2015)。これは点突然変異の話だが、染色体レベルの大きな変異の多くはやはり細胞分裂や減数分裂時に生じることがわかっている。これらの例から、形質の多様化の背景にあるゲノムの多様化を駆動するもっとも大きな原動力とは、生命に必須の細胞増殖そのものであることがわかる。言葉を変えると、複製されて子孫に分配されるというゲノムの働き自身が、多様化の原動力になっている。
最後に、生命の維持に必須のタンパク質や機能的RNAを作り続けるための情報としての働きがゲノムの4番目の働きで、テトラヒメナの大核が担っている。ただこの働きについては、ゲノムの解剖学で詳しく述べたので割愛する。
以上紹介したゲノムの4つの機能から見えてくるのが、ゲノムが時間スケールの異なる未来に向けての情報として用意されていることだ。まずゲノムは次の瞬間から未来に続く生命の維持のために、必要なタンパク質や機能RNAを必要な量だけ作り続けるための情報として働いている。次に、あらゆる生命は増殖を維持することが必要だが、ゲノムはこのとき様々な時間スケールで必要とされる細胞増殖の際に子孫細胞に分配するためコピーされる情報として働いている。以上二つのゲノム情報の働きが関わる時間はほぼオーバーラップしており、いずれも現在の環境に対応して生命を維持することに関わっている。ところが、テトラヒメナの小核の説明で述べたように、個体同士の情報交換の媒体としてゲノムは働いている。単細胞動物では、この交換は通常環境が変化したとき行われることから、もう少し長いスケールの時間で予想される環境変化に対応する情報として働いている。そして最後に、ゲノムは複製時に多様化する性質を身につけることで、遠い未来に備えるための進化可能性媒体として働いている。このようにゲノムは情報として様々な未来に備える働きをしている。面白いのは、転写や増殖のような近い未来に対しては、変化を抑えるよう安全弁を働かせ、一方、もっと長いスパンで予想される環境の変化に対しては自ら変化する性質を積極的に利用して備えている。
今回は、図のない説明になってしまったが、これでゲノムの働きについての説明は終わる。次回は、DNAを媒体とする生物の情報と、私たちが情報という言葉で一般的にイメージするものとの相違について見ていく。
[ 西川 伸一 ]


