2013年12月26日
話題の医薬品候補化合物について、今年の開発の進捗概要を青、黄、赤の三色シグナルに分類して紹介されていますので、分かる範囲で国内や稀少難病関連の情報を補って、概略を転載いたします。
青信号
・免疫治療剤としての対PD-1 (Programmed Death-1)受容体抗体に関して、BMS社のnivolumab単独およびipilimumabとの併用により、進行性悪性黒色腫のフェーズI試験で著効を示し、また同効であるMerck社のlambrolizumab(MK-3475)は、FDAから画期的治療剤の指定を受けました。
・FDAは、転移性非小胞肺がんの治療剤として臨床開発中の、何れもALK蛋白に対する分子標的薬であるNovartis社のLDK378およびRoche社のalectinib(RG7853)に対して、共に画期的治療剤に指定しました。
・B.Ingelheim社のアンジオキナーゼ阻害剤「GILOTRIF」(afatinib)が、肺がん治療剤として米国および欧州の双方で承認を受けました。
・Isis製薬からライセンスを受けたGenzyme社のアンチセンス剤「KINAMRO」(mipomersen)が、家族性高コレステロール血症(FH)治療剤として米国で承認され、世界初の市販されたアンチセンスDNA医薬となりました。
・GSK社の1日1回服用のHIV治療剤「TIVICAY」(dolutegravir)がFDAの承認を受けました。本剤は、レトロウイルスDNAの宿主ゲノムに取り込みに必須の酵素integraseを標的とします。
・Bayer社の「ADEMPAS」(riociguat)が、何れも稀少難病である慢性血栓塞栓性肺高血圧症(CTEPH)および肺動脈性肺高血圧症(PAH)=公費負担対象の難病で、バイエル社は我が国でも承認申請済み=の治療剤としての承認について、FDAの優先審査の結果「青信号」が点りました。本剤は、可溶性guanylate cyclase (sGC)の刺激薬です。
・Novaltis社の卵巣ホルモンの一種で、ストレス緩和ホルモンとして知られるrelaxinの合成ペプチドserelaxinは、急性心不全についてフェーズIII試験中ですが、FDAから画期的治療剤の指定を受けました。
・J&J社の、ナトリウム−グルコース共輸送体タンパク(SGL-2)阻害作用を持つ「INVOKANA」(canaglifloin)は、FDAが未だに腎毒性の懸念を持ちながらも、2型糖尿病治療剤として承認しました。
・Pharmacyclics社とJ&J社は「IMBRUVICA」(ibrutinib)について 、マントル細胞リンパ腫(MCL)および慢性リンパ球性白血病(CLL)に対してのFDAから画期的治療剤の指定を受けて共同開発中ですが、11月に承認が得られました。
・Gilead社の「SOVALDI」(sofosbuvir)は、FDAでC型肝炎治療剤として優先審査中ですが、その承認への推薦がなされました。
・Roche社の、B細胞表面たんぱくCD20を標的とする「GAZYVA」(obinutuzumab)について、慢性リンパ球性白血病(CLL)の治療剤としてFDAの承認を得ました。
黄信号
・DPP4阻害剤: グルカゴンの分泌抑制作用を持つ、2型糖尿病治療剤としてBMS社の「ONGZYLA」(sexagliptin)とAstraZeneca社と武田薬品の「NESINA」(alogliptin)が発売されました。
・BRISDELLE(paroxetine): 最初の非ホルモン更年期障害治療剤として、FDAはNoven Therapeutics社の選択的セロトニン再取り込み阻害薬(SSRI)である本抗うつ剤の低用量剤形を承認しました。
・DUAVEE(estrogenとbazedoxifeneの配合物):もうひとつの更年期障害治療剤としてRoche社の一過性熱治療薬の本剤が、FDAにより承認されました。
・Suvorexant: Merck社が不眠症治療剤として申請した、二重オレキシン受容体拮抗剤の本剤について、安全性に疑問ありと拒絶されました。本剤の低用量製剤については審査継続中で、覚醒神経伝達物質orexinを標的とする最初の承認取得治療剤になるのでしょうか。
・Ramucirumab: Lilly社による、転移性乳がんの腫瘍進行阻止と延命効果の試験は失敗しましたが、FDAは胃がんの化学療法剤として本剤を優先審査に付しました。
・Alirocumab: Sanofi社は、PSCK9酵素を標的とする本剤の、高コレステロール症に関するフェーズ3試験で良好な結果を得たと発表しましたが、副作用も多発しました。Pfizer社とAmgen社もそれぞれ同効薬を開発中です。
・Vercirnon: クローン病の治療薬としてフェーズIII試験中であるGSK社は、結果が思わしくないとして、全ての権利をChemoCentryx社に返却すると発表しました。同社は、化学シグナル受容体たんぱくCR9を阻害することにより腸の炎症細胞を消す本剤の、改めての開発計画を発表しました。
赤信号
・Dexpramipexole:Biogen Idec社が、FDAと欧州EMAの稀少難病の指定を受け、筋萎縮性側索硬化症(ALS)の治療剤として規模拡大フェーズIIIの試験を行っていましたが、関節機能と生存の改善効果が得られず、開発を中止しました。
・TREDAPTIVE(laropiprantとニコチン酸の合剤): Merck社は、善玉コレステロール産生作用を持つニコチン酸(niacin)とその顔紅潮の副作用を抑えるlaropiprantとの合剤の、心血管系に高いリスクを持つ大規模な患者を対象とした投与試験で、症状の改善効果が得られなかったとして開発もしくは販売(欧州)を中止しました。
・Preladent: Ligand社からアデノシンA2A受容体拮抗作用を持つ本剤を導入したMerck社は、フェーズIII試験でプラシーボ群に対する優位な治療効果の立証に失敗して開発を中止しました。
・LY2886721: Lilly社は、神経変性症で脳内に蓄積する蛋白質の産生に関わるβ−セクレターゼの阻害剤で、フェーズIIにあった本剤のアルツハイマー病治療薬としての開発を、肝毒性のために中止しました。
・Drisapersen: GSK社とProsensa社は、dystropin蛋白に変異を持つ、稀少難病デュシェンヌ型筋ジストロフィー(DMD)の治療薬としてフェーズIII段階にあったエクソン・スキップ作用の本剤の開発を、筋肉の消耗を低下できなかったとして、開発を中止しました。本剤は変異したdystropinのexon51遺伝子をカモフラージュして、本来の蛋白質を生産させます。別途、Serepta Therapeutics社では同様な作用を持つeteplirsenをDMD治療薬として開発中です。
・Gammagard: Baxter社では、本剤によるアルツハイマー病のフェーズIII試験において、免疫グロブリン療法による認識低下の減弱もしくは阻止ができませんでした。しかし、別の小規模試験においては、記憶消失を防止できました。同社は、現在被験者における別の側面からの有効性の試験を行っています。
・R343: Rigel製薬は、脾臓のチロシンキナーゼの阻害によって息切れを抑える本剤の、喘息患者でのフェーズII試験において、シャックリ発作が生じ、開発を止めたと報じました。
・MEGA-A3 vaccine: GSK社は、メラノーマ関連抗原を標的とする癌ワクチンである本剤が、皮膚がんの進行を抑制できなかったと公表しました。Agenus社が、腫瘍の免疫細胞を変化させるようにデザインしたもので、GSK社は、特定の遺伝子プロファイルの患者に対しての肺がんのフェーズIII試験を継続しています。 (田中邦大)
2013年12月11日
ヒストン脱アセチル化酵素(HDAC)阻害作用を有するボリノスタットは、第1回未承認薬等検討会議に開発要望書が提出されたことを端緒に早期審査を経て、皮膚T細胞性リンパ腫(CTCL)治療剤「ゾリンザ・カプセル」として、2011年7月からMSD社および大鵬薬品から販売されています。
米国Notre Dame大から、ニーマン・ピックC型病(NPC)患者の95%は、複数回膜貫通型膜タンパク質NPC1の遺伝子に変異が見られるが、HDAC阻害剤であるボリノスタットが、NPC1タンパク質を増やし、NPC患者由来の繊維芽細胞のコレステロール蓄積を減らした、と報告されました。(http://www.ncbi.nlm.nih.gov/pubmed/24048860 )
米国ではNPC患者を対象にしたボリノスタットの臨床研究が進んでいますので、本疾患の原因治療法としてのその結果に注目して、わが国でも適応外薬としてボリノスタットがNPC治療剤として早期に追加承認されることを期待しています。 (田中邦大)
2013年10月24日
今年度から国内の有望な基礎研究の成果を実用化につなげるために、内閣官房を軸に、関係各府省・関係機関が連携し「創薬ネットワーク協議会」を構築し、医薬基盤研究所創薬支援戦略室がその本部機能を担っていますが、その重点領域の第2番目として「難病・希少疾病」が掲げられており、各疾病患者にとっても具体的且つ早急な進展や成果が待望されるところです。(関連して、日経バイオテク7月13日号も参照: https://bio.nikkeibp.co.jp/article/news/20120713/162149/ )
一方、政府機関の閉鎖が解けた米国食品医薬品局(FDA)は、早速稀少難病の治療に関する15の研究プロジェクトに対して総額約14億円の研究資金を提供して支援することになりました。これは、同国の希少難病薬法に基づく希少難病治療薬助成プログラムによるものですが、税務上の特典、申請費用の減額および独占販売期間の延長など企業の希少難病への創薬研究開発活動の現行支援策・インセンティブにさらに加わることになります。(PMLiVE 2013/10/22: http://www.pmlive.com/pharma_news/fda_supports_rare_disease_research_512037 ) (田中邦大)
2013年10月2日
米議会での暫定予算不成立により、10月1日から一部の連邦政府機関が閉鎖されていますが、米国国立衛生研究所(NIH)で最先端の研究的治療を受ようとする患者は全て締め出されています。研究所長のDr.Francis Collinsは、子供で致命的な疾患の患者を除いては、受け入れることはできないと”悲痛”な状況であるといっています。(AP: http://abcnews.go.com/Health/wireStory/shutdown-means-nih-hospital-turn-patients-20435497 )
一方、米国食品医薬品局(FDA)でも、その主要業務である新薬承認審査が止まり、新薬承認申請(NDA)の審査の遅れは避け得ないようです。(http://blog.pharmexec.com/2013/10/01/government-shutdown-halts-fda-product-submissions/ )
特に新しい難病治療薬は、創薬段階から製造販売承認まで、全て米国の後追いの状況ですので、これら機関での業務の遅れは、わが国でもそのまま影響を受けることは自明で、対岸の火事では済まされません。 (田中邦大)
2013年9月29日
昨日FOP明石で、FOPの患者さんや、家族の方と話をする機会がありました。その時、家族の方からFOPの突然変異がどう発生するのかと言う質問がありました。多くの家族の方がご存知のように、ほとんどの場合FOPの患者さんのご両親が同じ突然変異を持っておられる事はありません。もし同じ突然変異を持っておられるとご両親にも同じ症状がでるはずです。従って、ご両親の遺伝子は正常だと考えられます。とすると、新しい突然変異が患者さんに発生した事になります。この新しい突然変異はではどこで起こったのでしょうか。一番可能性が高いのは、ご両親の身体の中で精子や卵子が作られる時にその突然変異が発生する事です。実際お父さんの睾丸の中では何千万個の精子が毎日作られています。また、発生段階でお母さんの卵巣の中には約200万前後の卵子が作られます。この時に誰でも一定の確率でこの遺伝子の突然変異が起こると考えられます。すなわち、どの夫婦にもFOPの子供さんが生まれる可能性があります。従って、FOPのお子さんを持っておられるご両親が、何か特別であったと考えられる理由は全くありません。
さて、精子や卵子を作る時に突然変異が起こるとすると、兄弟姉妹がFOPにかかる可能性はほとんどないと思います。また、他の遺伝病と同じで、妊娠中の子供がFOPにかかっているかどうかを調べる事も可能だと思います。
2014年8月8日付けの論文紹介で、両親の遺伝子異常がなくても、発生過程で遺伝的モザイク状態が形成されている可能性があります。このため次の子供を産む前にモザイク率を調べることは役に立つと思います。
2013年9月20日
I型糖尿病については、日本語、英語を問わず極めて優れたウェッブサイトがあり重要な情報が発信されている。実際、IDMMネットワークは患者さんの団体としては日本初の認定NPO資格を取り、活発な活動を行っておられる。私たちの出る幕ではない。代わりに、I型糖尿病の治療について今年発表された総説を読んで紹介する事にした。もとより、私はこの分野の専門ではない。しかし、医学をある程度理解できる人間として論文を読んだとき、どのような感想を持つのかを紹介する事も患者さんの役に立つと思った。従って、I型糖尿病については今後もこの様なスタイルで情報をアップデートできればと思う。更に多くの方に理解してもらうため、是非患者さん達とこれら総説の読書会を行って、少し突っ込んだ議論を行い、録画出来たらと考えている。
Juvenile Diabetesというキーワードで文献サーチを行うと、60000を超す論文がでてくる。オリジナルな論文を全部読むのは大変だ。次に総説と絞り込みを行うと、数は8000に減る。このうち今年2013年に出版された総説論文は32編だが、英語に限ると更に減って23編になる。ちなみに2013年に出版された若年性糖尿病に関わる論文総数は1000を超す。全てが1型糖尿病についての仕事かどうかは確かめていないが、しかし研究は活発である印象を持った。総説に戻ると、症例報告、診断関係、実地診療などが半分で、新しい治療についての総説は9編で、インシュリン療法、免疫関係、移植療法に分かれる。
まずインシュリン療法についてだが、最も新しい総説として、Diabetes, Obesity and Metabolism に掲載されたカナダのZinman博士の総説を読んだ。様々なインシュリン製剤や科学化合物の臨床治験が活発に行われているようだ。驚いた事に(専門外の私が)、長期効果を持たせたインシュリンの1型患者さんを用いた臨床試験も行われている。特にdegludecと呼ばれている極めて長期効果のあるインスリンはいい成績を上げているようだ。他にもモニタリングやポンプの方も改善が進んでおり、続々治験が行われている。この治療自体は病気を治すものではないが、生活の改善には間違いなくつながる。良いものは日本でもすぐ使える様、患者さんと医師、企業の協力体制を作っておく事が重要だろう。
次に移植については、Annals of Biomedical Engineeringに掲載されたHatsziavramidisらの総説と、Diabetesの8月号に掲載されたRickelsらの原著論文を読んだ。日本ではまだまだ敷居の高い膵島移植に代わる方法に関しては、iPS細胞から、膵臓幹細胞まで様々な可能性が研究されてはいるが、実用化にはまだまだ時間がかかるだろう。私も3月まではiPSなど幹細胞を用いた研究の現状について十分フォローしていたが、膵島移植が可能になるまではかなり時間がかかるという印象を持っていた。従って、総説では一般的な事が総花的に書かれているだけだが、たまたま目にしたDiabetes8月号の仕事は興味深かったので紹介する。この論文は膵島移植のCIT07と言う新しいプロトコルについての治験の途中経過を報告している。このプロトコルでは、取り出した膵島を3日間培養し、その間にリンパ球を取り除いたり炎症を防ぐ処理をして移植する。これによって、移植後ドナー細胞の生着が格段に改善し、1年後でも正常人に近いインシュリン合成能を維持していた。おそらくあまりにも成績がいいために早めの報告が行われたのかと思う。勿論この仕事は膵島移植の新しい方法として位置づけられる、大きな期待が出来る。それ以外にも炎症細胞を除く事で生着が上がる事をヒトではっきり示せた結果は重要だ。炎症につながる細胞を含まない純粋の膵島をiPSなど幹細胞から作る事が可能になれば、それ自身の生着は遥かに今の膵島移植より良い事が予想される。従って、iPS研究にとっても、この仕事は大きな朗報ではないかと思った。
最後に免疫療法についてはClinical & Experimental Immunologyに掲載されたvon Herrath等の総説と、The Journal of Diabetic Studiesに掲載されたWeigmannらの総説を読んだ。両方の総説ともだいたい同じ内容だ。1型糖尿病のほとんどが、自己免疫的機序で起こると考えられている。根治療法としてまず考えられるのが、免疫が成立する過程で病気を防ごうとするものだ。治験では、経口、経鼻など様々なルートでインスリンを投与する事で、インスリンに対する免疫寛容を起こそうとする治療法だ。この治療法は、1型糖尿病の発症前にインシュリンに対する抗体が出来ていると言う結果が根拠になっている。この抗インシュリン抗体が膵島障害の引き金になるのではという仮説だ。この治療は、インシュリンに対する抗体反応を起こさないよう免疫システムを飼いならそうと試みるものだ。総説では、期待の持てるデータが発表されている事に触れた上で、多くの場合は効果が見られない事が多いと結論している。しかし、まだ進行中の治験もあり注目していけばいいだろう。副作用がないとすれば、根治につながる最もコストの安い方法だ。この治療法のもう一つの問題は、発症が確実視される遺伝的背景がある場合は治療として成立できても、どちらか予見できない場合はやはり治療として用いられない事だろう。実際、一卵性双生児でも1型糖尿病の一致率は60%程度である事が知られている。免疫反応とは完全に遺伝だけで決まらない証拠だ。従って、普通に治療に利用されるにはまだまだハードルが高い気がした。
もし抗原特異的な治療が難しいとすると、次は免疫反応自体を抑える治療が考えられる。このため、抗体薬を含む多くの免疫抑制剤の治験が進んでいる。総説を読む限りで長期的効果もありそうに見えるのが、anti-CTLA4, anti-TNFa,, anti-CD3抗体で、気体を示す論文がずいぶんでているようだ。いずれも第3相試験も行われており、注目する必要がある。
最後に、免疫反応を抗原特異的に抑制する重要な細胞として日本で坂口さんによって発見された抑制性T細胞を注射する臨床試験まで行われている事を知り驚いた。実際、両方の総説ともこの細胞の将来の可能性を大きく扱っている。この抑制性T細胞を発見した坂口さんは山中さんと同じ時、京大再生研の教授だった。因縁話のようだが、iPSで細胞治療、抑制性T細胞で免疫治療が完成すれば日本の誇りになるだろう。期待する。
2013年9月5日
国立精神・神経医療研究センター(NCNP)は、厚労省から特定疾患に指定されている稀少難病ミトコンドリア病の一種MELAS(脳卒中様症状を伴うミトコンドリア病)への治療効果を調べるために、米国ベンチャー企業のエジソン社が開発中の酸化ストレス除去剤EPI-743について、8月から同センター病院の神経内科および小児神経科で臨床研究に入ると発表しました( http://www.ncnp.go.jp/press/press release130809.html )。
EPI-743は、米国および欧州でミトコンドリア病の一種のリー脳症(ミトコンドリア脳筋症)を対象に臨床第IIb試験を実施中で、日本でも既に今年3月に大日本住友製薬が、エジソン社からライセンスを受け、同用途での開発を進めており(http://www.ds-pharma.co.jp/pdf_view.php?id=493)、本試験薬が両社と同センターでの臨床開発が、協奏的に加速され、これら適用範囲の承認を得て、早期にミトコンドリア病患者に届くことを期待しています。
このように国内外を問わず、産官学が協力して稀少難病治療薬の創出に取り組まれる事例が、最近散見されるのを知り、稀少難病患者の実態が、社会でも認知され始め、また科学と創薬技術の進歩に各種制度の整備も進んでいることを実感し、さらに他の稀少難病にも目が向くものと期待が広がります。 (田中邦大)
2013年9月1日
- ミトコンドリア病とは
ミトコンドリア病(Mitochondrial Disease)は、全身の各種細胞に在って細胞機能維持に必要なエネルギー産生を行うミトコンドリアの機能不全による疾病で、部位によりそれぞれ異なる症状が見られます。
ミトコンドリア病は、エネルギー需要の多い脳、骨格筋、心筋で多く発症し、神経系、心臓循環系、眼科領域、消化器系に加え、新生児・幼児の虚弱や低血圧症など、年齢にも関係なく色々な部位で糖尿病、心臓機能不全、肝不全、難聴、失明、腎不全、筋脱力、疲労などの症状が見られます。
ミトコンドリアの働きに関わる1,000以上のタンパク質が知られており、対応する遺伝子(核DNAとミトコンドリアDNA)の変化によって、それぞれの部位で多様なミトコンドリア病を発症します。
ミトコンドリア病については、多くのサイトで、解りやすく解説されていますので、例えば以下を参考にしてください:
定番の「難病情報センター」の情報です。わかりやすくまとまっています。 http://www.nanbyou.or.jp/entry/335 もう一つは、「日本ミトコンドリア学会」です。ここは学会として責任を持とうと様々な試みを行っています。特に、http://j-mit.org/patiodoctorsoudan/read.cgi?no=365 はドクター相談室です。既に診断がついている患者さんはこのサイトで専門家に様々な質問をする事が出来ます。患者会のサイトとして「MCM家族の会」http://www.mitochon.org/pc/ を挙げておきます。
また、アメリカのミトコンドリア病を克服するために設立された財団が提供するすばらしいウェッブサイトを紹介しておきます。これらの財団では力強い活動を行っており、このサイトからうかがい知れます。ここでは、患者さんへの情報も豊富に提供されています。残念ながら日本語サイトはありませんが、グーグル翻訳を使うとかなりの程度でわかると思います。AASJでも引き続き自前の情報を発信しますが、とりあえず2つのウェッブサイトを紹介しておきます。
1 United Mitochondrial Disease Foundation (ミトコンドリア病連合財団)
http://www.umdf.org/site/c.8qKOJ0MvF7LUG/b.7929671/k.BDF0/Home.htm
2. Foundation for Mitochondrial Medicine (ミトコンドリア医学財団)
http://mitochondrialdiseases.org
ミトコンドリア病はいろんな臓器の異常として現れます。それをまとめたわかり易い図です。参考にして下さい。図はクリックすると大きくなります。(図はBates MGD 等がEuropean Heart Journal 33:3023(2012)に発表したCardial Involvement in Mitochondrial Deseaseの図を邦訳しました) また、病気は多様な表現で記載されますので、第1表も参考にして下さい。
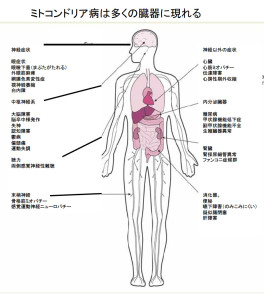
第1表 (代表的なミトコンドリア病)
|
・ 慢性進行性外眼筋麻痺 “CPEO: Chronic progressive external ophthalmoplegia”
・ ミオクローヌスてんかん症候群(福原病、マーフ、”ミオクローヌスてんかん、ミオク ローヌスてんかん等) “MERRF: Myoclonus epilepsy associated with ragged-red fibers”
・ ミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様症候群(メラス、脳卒中様症状を伴うミトコンドリア脳) ”MELAS: Mitochondrial myopathy, Encephalopathy, Lactic Acidosis, Stroke-like Episodes”
・ リー脳症 (精神運動発達遅延、大脳基底核や脳幹の対象性の壊死性病変) “Leigh Encephalopathy”
・ ミトコンドリア異常による心筋症 ”Cardiomyopathy with Mitochondrial Disorder”
・ レーバー病(視力低下、視神経萎縮) “Leber’s Disease”
・ ミトコンドリア糖尿病 “Mitochondrial Diabetes”
・ パーソン病(汎血球減少症、多臓器障害) “PEAR: Pearson’s Disease”
|
私たちはミトコンドリア病の専門家ではありませんが、医学や生物学の知識は十分あると思っています。文献などにあたって、現在この病気が世界レベルではどのように取り組まれているのか調べていきます。そのとき、ミトコンドリア病で苦しまれている患者さんと一緒に勉強する企画を行って、ニコニコ動画で流したいと思います。もし興味のある方がおられたらAASJまで連絡をお願いします。
2. 私たちとしてのミトコンドリア病への取り組み
では私たちは何をNPOでやろうと考えているか紹介します。このサイトでは、医学教育を受けた素人が見た時、その病気について何を感じるのかを素直に伝えたいと思います。即ち、皆さんの側にいる専門家と言った様なものです。
さて、素人の私たちが色々勉強してみて感じるのは、この病気の難しさは、「よくわかっているのにわかっていない」と言う状況があるからだと思います。まずミトコンドリアの機能は大変良くわかっています。細胞の使える唯一のエネルギー、ATPを作る事です。他にも幾つかの機能はある様ですが、ミトコンドリアの異常による病気は、このATPを作る機能が様々な場所で、様々な程度障害される事によります。しかし、完全に原因遺伝子がわかっていても、どう病気が出てくるのかわからないと言う問題があります。
もしミトコンドリアの機能が完全に消失すると細胞は生きていけません。なのに多様な症状が出てくるのはなぜでしょう?この病気の難しさは、ミトコンドリアが細胞に完全に支配されていないところにあります。ミトコンドリアは細胞の中で、細菌のように増える事が出来ます。そして、細菌と同じように、自分自身の活動のための遺伝子をミトコンドリア内に持っています。しかし、細菌と違うのは、ミトコンドリアの活動に必要な遺伝子のほとんどは細胞の遺伝子の中にあることです。そして何よりも、私たちの体の中にあるほぼ全てのミトコンドリアは、全て最初の一個の卵子に由来しています。このため、卵子からだけ由来するミトコンドリアと、その活動を支配する細胞側の遺伝子が複雑に絡まっているのです。このため、原因遺伝子までわかっても病気の事を正確に予想できない最大の原因です
つい先日Nature紙に、お母さんから受け継いだ突然変異を持ったミトコンドリアと、細胞の遺伝子の方の突然変異の組み合わせを調べた論文がありました(Nature, doi:10.1038)。この様な実験的に計画されたモデル系ですら、予想される結果とともに、全く予想できない結果も生まれている様です。複雑だから挑戦しがいがある、新しい分野に多くの人が参入してほしいものです。私たちも、一度ニコニコ動画を通してこの複雑性について解説したいと思います。
ただ、標的については大変良くわかっています。このため将来治療法が開発される可能性も大です。Scott B. Vafai & Vamsi K. Moothaによる Mitochondrial disorders as windows into an ancient organelle Nature 491,374 (2012) と言う論文の中に力強い予想が書かれていたので転載しておきます。「ミトコンドリア病の遺伝子と症状を結びつける事はまだ難しい挑戦だ。しかし、ミトコンドリアについては生化学がよく研究されており、存在する蛋白についてもほぼ完全にわかっている。さらに、ミトコンドリアを取り出して調べたり、細胞の中で調べたりできるという利点もある。遺伝子異常がよくわかっている患者さんも多くおられ、何よりも患者さんの団体もしっかりしている。このような特徴を考えると、この病気はシステムとして病気を考える上で大きな利点がある。・・・・・私たちは、ミトコンドリア病の発病機序を理解する事で、この様な破壊的な病気に対して新しい治療を開発できると楽天的に考えていい。また同じ治療法は他の普通の病気にも効く可能性が高い」。期待しましょう。
3.ミトコンドリア病の治療薬について
ミトコンドリアの機能低下を原因とする病気を一律にミトコンドリア病と総称しますが、上記および第1表に代表的な疾病名を挙げたとおり、多彩な症状として現われます。従って、それぞれの症状に応じた一般的な治療薬を用いる対症療法が主流となっています。
ミトコンドリア病の確立した原因療法は存在しませんが、ミトコンドリアの機能を回復させる目的で、血管を拡張するアルギニンが用いられており、同様にアミノ酸類縁化合物のタウリンの治療薬としての開発も進んでいます。
ミトコンドリアは、酸化的リン酸化によってATPを供給し、重要な生体分子を合成し、カルシウム濃度勾配の緩衝材になるなど、細胞にとっては必須のオルガネラ(細胞小器官)であり、生体のホメオスタシス(恒常性)や加齢を制御しています。ミトコンドリアの不具合は、炎症や加齢ほかエネルギー由来の変調を来たすことになりますが、このような不調は、活性酸素種(ROS)の生成による細胞の酸化障害でもあります。近年抗酸化剤による加齢関連機能低下の抑制療法の試みがなされており、動物モデルにおいて、ミトコンドリアを標的とする抗酸化剤を用いて加齢抑制効果が確かめられています。
主にミトコンドリアの機能不全による酸化ストレスは、NO合成を減じ、血圧を上げ、接着分子と炎症サイトカインの分泌を制御し、LDL酸化の原因となります。筋肉組織のミトコンドリア機能の欠陥により、脂肪酸酸化が進まず、グルコース輸送を阻害し、インスリン刺激のグルコース輸送の低下として現れ、結果は間違いなくインスリン抵抗性を発症しII型糖尿病となります。慢性的なROSの過剰と炎症は、ミトコンドリアの機能不全をもたらし、組織での脂肪蓄積とインスリン抵抗性の果てし無い悪循環を来たします。
また、ミトコンドリアROSは、電子伝達からATPを共役する脱共役たんぱく質(UCP)の活性増加に関係します。UCPの活性化により、ATPを産することなく熱を産生できるので、ATPの長期間の低下を招き、細胞インスリンのシグナル伝達に影響を及ぼします。
第2表に米国FDAのオーファン薬の指定を受けてミトコンドリア病の治療薬として開発中の一覧を掲げます。 131001_DrugUnderDevelpment ForMitochondrials
ミトコンドリア病の原因療法として、ミトコンドリアでの電子伝達系を補うためにコエンザイムQ10やビタミンEの抗酸化作用を持つ各種誘導体の開発が米国FDAの下で進んでいることが判ります。 FDAは、稀少難病薬指定をしているエジソン製薬のEPI-743(α-トコフェノールキノン:CoQ10類縁化合物)にEID(緊急時介入薬)としての承認をしました。本剤については、今年3月に大日本住友製薬が同社から製品導入し、リー脳症の治療剤として開発すると発表しています。 (西川伸一 ・ 田中邦大)
2013年8月28日
京都大学で生まれた稀少難病薬が一昨年に日米で発売されましたが、昨年はその売上が1,500億円に達して、2年目にしてブロックバスター入りしました。
フィンゴリモド(fingolimod)は、京都大学薬学部 藤多哲朗教授(当時)により冬虫夏草の成分を基に見出され、吉富製薬(現田辺三菱製薬)との共同研究・開発を経て、ノバルティス社(スイス)にライセンスされて多発性硬化症( MS)の治療剤として承認を受け2011年に発売されました。日本では、「イムセラ」(田辺三菱製薬)および「ジレニア」(ノバルティスファーマ)として、それぞれの独自商品名で共同販売されています。
多発性硬化症(患者会「MSキャビン」 http://www.mscabin.org/)は、感覚障害、視神経炎、運動麻痺などが認められる中枢神経系の炎症性脱髄疾患で、厚労省の難治性疾患克服研究事業において特定疾患に認定された130疾患に含まれる疾病で、国内における患者数は、約15,000人と代表的な稀少難病です。
本剤は、既存の治療薬とは異なる全く新しい作用機序(リンパ球上のスフィンゴシン1-リン酸受容体(S1P受容体)に作用して、自己反応性リンパ球の中枢神経系への浸潤を阻止し、その結果、多発性硬化症における神経炎症を抑制する) を持つ免疫調整剤の一種です。
藤多京大名誉教授の熱心なご尽力に加え、過去20年間内外製薬企業の合従連衡に耐えての厳しい開発業務の成果でしたが、残念ながら国内の製薬会社単独の発売とはなりませんでした。今年5月の田辺三菱製薬の「昨年度決算説明会」では、ライセンシーのノバルティス社から195億円のロイヤルティを得たと発表しており、一製品で得た収益としては同社として最上位クラスであったはずです。因みに、「イムセラカプセル0.5mg」は、1日1回経口投与で、薬価は8,172円/カプセルです(2011年11年25日の当初薬価収載時)。
その市場性のなさから、研究段階から見向きもされない稀少難病治療薬ですが、患者のためにリスクに挑戦して医薬品とすれば、企業にとっても十分利益になることが裏付けられました。この成功例に基に、大学の研究室での研究対象に加え、製薬会社や化学会社など他業種の研究室においても、難病治療薬にも目配りされ、その創薬の芽を見落すことなく、さらに開発に向けての検討がなされる契機となることを願っています。 (田中邦大)




