2024年9月28日
今日紹介するのは、スイス EPFL 、米国ペンシルバニア大学、クリーブランドクリニックなどが共同で9月24日 Nature に発表した論文だが、同じ号に CAR-T 治療を行った患者さんの予後調査を行い、導入した CAR-T 自体が IL-4 の作用を受けて2型に変化している場合に長期予後がいいことを明らかにした論文が、このグループから発表されている。
今日紹介する論文は、この結果を受けて、では IL-4 自体を CAR-T とともに使うことで、CAR-T の疲弊を抑えガンをより効率的に制御できないか調べた研究で、タイトルは「The type 2 cytokine Fc–IL-4 revitalizes exhausted CD8 + T cells against cancer(2型サイトカイン Fc-IL-4 は疲弊したガンに対する CD8 T細胞を再活性化する)」だ。
もう一つの論文でマウスを用いた研究も行って、2型サイトカインが CAR-T のキラー活性を促進していることを明らかにしているので、この研究ではストレートに CAR-T 治療の際 IL-4 を主要局所に注射して効果を調べる実験へと進んでいる。ただ、IL-4 の半減期が短いことから、免疫グロブリンの Fc を結合させて、体内で長期間作用できる IL-4 を実験に用いている。
効果は絶大で、腫瘍を植えた後、CAR-T 投与と同じ時から主要局所に2日ごと Fc-IL-4 を投与すると、局所の CAR-T の浸潤が高まり、CAR-T だけでは除去できなかったさまざまな腫瘍を完全に除去することができる。
免疫不全マウスに人間のガンと人間の CAR-T を投与する実験でも同じように効果を確かめることができる。
通常の CAR-T はサブセットの区別なく T細胞にキメラ抗原受容体遺伝子を導入するので、これまで CD8キラー細胞ではなく、これを助けるヘルパー集団に Fc-IL-4 が作用する可能性もあるが、さまざまな実験で、CD8T細胞に直接 Fc-IL-4 が働きかけること、特に抗原と反応して機能が抑制された細胞が IL-4 受容体を強く発現しており、Fc-IL-4 刺激により、BCL2 など生存シグナが再活性化され、キラー細胞として長期間働くことができることを明らかにした。
そして最後に、Fc-IL-4 が疲弊しかけた CAR-T を再活性化する機構を調べ、通常の IL-4 シグナルを伝達する STAT6 や STAT5 ではなく、インシュリン受容体と同じように PI3K-AKT を解するシグナルを通して、解糖系を活性化することで、疲弊しかけた CAR-T細胞を活性化していることを発見する。
結果は以上で、IL-4 という意外なサイトカインが CAR-T 増強因子としてクローズアップされた。アトピー治療に IL-4 を抑えることは行われているが、サイトカイン治療としては、IL-4 は遅れてきたサイトカインだと思うが、明日からでも臨床試験を始める意義は大きい(おそらくすでに進められているとは思うが)。現在 CAR-T 治療は固形ガンには有効性が低いこと、白血病に対しても半数以上で効果が短期で終わってしまう問題がある。その意味で、もう一つの論文で示された、CAR-T 生産課程で IL-4 で刺激すること、そして CAR-T 治療と共に腫瘍組織に Fc-IL-4 を注射する2種類の方法は試してほしいと思う。
2024年9月27日
我々の知性は経験によって形成されることで知性の普遍性が保証されるとするヒュームを評価しつつも、これに伴う独自の自己の消失という問題に気づき、自己を保持したままで、我々の経験は、経験以前の先験的枠組みを通ることで、普遍性を獲得すると考えたのはカントだ。「生命科学の目で読む哲学」では彼の哲学を脳科学の視点で扱おうと1年以上格闘しているが、彼が先験的な認識の枠組みとして示した空間と時間を我々の脳がどう処理しているのか、研究が進んでいる。
今日紹介するカリフォルニア大学ロサンゼルス校からの論文は、我々の前を通り過ぎるイベントに特定のルール(順番)に基づく時間制を与えたとき、それは神経細胞レベルでどう処理されているのかを調べた研究で、9月27日 Nature にオンライン掲載された。タイトルは「Human hippocampal and entorhinal neurons encode the temporal structure of experience(人間の海馬と嗅内野は経験の時間的枠組みをエンコードする)」だ。
タイトルを読むと、まさにカントの純粋理性批判の課題そのものといってもいい。しかも動物実験ではなく、人間の脳内電極を用いた研究であることが重要だ。さて、この研究が採用した課題について説明する。幸い、この論文はオープンアクセスになっているので、図の一部を拝借することにした。
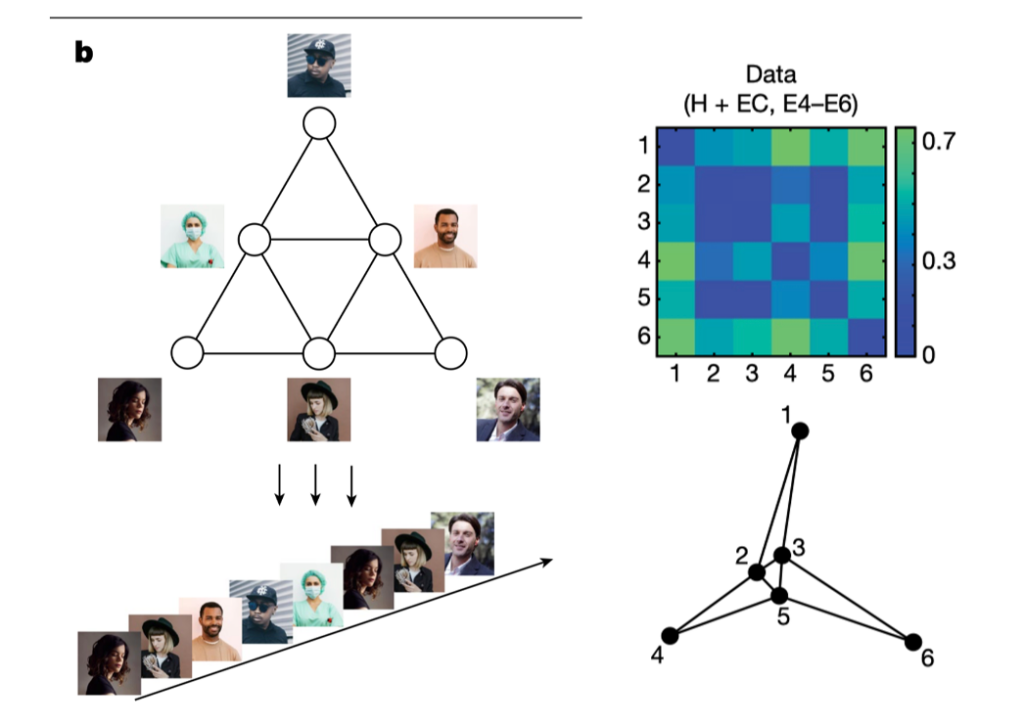
右の図が課題で、研究参加者にまず多くの写真を見せその中から反応の強い写真を6枚選ぶ。その写真を上に示したピラミッド上に配置して、例えば左下の女性から順に、ピラミッド上で直接つながっている写真を見せていくことで、このピラミッド構造が頭の中に形成されるかどうかを調べている。
最初はランダムに写真を見せると、当然それぞれの写真に反応する神経だけが興奮し、他の写真に反応する神経は特別興奮することはない。ところが、ピラミッド構造に従って写真の順序を決めて提示していくと、徐々に一つの写真を見せたときその神経だけでなく、直接つながる写真に反応する神経も興奮するようになる。そして、このようなしっかりした構成が海馬と嗅内野に形成されたあと、またランダムに写真を見せると、最初と異なり構造の影響をそれぞれの神経興奮に見られる。ただ、面白いことに本人に写真の見せ方にパターンがあるかと聞くと、特にないと答えるので、このピラミッド構造は脳内に描かれていても、経験として認識されていない。ただ、我々の経験のための枠組みとして存在している。
このような構造が頭の中に形成されたあと、今度は写真を見たときの神経興奮から、その構造を計算してみると、右図にあるような完全にピラミッドではないが、順番については正確な構造が浮き上がる。これは中間に存在する写真は、並べていくときに当然現れる頻度が高いために、興奮動態が変化することで起こると考えられる。
さらに、海馬や嗅内野にこのような構造が形成されるが、海馬の構造と比べ、嗅内野の構造は比較的安定に維持されることがわかる。しかも、写真を示さないときも、この構造を維持するために繰り返し構造が頭の中で無意識に再現されていることもわかる。そして、これらの構造が、写真を見るとき暗黙の枠組みとして次に現れる写真を予想する役割があることが示された。
以上、経験(何がいつどこで)が空間化されて海馬や嗅内野で表象されていく。一度時間や空間を人間がどう表象しているか、まとめてジャーナルクラブを行おうと考えている。
2024年9月26日
様々な食品には、我々が作れないミクロニュートリエントが含まれており、その中の一部は身体に良いとして摂取を勧められる化合物も多い。これらを xenobiotics と呼んでおり、そのまま訳すと異物になるが、ポリフェノールやイソフラビンといったよく知られた化合物から人工甘味料として使われているステビオサイドまで、多種多様な Xenobiotics が存在する。これらはほとんど我々が日常食べている食品に含まれているため、わざわざサプリメントでとらなくとも毎日摂取している化合物だ。
今日紹介するイェール大学からの論文は、 多種多様なXenobiotics が、私たちの身体だけでなく細菌叢にも影響し、さらには Xenobiotics 自体も細菌叢で変化する可能性があり、このような場合には毒性を発揮するのではと着想し、150種類の Xenobiotics と細菌叢の関係を調べた研究で、9月24日 Cell にオンライン掲載された。タイトルは「Microbial transformation of dietary xenobiotics shapes gut microbiome composition(細菌叢によるXenobioticsの変化は細菌叢の構成を変える)」だ。
この研究では Xenobiotics の我々の身体に対する影響は無視して、複雑な細菌叢に対する影響に絞って調べている。まず、我々が日常接する22種類の Xenobiotics に絞り、それをヒト細菌叢に加えたとき、Xenobiotics はどのように変化するかを調べることで、多くの Xenobiotics が様々な修飾を受けることを確認している。
また、ヒト細菌叢の中から26種類のバクテリアを選び、修飾された化合物も含めて、161種類の Xenobiotics を培養に添加して、それぞれの増殖に対する影響を調べ、細菌の増殖を強く抑制できる Xenobiotics が存在することを確認している。
このように Xenobiotics が抗菌物質と同じように特定の細菌の増殖に影響があることを確認した上で、これらが細菌叢そのもののエコロジーを決める可能性に絞って研究を進めている。実際、ヒト細菌叢全体を培養して単独の細菌への影響が確認された化合物を加えると、ものによっては大きく多様性が変化することを確認し、Xenobiotics が細菌叢の構成を調整している可能性を確認する。しかも、それ自身は細菌の増殖に影響なくても、細菌叢自体により代謝変化を受け毒性が高まり、細菌叢の構成を変える化合物が存在することを確認する。すなわち、ある細菌により変化指された Xenobiotics は他の細菌の増殖に影響し、さらにそれを代謝する細菌がこの栄養を和らげる、といったダイナミックな相互作用が存在することを確認する。
そこで、この代表としてブドウに含まれるポリフェノールの一種のポリダチン、柑橘類の皮に含まれるポリフェノールの一種ヘスペリジン、そして人工甘味料として使われる菊科植物ステビアに含まれるステビオシドの3種類を選んで、細菌の種類を限定した培養で、細菌同士の相互作用に関わる可能性を探るモデル実験を行っている。選ばれたそれぞれの化合物はそれ自身では毒性がない。しかし、ここから糖鎖が除去されたアグリコン構造はバクテリアによって毒性が出る。すなわち、バクテリア同士が Xenobiotics を介して相互作用する可能性を調べる格好のモデルとなる。
期待通り、それぞれの化合物をアグリコンへと転換する酵素を持った細菌が存在すると、細菌叢の中の特定の細菌の増殖が強く抑えられる。しかし、そこにアグリコンを代謝してしまう細菌が存在すると、この毒性が消える。
このようなモデル実験を繰り返し、代謝に関わる酵素を特定した上で、ヒト細菌叢を移植したマウスを用いて、ブドウに含まれるポリフェノールポリダチンを投与する実験を行い、モデル事件通りの動態をマウス内でも観察できることを示している。
以上が結果で、我々が身体に良いとして摂取を進める多くの物質も、細菌叢のことをカウントして考えないと、ほとんど意味がないか、場合によっては良くない結果につながる可能性を示唆している。その最大の例が、人工甘味料は細菌叢が代謝して、結果として糖尿病のリスクになるという論文だろう(https://aasj.jp/news/watch/2190 )。細菌叢はもう一つの自分だと思うが、なかなか言うことを聞かない自分だ。
2024年9月25日
臨床の調査研究は、十分な数と正しい統計学的手法を用いて行って初めて結論が出るが、調べてみようという気持ちを後押しする気づきが存在することが多い。すなわち、統計学的には優位といえないが、気になる結果を示す調査研究が存在し、米国医師会が発酵する JAMA Network Open というフリーアクセス雑誌にはそのような論文が掲載されており、気づきという面では面白い。特に9月号では、強く興味を引かれた論文が2編発表されていたので紹介する。ただ統計学的には問題があることは断っておく。
最初の論文は心室細動 (VF) と脈が触れない心室頻拍 (pVT) に対する AED 処置の際、電流を流す2枚のパッドをどこに置くのがいいかという研究だ。
恥ずかしいことに AED を使うときパッドは右前胸部と左側胸部 (AL) だけと思っていたし、おそらく我が国の AED はそのように明確に指示されている。ところが実際には AL だけでなく心室部位の前後に設置する方法 (AP) もあるようで、米国では場所によって両方の可能性が示されており、さらに AL で3回ショックを与えてうまくいかないときには AP に変えるという指導もされているようだ。
この研究では VF と pVT で救急出動した255例で、救急隊員が AL、AP どちらを使ったかで循環が回復する確率を調べている。VF の場合救急車が駆けつけるまでは持たないと思うが、到着前に AED が一般人によって行われたケースが37例存在する。驚くのは、一般人が AED を行った場合は AP の方が AL より多いことだ。
いずれにせよ、調査は救急隊員が行った AED 処置時のパッドの位置が対象で、症例数が少ないので有意差と結論できないが、明らかに AP 設置の方が循環回復頻度が高い。特に体重が増えた場合、AP ではほとんど影響を受けないが、AL では体重が増えるとともに循環回復率が低下する。
AED が開発されたとき、AP、AL が比較され、ほとんど有意差がないとして、日本やヨーロッパでは AL のみ指示するようになっている。しかし、このように詳しい調査を繰り返すことは重要で、せっかく設置した AED を有効活用することが重要だと思った。
2番目の論文はニューヨークで進行中の自閉症スペクトラム (ASG) コホート研究で、Covid-19 前後に生まれた子供たちの比較、そして Covid-19 パンデミック中に母親が CoV2 に感染したケースとしなかったケースでの自閉症発症率の比較だ。
まず、Covid-19 パンデミック前と後で、ASD の発症率は変わりがない。驚くことに、パンデミック中に生まれた子供の ASD 発症率が、感染した母親からの子供の方で半減しているという結果だ。
対象の人数の問題で、もっと広範な研究が必要になるが、これが正しいとすると妊娠中のウイルス感染は必ずしも ASD 増加につながらないとする初めての結果だ。全く予想外の結果で、驚いた。
この研究は幼児期のスクリーニング結果だが、例えば我が国では子供が目にする家族以外のほとんどがマスクを着用している状況で育っており、このような環境変化の ASD 発症率に及ぼす変化も今後調べる必要があると思う。
2024年9月24日
大学で医学を学び始めてからもはや60年以上になろるが、それまで全く聞いたこともなかった細胞があることに気づかされることがしばしばだ。これは、我々の身体が細部に至るまで精巧にできており、場所場所に機能が特化した細胞を分化させていることを示している。
今日紹介するカリフォルニア大学サンフランシスコ校からの論文も、全く初耳の細胞 cerebrospinal fluid-contacting neuron (CSF-Ns) の機能についての研究で、9月18日 Nature にオンライン掲載された。タイトルは「Endogenous opioid signalling regulates spinal ependymal cell proliferation(内因性のオピオイドシグナルが脊髄の上衣細胞増殖を調整する)」だ。
脳脊髄液を通す脊髄内の回路の一つが脊髄内の中心管で、回りは上衣細胞によって取り囲まれている。この上衣細胞ライニングに割り込むように存在しているため cerebrospinal fluid contacting と名前がついたのが CSF-Ns で、鼻粘膜に存在する嗅覚細胞に似ている。ゼブラフィッシュでは脊髄の曲がりを検知して運動調節に関わる可能性が示唆されるが、脊髄を動かして運動をしない動物での機能はわかっていない。
この研究では、この細胞を特異的に染色する方法を追求し、最終的にこの細胞を脊髄から純化することに成功し、RNA発現解析からこの細胞が κオピオイド受容体を発現していることを突き止めている。次に、この受容体に結合するオピオイドの発現を探り、隣接する上衣細胞がディモルフィンをはじめとするいくつかのペプチドを発現し、κオピオイド受容体を刺激することを発見する。
脊髄組織を切り出して、CSF-Ns の興奮を生理学的に調べ、この細胞が上衣細胞から分泌されるオピオイドにより常に刺激されていること、この自然興奮反応を κオピオイド受容体阻害剤で抑えることができることを明らかにしている。一方刺激剤では自然発火は上昇しないので、上衣細胞からのオピオイドから十分な刺激が常に提供されていることを明らかにする。
次はこの自然興奮の機能だが、上皮との密接な関係から、CSF-Ns の自然興奮が上衣細胞の増殖を調節しているのではと着想し、CSF-Ns を除去、あるいはオピオイド受容体の阻害実験を行い、CSF-Ns が上衣細胞の増殖をGABA分泌を介して抑制しており、この経路が抑えられると上衣細胞の増殖が上昇することを発見する。
上衣細胞は脊髄損傷時に増殖することが知られているが、このときオピオイドシグナルを刺激剤で活性化すると、上衣細胞の増殖が抑えられる。すなわち損傷時に上衣細胞の増殖が高まるのは、損傷によりCSF-Ns からの抑制が外れることが一部寄与している可能性が示された。
そこで、脊髄損傷後長期にわたってオピオイドを接種させ脊髄組織と機能を調べると、刺激剤により上衣細胞増殖は抑えられ、損傷後の瘢痕も抑えられる。ただ、このままでは運動機能は何もしないで瘢痕形成が起こるマウスと比べると、明らかに低下する。
以上が結果で、オピオイド刺激剤や阻害剤をうまく使って脊髄損傷の瘢痕化を一定程度抑制して再生を促すという実験があるかと期待したが、残念ながら示されていない。ただ、少なくともオピオイドで調節可能な脊髄損傷治癒過程があることは間違いなく、炎症抑制とともに今後重要な標的になると期待する。
いずれにせよ、新しい細胞を一つ勉強できた。
2024年9月23日
複製開始点を特定する研究は様々な方法を用いて行われ、これまで数多くの論文が報告されているが、どうしても増殖を観察しやすい培養細胞か、あるいは胎児期の細胞に限られていた。今日紹介するジュネーブ大学からの論文は、マウスの肝臓部分切除後の再生モデルを用いて正常肝細胞が増殖するときの複製開始点を調べた研究で、9月17日 Cell にオンライン掲載された。タイトルは「In vivo DNA replication dynamics unveil aging-dependent replication stress(生体内での複製動態は老化に伴う複製ストレスを明らかにする)」だ。
大腸菌と違って、我々の大きなゲノムは様々な場所から複製を一回だけ開始する機構を備えており、そのときに複製が開始される場所を複製開始点と呼んでいる。この複製開始点は、完全に決まっているわけではなく、細胞に応じて開始点がきめられる。この論文では、肝臓再生の現場でどう複製開始点が決まるかをまず明らかにしようと実験を進めている。
まず、肝臓再生時の複製開始点を正確に割り出すための技術的検討を行っている。開始点を決定するための様々な方法があるが、この研究では DNA 複製時に取り込まれるEdU と 複製フォークを抑える hydroxyurea を組み合わせ、EdU でラベルされた DNA の配列を決め、ラベルされた配列の中から開始点をピンポイントで特定するデータ処理を合わせて、最終的に3517の開始点を特定している。
この開始点は一定の間隔で存在するものではなく、短いストレッチにいくつもの開始点が存在する場合もあるし、また長いストレッチに一つしかない場合もある。そして、最も重要なことは、4匹のマウスを比べると、ここのマウスでほぼ同じ開始点を使っていることがわかる。すなわち、肝細胞では開始点はほとんど変化しない。
細胞は分裂しながらも、そのアイデンティティーを守り生きて行く必要がある。そのためには転写が必要だが、この転写と複製がかち合うと DNA のストレスが生じ変異が起こる。そこで、肝再生時に転写される遺伝子と複製開始点との関係を調べている。
まず肝臓で転写されている遺伝子に近い開始点は早期に複製が始まる。すなわち、転写と複製がうまく調整されている。さらに調べていくと、転写される遺伝子の開始点はほぼ例外なく、遺伝しないには存在せず、転写開始点の 10−50Kb 上流か、転写終了点の 10-50Kb 下流に存在しており、まさに転写と複製がかち合わないような開始点の選び方ができている。これを人間の細胞で調べてみると、ほぼ同じことが観察され、進化的にも細胞ごとの開始点の選び方は保存されている。
面白いことに、DNA 複製ストレスがおこるよう hydroxyurea 処理を繰り返すと、それまで活性化されていなかった開始点が活性化する。そして、ストレスを関知する ATR分子を阻害すると、多くの開始点が新たに動員されてします。
次に老化マウスで同じ実験を行うと、今度は開始点がうまく働かないものが増えることがわかる。その原因を探ると、おそらく開始点近くで DNA 損傷が蓄積していたため、そこで複製ストレスが起こるためである可能性が強い。これは肝臓や神経のようにほとんど増殖しない細胞に特徴的だと考えられる。実際、このストレスを関知する ATR 分子を阻害すると、開始点の欠損は見られなくなる。このようなストレスが、細胞老化だけでなく、自然炎症を誘導し全身の老化に寄与する可能性も示している。
以上が結果で、転写と複製が本当にうまく制御されていることがよく理解できる論文で、一読を勧める。
2024年9月22日
K-RAS (G12C) 変異体特異的な薬剤(ソトラシブ)が開発されて以来、新しい阻害剤の開発が相次いでいる。なかでもほぼ全ての RAS に結合する化合物と、タンパク質機能抑制するイムノフィリンに結合する化合物を連結して RAS 機能を抑える薬剤(https://aasj.jp/news/watch/22741 )は第二相の治験に進んでおり、また我が国の中外製薬が開発した環状ペプチドを用いて RAS の動きを抑え込む薬剤(https://aasj.jp/news/watch/23613 )も治験が行われている。もちろん結果次第だが、様々な RAS 阻害剤が市場に出回り、どれを選ぶか困るといったうれしい悲鳴も何年か後には実現するのではと期待している。
今日紹介するべーリンガーインゲルハイム社研究所と英国 Dundee 大学からの論文は、上記に加えてプロタック法と呼ばれる、RAS にユビキチンリガーゼをリクルートして、RAS 自体を細胞内で分解してしまう方法の開発で、9月20日後 Science に掲載された。タイトルは「Targeting cancer with small-molecule pan-KRAS degraders(全KRASを分解する小分子化合物でガンを狙い撃ちにする)」だ。
プロタックと呼ばれる標的分子を特異的にユビキチン化(分解のための印)して分解してしまう薬剤は骨髄腫に対するサリドマイド型薬剤を皮切りに、新しい標的に対する化合物の開発が進んでいるが、開発スピードは予想より遅いような気がしている。おそらく2種類の分子に別々に結合する必要があり、分子量がどうしても大きくなり、薬剤動態などをコントロールしにくいかもしれない。
それでも KRAS に対する阻害剤が開発されてきた今、この阻害剤を起点にプロタックに仕上げて、標的分子をより確実に制御しようと製薬会社が考えるのは当然で、この研究ではすでに開発してきた全ての変異KRAS に結合する BI-2865 を VHL と結合する VH032 という薬剤を結合させた化合物を起点に、より効果の高い薬剤開発を目指す、創薬企業ならではの研究だ。
VHL は腎臓ガンのドライバーとして知られているが、定常状態で酸素により水酸化された HIF分子の分解に関わることが知られている。この研究では VHL をユビキチンリガーゼとしてリクルートする方法を選んでいるが、他のリガーゼではなく VHL にした理由はよく理解できない。
いずれにせよ、まず KRAS (G12D) 結合化合物を、VJ032 と結合しやすいように至適化し、VO032 が結合しない単純な阻害剤と比べて、高い持続的効果が細胞レベルで得られることを確認したあと、X線回折や、クライオ電顕を駆使した構造解析を元に、さらに G12D だけでなく他の変異にも対応できるように分子設計を進め、化合物4と、VO032 の結合していない化合物5を作成、両者を細胞レベルで比較して、プロタックにすることで RAS阻害剤単独より高いガン抑制効果が得られることを確認している。また、3300種類の細胞株を調べ、化合物4は変異のタイプを問わず KRAS特異的に増殖を抑制することを確認している。
一方で、大きな分子にすることで細胞の分子くみ出し機構に検知され、細胞内からすぐにくみ出されて効果が出ない細胞株の存在も明らかになった。
最後に生体内投与後の安定性を高めるための有機化学的変更を加えて ACB13 と名付けた化合物をガンを移植したマウスに投与する実験で調べ、腹腔注射で治療効果があること、しかしまだガンによっては分子くみ出し機構により効果が見られないことも明らかにしている
結果は以上で、KRAS に対するプロタック薬が可能なことはわかったが、本当にプロタックの問題を全て解決できるのか、またサリドマイド系薬剤のように経口投与可能な薬剤に発展できるのかは、素人の私に判断できない。しかし、是非 RAS 阻害剤競争を賑わせてほしい。
2024年9月21日
セマグルタイドをはじめとするGLP-1アナログは、2型糖尿病だけでなく一般的な肥満にも安全で効果があることが発表されると(https://aasj.jp/news/watch/19826 )、少しでも痩せたいという多くの心を捉え、疾患治療の枠を超えて一般に提供されている。もちろん医師の診察が必要な処方薬なのだが、オンライン診療の衣を着て、診察なしに薬剤を提供することが広く行われるようになっているようで、製造元の製薬会社も困惑している。例えば Google でセマグルタイドと検索すると、多くのオンライン診療サイトの中で堂々トップに来るのが elife というサイトで、日本から GLF-1 アゴニストを外国にまで送っているようだ。
このように医師のコントロールを離れて治療薬が拡大するのはゆゆしき事態といえるのだが、病気の定義を広げて治療対象にしてきた医学側にも責任があると思う。その意味で今日紹介するミネソタ大学からの論文は、12歳以下の小児の肥満に GLP-1 阻害剤を用いて治療する治験研究で、小児の肥満にもこの治療が効くことはわかるが、ここまで治療対象を広げていいのか心配になる研究だ。タイトルは「Liraglutide for Children 6 to <12 Years of Age with Obesity — A Randomized Trial(6歳から12歳までの肥満の小児に対する Liraglutaide ― 無作為化治験)」だ。
GLP-1 アナログを使用する年齢を下げられないかという治験はかなり以前から進んでおり、2020年3月、同じグループが12歳以上18歳までの肥満児を対象に Liraglutide 治験を行い、やめるとリバウンドはあるが効果が見られることを、同じ The New England Journal of Medicine(382:2117,2020)に発表しており、この延長でさらに対象年齢を下げたのがこの研究になる。
毎日皮下注射を自分で行うというのは小児には大変な作業だと思うが、semaglutide のような長期効果(1週間に一回の注射でいい)があると、いざというときに薬の作用を避けることができないことから、作用が持続しない Liraglutide を用いているのだと思う。最初 0.6mgから徐々に容量を上げて1日3mg を56週間続け BMI の変化を最も重要な指標として追跡している。
この治験では、全ての肥満児に薬剤治療だけでなく、生活指導も行い、最終的には薬に頼らない改善を目指しており、成人治験とは違った配慮が見られる。
当然と言えば当然の結果で、最終時点で BMI が 5.8%低下し、正常児の平均に近づくことができている。一方で、コントロールグループは生活指導の効果はあるが、それでも BMI は開始時と比べて 1.6%上昇していることを考えると、トータルで 7%近い改善が見られたことになる。
残念ながらリバウンドも早い。投与をやめてから半年後には BMI は 0.8%低下と戻ってしまっている。それでもコントロール群は 6.7%のゲインと大きく上昇しているので、良くなったと判断はできるが、長期に追跡しないとわからない。
これも当然のことながら嘔吐などの消化器の副作用はほとんどの子供で発生し、最終的に10%がドロップアウトしている。
血圧や、HbA1c の改善がある程度見られているが、治療前の数値は特に病的ではないので、これが将来の様々な生活習慣病リスクを下げるかどうかはわからない。
以上が結果で、確かに効果はあるという結論だが、糖尿病など明確な問題がない肥満児を対象にこの薬剤を本当に使っていいのか、読んだ後疑問に思った。まず BMI だけでどこまで将来を予測できるのか、さらにリバウンドがあるからとずっと続けていいのかなど素朴な疑問が生まれる。現在さらに新しい対象をリクルートして治験は拡大しているようだが、おそらく一番大事なのはさらに長期に追跡して、小児期の治療効果を検証することではないかと思う。最終的に子供の肥満の治療として認めるのは、その結果が明らかになるずっと先でもいいのではと思う。
医学は治療の対象を拡大して今や肥満がその対象になった。ただ、一般の人の頭の中では病気治療とダイエットの区別がつかないという混乱が生じてしまっている。この混乱が子供と父兄にまで拡大し、オンライン診療で GLP-1 アナログが処方されることは避ける必要がある。
2024年9月20日
現在前立腺ガンなどには、高線量率小線源療法(ブラキセラピーと呼ばれている:BT) が行われる。この方法は腫瘍内に小線源を埋め込むことで、周囲の正常組織への放射線影響を抑えようとするもので、当然ガン組織内でも線量の違いが生じる。
今日紹介するウィスコンシン大学からの論文は、BT が免疫チェックポイント治療(ICI)と相性がよく、その理由がガン組織の放射線量に違いが生じることでガン組織に異なる免疫環境が作られることを動物実験で示した研究で、9月18日 Science Translational Medicine に掲載された。タイトルは「Intratumoral radiation dose heterogeneity augments antitumor immunity in mice and primes responses to checkpoint blockade(腫瘍内の放射線量の不均一性がマウスの抗ガン免疫を高め、チェックポイント治療効果を高める)」だ。
この研究では一般の均質な放射線照射 (EBRT) や BT 、そして ICI 単独では治療が難しいことがわかっているガンを移植したマウスに、様々な線量の BERT や BT の放射線治療と ICI を組み合わせたときにガン抑制効果が得られないかを調べ、BT と ICI を組み合わせたときだけ絶大な効果が生まれることを発見する。このとき、BT の線量は多すぎると併用効果が低下する。
この原因がガン組織内の線量の不均質性によるのではないかと考え、線量と腫瘍環境の遺伝子発現を調べると、遺伝子発現パターンが線量を反映し、BT では線源からの距離に応じて遺伝子発現パターンが異なっていることを確認する(組織上での遺伝子発現ライブラリー作成方法まで用いて放射線の量と組織反応の相関性を示している)。
どの遺伝子がどこで発現しているのかなどの詳細は全て割愛して紹介するが、要するに低い線量部位が存在することが重要で、そこではキラー細胞やヘルパー細胞が集まり、逆に抑制性T細胞は減る腫瘍組織が成立している。逆に、高線量領域では抑制性T細胞が増えて、キラー細胞やヘルパーT細胞が減っている。
BT と ICI で誘導されたガン免疫には CD8T細胞と CD4T細胞の両方が必要で、これは局所での反応がリンパ組織で免疫記憶へと発展する必要があるためで、脾臓の CD8T細胞のインターフェロンγ分泌が BT と ICI で最も高い値になることを示している。
この論文で示された免疫系やサイトカインの解析は、著者独自の解釈が多くわかりにくい。しかし、これら分子機構の集まった結果としてのガン免疫成立を指標としてみると、ガン組織が暴露される線量の不均一性が存在する BT の方が ICI との相性がいいという結果は、極めて面白い。ガンを殺すために、どうしても必要な線量を照射することは当然のことだが、一部低線量部位を残すことで、ガン免疫を育てていけるという話だ。とすると、例えば別々の場所で増殖する転移性のガンを使って、両方とも低線量で免疫を育てた方がいいのか、あるいは片方は高線量、片方は低線量照射して ICI と組み合わせた方がいいのかといった実験は重要になる。もし一部の組織に低線量で照射することが最も重要なら、放射線治療を諦めた場合でも、一部の転移巣に低線量照射を行い、ICI と組み合わせることで免疫を高めることができる。もしこれが正しいとすると、BT だけでなく EBRT でも同じ結果が得られるかもしれない。まだまだ臨床に即した実験を期待したい。
2024年9月19日
TGFβ はガン転移を誘導するシグナルとして広く知られている。このメカニズムについて我々のレベルでは、TGFβシグナルは転移につながる上皮間葉転換(EMT)やマトリックスの繊維化を促進し、ガンの転移を促進するで終わっているが、もちろん専門家は膨大なエネルギーを使ってさらに分子間相互作用を追求する。
今日紹介するスローンケッタリング癌研究所 J.Massague 研究室が9月6日 Cell にオンライン発表した論文は、プロの研究を学べる格好の論文で、TGFβ が Ras をドライバーとする肺ガンの転移を誘導する詳細なメカニズムを理解することができた。タイトルは「TGF-β and RAS jointly unmask primed enhancers to drive metastasis(TGFβ と RAS は協力してあらかじめ決められたエンハンサーの抑制を外して転移を促進する)」だ。
J.Massague は TGFβシグナル研究のトップを長く走ってきた大御所で、我々が単純に RAS = ガンドライバー、TGFβ = 転移 と分けて考えてしまっているのを、なぜ RAS をドライバーとするガンが TGFβ で転移するのかという統合的問題として設定し、この問題から始めている。
膨大な仕事で、SMAD の機能から構造まで熟知していないと思いつかない実験が行われており、まず紹介しきれないので、明らかになった結論について一つ一つ解説する。
まず、RASドライバーの TGFβシグナルに関わる役割だが、RREB1 と呼ばれる転写因子が RASシグナルにより活性化されることで初めて TGFβ 下流の転写が始まる遺伝子群が存在し、これらが EMT や線維化に関わる遺伝子を誘導するのに必須であることを明らかにする。
次に RREB1 の役割をゲノム上の結合部位を探索して調べると、TGFβシグナルを下流の SMAD2/3 が結合するエンハンサー部位近くに存在して、SMAD2/3 が結合すべきエンハンサー部分を指定する役割があることがわかる。すなわち、RAS によりRREB1 がまず一部の SMAD 結合部位に結合して、閉じられていたクロマチンを SMAD 結合可能にする役割があることがわかる。
次に、RREB1 下流で SMADリクルートに関わるさらに詳しい分子メカニズムを調べる目的で、まず RREB1 に結合するタンパク質を82種類を特定、クリスパーノックアウトスクリーニングにより DHX9 と INO80 と名付けられたタンパク質が、RREB1 が SMAD結合部位を指示するために必須の分子であることを明らかにする。
続いてそれぞれの分子の SMAD との関わりを調べると、DHX9 は SMAD3 と、INO80 は SMAD4 と結合していることが明らかになった。SMAD3-DHX9、SMAD4-INOX80 は TGFβシグナル下流で複合体を形成し、この複合体を形成することで RREB1 が指示するエンハンサー部位へリクルートされることがわかった。
次に、INO80/SMAD4 の機能について調べているが、SMAD4 は転移に関わると言われていたがそのメカニズムはわかっていなかった。Massague は SMAD4 が他の SMAD と比べ少し異なる構造を持っており、この部位に INO80 が結合すると着想し、INO80 と SMAD4 の結合部位を初めて決めることに成功している。SMAD構造を熟知したまさにプロの目を感じる。そして、INO80/SMAD4 は転写因子として働くのではなく、RREB1結合により指示された部位の転写を抑制しているヒストン構造を除去して、DHX9/SMAD3 がエンハンサー部位に結合できるように準備することを明らかにしている。
最後に DHX9/SMAD3 は、アクセス可能になった DNA結合部位と結合して、ヒストンアセチル化酵素CBP をリクルートし、転写を活性化する。
以上さすが Massague と感心する研究で、是非自分で読んでみてほしい。