2025年8月27日
Gene meltingというと古い世代は二本鎖が熱で解離して一本鎖になることを考えてしまうが、2021年、ドイツ ベルリンにあるマックスデルブリュックセンターのグループはこの言葉に新しい定義を与えた。神経細胞の分化に伴う大きな転写調節の変化を正確に捉えるため、分化各段階の核を取り出して領域間の結合性を調べる方法で、分化に伴いTADと呼ぶ区切り(https://aasj.jp/news/watch/3533 参照)が維持できずに溶けたように見える現象、即ち遺伝子コンパートメントが失われリラックスすることを gene melting と名付けた。
この時から4年を経て、今日紹介する米国クリーブランドのケースウェスタン大学からの論文は、TADではなくSox6遺伝子のゲノムとの結合様態から同じように gene melting が観察できることを示した面白い研究で、8月25日号の Cell に掲載された。タイトルは「Transient gene melting governs the timing of oligodendrocyte maturation(一過性の遺伝子メルティングがオリゴデンドロサイト成熟を調節している)」だ。
研究自体はオーソドックスな淡々とした細胞分化研究と言える。iPS細胞からオリゴデンドロサイト前駆細胞 (OPC) 、未熟オリゴデンドロサイト (IO) 、そしてミエリン合成を行う成熟オリゴデンドロサイト (MO) を誘導し、この分化を決めている転写因子を調べる目的でスーパーエンハンサーを形成している領域などについて調べ、OPCからIOではSox6がスーパーエンハンサー支配下にある重要な共通遺伝子で、MOになると発現が抑えられる事を確認する。さらに、この分化の過程で発現しSox6の転写後の調節に関わる数種類のmiRNAの発現が成熟に伴うSox6の抑制に関わることを明らかにし、Sox6のかなり複雑な発現様態が分化をコントロールすることを明らかにしている。
ノックダウンやノックアウトを用いて遺伝子発現を止めると、成熟が進みミエリンが合成される。ただ、オリゴデンドロサイトのアイデンティティーを決定するわけではない。すなわち、Sox6はオリゴデンドロサイトの未熟性を維持する役割を演じていることがわかる。
そこでSox6に結合している遺伝子領域を免疫沈降法を用いて調べると、OPCでは細胞分化に関わる重要な遺伝子を調節しているスーパーエンハンサー内に参加し、特定の調節領域を標的に結合が見られるが、IOの段階になるとスーパーエンハンサー内での結合が外れて、それまで支配していた遺伝子全体に広がって結合することを観察する。即ち、構造化されたエンハンサー内のSox6が溶けるように遺伝子全体に広がることを観察し、これこそが gene melting だと考えた。
Atac-seq を用いてクロマチンの状態を調べると、Sox6が溶けるように広がった遺伝子領域は染色体構造が開いており、また転写マシナリーがアクセスしやすくなっていることを発見する。そして、こうしてSox6が結合する遺伝子のほとんどはオリゴデンドロサイトの分化を未熟状態に置くために必須の遺伝子である事がわかる。即ち、Sox6はIOでは未熟性を保つための遺伝子全体に結合して、クロマチンを広げて転写を維持するのに働いていることがわかる。
その後、何種類ものmiRNAが発現しSox6のmRNAを抑制し始めると、Sox6結合が解消してクロマチンが閉じ、この結果未熟性がないMOへと分化し、ミエリンを作り始める。
以上が結果で、未熟な間はミエリンを作らせずに機動性を重視するため、未熟性を維持する面白い機構として gene melting が使われていることがわかる。TADは調べていないので、マックスデルブリュックセンターが定義した gene melting と完全に一致するかはわからないが、Sox6が全体に溶けるように結合しており、そこに様々な調節領域がアクセスするとTADも溶けてしまうように見えると思う。
この研究はこれで終わらず、多発性硬化症でオリゴデンドロサイト増殖が繰り返し刺激されることで完全な成熟が止まってしまうという現象を捉え、この時Sox6を抑制してやることで成熟を誘導しミエリン合成を促進でき、病気を抑えられる可能性まで示している。また、スーパーエンハンサーとの関係で gene melting が存在するとする考えは gene melting の意義を広げると思う。
2025年8月26日
様々な細胞系列へと分化できるiPS細胞は、実験的進化研究の重要な土台になる。特に古代人も含めて全ゲノムデータが揃ったおかげで、ゲノムレベルの進化を実際の細胞で確かめたい時にはほとんど必須のツールになりつつある。とはいえ、この方法は脳進化によく用いられるようになったが、他の臓器はまだまだ利用が進んでいない。
今日紹介するデューク大学、ミシガン大学、そしてバーゼル大学が共同で8月21日号 Science に発表した論文は、これを腸管上皮の進化について行った研究で、タイトルは「Recent evolution of the developing human intestine affects metabolic and barrier functions(人間の腸管の最近の進化は代謝とバリアー機能を変化させた)」だ。
以前チンパンジーとヒトの脳の大きさの違いの背景について研究した論文を紹介したが(https://aasj.jp/news/watch/26767 )、方法は少しづつ違うが枠組みは同じなので参考にしてほしい。
この研究でもまずヒトの腸管上皮の単一細胞レベルの遺伝子発現から、様々な細胞の特徴的な遺伝子セットを特定し、2つの種で起こったアミノ酸変化のない変異と、アミノ酸変化のある変異の比を計算して、アミノ酸変化のある変異の多い強く選択された遺伝子をリストするとともに、それぞれの遺伝子の調節領域の変異を調べる方法を組み合わせて、調節領域のサルからヒトへの変化もリストしている。この領域特定には教師付のAIが役に立つことも示している。
次に、ヒトのiPS細胞から腸管オルガノイドを作成し、まだ未熟な部分をマウスの腎被膜下に移植する方法で成熟させる方法を開発し、これにより誘導される腸管上皮がほとんど正常と変わらないこと、そしてこの細胞を用いてsingle cellレベルの遺伝子発現テストが可能なこと、そして遺伝子調節領域、特にエンハンサー活性を蛍光遺伝子を指標に調べられることを確認している。
そのあと、同じ方法でチンパンジーiPS細胞から腸管オルガノイドを誘導し、組織形態、遺伝子発現、クロマチン状態などから正常の腸管上皮に近いことを確認している。
その上で、ゲノム発現量、クロマチンの変化を調べる Atac-seq などによる解析と比較を行って、それぞれの細胞の違いを明らかにした結果、
マウスも含めて比較したとき、ヒトへの進化だけで大きく変化する遺伝子が数百種類存在すること。
その中で選択圧にさらされ進化してきた遺伝子が40種類ほど存在し、バリア機能や脂肪吸収に関わる遺伝子の大きな変化が見られること。
などを示すリストを作成している。
その上で、いくつかの遺伝子について特定した調節領域の変化がオルガノイド実験系で、サルからヒトへの過程での遺伝子発現進化を説明できることを示している。
例えば
乳酸を分解する酵素に関わるMCM6のヒト調節領域が長期に渡るこの遺伝子の発現維持に必須であること、またこの発現に関わる新しい調節領域の特定、
十二指腸のアイデンティティーに関わる分子PDX1が人間で強くなる発現調節領域の特定と、この領域が欠損して十二指腸アイデンティティーが抑えられると脂肪吸収が低下すること、
そして insulin like growth factor シグナルに関わる分子の発現がヒトとチンパンジーの腸管の発生と機能に関わること。
などを明らかにしている。
大変な量の仕事でさすがに3つの研究室が総合で関わった感がするが、腸管の発生の進化は絶対に面白いし、細菌叢との関わり、あるいは今はやりのインクレチン遺伝子調節など、今後重要な研究分野になる気がする。
2025年8月25日
小細胞性肺ガンは肺ガンの中でも最も悪性度が高いが、Rb1とp53のガン抑制遺伝子の機能喪失変異以外に決まったガンのドライバーを特定することが難しい。ただ、Rb1機能が失われているため、サイクリンにより活性化される転写因子E2Fの活性のブレーキがきかず、これがガンの弱点になる可能性がある。
今日紹介するハーバード大学からの論文は、普通ならほとんど無理と考えるサイクリンA/Bに対する薬剤を開発して、細胞周期のブレーキをさらに外すことで、元々ブレーキの効きが悪い小細胞性肺ガン殺す可能性を追求した研究で、8月20日号の Nature に掲載された。タイトルは「Targeting G1–S-checkpoint-compromised cancers with cyclin A/B RxL inhibitors(G1-S-チェックポイントに脆弱性のあるガンをサイクリンA/B RxL阻害剤で治療する)」だ。
細胞が増殖するためにはG1サイクリンだけでなく、DNA合成が進むS期の交通整理を行うサイクリンA、そしてM期への移行に必要なサイクリンBが必須で、素人目に考えるとタイトルにあるようにサイクリンA/Bを標的にするなど、副作用が強くてもってのほかと思ってしまう。
しかしプロはさすがに違う。サイクリンA/Bが他の分子と相互作用する時に結合する相手方のアミノ酸領域を標的にした経口摂取可能な環状ペプチドを開発し、小細胞性肺ガンを処理すると、かなりの数のガンがアポトーシスに陥る一方、正常細胞はほとんど影響がないことがわかった。要するに案ずるより産むが易しとはこのことだ。
しかしなぜこのような特異性が出るのかを調べる目的で、この阻害剤が効く細胞と効かない細胞を調べると、E2Fの活性化が最初から高い細胞に効果が高いことがわかる。当然Rb1が機能的に失われた小細胞性肺ガンはE2F活性が高く感受性が高い。サイクリンAは様々な過程に関わるが、E2Fをリン酸化して機能を低下させ、サイクリンB/Cdk1によるM期移行を用意する作用もある。即ち、今回開発された環状ペプチドはこの作用を抑えるため、Rb1機能欠損でE2F活性が高い細胞は、さらにサイクリンAを介するE2F活性抑制が効かず、強いストレスにさらされ細胞死に陥りやすいことがわかった。
さらに、この阻害剤を処理すると分裂期に必要な様々な分子の活性化が上昇するという、サイクリンBを標的にしたとは思えない過程が誘導され細胞死が起こることもわかった。即ち、サイクリンB阻害剤がサイクリンBの活性化を上昇させていることになる。この原因を探ると、この環状ペプチドはサイクリンBとCdk1の活性化を抑えるチェックポイント分子Myt1との結合を阻害して逆にサイクリンBの活性を高め、分裂期の転写のブレーキがきかなくなることがわかった。
さらにこの過程を解析して、Myt1とサイクリンBの結合が阻害されることで、通常ならサイクリンBが結合しないCdk2との結合が細胞内で起こってしまい、分裂期の微小管の活性化に対するブレーキも効かなくなり、細胞死へと誘導されていくこともわかった。
細胞周期の研究はもともと複雑で、実際には複雑な実験を繰り返し以上の結果を得ているが、わかりやすく一言でまとめると、今回開発されたサイクリンA/B阻害剤は、Rb1やp53欠損のようなチェックポイントが効かない特徴を利用して、さらにS/M期のブレーキを外すことで、細胞を殺すという不思議なタイプの抗ガン剤になることがわかった
最後に患者さん由来の小細胞性肺ガンを免疫不全マウスに移植し、開発された環状ペプチドを経口摂取させると、ガンの増殖を強く抑制することを示し、臨床応用可能性を示している。
以上タイトルを見たとき必須サイクリンを標的にした薬剤とはなんと乱暴なと思ったが、最後は納得するとともに、細胞周期の知識をアップデートできた。
2025年8月24日
胸腺でT細胞が作られるとき、自己に対する抗原に対するトレランスが誘導され、自己の細胞や分子に反応するT細胞受容体 (TcR) を持つT細胞は細胞死に陥る。ではどうして胸腺上皮に多様な自己抗原が提示できるのかという問題が発生する。これを解決したのがAireと呼ばれる分子により、胸腺上皮のゲノムの関係の無い場所から転写を誘導する機構が存在し、いわば胸腺上皮に様々な組織の分子が提示されるびっくり動物園ができていることの発見だ。この驚くべき仕組みについてはこのブログでも紹介したし(https://aasj.jp/news/watch/19920、https://aasj.jp/news/watch/24110 )、Youtubeでも詳しく解説した(https://www.youtube.com/watch?v=pitYM7YqUnY&t=23s )。
Aireが働くメカニズムに関しては、最初クロマチンに直接作用して閉じたクロマチンを開いているのではと考えられたが、CAリッチな配列にストレスが働いてDNAが切断しこれを修復する過程で転写が始まることが示された(https://aasj.jp/news/watch/24110 )。
では通常閉じているクロマチンがどのように開いているのか、これについて研究したのが今日紹介するシカゴ大学からの論文で、8月20日 Nature にオンライン掲載された。タイトルは「Thymic epithelial cells amplify epigenetic noise to promote immune tolerance(胸腺上皮はエピジェネティックなノイズを増幅し免疫トレランスを促進する)」だ。
まず single cell レベルの解析で胸腺上皮の分化過程を5種類のステージに分け、この中で第3、4段階でAireが発現していることを確認したあと、Atac-seq を用いてそれぞれのトレランス誘導のために発現する組織遺伝子との関わりで詳しく調べ、組織遺伝子の転写開始点周りのクロマチンにノイズが入って開いてしまっていることを発見する。また、これはAireを必要としないことも明らかにしている。
このクロマチンの不安定性を誘導するメカニズムについて、組織遺伝子が活性化されるとき最も変化するのが p53結合領域であることに気づき、p53がこの不安定性の原因ではないかと考えた。事実、胸腺上皮の分化では p53の発現がシステマティックに低下する。p53はゲノム安定性に関わることから、胸腺上皮細胞で p53の発現を低下させることで、クロマチンの不安定な状態を許容して組織遺伝子を発現させている可能性が考えられる。
そこで胸腺上皮細胞で p53の発現が維持されるようなマウスを作成して胸腺上皮細胞を調べると、クロマチン不安定性の指標が低下して、更にはAireによる組織遺伝子の発現が低下することがわかる。詳細は全て省いて結論を述べると、p53が直接クロマチンに働くのではなく、元々クロマチン不安定性が発生しやすい胸腺上皮の細胞死を p53が誘導するからであるとわかった。即ち、正常の胸腺上皮発生では p53発現を低下させて、このチェックポイントの閾値を下げ、通常ではあり得ない様々な組織遺伝子の発現を許容していることになる。先に紹介した Dian Mathis らの論文でも、Aireはストレスが高い遺伝子領域のDNA切断を修復する機構を利用していることがわかっており、p53が低下することはこの点でも重要だと思う。
最後に p53発現が維持されるマウスの免疫システムを調べると、期待通り組織遺伝子と出会えなかったため、Aireノックアウトと同じような自己免疫状態が発生していることを示している。
以上が結果で、胸腺上皮とトレランス誘導についての研究だが、当然 p53が失われるガンについても新しい視点を提供する重要な研究だと思う。なるべく難しい話は省略して、わかりやすく紹介したつもりだが、少し難しいかもしれない。
2025年8月23日
我々現生人類以外から受け継いだ遺伝子で現在も維持されている遺伝子は我々が生き残る上で重要な役割を演じた可能性が高い。Covid-19パンデミックの時、重症化する遺伝子、あるいは重症化を防ぐ遺伝子の中にネアンデルタール人由来の遺伝子が特定され、話題になった。しかし数ある古代人からの遺産の中でも最もわかりやすいのが、デニソーワ人由来の心臓や血管機能に関わる遺伝子EPAS1がヒマラヤの高地に住むチベット人やシェルパの高地適応を助けたという発見だろう。
今日紹介する米国ブラウン大学からの論文は、やはりデニソーワ人由来の遺伝子で、現在のメキシコ人に強く保存されている粘液分子MUC19の伝搬形式を詳しく調べた研究で、8月12日号の Science に掲載された。タイトルは「The MUC19 gene: An evolutionary history of recurrent introgression and natural selection(MUC19遺伝子:繰り返す遺伝子移入と自然選択)」だ。
MUC19遺伝子の回りにデニソーワ人由来の多型が集中しており、またメキシコ人でデニソーワ人由来遺伝子が強く選択されていることが知られていた。この研究では、MUC19周辺をデニソーワ人ゲノムと徹底的に比較し、メキシコ人に移入したと考えられる742Kbの中の72Kbにデニソーワ人の多型が集中していること、そしてこのMUC19を含む72Kb領域がメキシコ人で強く自然選択されていることを確認する。事実デニソーワ人遺伝子は9カ所のアミノ酸変化を伴う変異が存在するが、それらは全てメキシコ人に移入したあと保持されており、MUC19のデニソーワ人型機能変化がアメリカでの適応に役立ったと考えられる。すなわち、メキシコ原住民はシベリアから渡ってきた現生人類だが、どこかの時点でデニソーワ人遺伝子領域72Kbを含む742Kbの遺伝子流入が起こり、これがアメリカに適応過程で選択された。
面白いのは、デニソーワ人の遺産をそのまま使うのではなく、アメリカでの適応過程でMUC19遺伝子内の30bpの繰り返し配列の数を増やしていったことで、この領域がMUC19の重要な機能ドメインであることから、デニソーワ人遺伝子をベースに、より高い機能を保つ遺伝子へと変化させたことを示している。
最後に、このデニソーワ人遺伝子がどのような経緯で現生人類へと移入したかを72Kbと742Kbの配列をデニソーワ人、ネアンデルタール人、そして現生人類と比較して調べている。なんと742Kbの領域には多くのネアンデルタール人の多型が存在している。そして、3種類のネアンデルタール人ゲノムを調べ、古いネアンデルタール人ではデニソーワ人の72Kbが移入していないが、新しいネアンデルタール人には移入していることを発見する。
以上の結果から、デニソーワ人MUC19はまずネアンデルタール人とデニソーワ人との交雑過程で移入し、その後ネアンデルタール人と現生人類との交雑過程で72Kbを含む742Kbが現生人類に移入し、アメリカ大陸への適応過程で、デニソーワ人の遺伝子が強く選択され、さらにそれをベースに30bpリピートを倍加させるという新しい機能進化が起こったことを示している。
残念ながら、この進化を推進した環境要因が何かは明らかでない。そのためにはアメリカ型のMUC19を様々なMUC19と機能的に比べる実験が必要になる。しかしこれほど大きな変化と選択が起こっている場合、自然選択の跡をたどれる可能性は高い。
2025年8月22日
外耳道にできる扁平上皮ガンで顔面神経麻痺が起こると予後が悪いことが知られており、ガンの神経浸潤はガンの増殖を助けるのではと考えられていた。
今日紹介するテキサス MDアンダーソン ガンセンターからの論文は、ガンの神経浸潤はガン免疫反応を抑えることが、神経浸潤がガンの予後を悪くする一つの要因であることを明らかにした研究で、8月20日 Nature にオンライン掲載された。タイトルは「Cancer-induced nerve injury promotes resistance to anti-PD-1 therapy(ガンによる神経障害は抗 PD-1 治療抵抗性を促進する)」だ。
この研究は臨床研究から始まっている。手術前に抗PD-1抗体を投与したあとガン組織を切除するネオアジュバント治療を受けた患者さんを対象に、PD-1抗体が効いた患者と効かなかった患者さんの組織を詳しく調べ、ガンが神経を巻き込んで神経の損傷反応が高まっている組織はPD-1抗体の効果が無いことを発見する。データベースを調べて、この傾向はメラノーマや胃ガンでも見られることも確認している。
この結果をベースにマウス実験に移り、ガンを移植する前に局所の神経を除去しておくと、PD-1抗体治療の効果が高まることを明らかにしている。もしガン組織を支配する神経が特定できれば、元で切断すれば神経障害は残るが、ガンの免疫療法効果を高められる事は臨床的にも重要だと思う。
あとはメカニズムを調べており、現象論的にはガンの神経浸潤により脱ミエリン化が起こり、これが炎症を誘導していることを明らかにする。そして、この時、ガン免疫を抑制側に引っ張るマクロファージの浸潤が高まり、キラー細胞が疲弊することがPD-1抗体抵抗性が発生する原因であることを突き止める。
ガンの浸潤により障害を受けた神経の遺伝子発現から、強く障害に対する反応をコントロールする遺伝子の発現が見られ、これが炎症を誘導していることが考えられる。そこでこの損傷反応に化関わるAtf3遺伝子を神経でノックアウトしたマウスを作成し、これに腫瘍を移植すると、Atf3ノックアウトだけで腫瘍の増殖が抑えられる。そして、損傷に対する神経の反応がガン免疫の抑制的環境を作っていることを明らかにしている。
最後にガン免疫抑制的環境を作っている炎症性サイトカインを探索し、インターフェロンや炎症誘導性のSTINGシグナルよりはIL-6の関与が強いことを示している。即ち、神経浸潤のある場合PD-1抗体とともにIL-6に対する抗体を投与すると抑制効果が高まると結論している。ただ、実際のデータで見ると効果は神経を除去したりAtf3をノックアウトしたときよりは遙かに低く、IL-6を決め手として治療標的と決めるのはまだ早いと思う。
以上、神経浸潤がこれほどのガン免疫抑制効果があるというのに本当に驚いた。症例によって神経切除は選択肢になる。
2025年8月21日
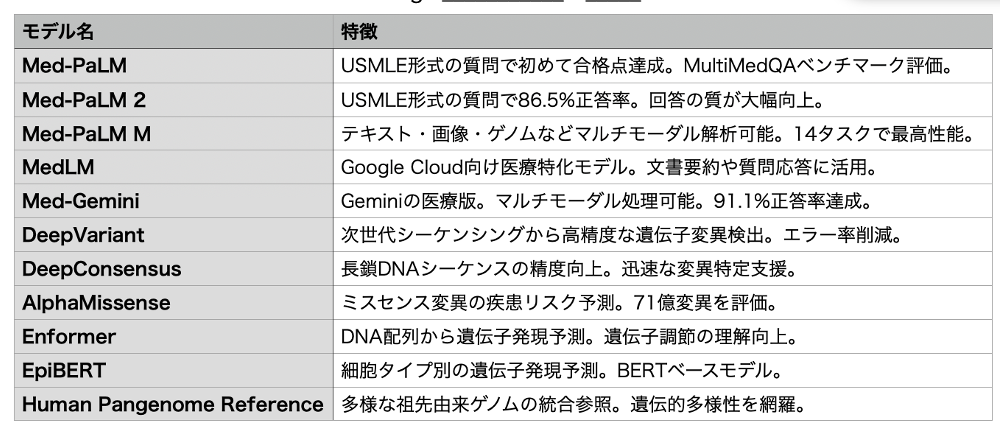
Google の2人の科学者が昨年のノーベル化学賞を受賞したことから分かるように、大規模言語モデルを進化させるためには医学生物学への進出が欠かせないと、生命科学では Alfafold2、3 だけでなくさまざまなモデルを開発している。私が目にしたモデルだけを表にしてみたが、自然言語からDNAまでまさに統合的に扱うのは医学生命科学分野だと焦点を当てているのがわかる。これにアルファフォールドや、最近紹介した鑑別診断モデルAMIEも加わり、多くがトップジャーナルへに掲載されている。
ただ Google 一人勝ちではもちろんない。それぞれのテックが生命科学に新しい可能性を求めている。例えばメタはアルファフォールドに匹敵する構造予測モデルを作成すべくスタートして、自然言語による機能記述、DNA配列、そして構造を一つの多次元空間にまとめ、言語記述から欲しいタンパク質のDNA配列を作成できる EMS3 を発表し、新しい領域を切り開き(https://aasj.jp/news/watch/26196 )、なんと生命情報の研究所まで設立している。
これに対し今日紹介するのはマイクロソフトの AI 研究所からの論文で、一つのタンパク質がとりうる様々な構造を予測できるモデルの開発で、8月21日号 Science に掲載された。タイトルは「Scalable emulation of protein equilibrium ensembles with generative deep learning(タンパク質のさまざまな平衡分布を生成深層学習を用いて大規模にシミュレーションする)」だ。
アルファフォールドでタンパク質の構造予測を行うとき、最も可能性が高い一つの構造が提案されるが、実際のタンパク質はさまざまな構造変化を短時間で繰り返しており、また条件に応じて大きな構造変化をしている。これを捉えるために、スーパーコンピュータを使って自由エネルギーの計算を行いタンパク質動態を解析することが行われるが、気楽に行えるものではない。スパコンによる天気予測のように大変な計算量を伴う。
最近天気予報も普通の計算量で行えるよう大規模言語モデルが使われるが、この研究でもスパコン並の計算量が必要なシミュレーションで得られる構造変化に対応する様々な構造を予測できるモデルの開発を試みている。
これまで行われた計算シミュレーションの結果をそのままインプットしたモデルも作成できるが、データが少なすぎる。そこで、AlphaFold2 に目をつけた。以前紹介したように構造予測という点では AlphaFold2 は AlphaFold3 に道を譲った感がある。これは、AlphaFold2 がその中核の Evoformer と呼ばれる一つのタンパク質の構造を制限する進化的変化を数多くのタンパク質を比較してコンテクストとして取り出し構造予測をするためで、どうしてもタンパク質のみに構造予測が限られる。この縛りを緩めて配列自体にある構造的制約を計算することで、進化に関わらない分子との関係も自由に予測できる利点が AlphaFold3 にはある。
一方で、Evoformer は一つのアミノ酸配列を他の少しづつ違う相同分子と比べることで、どのような構造がありうるかを反復的にアップデートしながら構造を決めている。この AlphaFold2 から計算される反復的アップデートされる表象を、今度は AlphaFold3 で、進化的コンテキスト非依存的に構造化すると、一つのアミノ酸配列に対する数十種類の構造が得られる。このような Evoformer と diffusion を組み合わせた膨大なタンパク質構造データを学習させる。
これとともに、実際のタンパク質構造計算による200ms時間内の構造変化のシミュレーション結果も学習させるが、データの数は数千種類にとどまっている。一つの配列に何十種類もの異なる構造をインプットするという点では同じだが、これは物理的計算が行われた結果なので信頼でいるデータとして扱える。
最後に、たんぱく質の構造的安定性について計算した50万種類のデータをファインチューニングに使っている。(注:たんぱく質の安定性と AlphaFold2 を組み合わせる方法は、突然変異の効果を調べるGoogle Missense でも用いられている。アルゴリズムに物理法則を反映させる一つの方法のようだ)。
これら2種類のプレトレーニングと1種類のファインチューニングの結果できたモデルでは、
RAS の GTP と GDP 結合型の構造や、CAM-KinaseII の autoinhibition による構造変化などを例に、大きく変化した構造を予測できることを示している。
また、通常は数ヶ月もかかわる分子動態の計算シミュレーションを、小規模の GPU だけで再現できる。
そして、たんぱく質の安定性を自由エネルギーの数値として推定できる。これは Google Missense と同じような遺伝子変異の機能解析にも使える。
以上が結果で、過去のデータを学習することで、計算に時間とコストのかかるタンパク質の動態シミュレーションを手軽に行えるようになったという話になる。
同じようにEvoformer+Diffusionを用いたタンパク質動態解析法が、中国のマイクロソフト研究所からちょうど一年前に発表されている。今回のモデルの方がスケールアップし使いやすいと思うが、異なるマイクロソフトのグループが独立によく似た方向の研究をしていることに驚いた。
このように世界を席巻しているテックは生命科学をそれぞれ独自の方法で取り込むことで、AI を進化させているのがよくわかる論文だった。現在渋谷に行くと AI センターが林立しているが、我が国でDNAを情報媒体として新しい AI モデルを目指すグループがどの程度存在しているのか気になる。少なくともトップジャーナルの論文で見る限り、テック、アカデミアを問わず日本からDNA やアミノ酸配列を媒体とした新しいモデル開発論文をまだ目にすることはない。しかし、DNAから脳、そして言語から AI と繋がってきた以上、言語以降の AI だけを扱っていては、人の後を追いかけるだけになる。我が国の若手研究者がこの分野で活躍することを願っている。
2025年8月20日
遺伝子の解析が可能になったホモ属(ネアンデルタール、デニソーワ、そして我々サピエンス)は全て、サルから分かれた様々なヒト属のアフリカでの進化の結果形成されたもので、アフリカでのヒト属の進化研究が熱を帯びてきた。
一般的には、最初のヒト属が400万年前に2足歩行を確立したアウストラロピテクスで、200万年前まで少しづつ分化したサブグループ( anamnennsis, frarensis など)を生み出しながら200万年前まで続いたと考えられている。
この中から分かれたHomo属(H.abilis)が260万年ぐらい前に別れたと考えられているが、アフリカにはこれ以外に同じくアウストラロピテクスから分かれたパラントトロプスが東アフリカで生息していた。すなわち300万年前から2200万年前の間には、アフリカには3種類のヒト属が同時に存在していた可能性が高く、研究の焦点になっている。
今日紹介するアリゾナ州立大学からの論文は、エチオピアの Ledi-Geraru で始まった発掘研究から発見された歯の化石についての分析で、同じ場所からほとんど同時期にアウストラロピテクスとホモ属の歯が出土したことの報告され、8月13日 Nature にオンライン掲載された。タイトルは「New discoveries of Australopithecus and Homo from Ledi-Geraru, Ethiopia(エチオピア Ledi-Geraru でのアウストラロピテクスとホモ属の新しい発見)」だ。
Ledi-Geraru は焦点になっている250万年から300万年前の地層が存在していることから、実際にはかなり広い範囲にわたっているが、アリゾナ州立大学を中心に2002年から発掘が続けられている。その中から見つかってきたのが13コの歯の化石で、ほぼ1kmも離れた3カ所から発見されている。登呂遺跡でも十分広いが、これほど広い範囲の発掘プロジェクトから、このような小さな歯をしっかり見つけ出せているのに驚く。
まだ研究途上で、年代測定はほぼ完全に地層学に依拠して行っている。そして、今回見つかった LD302 及び AS100 は地層学的に278万年から259万年前の化石で、形態学的にホモ属のものと特定している。一方、そこから1kmほど離れた地層から出土した LD750 と LD760 は265万年前の地層で、形態の検討からアウストラピテクスのものと結論している。
と、簡単に紹介してしまったが、歯の計測と評価の過程がともかくすごい。素人目にはほとんど区別できない多様性の中から、最も確率の高い結論を導くための議論が行われている。特に問題なのは、最終的にアウストラロピテクスのものと結論した LD750、LD760 が、アウストラロピテクスの代表 afarensis や最も最後まで生きていた garhi とも一致しないこと、しかしホモ属だけで無く、同じ時期に東アフリカに生息していたパラントトロプスの歯とも一致しない点で、考察の結果アウストラピテクス afarensis が独自に進化してきた新しいサブグループではないかと結論している。
いずれにせよ、アウストラロピテクスとホモ属が1kmしか離れていない場所で10万年程度オーバーラップして存在していた可能性がある。もちろん化石は出ていないが、パラントトロプスも東アフリカに生息しており、それぞれの能力についての研究が重要になる。
アウストラロピテクスはオルドワン型石器で有名だが、その後ホモ属を特徴付けるアシュール型石器へと変化していくのだが、エチオピアはこの進化の中心地と言えるので、石器との対応がこれからの課題になると思う。
2025年8月19日
歳をとってボケてきたのか、寝入りと目覚めはすこぶる快調だ。ただ、時差のある地域に旅行すると調節力が低下していることを感じる。誰にとっても睡眠は健康にとって最も重要で、その理由も次々と明らかになっているが、20人の人間の様々な目覚めを256チャンネルの脳波計で記録した論文をたまたま目にしたので紹介することにした。オランダ神経研究所からの論文で、20人1073回の様々な目覚めを、脳波と行動上の覚醒時期との関わりで調べた研究で、8月18日 Current Biology にオンライン掲載された。タイトルは「Cortical activity upon awakening from sleep reveals consistent spatio-temporal gradients across sleep stages in human EEG(睡眠から覚醒する皮質活動記録は様々な睡眠ステージで見られる人間の脳波での空間的時間的勾配を明らかにする)」だ。
この研究では頭蓋の外に設置した電極による脳波記録だけを用いて覚醒を解析しているため、内部領域の活動は皮質活動から推察するほかない。そのための精緻な解析と知識の結果結論が出されているので、今回は最終的に著者らが出した結論から紹介する方が内容がわかりやすいのではと思う。
まず覚醒を支配する2つのシステムが存在し、両方が一致したときに快適な目覚めが生じる。一つは、視床から皮質に伝わる回路で、元々睡眠時に見られるゆっくりとした波長成分(δやθ)を特徴としている。この睡眠時の遅い波は覚醒の前に急速に高まり、完全に覚醒すると消失する。この覚醒シグナルは、感覚野や運動野と言った皮質中央へと伝搬していく。ただ、このシグナルだけでは覚醒に至らず、実際睡眠時の K-complex として知られる脳波はこのシグナルが重要な役割をしている。即ち、視床では一定の間隔で、覚醒へのシグナルが発生していることになる。
実際に覚醒するときは、この遅い波が一過性に高まったのをきっかけに、早い波(β波)が高まるが、もう少し遅い波の α、σ 波を含めて、これらは脳幹の青班核を中心とした領域から発生し、前頭葉を通って皮質を前から後ろへと覚醒させる。例えば、REM 睡眠から急に覚醒する場合は、遅い波の上昇なしに、直接この覚醒経路が活性化される。
重要なのは遅い波が上昇したあと、早い波の覚醒にシフトする場合は寝覚めがよく、これがノンレム睡眠から自然に覚醒したとき、レム睡眠からの覚醒よりすっきり覚醒できる理由になる。また、音で覚醒させるとき、遅い波が高まるときに起こすと、寝覚めがいい。
以上が結果で、それぞれの波がどのように生成され、また脳を覚醒させていくのかについては何も示されない現象論的研究になる。この研究の前に、覚醒に関してどれだけわかっていたのか把握していないのでなんとも言えないが、今後は視床や青班核でそれぞれの波がどう発生するのか、そしてこれらの波が脳を覚醒させるメカニズムについて調べることが重要だと思う。
ただ、現象論でもこれを利用して、視床由来の波が高まるときを狙って起こしてくれる目覚ましができればヒットすること間違いない。
2025年8月18日
末梢血には血液細胞を中心に、様々な細胞から吐き出されたDNAが流れている。この中にはガン細胞から吐き出されるDNAもあるし、妊婦さんの場合は胎児に由来するDNAも流れている。これを利用して、ガンの経過を追跡したり、胎児の出生前診断が行われている。このように末梢に流れるDNAは臨床に利用できる便利な材料だが、例えば感染や敗血症で量が増えると、腎臓での濾過障害や炎症を起こすこともある。従って、一定の量を超えないようにDNAを処理できるようになっている。最も重要なのは血中のDNaseによる分解、マクロファージなどによる除去、そして断片化されたDNAは腎臓から濾過される。
今日紹介するオックスフォード大学からの論文は、血小板も末梢のDNAを取り込んでDNA濃度を抑える働きがあり、末梢血の cell free DNA (cfDNA) と同じように利用できることを示した研究で、8月14日 Science に掲載された。タイトルは「Platelets sequester extracellular DNA, capturing tumor-derived and free fetal DNA(血小板は細胞外のDNAを隔離する機能を保ち、腫瘍や胎児由来のDNAを捕捉できる)」だ。
血小板や赤血球がDNAを取り込む可能性があることは以前から指摘されていたが、これが血中からDNAを除去する一つのメカニズムではないかと着想したのがこの研究の全てといえる。
まず血小板にDNAが取り込まれていること、そして通常は全体の8%ぐらいが多くのDNAを取り込んでおり、取り込まれたDNAには胎児のY染色体由来の遺伝子も含まれることから、血小板ができるときに取り込まれたDNAではなく、末梢に流れる間に取り込んでいることを確認している。
次に血小板が血中DNAのクリアランスを行っていることを示すため、人為的に血小板減少症を誘導して血中のDNA量を調べると、血小板の低下に伴い、血中DNA濃度は4倍近くも高まることを示している。即ち、DNA分解酵素だけではなく、血小板も血中 cfDNA濃度の調節に重要な働きをしている。
次は血小板にDNAが取り込まれる様式を細胞学的に調べ、一つは血小板がエネルギー依存的に膜が落ち込むエンドゾーム形成による cfDNA取り込みと、細胞から吐き出されたDNAが詰まったエクソゾームを取り込むことが主な様式で、DNAは膜で守られているため、外部のDNaseの影響を受けないことを示している。血小板の寿命は1週間から10日ぐらいなので、血小板とともに貪食細胞に処理されることになる。この過程は、細胞骨格の変化を伴う過程なので、様々な化合物を使って抑えたり、高めたりすることもできる。
では血小板に取り込まれたDNAをガンの診断に用いることができるか?結論的には、cfDNAと同じぐらいの感度でガンや胎児診断に使うことができる。ただ、マウスを使った大腸ガンモデルを使って cfDNAと検出感度を比べ、少し血小板のDNAの方が感度良くガン特異的DNAを検出できることを示しているが、手間も考えると cfDNAアッセイに変わるところまでは行かないだろう。
結果は以上で、着想の面白さと血小板減少と血中 cfDNAを比較した実験以外は、驚くほどの結果ではなかったが、例えばSLEで血小板減少が見られるときには腎障害の頻度が高まると言った現象も新しい見方ができるかもしれない。