2020年4月23日
胎児期は原則として無菌環境にあるが、生まれる時産道で最初の細菌やウイルスに出会う。この出会いをはじめに、その後急速に様々な外来因子と出会い、しかも皮膚から腸まで、外界と直接繋がっている部分では、これらの因子との共存が行われ、多くの細菌は私たちの健康になくてはならない役割を果たしてくれている。この、外来因子と私たちの身体との関係については、細菌叢研究として21世紀急速に進んでおり、このブログでも多くの論文を紹介してきた。しかし、これらの研究は細菌が中心で、今私たちを苦しめているウイルスと私たちの最初の出会いの過程については論文を見かけたことはほとんどなかった。
今日紹介するペンシルバニア大学からの論文は胎児期に飲み込んだ最初の胎便から4ヶ月齢まで、胎児大便中にあるウイルスの種類と量を調べたもので、4月22日号 Nature に掲載された。タイトルは「The stepwise assembly of the neonatal virome is modulated by breastfeeding (新生児のウイルス集団の形成は母乳により変化する)」だ。
研究は単純で、胎便、1ヶ月、4ヶ月の便中のウイルスの種類と量を、物理的な方法でウイルス粒子を分離した後、サンプリングした全DNA、RNA配列を決定して調べているだけだ。そして同じ解析を、米国の黒人と、アフリカ・ボツワナの黒人で行い、比べている。
ウイルス粒子をザクッとカウントして、ほとんどの胎便にはウイルス粒子が存在しないが、1ヶ月、4ヶ月と存在するウイルスの種類と数は高まることをまず確認している。
これら粒子のDNA,RNA配列解析を行うと、
大便中のウイルスの多くは、細菌に感染しているファージウイルスが占める。 ファージウイルスのほとんどは、バクテリアゲノムにプロファージとして組み込まれていたものが、何らかの刺激による誘導で細菌外へ分泌されたもの。後期には、外界から腸内細菌に感染したファージも見つかる。 プロファージの種類は、形成された細菌叢の種類と比例する。 人の細胞に感染するウイルスは胎便にはほとんど存在しないが、1ヶ月、4ヶ月と数と種類が増える。 アフリカの子供の方が人の細胞に感染できるウイルスの種類や量が多い。 人工栄養の子供と母乳で育てた子供を比較すると、母乳により、ヒトに感染するウイルスの上昇は強く抑制されている。 以上が結果で、論文ではウイルスが存在することを強調して書いているが、個人的には1gの鞭虫に10億個レベルの粒子しかないということで、腸内はウイルスが多い場所とは言えないなという印象を持った。
論文としては珍しい研究である以上には評価しにくいが、一番重要だと思ったのはやはり母乳の力で、抗体を始め、オリゴ糖、ラクトフェリン、抗ウイルスタンパク質などが存在する。もし母乳の力をコロナ予防にも生かすことも考えられるかもしれない。
2020年4月22日
ヨーロッパ各国で感染係数が1を切り始めて、オーストリアを皮切りに、ドイツやイギリスでロックダウンを徐々に解除する動きが始まっている。ただ、ワクチンや、絶対と言われる治療法が開発途上の段階で、パンデミックが再発しないという保証はない。実際、抗体を用いて感染の広がりを調べたカリフォルニア大学の結果では、抗体保有者が4.1%に拡大しているという結果が出て、大変な数の人が非顕在感染していたと大騒ぎになっているが、もし感染者が5%程度しかいないなら、必ず2回目のパンデミックは起こるだろう。パンデミックを防いだ社会には6割の人が感染している必要があるとされている。
いずれにせよ、繰り返す流行を覚悟つつ、それを最も低いダメージで抑える政策を進めるのが重要で、政治家がダメなら、いまこそ優秀と言われる役人の構想力の新しい出番が回ってきたのかもしれない。当然科学の方も、目の前の対策のための研究だけでなく、感染症に対する一歩先の技術を構想する必要がある。
例えばワクチンも、非常時ならどんな方法でも安全に抗原を作って注射することになるが、この時自然免疫も同時に誘導する技術が必要になる。ただ、コロナも、インフルエンザも、抗体を誘導できるワクチンだけで正常な社会を保証できるかわからない。感染細胞が減少した時にウイルス感染細胞を除去してくれるのはT細胞免疫だ。実際、エイズウイルス感染細胞を完全に消滅させるためにエイズ感染細胞を殺すCAR-Tの開発が進んでいる。さすがに、CAR-Tがコロナに対する次の技術にはならないと思うが、T細胞を誘導できるワクチンはパンデミックの再発を防ぐために必須になるだろう。例えば肺のサーファクタントに馴染むリポソームを用いた吸入ワクチンは、抗体誘導能はそれほどでもないのに、これまで考えられなかったインフルエンザ免疫能を与えることができるという最近の研究はヒントになる(https://aasj.jp/news/watch/12433 )。非常時のワクチンと、その次を睨んだワクチンは必ず違うので、そこまで視野に入れた研究が必要だろう。
治療でもそうだ。SARSでわかったようにウイルス由来のRNAすら治療標的になる(https://aasj.jp/news/watch/12590 )。幸い肺の場合、線維性嚢胞症の治療なので吸入遺伝子治療も進んでいる。事実、オルベスコが効果を上げたとすると、吸入療法だったからだろう。
将来型の検査開発も重要だ。PCR検査を増やす、増やさない(フェーズが変わって現在はもはや必要ないという意見は少数になったように思うが)という議論が延々続けられているが、この延長に検査拡充によるキャパシティーの拡大だけを見ているようでは次に備えることはできない。極論すると自宅隔離の時代には、自宅でもできる検査を目指してもいいはずで、インフルエンザのようイムノクロマトを開発して、例えばAIアプリと組み合わせて自宅トリアージができるようにすることすら可能になる。
もちろん感受性などの問題で、もう少し専門的に検査することも大事だが、それでも現在のように検査がボトルネックになるのは最悪だ。とすると、簡単な機械で検査ができる必要がある。すなわちワンステップで検査ができる必要がある。理研の林崎さんたちのワンステップ法の開発がメディアで報道されていたが、もともとこの分野は日本のプレゼンスは高く、例えばMERSの診断でRT-LAMP法が開発されている。
個人的にもう一つ注目しているのが、CRISPR/CASを用いる方法、特に活性化されると周りの一本鎖RNAやDNAを切ってしまうCas13やCas12を使う方法だ。ずいぶん昔にCas13aを使った検査法を紹介したことがある(https://aasj.jp/news/watch/6731 )。この方法はすでにSherlockという名前でキット化されており、新型コロナウイルスを検出するキットがすでに発売されている。
最後になるが、同じように今日紹介したいと思ったのがカリフォルニア大学からNature Biotechnologyに発表されていたCas12を使った方法だが、原理はSHERLOCKと同じなので、タイトルだけを紹介しておく。
SHERLOCKも、この論文も、Cas13,Cas12の差はあるが、ラベルされた一本鎖RNA or DNAを、ウイルスRNAで活性化されたCasで切断させ、切断された断片をクロマト法で検出する方法で、現在のところ最初の段階で、定温の遺伝子増幅を用いている。
ただこれは検出時間短縮を目指すためで、実際には活性化されたCas13or12の活性が持続すれば切断反応は無限に続くので、将来増幅が必要のない方法にグレードアップできるかもしれない。また、カリフォルニア大学ではウイルスRNAを捕捉するガイドRNAはウイルスの3種類の場所から選んできて感度を上げている。
要するに病院すら足りなくなることが今回よくわかった。政治も大事だが、これに有効な答えをまず提供できるのは、一歩先を見据えた科学技術研究で、それが結局は様々な政策を可能にする。いまこそ科学者の力を見せる時だと思う。
2020年4月21日
アルツハイマー病では、アミロイドβの細胞外蓄積とリン酸化Tauタンパク質の細胞内蓄積が発症過程で重要な役割を演じていることは誰も疑わない。ただ、アミロイドβ蓄積が症状と相関するとする最初の考えは、アミロイドβと痴呆症状との相関があまり見られないことから、アミロイドβの蓄積が何らかの過程でリン酸化Tauの細胞内蓄積を誘導し、これが直接痴呆を誘導するという考え方に変わってきた。
私もこのブログでこの考えを紹介してきたが、カナダ・マクギル大学のグループが、アミロイドβの蓄積も脳機能に影響することを示した研究をAlzheimer’s & Dementiaに発表しているのを最近知った。1月号と少し古いが、紹介することにした。タイトルは「Mild behavioral impairment is associated with β-amyloid but not tau or neurodegeneration in cognitively intact elderly individuals(認知機能が正常な高齢者の軽度行動障害はTauや脳変性とは相関が見られないが、くアミロイドβとは相関する)」だ。
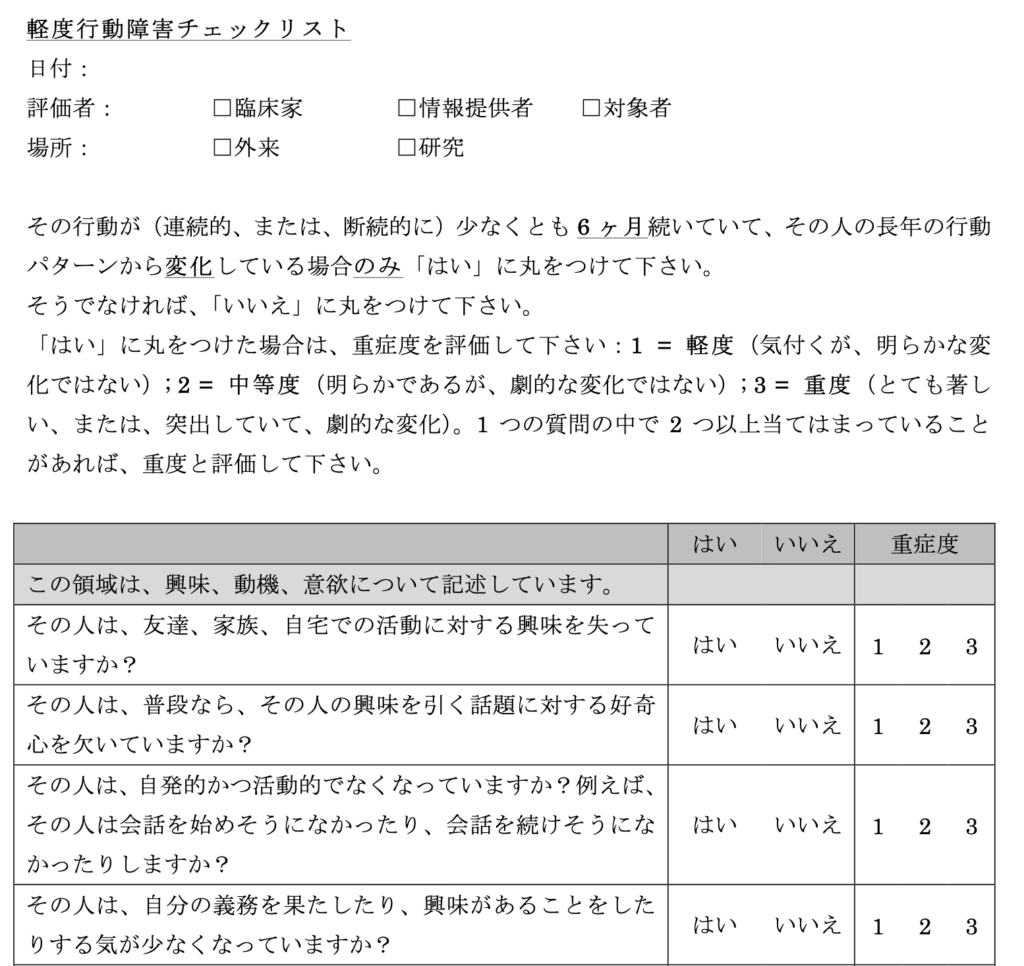
研究では96人の認知障害が見られない高齢者を集め、図に示す軽度行動障害テスト(MBI-C)で、意欲減退、不安や落ち込んだ気分、忍耐力、社会性、感覚などをスコア化して、このテストで見られる変化と、PET で検出されるアミロイドβの蓄積、Tauの蓄積、そして灰白質の萎縮などとの相関を調べている。
MBI-Cテストは本人ではなく、配偶者などの家族にお願いしてチェックリストを作成している。日本語版もあるので例を示しておく。
96人のうち、結局MRI-Cテストで軽度行動異常が存在すると診断されたのは7人だが、この7人ではアミロイドβの蓄積度と行動異常のスコアが、はっきりしたしかし緩やかな相関を示すことがわかった。また、アミロイドβ蓄積場所との相関を調べると、左の前頭皮質および前帯状皮質での蓄積と強い相関が見られた。一方、Tauの蓄積や、灰白質の変性とは全く相関が見られなかった。
以上が結果で、痴呆がない高齢者の中には、軽度行動異常が発生している場合があり、この場合アミロイドβの蓄積がその原因になっている可能性が高いという結論だ。
もちろんMBIが認めらてアミロイドが沈着している人たちがTau蓄積へと進んでアルツハイマー病まで発展するのか、あるいは全く異なる疾患群を見つけたのかはよくわからない。しかし、アミロイドβ蓄積の神経学的意義を解明する必要性を強く感じた。
2020年4月20日
新型コロナウイルスの重症化と相関するマーカーが明らかになり、新しい治療方針につながる可能性が生まれているが、例えばフィブリンの分解でできるD-ダイマーが重症例では著明に上昇しており、静脈血栓症が重症化に関わるのではと示唆されている。事実マサチューセッツ総合病院のマニュアルでは出血や腎不全がない限りヘパリンによる予防的抗血栓療法を推奨している(https://www.massgeneral.org/assets/MGH/pdf/news/coronavirus/guidance-from-mass-general-hematology.pdf )。
もう一つ直接治療につながる重症度と相関するバイオマーカーが血中IL-6の上昇で(https://pubmed.ncbi.nlm.nih.gov/32301997/ )、 阪大の岸本先生たちが開発したIL-6に対する抗体で治療効果がみられた症例がわが国を含め蓄積しているようだ。ウイルス感染によるサイトカインストームが重症化の原因と考えると、この結果は納得できるが、様々なサイトカインが分泌されると考えられるのにIL-6を抑えるだけでも十分効果があることは重要だと思う。
今日紹介するスタンフォード大学からの論文はサイトカインストームとIL-6を理解する上でも面白いと思った研究で、急性骨髄性白血病の貧血がIL-6により誘導される可能性を示唆している。タイトルは「IL-6 blockade reverses bone marrow failure induced by human acute myeloid leukemia (IL-6阻害はヒト急性骨髄性白血病により起こる造血不全を正常化できる)」で、4月8日号のScience Translational Medicineに掲載された。。
急性骨髄性白血病(AML)は、血液幹細胞の病気で、白血病細胞が増加した結果、重度の貧血が起こり、その結果起こってくる出血や感染症が直接の死因になる。このAMLによる貧血の原因については、造血に必要な場所を白血病が占拠するからだろうと単純に考えていた。
この研究ではこの常識を疑い、人間のAMLを免疫不全マウスに注射した時に起こる貧血の原因を探っていった。その結果、
ヒトのAMLで、骨髄中の白血病細胞の数と貧血との相関を見ると、ほとんど相関が見られない。したがって、造血の場が失われることが貧血の原因と単純に決められない。 AMLをマウスに移植する時、髄外造血の場である脾臓を摘出しておくと、骨髄造血を代償することができなくなる。この実験系でAMLを注射すると、骨髄正常造血が抑えられて、マウスは少数のAMLでも早期に死亡する。すなわち、AMLはマウスの骨髄造血を抑制し、それが死因で死亡する。 試験管内でAMLは造血抑制を誘導する分子を分泌するが、中でもIL-6が造血抑制と強く相関する。 IL-6に対する抗体をAML移植マウスに注射すると生存期間が倍加する。 以上が結果で、IL-6に対する抗体だけではマウスを治癒することはできないが、骨髄抑制を正常化して貧血を直せるという結果だ。これは、AMLの病態の一部をサイトカインストームで説明できる可能性を示唆している。確かに、急速に進む白血病ではサイトカインストームと同じ症状が見られることがある。もちろん白血病では感染など他にもサイトカインストームの原因は存在すると思うが、IL-6抗体治療は納得できる選択肢ではないかと思う。
2020年4月19日
一昨日慢性炎症の一つの典型とも言える変形性関節症の軟骨がメチル化DNAをハイドロオキシ化するTet1の発現上昇による、軟骨の一種のリプログラム病である可能性を示した論文を紹介した(https://aasj.jp/news/watch/12821 )。このように、慢性炎症は感染や慢性刺激などが誘因になってはいても、最終的にはリプログラムされた細胞が発生してそれが炎症組織を置き換えていくという可能性が示唆されてきた。
今日紹介するテキサス・ヒューストン大学からの論文はもう一つの典型的慢性炎症である慢性閉塞性肺疾患(COPD)の肺に存在する幹細胞の多くがリプログラムされており、それが繰り返す炎症の原因になることを示した研究で5月14日号の Cell に掲載された。タイトルは「Regenerative Metaplastic Clones in COPD Lung Drive Inflammation and Fibrosis (COPDでメタプラジア組織を再生するクローンが炎症や繊維化を誘導する)」だ。
この研究ではCOPDの患者さんの切除肺組織の細胞を培養、クローン性増殖を起こす細胞の遺伝子発現プロフィルから4種類のクラスターに別れることをまず示している。すなわち、肺の再生に関わる増殖能力の高い細胞が4種類存在していることを意味している。もちろん、同じような4種類の細胞は正常組織にも存在しているが、遺伝子発現を比べると、COPD患者さん由来のそれぞれの細胞は、明らかに正常のグループとは異なり、メタプラジア(組織のアイデンティティーが崩れている)に関わる遺伝子の発現が高まっていることがわかった。
それぞれのグループのクローン(患者さん由来)を免疫不全マウスに移植すると、正常のクローンを移植した時にはほとんど見られないメタプラジアが起こり、この性質は細胞を継代しても維持される。すなわち、増殖する幹細胞レベルでのリプログラミングが起こっていることがわかった。
またそれぞれのクローンについてsingle cell trascriptome解析を行い、メタプラジアに関わる特異的遺伝子も特定し、その中からFACSで利用できる表面分子マーカーも開発している。
4種類の増殖性の幹細胞のうち最も興味を引くのがクラスター4と名付けられた幹細胞で、COPD患者さん由来のクラスター4は、炎症を誘導するサイトカインやケモカインの発現が高い。そして、COPD由来のクラスター4細胞をマウスに移植すると、白血球の浸潤を含む強い炎症が起こる。
一方、ホストの線維化を誘導するサイトカインの分泌はクラスター3(扁平上皮へ分化)とクラスター4で強く、それぞれ移植したマウスでは繊維化が誘導されることを示している。
詳細をかなり省いて紹介したが結果は以上だ。要するに、肺の細胞の新陳代謝を担っている幹細胞がタバコの刺激など慢性の刺激によりリプログラムされ、異常組織の再生産を維持しているという話で、前回紹介した変形性関節炎とともに慢性疾患で、細胞がエピジェネティックにリプログラムされていることを示唆している。
とすると、肺の幹細胞を対象に、エピジェネティックな変化を元に戻せないか、変形性関節炎と同じような治療法開発も可能だと思うし、何よりも正常の幹細胞で置き換えられないか、これまでとは全く異なる方向での治療法が可能になるかもしれない。慢性炎症は本当に奥が深い。
2020年4月18日
脊椎動物の中でも最も地球温暖化によって絶滅が危惧されているのが爬虫類だ。というのも多くの種で負荷時の温度によりオスメスが決定されるからで、卵が産み落とされた環境の温度が例えば上がりすぎると、孵化した個体が全てメスになり、生殖が不可能になる。
温度依存的性決定については興味を持っていたが、論文をフォローしておらず、性決定に関わる何らかの転写因子の温度感受性の問題かななどと勝手に思っていた。今日紹介するデューク大学からの論文はミシシッピーアカミミガメをモデルに、性決定過程の大枠を解明した研究で4月18日号のScienceに掲載された。タイトルは「Temperature-dependent sex determination is mediated by pSTAT3 repression of Kdm6b (温度依存的性決定はリン酸化STAT3によるKdm6bの抑制により決められている)」だ。
線虫から哺乳動物まで、オスの性を決定するマスター遺伝子としてDMRT1が知られているが、このグループはアカミミガメの性決定が、KDM6B:ヒストン脱メチル化酵素によるDMRT1遺伝子発現誘導を軸として行われていることを明らかにしていた。
今回の研究はこの軸を調節する上流の温度感依存的過程に関するものだが、対象となる野生動物の研究上の制限から、可能性の高そうな候補遺伝子を絞って、古典的な手法を用いて研究を行うことで進めている。こうして上がってきたのが、意外なことに通常サイトカインシグナルの下流にある転写因子STAT3で、まずメスを誘導する温度31度でSTAT3のリン酸化レベルが上昇すること、そしてSTAT3がKdm6bヒストン立つメチル化酵素遺伝子に結合していることを明らかにする。
STAT3のリン酸化が高まるのはメスを誘導する温度31度なので、リン酸化によりオスを決定するKdm6b遺伝子が抑えられる必要がある。そこで、STAT3阻害剤を用いてオス決定軸を形成するKdm6bおよびDmrt1の発現を生殖器官で調べると、期待通り発現が上昇する。すなわち、STAT3はKdm6bに結合して抑制因子として働いている。また、STAT3が活性化されメスを誘導する温度でSTAT3阻害剤を卵に注入する実験を行うと、生殖組織をオス型に変化させられることを示している。
最後に、では温度変化をSTAT3のリン酸化へと転換する仕組みについても、細胞内へ温度依存的にカルシウム流入が起こることでSTATA3リン酸化が起こるのではと仮説を立て、実際31度で細胞内カルシウム濃度が上がること、またカルシウムイオノフォア処理により、STAT3がリン酸化されることを示している。
データはここまでで、カルシウムチャンネルの温度依存的変化、細胞内カルシウム増加をシグナルとするSTAT3リン酸化、STAT3によるKdm6b遺伝子の発現抑制、その結果のDmrt1遺伝子発現抑制により、高い温度でメスが誘導されるというシナリオが示された。
まだまだ、温度感受性カルシウムチャンネルの特定、STAT3をリン酸化するメカニズムなど解明しなければならない点は残っているが、あとは時間の問題だろう。候補遺伝子を一つ一つ確かめていくという地道な仕事だが、温度依存的性決定についてはすっきりと整理がついた。
2020年4月17日
変形性関節症(OA)は特に高齢女性の運動能力を低下させる最大の原因だが、何十年も使い込めば関節が痛むのも当然と、私たち専門外はあまり興味を持てなかった。しかし、今日紹介するスタンフォード大学整形外科からの論文を読んで、単純に見えて奥の深い、しかも治療可能かもしれない面白い病気であることを認識した。タイトルは「Inhibition of TET1 prevents the development of osteoarthritis and reveals the 5hmC landscape that orchestrates pathogenesis(TET1阻害は変形性関節症を防ぎ、関節症への5hmCの関与を明らかにした)」だ。
おそらくOAの論文を読むのは初めてのような気がする。このグループはもともと人間のOAでゲノム全体に5hmCマークが増えてくることに興味を持って研究していたようだ。全く初耳だが、半月板障害での慢性炎症でDNAメチル化部位がハイドロオキシメチルに変わるというのは意外で、紹介することにした。
これまでの結果を半月板損傷によるOAモデルマウスで確かめ、OAが長引くとともに、ハイドロオキシメチル化(5hm)が進み、その結果1000近くの遺伝子発現が上昇することを確認する。すなわち、5hm化はOAの関節軟骨細胞を特徴付ける所見になる。
ではこれがOAの病理と関わるのか、Tet1ノックアウトマウスを用いてOAを誘導する操作を行い、Tet1が欠損すると、5hm化が抑えられ、それとともにOAの病理が強く抑えられることを示している。これはOAの進行をTet1操作で治療できる可能性を示しており、研究のハイライトと言える。
なぜこのような効果が見られるのか、Tet1ノックアウトにより発現が変化する遺伝子を詳細に調べており、例えば文化に関わるWntシグナルや、マトリックスの調節に関わるメタロプロテアーゼ、あるいは軟骨を守るために必要な転写因子など、遺伝子発現全体をOAの進行を止める方向へ再プログラムできる。この合目的性には驚くと同時に、Tet1とは何かを考えさせられる。私の頭の中でTet分子は、発生やガンのプログラムにとどまっていたが、考え直さなければならない。
いずれにせよ、Tet1はなぜかOA誘導のマスター因子として働いている。とすると、当然これを抑制することでOAの進行を止める可能性が出てくる。この研究ではOA患者さんの軟骨サンプルでTet1ノックダウンが期待の変化を示すことを確認した上で、同じ効果をTet全体の阻害剤2HG でも誘導できることを示している。
そしてマウスモデルで2HG を関節に注射して、OAの信仰を抑制できることを示している。
結果は以上で、慢性炎症で関節軟骨細胞のこれほど大きなプログラム変換がおこり、それにTet1による5hm化が関わるという発見も大変面白いが、それを治せる可能性が生まれたことは、期待できるのではと思っている。
2020年4月16日
これまで12回、ギリシャ、ローマ、中世と哲学書を読んできた。大学時代から今まで、古典的な哲学書も比較的読んできた方だと思うが、系統だって読むことはなかった。時代を追って哲学書を読むという体験は今回が初めてだ。哲学を教えているわけでもないのに、ちょっと馬鹿げているとは思ったが、「この機会を逃せばもう気力は失せるだろう」と読み始めて、そろそろ一年になろうとしている。こんなことでもなければローマ時代や中世哲学書など手に取ることはまずなかったと思う。「しんどいか?」と問われれば、確かに「しんどい」し、何より他のことを犠牲にして本を読む必要がある。すなわち、論文を読むときと同じで読書が義務になる。しかし、しんどいだけではない。中世の著作でさえ、現代の哲学にまで続くルーツを発見することができるし、何よりもアリストテレス、オッカムなど、実際に読んでみないとその価値はわからない著作にも出会うことができた。とはいえ、ようやく中世を抜け出せるかと思うと、正直ホッとする。
近代哲学に突入できれば、一度は読んだことのある哲学書が多い。また紹介しながら、現代の科学や、生命科学の課題へ話題を広げて議論も可能だし、自分の考え(と言っても多くの人の考えに触れる中で形成することができた考え)を積極的に紹介することもできる。などと考えて、パスカルやロジャー・ベーコンを読み始めた時、ドイツの若手哲学者マルクス・ガブリエルが話題になっているのを知って、講談社メチエとして出版された「なぜ世界は存在しないのか」と「私は脳ではない」の2冊を読んで感心した。
図1 講談社メチエで出版された2冊のマルクス・ガブリエルの著書
「生命科学の目」のバイアスを持つ私の好みの問題だが、現代の哲学者に限ると、ラカンやガタリといった大陸の哲学者より、米国の哲学者の方が、同じ課題を共有でき、身近に感じて来た。実際、米国の多くの哲学者は現代科学(特に脳科学)についての造詣が深いし、つねに科学者との対話を保っているのが感じられる。といっても科学哲学に取り組んでいるというわけではない。形而上学や精神といった哲学本来の問題に挑戦している。例を挙げれば、サール、ネーゲル、デネット、そして哲学者ではないが脳科学者のディーコンなどで、いつかここでも取り上げてみようと思っている。しかしマルクス・ガブリエルを読んで、これまで感じていた大陸の哲学・米国の哲学などという区別は解消した。あまり長くない2冊の本だが、内容は重厚で、まさに現代を代表する重要な哲学者の一人だと思う。これから近代哲学の著作を紹介するときも、参考になる点は多い。そこでちょっと寄り道して今回はマルクス・ガブリエルを取り上げることにした。
これらの著書でマルクス・ガブリエルは、「世界」や「精神」といった哲学本来の課題が、20世紀以降は科学の専権課題になっているが、本当にそれでいいのか?と問う。そして科学にとらわれず多様な角度からのアプローチが必要で、哲学でしか取り組めない問題も多く存在すると主張する。難しい哲学用語を使わない素晴らしい翻訳なので(といっても原文は読んでいないが)、詳しい内容については、是非みなさんが自分で読んで確かめて欲しいと思う。新型コロナ感染による自粛で時間ができた人たちには間違いなくオススメの本だ。特に私たち科学者は、彼が新たに提起した哲学の課題についてどう考えるのか自問した上で、自分が属している科学という領域を再確認する必要があると思う。もちろん私にとっても、生命科学の課題を再考する機会になった。しかし、科学の手法や課題についての彼の理解、そして科学では扱えないと彼が考える課題の位置付けについては意見の相違を感じる点も多かった。そこで今回は本の紹介というより、科学者として彼の投げかけた問題にどう答えるか考えてみたい。
まず彼の著作の簡単な紹介として、マルクス・ガブリエルを褒めるところから始めることにする。
読んでまず驚くのは、彼の分野を超えた膨大な知識だ。しかも、普通哲学書を読んでいるとき感じるアカデミックな匂いがない。驚くべき「物知り」と言ってもいいかもしれない。その知識は、哲学は言うに及ばず、自然科学、芸術など、人間のあらゆる文化をカバーしている。彼が天才と呼ばれるのはこの点だろう。驚くのは、これらの知識が全て、彼の独自の視点を展開するために総動員できるよう整理されており、さらに誰もが身近に感じられる文章で語られる点だ。すなわち、哲学が知識として蓄積され、それらが彼の言葉として語られる。
彼のもう一つの特徴は、多くの人にわかってもらおうと、たとえ話や具体例を多用する点だ。「なぜ世界は存在しないのか」で彼は「世界とは何か」という形而上学問題について、
「わたし自身の答えは、最終的には次のような主張に行き着くことになるでしょう。たったひとつの世界なるものなど存在せず、むしろ無限に数多くのもろもろの世界だけが存在している。そして、それらもろもろの世界は、いかなる観点でも部分的には互いに独立しているし、また部分的には重なりあうこともある、・・。」 マルクス・ガブリエル. なぜ世界は存在しないのか (Japanese Edition) (Kindle の位置No.1335-1338). Kindle 版.
と独自の多元的認識論を提案する。すなわち、皆が共有できる一つの世界が存在すると考えるのは幻想で、独立しつつ重なり合う無限に多くの世界が現れるとする新しい多元論だ。その上で、我々の認識にとって存在とは、意味の場に現れたものを認識することだと語っている。
私が驚くのはこの議論自体ではなく、彼がこの概念を一般の人にわかりやすく説明する仕方だ。なんと、ジャクソン ポロックのアクションペインティング(私には意味を拒否した感性の塊としか見えないのだが、例としてウェッブ上の写真を見て欲しい:https://www.flickr.com/photos/piljun/6301137213 )を例に概念を説明している点だ。そして、作品全体を眺めるだけでなく、一つの色に集中して筆の動きを読んでみるよう読者を促し、こうすることで一筆一筆がカンヴァス上の「意味の場」に提示されていることが理解され、私たちの頭の中に様々な「意味」の集まる「世界」が再構成されると語る。読んだ後ポロックの絵をもう一度見てもこの「意味の世界」は私のような凡人には見えてこないが、説明はとても新鮮だ。これだけで、十分ベストセラーになること請け合いだ。
美術の他にも、より大衆的な様々な映画も頻回に取り上げている。例えば、宗教、フェティシズム、商品と議論を進めた上で(なぜこのような連環が生まれるのかは本を読んで欲しい)、これを食肉消費(フェティシズム)、肉片から作られたソーセージ(商品)と連想して、最後にドイツの芸術家シュリンゲンジーフの「ドイツチェーンソー大量虐殺」の映画を例として解説している箇所は圧巻だ(彼についてはAASJでもYouTubeで取り上げている:https://www.youtube.com/watch?v=hbeG2z0lLJs&t=5976s)、 。
「そのようなヴルスト業界の真実は、一度見たらトラウマになりかねません。そのような事態が、クリストフ・シュリンゲンジーフの映画作品『ドイツ・チェーンソー大量虐殺』では、美学的に見て爆発的とさえ言える表現にまで先鋭化されています」
と、私にとっては見るにたえなかった超グロテスク映画の新しい側面を教えてもらって、なるほどと膝を打った。
もちろん古代から現代まで、哲学者の引用も多い。大事なのは、大陸or米国、過去or現代、という区別なく、各哲学者の著作に現れた「意味の場」が、マルクス・ガブリエルの中に蓄積され、メタ概念として彼の言葉で語られる点だ。多くの哲学者の思想が自由自在に集められ、形而上学や、精神といった哲学本来の課題についてのまとまった概念として、一般の人にもわかりやすく示されていく。しかしわかりやすいからといって、決して哲学の解説書といった類ではい。古代以来、人間が知ろうと努力してきた課題に真正面から取り組んでいる。わかりやすく語ることができるのは、知識が本当に身についているからなのだ。
さらに感心するのは、彼が哲学と科学を決して区別していないことだ。というより科学に対する厳しい批判を行ってはいても、科学を同じ問題を共有するパートナーと考えている。現代科学についてもよく理解しているからこそ自信を持って語れる。科学と哲学がパートナーとして同じ課題に取り組まなければならない点については私も全く同感なのだが、現代の脳科学やダーウィン主義を、哲学の可能性を認めない還元主義として批判する点については (後述)、生命科学者として一言述べたいので、以下「私は脳ではない」を題材に、彼の課題と、科学批判について見て行こう。
この本で彼が目指したのは、「精神哲学:精神を持つ生物としての私たちについて理解すること」 、と明快だ。言い換えると、なぜ宇宙の中に生命が誕生し、その中から精神が誕生したのかという問題だ。このように問題設定されると、「え?これが哲学の問題?」と、確かに驚いてしまう。例えば、米国のディーコンのように「宇宙になぜ精神が存在するのか?」を総合的に扱おうとしている科学者/哲学者(彼は認知科学の教授で、哲学者と表現するのは間違っているかも知れない)も存在するが、これほど包括的に問題提起する現代の哲学者はまずお目にかかれない。
科学の問題にも自由に踏み込む米国の哲学者ですら(例えばダニエル・デネット)、「意識:解明される意識」、さらに生物について「進化:ダーウィンの危険な思想」といった具合に、全体の中から一部を取り出し、哲学として議論するのがせいぜいだ。マルクス・ガブリエルのように精神を宇宙の中に位置づけて、その理解を目指すと明言する現代哲学者は、少なくとも私は読んだことがない。そして、精神や意識の問題は、包括的な理解を目指すべきだという考えには私も科学者として完全に同意する。
これまで紹介してきたように、ギリシャ哲学や、あるいはスコラ哲学では、宇宙の中の精神は哲学が取り組むべき当たり前の課題だった。ただ、近代が始まった時点から、このような包括的な課題は科学に任せれば良いという風潮が徐々にたかまり、現代に至っている。この結果、彼が指摘するように「宇宙の中の精神」のような包括的問題については、科学的自然主義か、それと対立する宗教的神秘主義だけが取り組む課題になり、哲学はもはや土俵を下りた感がある。
この状況に対し、マルクス・ガブリエルは「宇宙の中の精神を理解する」と言った包括的な問題は今もなお最も重要な哲学の課題であると主張する。ではこの問に対する彼の答えはなんだろうか?
がっかりさせて悪いが、イオニアの哲学者のように「万物は水からできている、とか原子からできている」などといった解答が示されるなどと期待しても、結局答えは示されない。しかしこれは当然だ。もしこの問題に彼が納得できる説明を示していたら、それこそ大騒ぎになる。事実、哲学どころか科学だって、誰一人として宇宙の中の人間の精神の存在を説明できる人などいるわけが無い。
代わりに「私は脳ではない」では、「意識」、「自己意識」「実のところ私とは誰、あるいは何なのか?」「自由」とセクションを設けて、それぞれの問題に関して、科学、哲学、宗教がこの問題にどうアプローチしたか説明していく。大事な点は、ここで登場する哲学者の引用が「xxxが意識についてこう語った」と言った紹介ではなく、各課題に対するこれらの哲学者の考えが一度彼の頭の中で咀嚼された後、彼の意見として語られる点だ。すなわち、それぞれの哲学者の引用は、すべて彼の頭の中にある思想の核とつながっている。科学では様々な知識が蓄積し、一つの問題に対してその蓄積を持って説明するのが普通だが、彼は哲学、宗教を問わず、あらゆる分野の思想を蓄積して、それを自分の言葉で語るスタイルが可能であることを示している。もちろんこんな離れわざは誰でもできるわけでは無いが。
一方、同じ問題に対する科学領域からの知識は、もちろん彼の頭の中で咀嚼されてはいても、基本的には批判の対象として、手厳しく扱われている。少し長くなるが、一つの例を見てみよう。
「私はミラーニューロンがあることを否定するつもりはありませんし、それがなければ自己意識にも、他者の意識に対する意識にも到達できなかったかもしれないということを否定するつもりもありません。まったく同様に、人間の精神の状態にとって重要な生物学的土台が、偶然の──つまり、それを目的にして計画的になされたのではない──遺伝子組み換えによって生まれ、その後、環境の圧力によって淘汰・選択されたことも否定するつもりはありません。この惑星に意識をもった生物がいること、もしかしたら他の惑星にも意識をもった生物がいるかもしれないことは、宇宙という観点から見れば、偶然の産物です。つまり、特別な理由があって、そうなったわけではありません。あるものはある、それだけのことです」 マルクス・ガブリエル. 「私」は脳ではない (Kindle の位置No.2576-2582).
と、精神の存在が、宇宙誕生以来の必然であるように語る科学(ほぼ物理学とオーバーラップする)に対して反論している。そして、特に最近になって科学は、宇宙から精神までいつか解明できるという思い上がった考えを持つ傾向があることを次のように批判している。
「宇宙の真理についての無知ゆえに、人間には精神をもつ生物としての己の立場を誤って判断する傾向がありますから、神経生物学のフィールドで我々の認識が進歩すれば、それは当然、自己認識の進歩に役立ちます。なぜなら、太陽は私たちが物を見るために輝いているとか、私たちに意識と自己意識があることは、「地上で」繰り広げられる見世物をはるか彼方から文字どおり見物する神の栄光のために催される一種の精神的シンフォニーであると信じるなら、まさに相当な勘違いですから。とはいえ、我々は神経生物学の知識のおかげで、自己意識について、エンヘドゥアンナ、ホメロス、ソポクレス、龍樹〔ナーガールジュナ〕、ジェーン・オースティン、アウグスティヌス、ビンゲンのヒルデガルト、ジョルジュ・サンド、ヘーゲル、ベッティーナ・フォン・アルニム、あるいはマルクスが有していた以上の理解を手にしていると考えるなら、それは誤解です。」 マルクス・ガブリエル. 「私」は脳ではない (Kindle の位置No.2595-2603).
ここでは、「神の栄光を信じる」宗教と比べると、科学は宇宙の真理対してよりまともなアプローチしているとは言え、古今の多くの哲学者の思想を凌駕できていると考えるのはまだまだ早いと述べています。
おそらく彼も、多くの科学者が、科学は全てを説明できるなどと思い上がることなく、黙々と目の前の問題に取り組んでいることを知っているはずだ。しかし、今も昔も、科学は宇宙から精神まで説明したいと考えようとしてきたのも確かだ。そして、この時こそ科学が思い上がる時だと彼は語る。例えばこの本では、利己的遺伝子のドーキンスや、神経学者エリックカンデルを名指しでこの思い上がりの例として批判している。しかしドーキンスもカンデルも、私たち科学者側では、哲学の素養があり、大きなパースペクティブで生命や精神を語れる科学者だと評価し尊敬されている。
彼が言いたいのは、科学者が科学を盾に「宇宙の中の精神」という「一つの世界」を普遍的に語ろうとするときに、落とし穴に落ちるという点だ。確かに私も含めて科学者も、大きな問題に大上段で構える時、哲学をしばしば引用する。これはすでに科学者が科学者であることをやめている証拠だと彼は思っている。だからこそ、私たち科学側のヒーローに対して「カンデルはカントを読んでいないか、読んでいてもわかっていない」と喧嘩を売って、「科学的」であることを裏付けようと、勝手に哲学者まで引っ張り出すなと叱責する。この叱責はさらにつづく。
「神経構築主義は、繰り返し好んで、しかも不当にカントの説に寄りかかっていますが、カントのほうがよほど首尾一貫しています。それは、カントが、神経構築主義が絶えず巻き込まれる矛盾を見破っていたからです。主著『純粋理性批判』でカントがテーマの一つにしているのは、思考という事象の担い手を(非物質的な魂であろうが、脳であろうが)何らかのものとして同定するのは誤った推論であるのを実証することです。こういう誤った推論は自己認識という領域で私たちにつきまとっていて、カントはその誤りを暴こうとしたのです。カントはこういう推論に「誤謬推論」という呼び名をあてましたが、要は誤った推論のことです。誤謬推論が登場するのは、カントによれば、特に、思考能力の担い手はこの世のどこかで見つかるものでなければならない、と信じられているときです。思考能力の担い手は、非物質的で探し出すのが困難な魂や気〔Seelenkraft〕でも構いませんし、脳全体──いくつかの脳部位でも構いません──の中での、はっきりとは場所が特定できないながらも認められている特質や活動でも構いません。」 マルクス・ガブリエル. 「私」は脳ではない (Kindle の位置No.1282-1292). Kindle 版.
このような批判を読んだあとで、ドーキンスやカンデルの著書を思い返してみると、彼の言うのも一理あると思う。要するに、宇宙の中の精神という大きな「世界(マルクス・ガブリエルにとって世界は存在しないのですが)」に立ち向かおうとする時、科学の間違いが始まると批判する。
さらに具体的に指摘が続く。
「神経中心主義が哲学を寄せつけないためにとる典型的な戦術は、まず「私」を「自然化」することです。つまり、「私」を自然科学的に説明したり理解したりできる対象の領域に編入するのです。そうして、「私」は言うなれば神秘的であるという特性を失います。現象の自然化とは、一見すると自然科学的に研究できそうもない現象を、その見かけに逆らって、自然科学で表現できるもの、探究可能なものとして扱うことです。したがって、ここで言う「自然な」とは、「自然科学で探究可能な」というような意味です。そして、このことはすでに多くの疑問を投げかけています。というのも、自然科学で探究可能であるとはどういうことなのかが、まったくはっきりしないからです。」 マルクス・ガブリエル. 「私」は脳ではない (Kindle の位置No.3144-3151). Kindle 版.
すなわち、世界の理解に最も重要な主観的「私」を隠してわかった気になるのが科学の戦略で、この戦略だけで本当に世界を理解できるのかと問う。
そして最後の一撃だ。
「ですから、精神をもつ生物〔知的生物〕としての私たちの状況に新たな視線を投げかけるのは、今世紀に課された重要な課題です。私たちは唯物論〔物質主義〕を克服しなければなりません。唯物論は(物質エネルギーにも基づき、匿名の固い原因で成り立つ現実という意味での)宇宙に見出せるものしか存在しないと私たちに吹き込み、それゆえ意識からニューロンの嵐にまで還元することができる精神というコンセプトを必死で求めているのです。私たちは、多くの世界にある住民です。私たちは目的の王国で行動しており、そこでは自由のための一連の条件が提供されています。」 マルクス・ガブリエル. 「私」は脳ではない (Kindle の位置No.5041-5046).
手厳しい科学批判だ。特に、「(一つではない)多くの世界に住み、目的論の王国で行動し、自由な私が存在する 」と強調することで、「目的ではなく法則に支配されている一つの世界」を認める科学思想をわざわざ裏返して、NOを突きつけている。
私も少しムキになって紹介してしまったかもしれないが、「私は脳でない」は、現代の科学批判の本だというのが私の感想だ。では、この批判に科学者としてどう答えていけば良いのか。これについてはこれから多くの哲学書を読む中で答えて行こうと思っているが、とりあえず手短に私の考えを述べてみよう。
まず、「私たちは唯物論(物質主義)を克服しなければなりません」という点では私も完全に同感だ。しかしマルクス・ガブリエルがこう語るとき、科学=唯物論と言っているように思えてならない。もしそうなら、それは間違っている。唯物論は科学とは全く無関係だ。私が考える唯物論は、目に見える(物質による)因果性で現象を説明しようとする事で、誤解を恐れずわかりやすく言ってしまえば、物理学がそれに当たる。化学反応は複雑だが、それでも同じように目に見える因果性の連鎖で扱える分野だと思う。もちろん私たち生物も、目に見える物質からできており、物理や化学の法則に従って生き、死んでいくという点では、唯物論的だ。しかし、生物を物理学的因果性だけで説明することは不可能だと私は確信している。
例えば生物には物理世界(生命誕生前の地球に存在していたが因果性)に、生命と同時に誕生した「情報(もちろんその媒体DNAは物質ですが情報は物質ではありません)」が組み込まれている。しかも情報は核酸だけではない。エピゲノム、神経ネットワークなど、様々な媒体を使った情報が組み込まれている。例えば自然界で今、自然にDNAが生成することはまずない(もちろん不可能ではなく、少なことも一度はできてしまったのだが)。一方、どんな小さな生物の中でも、核酸の合成は普通に起こっている。これは、物理法則と、情報が統合されているからできることだ。さらに脳という神経ネットワーク媒体を介する情報のおかげで、人間は地球上にはけっして生じることのない物質を生み出してきた。今私が向かっているパソコンが生物なしに物理法則だけでできるには何年待てばいいのか?
では、科学が唯物論的自然主義ではないとすると、科学とは何か?ガリレオ・ガリレイを読むときに詳しく論じたいと思うが、科学とは事象の理解について、第三者とコンセンサスを得るためのプロトコルを認め合う集団(科学者)が形成するギルド活動だと思っている。このコンセンサス形成のためのプロトコルとしてギルドに認められている方法は、現在のところ数理や実験だ。数理は多くの人と一度にコンセンサスを取ることができるプロトコルだが、もちろん数理的に処理できるからといって正しいわけではない。また、実験は自分の体験を、他の人と共有する手段だが、コンセンサスを得るためには時間とコストがかかることが多く(重力波測定を考えてください)、しかも常に個別の事象だけを対象にせざるをえない。本当の意味で普遍的なコンセンサスを得る事は物理学以外は科学にとって苦手な作業だ。
しかし問題はあっても、実験や数理という手続きを踏めば、少なくとも他の科学者に認めてもらえることはできる。逆に、ギルド内では理論科学の概念が証明されるまで棚上げにされるのも、科学というギルドの規則から考えるとうなづける。このおかげで、私たちの直感とは全く外れるアインシュタインの相対性理論ですら、まず数理的に、そして重力波実験によりコンセンサスとして共有できるようになった。しかしコンセンサスを得るための独自のプロトコルを持つというだけなら、宗教も同じかもしれない。誰かの言葉を信じると決めておけば、信者内で概念を共有できる。
幸い、科学はこの問題を、概念の技術化を通して解決し、宗教や政治などとは異なる質のコンセンサスを形成できている。すなわち、科学ギルドで生まれた概念の多くは、技術化を通して、宗教信条から科学を批判する人とすら共有できる。イスラム教、仏教、キリスト教を問わず、スマートフォンを通して、皆さんは電磁気学の成果を共有しているはずだ。逆に、ギルドメンバーであっても、プロトコルを無視する(捏造する)と、その概念が正しかったとしても、もはや科学者というギルドを去らなければならない。
ただ、このような厳しいギルドのルールをどこまで守れるか、難しい問題だった。そのため17世紀近代科学が誕生した時、科学は物質的因果性に基づく物理学しか対象にできなかった。その結果、科学の対象から物質的因果性では到底説明できなかった生物や精神などが外れ、多くは宗教の領域に預けられることにななる。
しかし、ダーウィンの進化論、そして何よりも20世紀のシャノンやチューリングによる情報科学の成立により、非物理的因果性を科学として(すなわちギルドの認めるプロトコルに従って概念を検証する)扱うことができるようになって来た。今回読んだマルクス・ガブリエルの2冊の本では、情報や情報科学についてはほとんど言及がないのが残念だ。しかし、ダーウィンの進化論というアルゴリズムに情報科学(繰り返しますが、非物理的因果性と言っていいでしょう)が加わって、科学の範囲は大きく広がろうとしている。何よりも、一つの結果を科学というギルドの中で一般化することが可能になって来た(これについてはいつかもっと詳しく論じる)。
以前、柄谷行人さんが、カントのアプリオリは「他人」とおなじだと言っているのに感心したと書いたが、科学に他人とのコンセンサスを得るための揺らぎないプロトコルがあることで、主観的な概念を、他人と共有、すなわちアプリオリへと転換することが科学にはできる。一方、哲学には第三者と概念を共有するための確固たるプロトコルは存在しない。もちろん、マルクス・ガブリエルのように様々な思想を自分の頭の中でもう一度統合するという離れ業は可能なだが、どれほど多くの考えを統合できたとしても、それがコンセンサスになるという保証はない。
「私は脳でない」という彼の考えに私も納得できるのは、「・・・でない」という否定形だからだ。しかし今後哲学で「私はXX」とテーゼが示された時、このテーゼを共有するためのプロトコルは有るのだろうか。これは哲学書を読むときいつも感じる問題だ。おそらく、科学というギルド以外、このプロトコルを確立できたギルドはないと思う。
しかし、私は彼の科学批判を全面的に受け入れたい。まず科学者は、このギルドの中だけで科学者でありうるという点は重要だ。この不自由な牢獄から抜け出して、ちょっと広い世界で話をしてみたいという気になるのはよくわかるが、その時はギルドメンバーではなくなっていることを認識する必要がある。ギルドから離れて脳科学の概念に基づいて説明しても、その説明が科学的だと錯覚してはならない。ここでは、誰もが哲学者と同じ立場に立っている。
とはいえ、「宇宙の中の精神」について科学者も考える事は自由だ。しかし繰り返すが、このように包括的な課題を普遍的に考えてみる作業が哲学の本領と言え、この時は科学者も哲学者と同じ土俵にいる。もちろん自分のよく知っている21世紀に入って急速に進む脳科学の成果を「科学ギルドからの強固な概念」として取り込む事は、哲学的に考える時も重要だ。その意味で、科学者も常に普遍的に考えてみる事は大事で、幸い脳科学にはそんな科学者が多く存在する。
ギルドから一歩出たら哲学者と同じ土俵で対等に渡り合い、できれば協力し合う必要がることを忘れてはならない。ただ、このような対等の協力関係の成立は難しかった。今回彼の本を読んで、マルクス・ガブリエルは、同じ土俵で渡り合い、協力できる哲学者だと確信した。今後彼の新鮮な批判精神が、「宇宙の中の精神」についてわかりやすく説明してくれることを期待して待とうと思っている。我が国の哲学者だけでなく、若い科学者も彼と討論してみると面白い。
2020年4月16日
阪神の藤浪投手についての報道以降、新型コロナウイルスの可能性を調べる一つの症状として嗅覚障害が認められ、メデイアでも盛んに報じられている。最近 International Forum of Allergy & Rhinologyにカリフォルニア大学サンディエゴ校から発表された論文では、インフルエンザ症状を示した中で新型コロナと確定された患者さんの68%が嗅覚障害を示した一方、通常のインフルエンザでは16%で、嗅覚障害は100%ではないが、新型コロナと強く相関することを示していた。
今我が国では一般の感染がどの程度広がっているのか、クラスター対策が限界を迎えてしまったため、わからないという状況になっている。各地域でこれを調べる一つのアイデアがやはり同じ雑誌に紹介されていた。Google Trendを使って嗅覚障害に関わる様々な言葉が何回検索されているのかを調べると、その地域でのコロナウイルス感染者数とgoogle 検索数が高い相関を示す という研究だ。PCR検査を徹底的に行なっているドイツでも相関が見られることから、信頼できる方法ではないだろうか。メディアも、国の調査不十分を非難する前に、自前で様々な検索を行えばいい。 前に紹介したように下水のPCR検査(https://aasj.jp/news/lifescience-easily/12703 )と合わせれば、原発事故モニター並みの推定ができるかもしれない。
個人的には匂いに関わる単語検索数はかなり使えると思う。というのも、十年以上前私も感冒にかかり、すっかり匂いを失った。幸い徐々に回復したが、面白いことに花の匂い、香水の匂い、ワインの匂いなど良い匂いは回復し、今や前以上にワインテースターになった一方、臭いと言われる匂いは排泄物も含めて全く戻ってこない。介護向きの人間になったのも巡り合わせかと親の介護を待ち構えていたが、この能力を使う間も無く全員亡くなってしまった。
少し余談になったが、匂いを失うと回復するかどうかが不安になる。その結果間違いなく、検索は増える。一般の人にとっては藤浪選手の報道が一つのピークになると思うが、現在の検索数を調べてみるのは絶対おすすめだ。
と前置きが長くなったが、今日紹介したいコロンビア大学からの論文は個々の嗅細胞が様々な臭い物質に反応を示し、細胞の興奮を入り口で調節している可能性を示した論文で4月10日号のScienceに掲載された。タイトルは「Widespread receptor-driven modulation in peripheral olfactory coding (抹消の嗅覚コードの受容体依存性の調節は普通に起こっている)」だ。
この研究では匂いに反応する1万個近くの嗅覚細胞の興奮を、様々な匂い物質にさらして同時観察している。仕掛けは大掛かりだが、目的は単純で、1つの細胞が様々な匂い物質に反応する可能性を確かめようとしている。
これまでのコンセンサスは、それぞれの嗅細胞は原則1つの分子に反応して興奮し、ワインのような複雑な匂いは全て高次の統合で行われるとされていた。ところが、1万個単位の細胞を同時にモニターすると、1個1個の物質に対しては確かに反応細胞は分離しているように見えても、同時に2種類、あるいは3種類の分子に晒すと、1つの分子にしか反応しないと思われていた細胞の興奮がポジティブ、ネガティブな様々な影響を受けることがわかった。
詳細は全て省いて結論だけ紹介するが、匂い受容体は実際には様々な分子と反応することが可能で、興奮の閾値を超えるという点で調べると匂い物質との一対一で対応しているように見えるが、単独では刺激の閾値を越せない分子も受容体の反応をポジティブ、ネガティブに変化させられるということだ。要するに、一つの受容体で、何種類もの刺激に違う反応を示すということで、これは入り口から大変複雑だということを示している。なぜワインの匂いが区別できるのか、到底わかりそうもない。
コロナに戻るが、匂いが戻るまで、嗅覚障害に陥った人はgoogleやYahoo検索を続けるだろう。嗅覚細胞は新陳代謝する細胞なので、必ず回復すると言えるが、自分の経験では完全に元どおりにならなかった。おそらく、この回復過程で素晴らしい匂いを脳に焼き付けることで、ぜひ素晴らしい自分の匂い世界を形成してほしい。この論文が示すように、匂いの受容は入り口から複雑だ。
2020年4月15日
昨日紹介した論文からもわかるように(https://aasj.jp/news/watch/12797 )、ガン特異的抗原さえ発現しておれば、私たちに備わった免疫機構は極めてパワフルで、それだけでガンを抑えてくれる。このことがわかると、ネオアジュバント治療のように、まずチェックポイント治療を行なったあと外科治療を併用するという戦略が出てくるのは当然だ。
もう一つ期待されているのが、ガンを放射線や抗がん剤でまず傷害して自然免疫を高めておいたあと、副作用のある治療はやめて、チェックポイント治療に切り替える戦略で、昨年トリプルネガティブ乳がんについて調べた論文を紹介した(https://aasj.jp/news/watch/10264 )。ただ、この論文を読んで驚いたのが、シスプラチンのようなプラチナ抗がん剤はチェックポイント治療の前処置として強い効果があるのに、放射線照射は全く効果がない点だ。個人的には、切断されたDNAにより炎症が強く誘導できると考えていた。
今日紹介するテキサス・サウスウェスタン医療センターからの論文は私が抱いていたこの謎の答えを与えてくれた論文で3月30日号のNature Immunologyに掲載された。タイトルは「Tumor cells suppress radiation-induced immunity by hijacking caspase9 signaling (腫瘍細胞はcaspase9シグナルを取り込んで放射線による免疫反応を抑える)」だ。
放射線照射で免疫反が起こりにくい理由の一つは、なぜか腫瘍細胞の1型インターフェロンの分泌が抑えらるからだと知られていたようだ。このグループは放射線照射後の腫瘍細胞にインターフェロンを誘導できる薬剤をスクリーニングして、カスパーゼ阻害剤のemricasanがインターフェロンα、βともに分泌されるようになることを発見する。 すなわち、ガンが細胞死を調節するカスパーゼシステムをうまく利用してインターフェロンの分泌を抑えていることになる。
そこで、CRISPRを使って様々なカスパーゼ遺伝子ノックアウトを行い、casp9をノックアウトするとインターフェロン産生が戻ること、そしてその結果、放射線照射を受けたガン細胞に対する免疫反応が誘導され、ガンを消滅させられることを明らかにしている。
以上がこの研究のハイライトで、あとは
放射線によりミトコンドリアDNAが上昇し、これを感知して自然免疫系が活性化されるが、この経路をcasp9は抑制している。 インターフェロンは、ガンのPD-L1発現誘導に必要で、これが阻害される放射線治療ではチェックポイント治療が効かなくなる。 Casp9を抑制して放射線照射したガンは、チェックポイント治療に高い感受性を示す。 Emricasanを放射線照射とチェックポイント治療に併用すると、ガン抑制効果が上がる。 などが示されている。
状況に応じて細胞の死に方を調節するカスパーゼシステムを逆手に取った、ガンの巧妙な戦略といっていいが、放射線がなぜチェックポイント治療と相性が悪かったのかよくわかった。もしこのシナリオが正しければ、放射線照射したガン局所に、インターフェロンを投与できれば、チェックポイント治療の有効性を高められると思うのだが、それが示されなかったのは残念だ。ぜひ検討してほしい。