2020年3月20日
様々な疾患の支援団体のウェッブサイトでも新型コロナウイルス感染(Covid-19)に関する情報が提供されるようになってきた。ワクチンが開発されていない今、感染予防には日常の習慣が大事になるが、昨日送られてきたAutism SpeaksからのメールマガジンにはASDと家族のための様々な情報が掲載されていた(https://www.autismspeaks.org/covid-19-information-and-resources )。今後は、多くのビデオライブラリーも加えて充実させるということなので、少なくとも書かれた内容については、google翻訳でも使って、読んで欲しいと思う。ただこの中からASDのコミュニティーが知るべきこととして書かれていた短い文章については(3月4日付で少し古いが)簡単にまとめておくことにした。
まず当然のことだが、全ての人が理解しておくべき米国疾病対策本部のアドバイスが書かれている。
手の衛生が最も重要。何度も石鹸とお湯で手を少なくとも20秒以上かけて洗う。もし石鹸とお湯がない場合はアルコール消毒液を使う。 コロナにかかわらず、体調の悪い人と接触するのはできるだけ避ける。Covid-19の感染は接触が一番危険。 目、鼻、口には触らない。特に子供にはこのことをよく言い聞かせる。 もし気分が悪い時は、自宅から出ない。もし外出が必要ならマスクで鼻と口を覆って、飛沫が飛ばないよう注意する。 咳やくしゃみをする時は、口をティッシュでおおい、速やかにティッシュは廃棄する。ティッシュがない場合は、腕や肘で覆う。 家族が触れる家具やドアの取っ手、手すり、スイッチなどはいつも消毒を心がける。 その上で、ASDの家族がいる場合のアドバイスとして、
コロナについては、どこかから聞いてくるより前に話して聞かせる。こうすることで、子供の年齢や理解力に合わせた形で情報を与えることが可能になる。 子供の入りやすい方法、例えば絵を描いたり、あるいはお話にしたりして教える。例えば風について教えるための絵本がAutism Speaksに用意されている(https://www.autismspeaks.org/sites/default/files/flu_teaching_story_final%20%281%29.pdf ) 情報を子供が自分で十分消化するよう時間をかける。これにより子供が頭の中で内容を繰り返したり、恐ろしい話でもちゃんと話せることを意味します。もちろんその時一緒に手をとって、質問に答えられるようにすることが重要です。 子供の毎日に変化がないか、あるいはストレスがかかっていないかよく注意してください。ストレスや不安を感じている時は支えてあげる必要があります。 子供はこの恐ろしい事態の中で安心できるよう、正しいポジティブな情報を伝えて安心させましょう。 これだけの情報だが、さすがと思えるアドバイスだ。
最初の頃、子供は新型コロナウイルスにかかりにくいという話が流布したが、最近Pediatricsに発表された中国からの論文では、中国疾病対策センターが把握している小児の症例は、ウイルス検査が終わっていないが疑わしいケースは2145例にのぼり、平均年齢が7歳であることが示されており、おそらく重症化する確率は低いと思うが、是非Autism Speaksからのアドバイスをもとに、子供をCovid-19から守って欲しい。
さらに重要な情報が発信されれば、また報告する。
2020年3月20日
パーキンソン病にはαシヌクレインの蓄積が重要な働きをしており、シヌクレイン症として包括的に捉えるようになった。その意味で、アミロイドやタウタンパク質の蓄積によるアルツハイマー病と同じ土俵で考えられる過程も増えてきている。特に、蓄積したタンパク質をミクログリアに貪食させ、神経死をある程度抑えるプロセスについては共通性が高い。
少し古い論文になるが今日紹介するジョージア大学からの論文は沈殿したシヌクレインの除去にNK細胞も関わる可能性をモデルマウスで示した研究で米国アカデミー紀要に1月20日発表された。タイトルは「NK cells clear α-synuclein and the depletion of NK cells exacerbates synuclein pathology in a mouse model of α-synucleinopathy (NK細胞はαシヌクレインを除去する。そしてシヌクレイン症のマウスモデルでNK細胞を除去すると病像が悪化する)」だ。
この研究は、普通なら関連付けないパーキンソン病(PD)とNK細胞を関連付けられないかと考えたことが全てだ。実際パーキンソン病の患者さんで特にNK細胞の機能が低下したという話はあまり聞いたことがない。ただ、この研究では多くのPD患者さんの脳ではNK細胞が観察され、その数も増えていることを確認する。
あとは動物モデルでNK 細胞とαシヌクレイン、そしてPDとの関わりを調べている。結果をまとめると以下のようになる。
試験管内でNK細胞株は変性シヌクレインと反応して細胞内に取り込み、分解することができる。 NK細胞が変性シヌクレインに反応すると、キラー活性が低下し、インターフェロン産生能が低下する。 マウスPDモデルで、病気発症が始まる頃に抗体投与でNK細胞を除去すると、発症率が高まり運動機能の悪化が見られる。 病理的にもNK細胞が除去されたPDモデルでは、病変の拡大が見られ、また神経炎症も認められる。 ドーパミン神経の細胞死も起こるが、線条体が中心で不思議なことに黒質の神経細胞死はほとんど起こらない。 以上が結果で、黒質の細胞死を促進しないということで、モデルとしては一般的PDの枠内で考えるより、シヌクレイン症一般で見られるNK細胞の特殊な役割を明らかにしたと考えたほうがよさそうだ。これを念頭にまとめなおすと、シヌクレイン症ではNK細胞が脳に現れ、変性シヌクレインを除去するが、その時炎症誘導能が抑えられるので、ミクログリアなどの他の炎症細胞を活性化しない。すなわち、純粋なシヌクレイン除去が可能になるという話だ。その意味で、もう少しミクログリアの状況を調べる必要があったのではと思う。
ミクログリアと比べて炎症が起こりにくいという点で、面白いメカニズムだが、ではNK細胞移植がレビー小体認知症などシヌクレイン症にお治療になるのか気になる。
2020年3月19日
皮膚ケラチノサイトは基底層、有棘層、顆粒層と分化し、最後の角化層へ分化するが、顆粒層から角化層にかけて、皮膚を外界から守るバリアー機能が形成される。特に、フィラグリンという分子の変異により、アトピーが起こることがわかってから、顆粒層でのプロセスを皮膚のバリアー機能を準備する段階として研究されるようになった。
さて、顆粒層という名前の由来は細胞内にケラトヒアリン顆粒(KG)が存在するからだが、この顆粒の形成過程や機能についてはほとんどわかっていなかった。今日紹介するロックフェラー大学からの論文は、KGが、今流行りの相分離現象を反映するのではと着想した大御所フックスの研究室が、これを証明した力作で3月13日号のScienceに掲載された。タイトルは「Liquid-liquid phase separation drives skin barrier formation(液体同士の相分離が皮膚のバリアーを形成する)」だ。
この研究では最初からKG
がフィラグリン分子の相分離によって形成されるという仮説に立って進められている。長年皮膚分化あらゆる角度から見続けてきたフックスにとっては当然の結論だし、構造的にもフィラグリンは相分離する可能性が高い。
まずこの仮説を確かめるため、一般的に行われる、相分離を観察したい分子、この場合はフィラグリンに蛍光タンパク質を結合させたケラチノサイトに導入して、確かに相分離が起こることを示している。さらに、KG形成に欠損があるフィラグリンについても同じ方法で調べ、相分離が起こりにくいことを確認し、KGがフィラグリンの相分離により形成される構造であると結論している。
さらに原子間力顕微鏡を用いたKGの観察から、KG形成のオーガナイザーはフィラグリンで、KGへと構造化する分子の種類も、フィラグリンとの関係で決まり、フィラグリンの変異によりKGの成分や力学的性質が変化することまで調べている。
普通の研究はこのへんでよしとなるのだが、さすがにフックスで、蛍光分子を結合させる方法では実際のフィラグリンの相分離能力を正確に測れないと考え、相分離に影響を与えないセンサー分子の開発を行い、正常のフラグリンが相分離した時にそこに集まって蛍光標識できるセンサーを開発している。そして、これらのセンサーを発生段階の胎児皮膚に導入する新しい方法も開発して、実際の皮膚分化で相分離がどのように起こるのか確かめている。完全を求める、この分野の大御所の執念を感じる。
この結果、KG自体がオルガネラのような細胞小器官ではなく、相分離した液体としての性質を持つことを確認するとともに、一つ一つのKGが融合することなく独立したまま大きくなるという面白い特徴を発見する。すなわち、フィラグリンの相分離を調節する別の機構が存在することが示唆され、これにKeratin10(K10)が関わることを明らかにしている。すなわち、K10が相分離してできたKGを隔離して融合を防いでいることを明らかにする。
重要なのは、このKGの形成や構造、さらには構成成分がpHの変化を引き金に大きな変化を示す点で、これにより核が細胞から放出され、角化が進むことまで示している点だ。
話はここまでで、皮膚の機能的バリアーとの関係はまだこれからの課題だと思うが、この分野に新しい方向性を示した重要な貢献だと思う。さらに、相分離という、分子の構造化という現象が、形態学を刺激して新しい分野を形成しようとしていることがよくわかった。
2020年3月18日
各国の厳しい対応を見ていると、一旦始まった感染は次から次へと広がると思ってしまうが、実際にはそれほどでもないという論文を最後に紹介したい。もちろん気を緩めろというわけではないが、恐すぎるのもどうかと思う。
The Lancetに3月12日、16日と相次いでオンライン出版された論文で、最初は米国イリノイ州のEpidemic Intelligence Serviceからの論文で、タイトルは「First known person-to-person transmission of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) in the USA (米国での最初の人から人への感染が確認された新型コロナウイルス感染)」、16日はシンガポール厚生省からの論文で、タイトルは「Investigation of three clusters of COVID-19 in Singapore: implications for surveillance and response measures (シンガポールで起こった3つのCOVID-19感染クラスター:検査と対策についての示唆)」だ。
まず最初の論文だが、12月25日から1月13日まで武漢に滞在した女性からの二次感染の記録で、この女性は帰国後1週間目に発熱、倦怠感で診察を受け、最初の受診後7日目になってようやくPCRで新型コロナと診断されている。この女性がクリニックを訪れてから11日目に夫も発熱したので、すぐに検査して、家庭内感染と診断された。
夫は慢性閉塞性呼吸器疾患を持っていたが、どちらも入院後症状は回復、20日目には自宅待機で様子を見ている。症例自体は特にどうということはないが、確定診断時、鼻腔、口腔粘膜のシュワブだけでなく、喀痰もウイルスが検出され、さらに他の場所からウイルスが消えても長期間検出された点が気になった。すなわち、喀痰なら採取方法を工夫すれば、自分で採取して検査所に送ることができ、コロナと思ったら病院に行く前に電話という指示に適合するように思う。実際、確定診断はウイルス検査なので、結局病院に行くことになるのでは元も子もない。
さて、この武漢から帰国した女性および夫とコンタクトした人を、CDCの基準を使って3段階に分けて2次感染を調べると、ハイリスクの高い夫以外は全てウイルス陰性という結果で、また医療スタッフにも感染しなかったことが確認されている。すなわち2次、3次と感染が広がる可能性は高くないと期待させる。
この結論は、16日に発表されたシンガポール厚生省からの論文からもサポートされる。この研究では、シンガポールに訪れた中国人観光客から感染したと思われる3つのクラスターについて調べている。
一つのクラスターは感染していた中国人観光客が立ち寄った宝石店と健康グッズの店で接客した店員で、30分程度の接触だが、握手を含め身体的接触があったケースで、なんと6人が感染している。ただ、2次感染は一人の家族だけに止まっている。
次のクラスターは会議のため世界から人が集まり、会議、会食などを行なったケースで、この中に感染した中国人も参加していたと考えられる。この会議に参加した3人のシンガポール人、2人の韓国人、1人のマレーシア人、そして4人の英国人が感染している。この時の会議場やホテルのスタッフには2次感染はない。ただ、マレーシア人、英国人の家族で2次感染が確認されている。
3番目のクラスターは、教会の礼拝に中国から来た参加者が感染していた例で、最初の感染者はわかっていないが、5人がこの礼拝を通して感染している。幸いこの場合は家族感染も含めて2次感染はなかった。
以上が結果で、一緒に生活をする場合は2次感染が起こっているが、それぞれのクラスターから家族以外の2次感染がないということは、家族的な濃厚接触がない限り、伝染する可能性は低いということを示している。
一方、店頭での接客、会議と会食、礼拝などは、他人でも握手を始め直接の身体的接触があるため、多くの人が感染したことになる。
以上が結果で、読んでみると確かにまだ発症前の人からの感染が一番やばいという事が分かる以外は特に新しいことはないが、改めて肌と肌の触れ合いの危険性がよくわかった。また、今行われている対応は全て適切で、要するに、一定の距離をおく付き合い、これがコロナ対策一丁目一番地ということになる。とすると、日本は比較的対策が取りやすい国と言えるかもしれない。
明日からは普通の論文ウォッチに戻すが、もちろん重要な論文は重点的に紹介するつもりだ。
2020年3月17日
SARS,MERSに関する論文を紹介してきたが、今日紹介する米国化学学会が主導で専門家を集めて発表した総説は、新型コロナの治療法開発を展望するために、SARSやMERS も含めた開発研究の現状分析で、かなり新しい話まで網羅しており、役に立つ総説だと思う。タイトルは「Research and Development on Therapeutic Agents and Vaccines for COVID-19 and Related Human Coronavirus Diseases(Covid-19と関連するヒトコロナウイルス疾患に対する治療法とワクチンの研究開発状況)」だ。
現在新型コロナウイルス感染は拡大の一途を辿っており、ヨーロッパの状況を見るとその感染力の高さに目をみはるが、一方でこれを大きなチャンスと捉えて、ビジネスと割り切って行われる研究も急速に増えている。実際出版される論文の数は毎週大きく増加し、1月から現在まで500を超えた。最初は、ゲノム、臨床例についての報告が圧倒的に多いが、すでに紹介したように創薬につながる基礎研究も増えてきた。このスピードには圧倒されると同時に、将来への希望を感じる。
この総説はこれらの論文から明らかになったことを、公開特許出願との関連で紹介しているのが特徴で、治療手段を開発するためにはこのような目配りが必要になるのだろう。
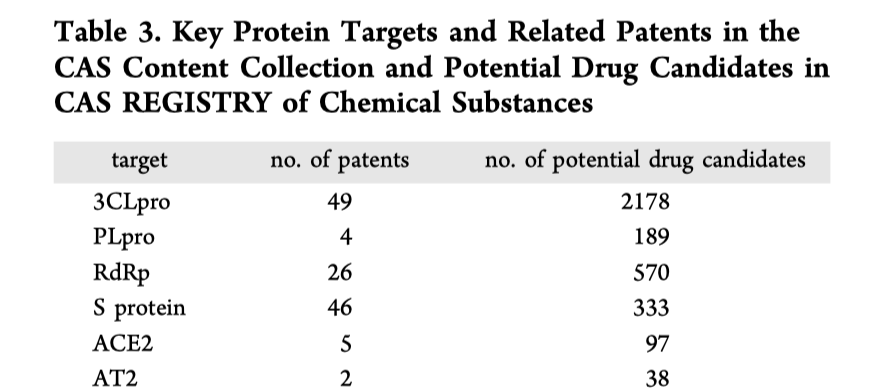
化合物の探索。 ウイルスに対する根本的な治療は、抗ウイルス薬と免疫になる。抗ウイルス薬の標的としては、ウイルスタンパク質の成熟に必要なペプチダーゼ3CLpro と PLproに対する阻害剤で、SARS,MERSに対し開発されたLopinavirやritonavirがこれに相当し、新型コロナにも使われている。
また、RNA依存性RNA ポリメラーゼ阻害剤としてレムデシビルやリパビリン、そして我が国で騒がれているアビガンもこれにあたる。新型コロナに対する治験結果も4月には出てくるだろう。
もう一つ重要な標的は、ウイルスの感染経路だが、スパイクタンパク質とその受容体、ウイルス粒子の融合に関わるTMPRSS2などに対する薬剤がすでに存在する。これらについては表2にまとめられているので、そのまま掲載する。
他には、ホスト細胞側のリソゾームの状態を変化させるクロロキンなども治験が進んでいる。
驚くのは、すでに薬剤が開発できているこれらの標的に対する化合物特許が他にも数多く存在することで、例えばプロテアーゼなどは多くのウイルス共通に効果がある可能性があるため、2000を超す化合物が特定されている。
このような中から、薬剤として開発が進んでいる化合物も増加している。
この表を見ると、我が国もシオノギ、小野、そして京大萩原さんが創業したキノファーマなど、ちょっと斜めから攻めているユニークな薬剤開発が行われており、期待したい。
生物製剤
炎症や免疫系に対する薬剤や、ワクチンが含まれる。新型コロナにも適応されるパテントで見ると、ワクチンが363、抗体薬99、RNA薬35、そしてサイトカイン療法が22種類も存在する。
驚くことに、SARSやMERSに対する抗体薬もすでに開発されており、ほとんどはスパイクに対する抗体だ。このうち新型コロナと交差反応するものはすぐにも使えるだろう。エボラの治験でも最も効果が見られたのは抗体薬だ。
これ以外にアクテムラなどの炎症性サイトカインを抑える抗体が、サイトカインストームを抑えるために治験されている。最近公開されたものでは炎症性ケモカインIP-10に結合する抗体薬なども注目されている。
ウイルス自体はインターフェロンなど自然免疫で抑えることができるので、インターフェロンを中心に様々な治験が進んでいる。全部紹介するのは大変なので、掲載の表をカットアンドペーストしておく。
肝炎ウイルスなどに対して抑制性RNAが使われるようになってきた。この分野も期待が持てるし、一昨日動物実験でこの手法を使った治療実験を紹介した(https://aasj.jp/news/watch/12590
)。また実際多様な方法が開発されているが、今回は割愛する。
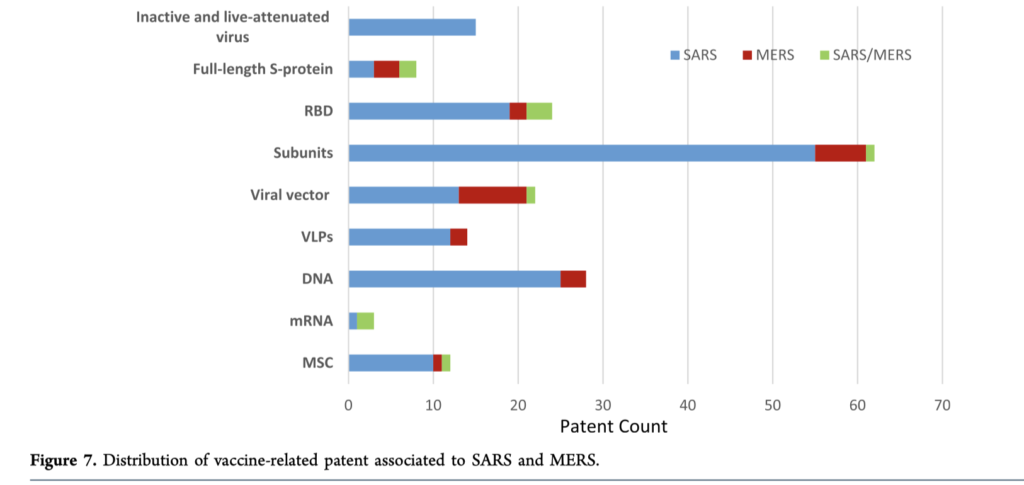
ワクチン 反ワクチン主義者のトランプも、今回ばかりはワクチンの開発を心待ちにしていることと思う。ワクチンは当然ウイルス粒子そのもの、あるいは粒子を形成するタンパク質を抗原として使う。すでにSARS.MERSの準備があるため、ウイルス粒子を抗原とするワクチンでも、同じラインで作れる可能性が高い。もちろん安全性などから考えると、スパイクなど部分タンパク質を抗原にするワクチンが開発されており、GSKと中国のベンチャー企業のワクチンは治験に近い。
抗ウイルス免疫にCD8T細胞が重要であることがわかっており、これは蛋白抗原では誘導できない。そのため、DNAワクチンやRNA ワクチンも開発が進んでいる。RNAについてはすでに米国で治験が始まっている。
現在特許として現れるのは、SARS,MERSに対するワクチンだが、どのようなタイプのワクチン開発が進んでいるのか、特許から調べた図を再掲する。
例えば精製タンパク質を使うワクチンだけでも100以上のパテントが存在し、おそらくこれらは新型コロナとも重なるだろう。おそらく全世界の人が心待ちにしているワクチンは、想像を絶するビジネスチャンスと言っていい。もちろん、一発で全て解決というわけにはいかないと思うが、とりあえず重症者の数を減らして、最後は一発で全て解決というワクチンに置き換わればいい。
以上で紹介を終わるが、新しい治療法やワクチン開発の可能性が高いことがわかり、安心できるレポートだ。一方で、世界中が消費収縮におののいているとき、ここに大きな消費機会を求めて壮烈な競争が繰り広げられていることもよくわかった。
2020年3月16日
新型コロナウイルスについて理解するとき、やはり強い肺炎を引き起こすことが知られているSARSやMERSなどのコロナウイルスについて知っておくことは重要だが、両方とも我が国では流行が起こらなかったため、専門家を除くと知識が欠けていることは確かだ。幸いThe Lancetのオンライン版にMERSについての総説が発表されたので、自分の頭の整理を兼ねて今日はこの総説を下敷きにMERSについてまとめておく。
ウイルス学 30-31Kbの大きなRNAウイルス。すでに名前から分かるように、新しいコロナウイルスはSARSの仲間として分類され、これらと比べるとMERSウイルスは少し遠縁になる。
最も面白いのは、スパイクがSARS と異なりDPP-4に結合する点だ 。ただ、違うと言ってもDPP-4はSARSスパイクが結合するACE2と同じ膜型エンドペプチダーゼだ。スパイクの結合にエンドペプチダーゼが必要なのか不思議だ。またインシュリン分泌に関わるインクレチンを標的にしている点でも、ACE2がアンギオテンシンIを対象にしているのと似ている点もあり、治療標的として期待されるスパイクの進化を考える意味で面白い。
疫学
ラクダがウイルスのキャリアーで、その結果中東に流行が限られている。ただ、人から人への感染があり、ラクダからを一次感染、人から人へを二次感染と呼んでいる。二次感染症例は大体50%。
この結果、人から人への多くは医療施設で多発する。韓国での流行も、中東からの帰国者が入院した施設から始まっている。すなわち、感染クラスターの重要性は全てのコロナ感染症共通だ。例えば韓国で起きた中東帰国者からの流行では、16の医療施設を巻き込んだ5人のスーパースプレッダーに由来することが突き止められている。
病理
信仰上の理由から報告された剖検例は2例しかない。ウイルス粒子は肺だけでなく腎臓などからも検出されるが、呼吸器のみで病理変化が認められる。基本は、出血性壊死性肺炎で、肺胞への浸出がつよい。動物モデルがあるので、期待できる。
免疫反応
免疫反応はウイルス防御と炎症誘導という諸刃の剣。
すなわち、抗原特異的免疫反応と自然免疫がうまくバランスされて初めて防御が成立する。
MERS の場合まずCD8T細胞が、その後CD4T細胞と抗体反応が続き、2−3週間で免疫反応が見られる。回復が早い場合は、抗体反応も一過性だが、重傷者では長く続く。一方、CD8T細胞反応は重症度にかかわらず長く続く。
SARSでは面白い現象として自然免疫が感染後長く続くと、抗体の産生が遅れ重症化する(これは新型コロナでも重要な点のように思える)。しかし、MERSではこのようなケースは見られない。 かわりに、MERSはT細胞に感染し、サイトカイン反応も抑えられる代わりにウイルスへの反応も低下する 。この差は、SARSとMERS で重症化機構が少し違う可能性を示唆して面白い。
感想だが、重症化の引き金を理解する意味でもsingle cell transcriptomics を用いた研究が大活躍すると思う。
臨床像
潜伏期間5−7日だが、免疫能力が低い高齢者などではもっと長い潜伏期間があり得る(ちょっと不思議な現象で、最初のウイルス増殖に免疫が役立っているのだろうか?)。
新型コロナと違い、無症状は5割以下。症状は熱、悪寒、こわばり、頭痛、空咳、喉の痛み、関節痛、筋肉痛などのあと呼吸困難。新型コロナと違い、消化器症状も多い。
高齢者や基礎疾患のある場合重症化し、ウイルス感染が遷延する。一方、子供の感染は少ない。
個人的印象では、X線所見は新型コロナとかなりよく似ている。
ウイルス診断。
MERSもSARSも最終診断はウイルス感染の証明だが、DPP-4の分布などからわかっているのは、スワブのような上部の検査だけでなく、痰に存在するウイルス検査が確定診断には必要な場合が多い。
検査自体は通常のPCRから、35分で終わる温度を変えないアイソサーマル検査、そして抗体検査まで全て開発されており、これが新型コロナ検査にも生かされている。
治療
現在新型コロナウイルスについて利用されているほとんどの治療方法はすでに試されている。
トリアージだが、56歳以上、高熱、血小板減少、リンパ球減少、CRP2mg/dL以上、痰中のウイルス濃度が高い場合は入院治療。残りはは自宅隔離。
抗ウイルス剤は、インターフェロンも含めて使われているが、科学的治験は現在進行中。おそらく、今回の新型コロナについては患者数も多いことからはっきりした結果が出てくると期待される。一般抗生剤は全く効果がない。また、新型コロナと同じで、ステロイド全身投与もあまり効果がない。
回復患者さんの血清療法は、ウイルスに対する抗体価が1/80以上の血清は確かに効果がある。また、すでにウイルスに対するモノクローナル抗体が開発され 、治験中。エボラの経験からも、これは期待できる。
新型コロナ感染で我が国でも効果が示されている体外式人工肺(ECMO)は対症療法としては最も効果がある。
ワクチン
様々なワクチンが開発中だが、多くはスパイクとDPP4の結合を標的にしている。
以上、新型コロナと共通点が多く、学ぶところは多い。ただ、違いも確かにあり、ここからも多くのヒントが得られると思う。研究の第一線では、当然MERS の経験は織り込み済みと思うが、ニュースを判断する意味でもMERSで何がわかって、また何が行われているかを知ることは参考になる。
2020年3月15日
CRISPR研究史を見れば、微生物に学ぶところが多いことがわかる。ところが、ウイルスや微生物学について多くの生物学者は意外と学んでいない。私のブログでもCRISPRや細菌叢の話題を除くと取り上げる回数は少ない。これは結局私自身の感染症の知識が乏しいことを示しており、新型コロナ感染を機会に少し勉強してみようと思っている。
以前エボラウイルスが持つ自然免疫から自己を守るメカニズムが、他のサイトカイン誘導にブレーキがかからない状態を作ってあのような激烈な症状をきたすことを紹介した( https://aasj.jp/news/watch/2023 )。SARSや新型コロナの肺病変も同じように一種のサイトカインストームによる強い炎症反応のせいだと思われるが、それぞれのウイルスは自然免疫から自分を守る個別のメカニズムを備えているはずで、このような研究分野は、治療法開発という意味では、時間はかかっても重要だ。
今日紹介するスペイン国立生物技術研究所からの論文はSARSウイルスについてそのようなメカニズムの一端を捉えた研究で、ウイルスの自己防御機能の多様性を実感することができた。タイトルは「SARS-CoV-Encoded Small RNAs Contribute to Infection-Associated Lung Pathology (SARSウイルスは感染した肺病変に関わるsmall RNAをコードしている)」だ。
私たちの細胞機能はsmall RNAと呼ばれる様々なRNAにより調節されているが、ウイルスも同じメカニズムを用いて細胞の持つ防御機能をかいくぐっていることが知られている。この研究では、まずSARSウイルス特異的に合成されるsmall RNAをSARSに感染したマウス肺上皮細胞(マウスにも感染できるSARSウイルスが開発されている)が発現しているsmall RNA配列を網羅的に調べ、3種類のウイルスゲノムにマッチするsmall RNAの特定に成功している。
これらsmall
RNA(svRNA)は、複製酵素とN遺伝子と呼ばれる領域に由来し、ウイルスゲノムと同じでセンスRNAであることがわかった。また、ホスト自体のsRNAを作るメカニズムにはほとんど依存しておらず、ウイルス感染により、ウイルスの持つ機構を使って合成される。
複製酵素やN遺伝子の転写や機能についてみると、svRNAは全く影響していない。しかし、svRNAに対応するアンチセンスRNAを持つmRNAの機能を抑えることができる。すなわちmiRNAと同じような働きを持っている。
残念ながらメカニズムについての研究はここまでで、このsvRNAがホスト側のどの分子に対応しているか特定されていない。代わりに、svRNAを抑制することのできる抑制性RNAを設計し、これを経鼻的に投与、その後SARSを感染させると、ウイルスの増殖だけでなく、炎症性サイトカインの分泌を抑えることに成功している。
おそらく、svRNAはホストから自身を守る一つのメカニズムと思われるが、今大事なことは新型コロナウイルスにも同じようなsvRNAが存在するのか、だとしたらホストのどの分子が標的かを大至急調べることだろう。SARSも新型コロナも肺病変の出現の理解が治療法開発に必須になる。幸いSARSに極めて近いという点から、SARS研究の蓄積は心強い。
明日はMERSについての総説を紹介する。
2020年3月14日
成熟後もいくつかの系列に分化できる幹細胞は存在しており、その分化決定については長年研究が続いている。分化決定が全くランダムに起こる場合もあるが、系列によっては精密に分化の方向性が調節されており、中でもよく研究されているのは昨年度ノーベル賞が授与された低酸素による分化スイッチだ。
今日紹介するベルギー・ルーヴェン大学からの論文は低酸素だけでなく低脂肪によって軟骨への分化が促進されることを示した面白い論文で3月5月号のNatureに掲載された。タイトルは「Lipid availability determines fate of skeletal progenitor cells via SOX9(脂肪の利用可能性が骨格系幹細胞の軟骨への分化を決定する)」だ。
この研究のハイライトは、移植した骨への血管侵入を人工膜で阻害した時、骨芽細胞への分化が抑制され、軟骨への分化が促進されるという、職人的な実験だ。もともと軟骨は血管が少ない組織で、おそらくこの現象は低酸素と関係していると最初は考えていたと思う。しかし、いろいろ検討しているうちに、なんと脂肪の供給がなくなると軟骨への分化が起こることを、細胞株を用いた研究で突き止める。この結果は、軟骨と骨細胞を比べた時、軟骨細胞では脂肪酸の活性が低くもっぱら糖代謝によりエネルギーを生産するのに、骨細胞では脂肪代謝への依存性が高いこととも一致する。
以上の結果から、組織形成時血管新生の抑えられた状況では血管から脂肪の供給が減り軟骨分化のマスター遺伝子Sox9が誘導され、軟骨へ分化決定が起こるということがわかった。
次に、なぜ脂肪が得られないとSox9が誘導されるのかについて追求し、脂肪酸の供給が切れると細胞内の脂肪酸を燃やして対応するが、その時ミトコンドリアで脂肪を利用するために、脂肪を蓄積している脂肪滴と細胞質の脂肪の動きを変化させるため、オートファジーシステムのスイッチが入る。この一種のストレス反応がSox9を誘導する可能性を示唆している。
最後に脂肪供給を止めた時に上昇してくる遺伝子の調節領域から、FOXO分子の誘導が脂肪代謝に対するストレスによって最初におこり、これがSox9を誘導するというシナリオを完成させている。
残念ながら、細胞内に貯蔵された脂肪を利用するストレス反応がFOXO誘導につながるのか明らかになってはいないが、脂肪が利用できないというストレスが軟骨への分化を誘導しているという発見は、意外だが説得力のある面白い話だと思う。今後、軟骨肉腫の研究、あるいは硬骨魚の進化などに関しても重要なヒントが生まれるかもしれない。
2020年3月13日
腸内細菌叢と免疫系の相互作用に酪酸、酢酸、プロピオン酸などの短鎖脂肪酸が関わっていることがわかってきた。すなわち、短鎖脂肪酸が多く合成されると、抑制性T細胞を選択的に増やしてアレルギーを抑えることができる。ただ、すべての短鎖脂肪酸が同じように働くわけではない。例えば糖代謝についてみると、酪酸はインシュリン感受性を改善させるが、プロピオン酸は糖尿病発症と相関することが知られている(https://aasj.jp/news/watch/10105 )。
今日紹介するドイツ・ルール大学からの論文は自己免疫病の一つ多発性硬化症の進行がプロピオン酸で抑えられることをヒトで示した。本当なら画期的な論文で3月19日号のCellに掲載された。タイトルは「Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism(プロピオン酸は免疫系を変化させて多発性硬化症の経過を改善する)」だ。
この研究ではまず多発性硬化症患者さんの血液と便の中の短鎖脂肪酸を測定し、プロピオン酸が患者さんで低下していることを発見する。これだけだとなるほどで終わるが、この研究では91人の患者さんになんと1日1gのプロピオン酸の服用を続けてもらうと、半分の患者さんで進行を止めることができることがわかった。また、MRIでミエリン繊維の多い灰白質を調べると、線条体で増大していることも観察している。さらに、長期に服用しても副作用はないとしている。
このプロピオン酸で多発性硬化症の発症が抑えられるという発見が研究のハイライトで、さらに人数を増やして治験を行うことが次のステップになる。ただ、著者らはCellにふさわしい論文にするため、
治療前のPAの量を決めているのは腸内細菌叢の違いで、多発性硬化症の患者さんでは短鎖脂肪酸を合成する細菌の割合が低い。 腸内細菌叢はプロピオン酸服用によっても変化し、抑制性T細胞にバランスを移す。 プロピオン酸服用により抑制性T細胞のIL10分泌が高まる。また、抑制性T細胞のミトコンドリアをリプログラムして酸素消費量を高める。 など、分子メカニズムも調べているが、驚く発見はやはりプロピオン酸服用で多発性硬化症の進行を抑えられるという発見だろう。
治験としては観察研究で、実際の効果はもう少し厳密なプロトコルで調べる必要があると思うが、期待したい。
2020年3月12日
社会性障害、言語能力低下、繰り返し行動がASDの三大症状などと言われると、何か最終宣告のように聞こえてしまうが、全くそんなことはない。今まで2回にわたって、絵本を通してのコミュニケーション、スポーツクラブに入って他の子供たちと運動する、などのプログラムで少しづつ新しい能力が開発できる可能性を示す論文を紹介してきた。
3回目の今日はバージニア大学のグループが学校で使えるようにデザインした言葉の能力を高めるためのプログラムについての治験研究で3月2日にJournal of Autism and Developmental Disordersに発表された。
このグループは長年にわたってASD児の言葉に関わる能力を高めるためのプログラムや材料を開発しており、この治験は彼らが2014年に開発した「Building Vocabulary and Early Reading Strategies 」というプログラムを小学校の課外授業として実施し、1)話し言葉の能力が改善するか、2)聞き取り能力が改善するか、3)教師がこのプログラムを実行できるか、の3つの問題を調べている。
具体的には5−9歳のASD児43人の参加を募り、まず年齢、背景、ASDの症状を揃えたペアに分けて、そのあとで無作為にペアの一人をプログラムを受ける群、もう一人を受けない群に振り分けている。
プログラムの内容だが、本に書かれた物語を大きな声で音読させることを基盤にして、読んでいる物語の内容を理解する、これまでの知識と比較する、物語をもう一度語る、物語から想像する、などの能力を途中で質問したり、文字に書せたりして意識させていくことで、言葉を使う能力を高めるようデザインされている。
重要なことは、このプログラムを学校で国語(?)の補修科目として組み入れている点で、このためにこのプロジェクトに協力してくれた先生を訓練している。
この補修プログラムは1日30分、週4日続き、全体で平均65セッション行うように計画している。そしてプログラム前後で様々な言語能力をテストして、改善が見られるかどうか調べている。
もちろん二重盲検、プラシーボなどは不可能な治験だが、プログラムを受けたグループは、ボキャブラリーのテスト、語る能力、言語全般の能力などで、受けなかったグループと比較して明確な改善が見られることから、効果は高いと結論している。
私も専門家でないので、言語能力測定に使われたEVT-2テスト、NEPSY-IIテスト、CELF-4テストで見られた改善が、実際にはどの程度なのかイメージすることはできないが、全てのテストでしっかり改善していることが示された。
詳細は専門家に任せることにして、学校で週4日、1回30分のコースが、ASD児の言葉の能力を改善できたことに感心した。おそらくわが国でも同じようなプログラムが開発されているのではないだろうか。大事なことは、これほど多面的な効果が得られるなら、学校での学習過程の中にそのようなプロジェクトが組み入れられ、多くの子供たちがプログラムを受け、その効果が常に検証されることだと思う。
以上、3回にわたって紹介した気になる治験論文は、家庭、スポーツクラブ、学校と異なる場所でのプログラムが少しづつではあってもASD児の能力を高めることができることを示している。思いつきでも、まだまだASDに対しては対症療法が重要であることが良くわかるが、それを治験として検証し、多くの人に使えるようにすることが最も重要だと強調して、ASD児に関する気になる治験シリーズを終える。