2023年9月22日
2日前から Google AlphaFold が可能にした膨大な蛋白質構造モデルから、それぞれの蛋白質のアノテーションを行う、蛋白質の機能についての理解を深めるための、新しい領域が始まった論文を紹介したところだが、今度は AlphaFold開発の本拠からさらに便利な、アミノ酸変異から病気の可能性を教えてくれる AlphaMissense が報告された。AlhphFold、 MedPalm そして AlphaMissenseと医学領域の公開AI をGoogle が席巻する勢いだが、その一貫性のある努力に素直に頭が下がる。タイトルは「Accurate proteome-wide missense variant effect predicition with AlphaMissense(AlphaMissenseによる蛋白質全体にわたる変異の効果の正確な予測)」で、9月19日 Science にオンライン掲載された。
GWASやゲノム配列決定が進み、我々の前には膨大な数の人間の遺伝子変異リストが存在する。これをアミノ酸をコードする領域の、ミスセンス変異に限っても膨大な数で、明らかな遺伝子変異による疾患として特定されているケースを除くと、多くの変異の意義が定義できないまま置かれている。
現在わかった変異にラベルをつけて機械学習を行うことで、新しい変異を診断する方法の開発が進められているが、うまくいっていない。そこに Transformer/attention を用いる大規模言語モデル(LLM)手法が登場し、アミノ酸のアノテーションや、変異の機能的効果を調べる LLM が開発され、患者さんのゲノム情報とその診断上の意味を診療室の医師が簡単に手に入れる日は近づいてきていた。
ただ、これまでの LLM は変異と医学診断というかなりかけ離れたレベルを統合しているため、正確さの限界があった。この研究では、AlphaFold という蛋白質の構造を介在させることで、変異と病気の相関性をより高めようとする試みになる。
方法だが、これまでの変異と病気診断を直接つなぐのではなく、まずそれぞれの変異箇所をマスクしてAlphaFold にインプットしたとき、構造予測がどの程度影響されるかを調べた上で、それを病気や発生異常とリンクさせるという方法をとっている。ただ、この方法では変異の構造を調べているわけではなく、変異箇所をマスクしたときの構造予測の確率計算変化を使っている点だ。
結果はこれまで開発された変異のアノテーションモデルを凌駕していることが示され、それを公開するといううれしい話だ。
具体的に、どんな変異が発達や健康の異常につながるかを16000蛋白質の、7千万変異について計算した結果のデータベースが提供され、このうち30%は異常の原因と考えられる変異で、この中にはこれまで特定された数の3倍を超える、7000種類の影響の大きなミスセンス変異が含まれている。勿論、あまり影響のない変異であることを確認する意味でもこのデータベースは重要だ。
AlphaFold と同じで、このデータベースには人間の持つ蛋白質に起こりうる2億種類の変異について計算したリストも存在しており、それぞれの分子を研究する前の重要な出発点にもなる。
以上、またまた Google 研究所の論文を紹介することになったが、この分野で世界をリードしていることは確かだ。最初に述べたように、一般医師がゲノム情報をわかりやすく簡単に得られる時代はすぐそこに来ている。
異なるレベルの生命過程を統合することが21世紀の主要な課題と思ってきたが、生成AIがそのための重要なツールとしてまず登場した。さらに目を見張るツールが現れるのか、出来たら我が国の若い研究者から報告されるのを期待したい。
2023年9月21日
ミトコンドリアは母方、すなわち卵子からだけ遺伝して、精子のミトコンドリアは子孫に伝わらないというのは誰もが知っている事実だが、なぜと問われると、よく理解していないことに気づく。ずいぶん昔、精子にミトコンドリアはあっても、ミトコンドリアDNAが欠損しているという論文が発表されているが、その後あまり追求されていない。逆に、ミトコンドリアがマイトファジーで破壊されるとか、今はやりの説明が行われているが、決定的ではない。
今日紹介する米国、トーマスジェファーソン大学からの論文は、2013年に提唱された精子ミトコンドリアにはミトコンドリアDNA(mtDNA)がないという説をメカニズムも合わせて支持する研究で、9月18日 Nature Genetics にオンライン掲載された。タイトルは「Molecular basis for maternal inheritance of human mitochondrial DNA(人間のミトコンドリアDNAが母親から遺伝しない分子メカニズム)」だ。
この研究ではまず単一精子のミトコンドリアDNAを調べて、ミトコンドリアDNAの量を調べると、バラツキはあるが、一個の精子あたり0.5−1ミトコンドリア程度で、実際には70個ほどのミトコンドリアがあることを考えると、ミトコンドリアあたり正常の14%しかDNAが存在しないことを確認している。
すなわち、精子のミトコンドリアは卵子に入っても、独自に分裂する能力が全く欠けている。実際ミトコンドリア維持に必要なDNA複製酵素や、転写のエロンゲーション因子などは全く見当たらないから、遺伝するはずがない。また、この欠損は、未熟な精母細胞から精細胞へと分化する間に誘導されていることもわかった。
この原因を調べていくと、核ゲノム(ヒトの場合10番染色体)に存在し、ミトコンドリア内での転写を調節するTFAM分子が精母細胞への分化の過程で、ミトコンドリア内に移行できなくなっていることを発見する。TFAMはミトコンドリアの核になる蛋白質なので、これがミトコンドリアにないと、ミトコンドリアの複製は望めない。
TFAMがミトコンドリアに移行できない原因をさらに探ると、転写後のRNAを短くするスプライシング過程で精子では5‘端が長いRNAができ、普通とは異なるN末端側に長い配列を持っているTFAMが精子だけで合成されていること、そしてこの長い部分のセリン配列のリン酸化により、ミトコンドリアの移行が積極的にブロックされていることを明らかにした。
この最後のメカニズムの分子基盤は完全に示されていないが、以上の結果は精子形成時にのTFAMのスプライシングを変化させてTFAMが翻訳後リン酸化されるように仕向けることで、ミトコンドリアへの移行を阻むメカニズムが進化していることがわかる。
以上が結果で、今回初めてミトコンドリアの母方遺伝の理由を納得した。勿論全ての生物がこの方法を用いているかはわからない。今後他の動物と比較していくことで、ミトコンドリア母方遺伝の始まりも理解できるようになると思う。
2023年9月20日
昨日紹介した論文は、DNA配列の比較だけでは相同性がわからなかった蛋白質を構造から比較するための新しいデータ解析の開発で、構造から蛋白質同士の関係や機能がわかる例をいくつか示している。しかし、構造の相同性で分類できたとしても、機能についてアノテーション出来るわけではない。
今日紹介するスイスバーゼル大学からの論文は、アノテーションを進めるための様々な戦略を探った研究で、9月13日に Nature にオンライン掲載されている。タイトルは「Uncovering new families and folds in the natural protein universe(蛋白質世界の新しいファミリーと構造を解明する)」だ。
研究では、3億5千万の蛋白質を50%配列相同性を指標にクラスター分けを行い、また相同性を元に全てのクラスターが関係づけられた大きな蛋白質のネットワークを作成、それにこれまでわかっているアノテーションや構造の相同性などを加えたデータベースを作っている(https://uniprot3d.org/atlas/AFDB90v4 )。
このネットワークの中で、これまでアノテーションが全く出来ていなかった蛋白質クラスターを、ダークマターと呼び、それにアノテーションを与える様々な方法を試している。
ダークマターとして分類されるクラスターも、ネットワークとして見ると、一部弱いアノテーションがつけられている分子を持つクラスターと系統的関係を見つけることが出来る。ここでは YfhOファミリーとアノテーションされた蛋白質を含むクラスターと近い関係にあるクラスターを、構造の類縁性で調べると、同じ機能を持ちそうな細胞膜分子としての構造の類似性が明確になり、アノテーションが可能になった例を示している。この結果は、昨日の論文と同じで、構造の類似性をもとに、新しい分類とアノテーションが可能であることを示している。
同じように、アノテーションが出来ていないとされる蛋白質も、クラスター化し、詳しく解析してみると機能が明らかになる場合がある。その例として、DeepFRI と呼ばれる構造を解析するソフトで新しいトキシン/アンチトキシンシステムとして機能を特定できたクラスターを紹介している。アノテーションが出来ると、バクテリアを用いた実験で、殺菌性、また殺菌作用をブロックする作用を確認できる。
面白いのは、最近整備されつつあるアノテーションのための生成AIにダークマタークラスターを読み込ませることも行っている。すると、ChatGPT と同じでハルシネーションと呼ばれる、ばらついたいい加減な答えが出てくる。ただ、答えの出方のバラツキ方は逆に利用できることがあり、多様な答えが返ってきたクラスターを選び、構造の相同性を調べると、最終的にプロファージ蛋白質とアノテーションがついた例を示している。
最後に、Protein databank に登録されている構造と異なっている度合いを算定するモデルを作成し、これを用いて Protein databank で全く分類できていない70万近くの AlphaFold によって決められた構造を特定している。そして、この中の最も美しい例として、βシートがねじれたばれる構造が花弁のようにつながったβフラワー構造をとるクラスターを特定し、その中の一部の構造から機能を phospholipid scramblase と特定している。
以上が結果で、構造だけに着目した昨日の論文と異なり、様々な手法を取り入れて、ダークマターに迫る方法を述べている。重要なのは、どちらの論文も、この宝の山が眠る荒野の入り口に立ったところで、今後新しい深層学習、相同性を探る新しい方法、そして AlphaFold を超える構造予測方法の開発が進むと、大きな研究領域になる予感がする。
2023年9月19日
ChatGPT が公開される前から、Transformer/attention と呼ばれる生成AIモデルの生命科学への導入が進められていた。中でも最大の成果が Google の研究室から発表された AlphaFold で、それまでの物理化学に基づく構造予測をほぼ過去の者にしてしまった。そして今や、2億種類の蛋白質構造が AlphaFoldデータベースで見られるようになっている。すなわち、実際の構造を見たこともない蛋白質の構造が提供されている。
9月13日、NatureにAlphaFold から見える新しい世界を解析する2報の論文が発表された。私にとってデータ解析分野は最も苦手な分野だが、それでもわくわくする論文なので、今日、明日と順番に紹介することにした。また、28日に予定しているジャーナルクラブでも少し振れようと思う。
今日紹介する韓国ソウル国立大学と、スイスチューリッヒ工科大学からの論文は、2億種類の蛋白質構造を解析するアプリケーションを開発し、見たこともない構造から新たに見える世界を示した研究で、タイトルは「Clustering-predicted structures at the scale of the known protein universe(予想された構造を現在知られる全ての蛋白質スケールで分類する)」だ。
繰り返すが研究で最も重要なデータ処理についてはちんぷんかんぷんで、この研究の結果見えた世界についてのみいくつか紹介する。
まず AlphaFold は、既に解析された36万種類の構造と92%の一致率があり、構造データベースとして信頼でき、公開データの利用も進んでいる。ただ、これまで40万種程度の構造から蛋白質の相同性を調べたり、機能を予測するアプリケーションを使うと、新たに予測された2億を超す構造の相同性やドメイン機能を解析するには、モンスターCPUと呼ばれる計算機でも10年以上かかるらしい。その結果、ほとんどの蛋白質はアノテーションが出来ないまま捨て置かれている。
このグループはまず50%の一致と、90%のアラインメントが取れる構造に限定してAlphaFoldデータベースから5日間で5千万の相同クラスターを特定、構造から相同性や機能を解析する Foldseek を開発した。研究のハイライトは、この開発部分で、これにより新たに見えてきたいくつかの例が示されている。
Foldseek により2億の蛋白質は、200万のクラスターに分類され、そのうち31%はこれまで構造的アノテーションは行われていない。ただ、全蛋白質からみるとアノテーションが出来ていないのは4%程度で、これまでの構造研究で多くのことが明らかになっていることもクローズアップされた。ただ、相同性の基準を高くとっているので、もう少し緩い基準で見れば新しい世界がもっと見える可能性がある。
最後にいくつかの新しい世界の例を箇条書きにしておく。
相同性が特定できることで、これまでアノテーションが出来ていない多くの蛋白質の機能が予測できるようになった。こうして新たにあのテーとされた分子はトランスポーターや膜蛋白質が多い。
これまで全くアノテーション出来ていない構造の進化を調べると、系統学的に古い構造が多く見つかり、細菌、古細菌、真核生物共通の構造も見られる。一方、新しく進化した構造は少なく、ヒト特異的に進化した構造は皆無と言える。
ヒトとバクテリアで構造が共通する分子には、自然免疫に関わる分子が多く、高等動物の自然免疫分子の機能は、原核生物でも必要とされていることがわかる。
中でも面白いのは、我々が外来DNAセンサーとして使っているAIMが、これまでの検索では関係がわからなかった、クロストリジウムや腸内乳酸菌の相同分子との相同性が明らかになり、原核生物のDNAセンサーがAIM分子として使い回されたことが明らかになった。
もう一つの例は、やはり自然免疫の中心分子gasderminで、最近になってgasderminと相同性を持つ分子がバクテリアにあることが示され始めているが、Foldseekを用いることで、特にこれまでアノテーションが出来ていないGroup1-gasdermin構造がバクテリアのgasdermin相同分子と強い相同性を持つことがわかる。
他にも面白い例が示されているが、それも氷山の一角で、紹介は個々まででとどめる。是非論文を読んで、蛋白質の機能や進化研究にとって全く新しい景色が見えるようになる実感を得て欲しい。
2023年9月18日
1年間カントの著作を読んできたが、そろそろカントについて書く気になってきた。といっても彼の哲学の解説をする気はないし、私がカントの解説をしても意味がない。「生命科学の目で見る哲学書」の目的は、それぞれの哲学者を生命科学者の視点で読み返し、現在の生命科学の中に位置づけることにある。特に哲学者の中の哲学者カントについては、この生命科学者の視点を貫徹して考えようと思っている。
人類が世界や自然について思いを巡らせ始めた頃、方法に科学 vs 哲学という区別はなかった。というより、科学は存在しなかった。もちろんギリシャ哲学やスコラ哲学でも、世界、自然、人間の理解について様々なアイデアが示されるが、結局Just a theoryあるいはjust an ideaでしかなかった。もちろん、Just an idea であっても権威があれば人間に大きな影響を持つ。たとえば、アリストテレスの生物に関する後生説のドグマは、18世紀になっても発生学の重要な問題として議論された。アリストテレスのドグマが現在にまで影響を保っているケースすらある。現在ユダヤ教やイスラム教は人間の始まりを受精後40日と定めているが、これも人間は最初子宮の中で生命とは言えない物質の塊(Vegetative state)を経た後、40日目に初めて人間になるというアリストテレスの考えを踏襲した可能性がある。一方キリスト教は、受精という概念が科学から提出されたとき、このドグマを捨て、人間の始まりは受精の瞬間からとする。この結果キリスト教ではヒト受精卵を用いてES細胞を樹立するのは禁止されるが、ユダヤ教では40日目までは胎児はモノでしかなく、受精卵を自由に使ってES細胞を樹立することが許される。このように一般社会では古いドグマの影響は維持され、科学の作用は限られている。しかも古いドグマが、ES細胞研究という科学を助けているのも皮肉だ。
しかし17世紀、ガリレオが確立した「科学」は、他の人と合意を得るための明確な手続きが示された革命的方法論だった。結果、この新しい方法は、どこまで行ってもJust an ideaから抜けられない哲学に大きなインパクトを与えた。もちろん哲学者が急に科学者に宗旨替えというわけには行かないが、哲学者も科学的課題により深い興味を示す様になる。例えばデカルトが解剖学に傾倒し、動物から人間まで、多くの解剖を自ら行って得た知識をもとに、自からの思想を形成したことは既に紹介した。他にも、ライプニッツは顕微鏡下にうごめく微生物に強く惹かれただけでなく、数学者としてニュートンに匹敵する業績を上げている。このように、ガリレオ以降の合理主義哲学では科学と哲学の積極的な交流が行われた。結果、逆に哲学が科学に対して大きな影響を持つケースも増えた。例えば深い解剖学の知識に裏付けられたデカルトの二元論は、人間の身体を機械と割り切ったことにより、身体の研究を加速させ近代医学の発展に寄与した。事実、「人間を機械としてしか見ない」という批判は、いまでも医学に対する常套句になっており、二元論の影響の深さを示している。
面白いことに17世紀に科学誕生後、哲学に科学の及ばない対象を求める傾向が現れる。例えば世界を考える時、自然の理解については物理学や天文学、すなわち科学に任せようとする意識が優勢になっていく。その結果、哲学の対象は人間の知識や理性へと向かい、これがイギリス経験論を産む。当時を考えると、おそらく科学者でさえ人間の知性や理性を科学の及ぶ対象とは考えていなかった。そこにロックが登場するが、彼について書いた時、「経験論は神経科学の始まりかも知れない」と紹介したように、経験論の課題は現在の脳科学者の課題とオーバーラップしている。ただ人間の知性は科学の及ばない課題として、自分の頭でじっくり考える中で理解すべき哲学の対象として位置づけられた。すなわち、デカルトでは自分とは何か、人間とは何かという問いでとどまっていた課題が、「人間の知性(Understanding)や理性(Reason)はどのように形成されているのか?」というより具体的な問題として扱われた。そして、皮肉なことに近代哲学者の中では、最も科学との接点の少ない(これは私の印象でしかないが)ヒュームによって、経験論は徹底され、私たちの知性や理性は全て経験の塊で、特別な自己すら存在しないとまで言ってのけた過激な、しかし魅力的な思想が誕生する。
我々の知性が経験で決まるというヒュームの哲学は、現代の生命科学の視点から見ても正しいと言える一方、それを支える脳については対象から除外してしまっている。このヒュームの経験論最大問題を解決すべく、人間の知性や理性、さらにこれを拡大して道徳や判断がどのように形成されるのかを、哲学の立場で考えたのがカントだ。言い換えると、ヒュームが一旦捨ててしまった自己、すなわち経験を受け取る自分の脳の役割を経験論に回復させることがカントの課題だった。そして、この困難な問題をカントはJust an ideaではなく、他の人も客観的に理解できる説明(科学的と言っていい)として提示できないか真剣に模索した。すなわち、知性や理性も生物の究極の形式として捉え、出来るだけ科学的に扱おうとした。この中で、アプリオリや、アンチノミーと言った概念が生まれるのだが、それは次回に回す。
以上がカントが取り組んだ課題についての私の個人的まとめだが、知性、理性、道徳までを生物の究極の形式として捉ようとしたカントについて教えてくれたのがシカゴ大学のジェニファー・メンシュによる研究書「Kant’s Organicism」だった、この本では18世紀の自然史と科学がカントの思想形成に大きく関わった可能性を調べている。そこでカントを直接扱う前に、この本について簡単に紹介し、批判シリーズ執筆前の、カントについて見ておくことにした。
この本の実際の出版は10年以上前で、JT生命誌研究館で中村先生を手伝っていたとき、Kindleでなんとなく購入し読み始め、難しい本なのに面白く一気に読んだ。メンシュさんは、カントが主要な著作を発表する前に書いた論文、手紙や、さらにはカントの講義を聴いた学生のノートまで丹念に読み込んで、彼がプロレゴメナや純粋理性批判を書く前に、当時自然史として知られる大きなトレンドをフォローし、生命の論理をヒントに彼の思想を形成した過程を検証している。おそらく、この時期のカントを調べた研究が本として出版されることは多くないと思う。しかし私にとっては、それまでのカント観を変えるインパクトがあった。すなわち、この本のおかげで、カントの哲学の基本が、タイトルにある「Organicism;有機体論」、すなわち生命の論理をヒントにし、形而上学と人間知性との統合を模索していたことに気づかされた。実際カントは批判シリーズの最後、「判断力批判」で新たに生命の問題をとりあげ、自然目的のもとにOrganizeされた有機体論を展開するが、メンシュさんの本は、判断力批判で述べられた思想が、実際には純粋理性批判を書くまでの長い準備期間に用意されていたことを示している。
この本はカントについての一般向けの解説書ではなく、専門家のための研究論文と言える。実際、カントについてかなりの予備知識がないと何が何だかわからないことが多い。カントの著作を読んだことがある私も最初はほとんど理解できなかったので、ざっと読み通すかわりに、自分の理解を確かめるために、翻訳しながら読んでみた。それでも理解できたとは言いがたいが、その時のつたない翻訳は残っているので、希望される方にはPDFファイルをお送りするので連絡して欲しい 。用語の統一性や哲学用語との調整などは全く無視しているので、翻訳内容については保証できないことを断っておく。
まずこの本の概要を紹介する。本の前半は、カントの哲学が準備される期間に自然史形成に関わった人々のことが紹介されおり、またカントが自然史思想とどのように接したかが描かれており、生命科学としてはその思想史を知るだけでも面白い。そして、新しい生命観、すなわち自然目的によりOrganizeされた有機体という、カントを知るための独自の視点は、その後のダーウィン進化論にもつながり、紹介する価値は高い。
この本は8章からなっており、まず各章ごとに簡単に要約する。各章のタイトルは実際のタイトルの訳。
序論
18世紀自然史の最も重要なテーマは生物の発生で、デカルト機械論の前成説(最初から身体が出来ている)から、後成説(後から形が出来る)を中心とした有機体論への移行が進んだ。とはいっても、自然史は純粋な科学と言うより、科学と哲学の混じり合った領域で、科学から哲学まで、多くの人を巻き込んで進展した。その意味でこの時代に形成されたカントの思想を後成説・有機体論、そして自然史という3つのキーワードで考えることは重要になる。実際、彼の最初の大学での講義シリーズは自然史についての講義で、人気を博している。そして、自然史から得た有機体の概念を、人間の知性や理性の理解へと拡大する。このように、自然史や当時の生命科学抜きにカントの思想形成を語ることは出来ない。
2,生命の発生と分類
自然史に関わった科学者や哲学者の多くは、発生の後成説を粒子説(我々は小さな粒子から出来ている)と組みあわせて考えた。この粒子説と後成説の考え方に当時の哲学者がどう関わったのか、ロックとライプニッツを中心に紹介している。この中で、それまでの分類中心の生物学が、「生命を持つ対象」を扱う方向へと進んだことについてもまとめている。
3,ビュフォンの自然史と有機体論の始まり
この章では、あの膨大な「自然史」を著したビュフォンと、彼と交流が深かったHales、Maupertuisを通して、彼らが自然史思想をどう形成させたか述べられている。ビュフォンは有名でも、彼の思想や業績が紹介されることは少ない。Menschさんは、当時の様々な文献を読み込んで、自然史がリンネの分類学批判に端を発し、進化、発生、代謝、遺伝と言った問題を扱う生命科学を目指していたことを、うまく紹介してくれている。また、当時の客観的科学はニュートン力学だったため、彼らが力学の力を生命理解に当てはめようとして様々なアイデアを提案していたことも紹介している。有名でも紹介する本の少ないビュフォンを知る意味でもこの章の意義は大きい。
4,カントと生命起源の問題
カントが有名な批判シリーズを発表するのは1781年からだが、これより前の30年間に自然科学の進歩を熱心にフォローしたことで、彼の哲学の基盤が準備されたと考えられる。この章では、物理学から生物学までカントがどのように理解していたのかについてまとめている。物理学や天文学分野では、カントはライプニッツから始め、ニュートン力学をマスターし、天体や物理について著作を残し、また講義も行っている。
そのカントも生命に関しては、物理学や数学とは全く異なる対象であることを認識しており、ビュフォンやMaupertuisのようなニュートン力学に基づく説明を否定し、まず理解することは不可能と考えていた。とはいえ、例えば「個体の発生についての機械論的説明が全て失敗に終わったとしても、超自然的解決を避ける方法」で理解しようとした。特にカントの理性が現象の原理からスタートして全体を認識する能力としていることを考えると、生命の起源の問題はカントにとって最も重要な問題だった。このなかで生命を目的により組織化される有機体としての彼の考えが形成される。
5,形而上学の再生
カントが正式にケーニヒスベルグ大学論理学・形而上学教授の職を得たのは1770年46歳の時だが、それまでの準備期間に様々な自然科学の最新の動向に習熟するとともに、ヒュームの経験論にも精通する。この過程でヒュームの経験論が科学に近い思想であることを認めた上で、形而上学の否定であると位置づける。そして、ヒューム経験論は新しい形而上学と統合されるべきだと考え、それを実現する新しい形而上学を模索し、それをやり遂げる自信も形成していった。この自信が彼の教授就任演説に結実することになるが、この章では「形而上学は、ある課題を自分が知りうることとの関連で決定できるかどうかを知ることと、私たち全ての判断が常に基盤としている経験的概念と問題がどのような関係を持つのかを知ることからなっている。この意味で、形而上学は人間の理性の限界の科学と言える」と、カント独自の形而上学の定義を引用し、彼の新しい形而上学について解説している。内容は難解な章だが、わかりやすく言うと世界の理解について、経験を基盤にする科学に、それを認識する脳科学を合体させるといった感じになる。重要なのは、彼の形而上学は「困ったときの神頼みと言える超越論的観念論を極力除外しようと試みている点だ。カントの目指した独自の形而上学とは何かが、彼の思想形成とともによくわかる様に書かれた章で、新しい方向からカントを理解することが出来た。
6,理性の統一から人種の統一へ
不思議なことに教授就任以降批判シリーズを発表する間の10年は沈黙の10年と言われるぐらい、ほとんどカントは外部への発信を行っていない。この章では、この沈黙の10年にカントが書き残したノートや様々な文章を読み込んで、この間、彼が何を準備していたのかを読み解こうとしている。自然史を含む科学領域から一定の距離を置いた上で、それでも人種といった遺伝と発達が組み合わさった問題と向き合うことで、動物とは明確に異なる人間精神の起源を自分なりに理解しようと試み、生命の起源もカバーできる包括的形而上学のあり方を考えた。この中で、後の判断力批判で扱われることになる、自然目的を因果性に合体さた自然史理解が生まれる。これにより、彼の批判哲学の準備は完成する。
8,Tetensとカントに見られる経験心理学
この章では教授就任後、純粋理性批判を発表するまでのカントの講義ノートなどを読み込んで彼が経験的科学を補う形而上学を構想する過程を検証している。この時カント自身の思想形成を助けたのが、タイトルにあるヨハネス・ニコラウス・テテンスだった。テテンスはドイツ語圏にヒュームを紹介したことで有名で、その思想は、経験主義的で我々自然科学者に近く、彼の「哲学探究」の一節からそれがよくわかる。
「魂の形成と発生、一連の観念の発生、そして思考の全内部体系の成長、即ち完全性の起源などなどは、もし肉体としての脳に基盤をおいているなら、有機的身体の形態形成や、発生、そして成長も同じように考えてはいけないのだろうか?」
このように、世界を外界と精神の統合として理解するという点ではカントと同じ方向を目指しながらも、完全に経験主義に立脚していたテテンスの考えは、反面教師としてなぜ経験の上に超越的理性が必要なのかについてのカントの思想形成に大いに参考になった。
最終章:カントの建築体系、純粋理性批判での体系と有機体
カントの理性は英語ではreasonだが、経験や知性を超えて、世界の原理を求める認識力のことを指している。だからこそ序論で、彼は経験できない神や霊魂の不死を純粋理性にとって避けることが出来ない課題だと、誤解を恐れず述べている。この章では、カントが経験や知性を超えた人間の理性を独自に位置づけることが出来たと確信したうえで純粋理性批判を発表し、また内容を常にアップデートし続けた彼の思想の展開を追いかけている。重要なのは、ともすると誤解される理性について、独断や神秘主義を排して説明できているかが問い直されていく点で、目的と結果が一体化した我々有機体の原理こそが、生命を可能にするとともに、人間理性を基礎であることをカントに確信させたと結論している。
以上とりあえず要約してみたが、研究書レベルの内容は、なかなかまとめるのが難しい。時間のある人は、拙訳Pdfをお送りするので読んで欲しい。
最後に、メンシュさんの本を読んで、私がカントを考える時参考にした点について箇条書きにして終わる。
カントが純粋理性批判を出版するのは1781年、カント57歳の時で、彼が哲学者を目指してから30年という長い準備期間を経てカントの主要著作が発表されている。
この準備期間は、ビュフォンを代表とする自然史思想の発展とオーバーラップしている。
自然史思想では、生物の発生や進化を取り上げることで、生物学を分類学から切り離して、生命生成の科学が目指された。最初自然史家の多くは、物理法則を生成に利用できると考えたが、最終的に生命生成を説明する基本的概念の確立は出来なかった。ただ、生命発生を、目的により組織化された有機体形成と考える点で一致する。
カントは、物理学や天文学とともに、当時大きな影響力を持っていた自然史思想の展開をフォローし、自らも自然史についての講義を行った。
この過程でカントは、後に判断力批判に示される考え方、すなわち生命は物理法則に従うだけでなく、目的により組織化され、目的と結果が一体化した物理法則では説明できない有機体という性質を持っており、人間の知性も理性もこの有機体原理に従っているという考え方に到達する。
生命科学も脳科学もまだ生まれていない時代、生命とは何か?生命進化の究極にある知性や理性とは何か?について理解するための模索が彼の著作の数々で、だからこそ生命科学や脳科学の視点から彼の試みを見直すことが重要であることがわかる。次回は、独断と偏見をおそれず、生命科学や脳科学へと発展する有機体論の萌芽として彼の思想をたどってみたい。
最後に:メンシュさんの翻訳については、一度某社から出版するという話があり、拙訳のままでは問題と思い、愛知教育大学の社会学者、哲学者の宮村悠介先生に添削をお願いし、丁寧な添削をいただいています。宮村さんの添削を参考に書き直そうとした矢先、出版しないという通告を受けました。その結果、宮村さんの添削を反映する作業を行わないまま現在に至っています。そのため、拙訳をお送りするときには、許可はいただいていないのですが宮村先生の添削もお送りします。わかりにくいところは是非宮村先生のコメントを参考にしてください。
またせっかく丁寧なコメントをいただきながら、出版できず宮村先生のご厚意を無にしてしまったこと、この場を借りてお詫びします。本当にありがとうございました。
2023年9月18日
天安門事件が起こる前の1988年に北京を訪れたことがある。あまり自由に散歩も許されなかったが、それでも朝早く北京市街を散歩すると、公園に鳥かごを持った人が集まって、おそらく鳴き声比べを楽しんでいる風景を見ることが出来た。当時は北京も高層建築はほとんどなく、胡同と呼ばれる共同住宅に人々は暮らしていた。
この時私が見た鳥の歌比べは、鳥によっては無限とも言える鳴き声を学習する種が存在するためで、行われていたのはできるだけ複雑な鳴き声を教え込む熟練の技を比べるコンテストだ。この複雑な歌を構成し発声する能力を決める神経細胞が学習とともに増えることがわかっており、Bird song learning は重要な研究対象になっている。
今日紹介するロックフェラー大学からの論文は、鳥が持つ多様な歌のレパートリーと問題解決能力が完全に比例することを示した研究で、9月15日号の Science に掲載された。タイトルは「Songbird species that display more-complex vocal learning are better problem-solvers and have larger brains(より複雑な声の学習能力を持つ鳴き鳥は問題解決能力が高く、大きな脳を持っている)」だ。
論文は現象論に終始しており、レビューアーもかなり優しいなと言うのが最初の印象だ。ただ、現象は極めて面白い。
この研究は大学の野外調査フィールドで3年間に捕獲できた鳴き鳥、およびブリーダーから購入した鳴き鳥、全部で23種類の鳴き声を記録し、鳴き声のレパートリーの数から、鳴き声の限られた種類と、限られていない種類に分けるとともに、鳴き真似能力、あるいは歌ではない呼びかける声のレパートリーを調べている。
この記録から、鳴き声の学習に制限がある鳥と、制限のない鳥に分けることが出来、制限のない鳥では鳴き声だけでも平均25種類近く、呼びかけの声を入れると100近くのレパートリーを確認できる。
次に、それぞれの鳥について、問題解決能力(例えば石をどかせて食べ物をとる)、連合学習、判断のフレキシビリティーを問う逆転学習、そして自己コントロール能について調べ、それぞれの鳥にランクをつけている。
このデータを元に、まず種レベルで歌のレパートリーと相関する能力を調べると、驚くことに歌や呼びかけのレパートリー数と、問題解決能力のランクは完全に正比例しているが、他の能力には全く相関がない。
次に種ではなく個体レベルで同じ比較を行うと、ここでも歌のレパートリー数と、問題解決能力の間でだけ、完全な比例関係が見られる。
以上のことから歌のレパートリーの学習は、問題解決の能力と同じ脳領域を用いて行われていると結論している。ただ、どの回路なのかについては全く研究が行われておらず、脳の大きさと歌のレパートリーや問題解決能力とは比例していることが示されただけで終わっている。
結果は以上で、歌の複雑さやレパートリーが、一般的学習能力ではなく、問題解決能力と完全に比例関係になるという意外な驚き以外は、ちょっと物足りない論文だ。
でも、3連休の最後、ちょっとした息抜きには良い論文だと思う。
2023年9月17日
生成AIを医療に用いる方法開発についての様々な論文がトップジャーナルに掲載されるようになってきたが、ここまで来るとあまり新味を感じない。ただ、多くの人に利用できるように学習を済ませた生成AIモデルの数が増えるのと平行して、医療や医学教育が急速に変わっていくことが予想できる。
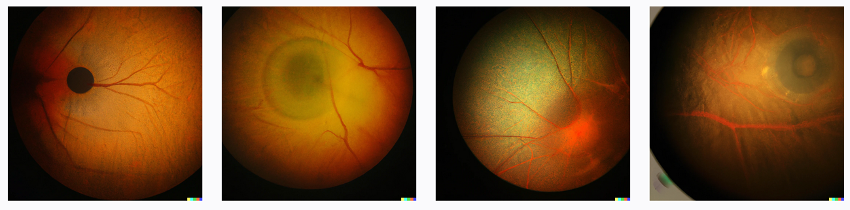
さらに今日紹介するロンドン大学からの論文が示すように、既存のAIモデルを利用して、専門分野の画像を学習させ、チューニングすることで、例えば網膜の画像から病気をかなりの精度で予測できるモデルを簡単に作れるとすると、変革の速度は想像以上になると考えられる。論文のタイトルは「A foundation model for generalizable disease detection from retinal images(網膜が像からの病気診断を一般化できる基礎モデル)」で、9月13日 Nature にオンライン掲載された。
研究自体は他の生成AI論文と変わるところはあまりない。既に、7月14日 GoogleのPaLMをベースに医学のquestion&answerを学習させ、最後に専門家がプロットを書いた内容によるIntruction fine tuningを行うことで、米国医師国家試験に85%の回答率で通過し、さらに専門家に匹敵するチャットボットが可能なMed PaLMについて紹介した。(https://aasj.jp/news/watch/22520 )。
この研究は、階層化されて集められた画像の生成AI、ImageNetに、眼科で一般的に行われる網膜画像検査のカラー画像、及びOCT(Optical coherence tomography)検査のイメージを、masked autorencoding(虫食いの画像を見せて完全画像を完成させる一種のクイズ的学習方法)と呼ばれる方法で事前学習させ、後は診断のついた画像でファインチューニングすることで、糖尿病性網膜症、緑内障などはほとんど確実に診断できる生成AIモデルが出来るという話だ。
既存の画像生成AIから専門のモデルを作れるのかといぶかしく感じられるかも知れないが、既存のAIもかなりすごい。例えばユニバーサルな画像生成AI、DALLEに、糖尿病性網膜症の眼底画像とインすると、たちまちこんな画像が出てくる。
ユニバーサルの画像AIもすごいのだ。だから、これを専門的画像だけで学習させ、少ない数の答えのわかった画像でファインチューニングするだけで、実用的な画像診断モデルができあがる。
この可能性は既に、スタンフォード大学から胸部X線写真で示され、この論文が出たときアノテーションなしにレントゲンをともかく読み込ませるtransformer/attemtopmの生成AIの力に驚いた。
以上から考えると、今回の論文は当たり前の話で、わざわざNatureが取り上げるほどかとも思ってしまうが、これまで網膜画像が診断に使われなかった、心臓疾患やパーキンソン病のような他臓器の疾患まで、網膜で診断できる可能性、及び年齢や人種に影響されにくい診断へと発展できることを示した点は重要だと思う。
ここで用いられたmasked autoencodingを用いた学習と、最後の答えを教えるチューニングのコストについて、この研究ではNNIDIAの16GのGPU一つだけ備えたPCで、かなり短期間の努力で、このぐらいの精度のモデルを形成できることを示した点でも重要だと思う。
要するに、あらゆる専門分野が、一般の生成AIとリンクされる時代がそこに来ていることが実感できた。
2023年9月16日
京大医学部の同窓会誌で、卒業後胸部疾患研究所で臨床を始めたときに世話になった泉孝英先生が亡くなったのを知った。私がすぐに基礎医学に行かずに臨床から始めたのも、また臨床研究のイロハを教えてもらったのも全て泉先生のおかげだ。この時臨床研究として取り組んだのが、サルコイドーシス、慢性ベリリウム症、そして汎細気管支炎だった。中でもサルコイドーシスは専門外来に最初から補助役として参加した。
その後1980年に留学して、完全に臨床を離れたので、これらの疾患についての私の知識はここで途切れている。しかし、何10年もたって当時感じた疑問が一つの研究で解明され感動することがある。その例が、このHP で紹介したように金属によりMHC構造が変化し、それに対する免疫反応が基盤にあることを示した研究だ(https://aasj.jp/news/watch/1783 )。
今日紹介する米国・テネシー州立大学からの論文は、サルコイドーシスの重症化に関わるCD8T細胞と細胞活性化メカニズムについて明らかにした研究で、9月13日号の Science Translational Medicine に掲載された。タイトルは「SHP2 promotes sarcoidosis severity by inhibiting SKP2targeted ubiquitination of TBET in CD8 + T cells(SHP2がCD8T細胞内でSKP2によるTBETのユビキチン化を阻害することでサルコイドーシスを重症化させる)」だ。
サルコイドーシスに関する私の知識は1980年からアップデートしていないので、Nature Review Disease Primers のサルコイドーシスを読んでみると、他の肉芽腫性疾患と同じで、何らかの抗原で刺激されたCD4T細胞が、自然免疫系、特にマクロファージを巻き込んで肉芽腫性炎症へ発展することは間違いなさそうだが、まだ抗原や悪性化についてはわかっておらず、治療も私が特殊外来に出ていた頃から特に進歩していないことがわかった。
この研究では、サルコイドーシスの進展にインターフェロンγ(IFNγ) が関わっており、膜型脱リン酸化酵素SHP2を阻害するとFNγが低下、症状が抑えられることに注目し、マウス肉芽腫モデルを用いて、SHP2を発現する細胞の特定から始めている。
結果は、CD4細胞ではなく、CD8T細胞のSHP2が肉芽腫の重症化に関わっていることを突き止める。そして、SHP2阻害剤を用いることで、肉芽腫性病変をつよく抑えることを示している。
あとは、CD8T細胞でのSHP2シグナル下流を生化学的に探索し、
SHP2はT細胞の転写因子TBETを介して、FNγ分泌を促進しするとともに、クラス1MHCの発現を高める。
TBETは、ユビキチンリガーゼSKP2によってユビキチン、分解経路に導かれる。
SHP2は直接SKP2に結合して脱リン酸化を介してその機能を低下させることで、TBETの分解が抑制され、TBETによるインターフェロン合成が誘導される。
サルコイドーシスの患者さんではSHP2の活性が高まっている。
サルコイドーシスの肺組織スライスをSHP2阻害剤で処理すると、FNγの分泌が抑えられるとともに、コラーゲン遺伝子の発現も抑えて肺線維症の進行を止めることが出来る。
以上が結果で、サルコイドーシスの重症化にCD8T細胞が関わること、この細胞が何らかの抗原で刺激されることで、サルコイドーシスの重症化が始まることをを明らかにしている。
治療の面では確かに大きな革新があるとは言えないが、ゆっくりとしてではあってもサルコイドーシスのメカニズムも徐々に解明が進んでいると実感できた。
2023年9月15日
小胞体のような膜構造を持つオルガネラ以外の細胞内凝集体は、大小を問わず今や全て相分離による凝集と考えられるようになっている。しかし振り返ってみると、相分離で細胞内のコンパートメントが形成されることが認識されるようになったのは、大きなコンパートメント、例えば核小体や P-granule と呼ばれる生殖細胞に特有の構造が最初だ。
面白いことに、核小体は rRNA が集まった相分離体だし、P-granuleはmRNA が集まった相分離体で、RNA が関わると大きな構造になるのは、それだけ RNA が大量に存在しているからと言える。
しかし、rRNA であれば種類は限られているので相分離で集まってもいいように考えるが、mRNA となると、化学的には RNA だとしても、その種類は膨大で、それぞれが P-granule に閉じ込められれば、正常な翻訳など出来なくなるのではと心配する。
今日紹介するフランス・コートダジュールの CNRS からの論文は、この素朴な疑問に答えてくれる面白い研究で、9月12日 Cell にオンライン掲載された。タイトルは「Self-demixing of mRNA copies buffers mRNA:mRNA and mRNA:regulator stoichiometries(mRNA の自己分離が mRNA同士及び mRNA/調節因子の量変化を緩衝する)」だ。
この研究では線虫の卵子形成で見られる P-granule(PG) を対象にしている。卵子の分裂が止まると現れる大きな粒子でこれまでの研究で様々な mRNA を含んでいることがわかっている。
まず PG を集めて、そこに濃縮されている RNA を調べると、基本的には静止期の卵子で翻訳が抑制されている mRNA が濃縮していることを発見する。すなわち、翻訳を抑制したい mRNA を翻訳機構から隔離している可能性がある。ただ、十把一絡げに隔離すると、当然問題が起こる。
そこで次に個々の mRNA と PG との関係を調べるため、spn-4 あるいは glp-1 をコードする mRNA に焦点を当てて動態を見ると、卵子が静止期に入ると、それぞれの mRNA は一定濃度に達すると速やかに単独で相分離を起こし、小さな相分離体を形成する。その後、単独で相分離した異なる種類の mRNA が集まり始め、大きな PG を形成することがわかった。
この過程をさらに詳しく見ると、卵子の翻訳機構が混乱しないよう、翻訳を抑制する mRNA は抑制因子と結合するが、この複合体が一定濃度に達すると、個別の相分離が起こる。こうして出来た個別の相分離体は、今度は抑制蛋白質など蛋白レベルの結合性を基盤にして大きな PG へと発展するというシナリオだ。
ではなぜこのような相分離が必要なのか?卵子は静止期に入ると、受精まで長期間既に合成した mRNA を大事に保存する必要がある。それを翻訳を抑える分子が行っているが、それだけでは細胞質への mRNA の漏れ出しを完全に抑えられないことから、相分離、そして PG形成を行うことで、細胞質の翻訳機構から完全に隔離することが出来る。
言い換えると、後で必要になる mRNA の利用を抑えてラップに包んだ後、冷凍庫にしまうようなイメージだ。ただ、大事なことは、細胞質での個々の RNA の濃度が低下すると、すぐに冷蔵庫から出し、ラップから出して使えるように出来ている点で、進化の偉大さを感じる。
これまで相分離というと、濃度を高めて機能を局在させると言った使われ方が多かったが、RNAが絡むと、細胞質への供給を適正に保つための保存庫としても機能できるとは本当に面白い。
2023年9月14日
様々な神経疾患の発生頻度には明確な男女差があるし、行動学的にも、解剖学的にも男女の脳は異なっている。この差はそれぞれのニューラルネットの違いなのだが、さらに突き詰めると遺伝子発現の差に回帰できる。ただ、人間の脳は多様性が大きく、何が男女差を決めるのか正確に特定するのは難しい。
今日紹介する米国エモリー大学からの論文は、蛋白レベル、mRNAレベルで脳の男女差に関わる分子/遺伝子を特定し、それと様々な精神状態や脳構造との関わりを調べた研究で、8月31日 Nature Medicine にオンライン掲載された。タイトルは「Sex differences in brain protein expression and disease(蛋白質の発現と病気の性差)」だ。
この研究では、男女の脳の各部分の蛋白質レベル(プロテオーム)と転写レベル(トランスクリプトーム)の分子発現を調べ、まずプロテオームレベルで13%近い蛋白質の発現が男女で異なっていることを特定する。
その上で、それぞれの分子の発現を決める遺伝要因を、全体、あるいは男女別で調べ、蛋白質の発現の差に関わるゲノムの中で、発現差の程度が男女ではっきり異なる、性バイアスが見られる遺伝子多型166箇所特定することに成功している。これまで、同じような比較で男女差を決める遺伝要因が特定された組織は乳腺で、脳はこれに匹敵する要因があることになる。
この遺伝要因の差をもう少しわかりやすく言うと、遺伝子発現に関わる多型のなかでも程度が男女で異なっている多型を特定している。そしてこれらの多型は転写調節領域やノンコーディングRNA、さらにエクソンの多型で、単純に性ホルモンで説明できない複雑な過程が関わると考えられる。
次に、蛋白質の発現とmRNAの発現を比較して、ほぼ8割の違いが両者で一致していることを確認した上で、こうして特定した男女で異なる多型分布を示すそれぞれのゲノム領域と、精神疾患の関わりについて調べ、性差を説明する14種類の多型を特定している。
例えば、その一つカドヘリン13はうつ病の原因遺伝子の一つとして知られている。あるいは統合失調症と相関するPEBP1の多型も男女差があり、この分子は脳発生に関わる。
重要なのは、こうして疾患との相関があり、同じ発現に関わる多型でも男女で程度が異な領域の多くが、炎症や免疫に関わる点で、アルツハイマー病の様な変性性疾患だけでなく、うつ病、アルコール中毒症などが含まれる。
結果は以上で、疾患と相関する多型自体は男女ともに同じように存在するので、その程度の男女差というと少しわかりにくかったかも知れない。しかし、多型の現れ方に男女差があることは、男女差を考える時に重要で、絶対的差と言うより、傾向と言えるような差を扱っている。そして、多くが様々な精神疾患の男女差とも関わっているとすると、この研究の先には、我々が自分の性をどう認識するのか、そして性同一性障害が起こるメカニズムの解明に進む気がする。その意味で、今回特定された遺伝子発現の差の中で環境に影響される可能性があるのが1%に満たない点は重要だ。すなわち、性同一性障害は遺伝的差異として調べることの重要性を示している。