2019年10月25日
お茶が健康にいいという研究は疫学から栄養学まで数多くあるとおもうが、さすがにお茶を飲んでいる人と飲まない人の脳の構造を比べた研究は見たことがなかった。
、ところが、英国とシンガポールのグループがお茶をよく飲む生活を送ってきた人と、あまり飲まない生活を送って来た人(平均70歳、1日3回以上を6点、全く飲まないを1点、それに生活年数をかけて計算したスコアで分けている)をそれぞれ15人、21人集め、なんとMRIで脳の機能と構造を調べたた論文をAging 11月号に発表した。
詳細は専門的なので省くが、お茶を長年飲んで生活してきた高齢者は、
右脳と左脳の構造的神経結合のバランスが取れているが、機能的な左右の差に大きな変化はない。 お茶を飲む人は、安静時に調べる脳全体の機能的結合が強まっている。しかし、構造的には両者で大きな差はない。 以上が結果で、お茶を飲む習慣はMRIレベルでわかる脳の変化をもたらすことを初めて示した面白い論文だと思う。
2019年10月25日
塩分のとりすぎは認知症の原因の一つになるが、これはすべて高血圧などの血管疾患の結果起こる循環血液量の低下によると考えていた。ところが今日紹介するコーネル大学からの論文は、塩分が認知症を誘導するのは、循環血液量の低下を介してではなく、Tauタンパク質をリン酸化することで脳内に沈殿させ、アルツハイマー病に似た同じメカニズム(Tauopathy)で認知症を誘導することを示した研究で、10月23日号のNatureに掲載された。タイトルは「Dietary salt promotes cognitive impairment through tau phosphorylation (食塩の摂取はTauタンパク質のリン酸化を介して認知障害を促進する)」だ。
研究では最初から食塩を多く取るとTauタンパク質が沈殿するという仮説を出して、これを検証するところから始めている。マウスに普通より8−16倍の食塩を摂取させ(人間の摂取量に換算すると12−20g)、その後様々な時期に脳内のTauタンパク質のリン酸化の有無を生化学的、組織学的に調べている。結果は著者らの予想通りで、皮質や海馬で摂取を始めて4週間と早い段階からTauタンパク質のリン酸化が見られる。また、リン酸化により切断された短い沈殿型のTauタンパク質の蓄積も進むことも確認している。そしてこれに並行して12週ぐらいから認知機能の低下が認められた。ただ、アルツハイマー病と違い、アミロイドβの蓄積は認められていない。すなわち、純粋なTauopathyが塩分摂取により誘導されることが示された。
はっきり言って、この発見がこの論文のすべてで、全く予想外の結果だ。通説にとらわれずになんでも確かめることの重要性を示している。次に、塩分摂取によりなぜTauリン酸化が起こるのか、生化学的過程についても調べている。その結果、高い塩分の食事はNO産生を低下させ、これが神経細胞内のカルパインニトロシル化を抑制してカルパインを活性化、その結果CDK5が活性化され、Tauをリン酸化する経路を特定した。これに基づき、NO産生を高めるためアルギニンを同時に摂取させると、Tauリン酸化を抑制でき、またNOの生産が低いマウスでは、高い塩分とは無関係にTauリン酸化が亢進することも明らかにした。以上の結果は、脳でのTauリン酸化の引き金はこれまで考えられていたような食塩による血管障害で、ただ脳血液循環により認知症が起こるのではなく、血管障害がTauopathyを誘導し認知症が起こることを示している。
以上がシナリオだが、このシナリオを決定的にするため、Tauの欠損したマウスに高い塩分を摂取させる実験を行い、Tauが存在しないと全く認知症は起こらないことを示している。
もしこれが正しいとすると血管性とされてきた多くの認知症でもTauopathyが起こっている可能性を示す。これについては、PETを使って確かめられるので、ぜひ新しい目で認知症を調べなおしてほしいと思う。
2019年10月24日
9月9日、「寝ないで済む突然変異」というタイトルでカリフォルニア大学サンフランシスコ校が発表したアドレナリン受容体の活性が低下する突然変異の論文を紹介したばかりなのに、今度は同じグループから違う遺伝子の活性が高まった突然変異がやはり睡眠時間の短縮につながるという論文が10月16日号のScience
Translational Medicineに掲載された。タイトルは「Mutant neuropeptide
S receptor reduces sleep duration with preserved memory consolidation (Neuropeptide S 受容体の突然変異は記憶の固定化機能を損なわずに短時間睡眠を可能にする)」だ。
要するにこのグループは睡眠時間が一般より短い人を代々輩出している家族を見つけ出し、その遺伝子を特定して睡眠の分子メカニズムを研究している。今回は、父親と息子睡眠時間が短い(父親平均5.5時間、息子4.3時間)家族を発見し、両方に共通な遺伝子変異をエクソーム解析でNeuropepitide Sに対する受容体NPSR1の206番目のアミノ酸がチロシンからヒスチジンに変化していることを特定する。206番目のチロシンはなんとカエルやトカゲから人間まで保存されている。
そこで例のごとく同じ変異をマウスに導入して、マウスの行動解析を行うと睡眠時間が1時間近く低下、また活動的に動いている時間も1時間ぐらい増加している。
次にこの突然変異による分子機能を調べるため、受容体下流のリン酸化CREB量を調べ、覚醒時、睡眠時ともに突然変異マウスで上昇していること、また脳のスライス培養を用いて睡眠に関わる脳領域の細胞のNeuropeptideSに対する反応を調べ、刺激に対して深く長く反応するタイプの神経が突然変異マウスで増加していることを明らかにする。すなわち、この変異は活性化型の突然変異であることを示している。
さて、普通睡眠時間が短いと、睡眠中に行われる記憶の固定化が障害されたり、様々な問題が発生するのだが、この家族は特に症状はなく、また突然変異マウスも特段の行動以上は示さない。それどころか、睡眠を障害することで低下するコンテクスト記憶の固定化も、突然変異マウスではあまり低下しない。すなわち、寝なくともしっかり記憶機能を維持できるということがわかった。
話は以上で、読めば読むほど望ましい突然変異で、どうしてこの変異が極めて稀な変異のままで止まっているのか不思議な気がする。残念ながら、この変異を持つshort sleeperが本当に何の問題もないのか、詳しい臨床的研究も必要だろう。何か睡眠の秘密が、このグループの発見した家族の解析から分かるような気がする。
2019年10月23日
バイアグラというと男性の不能症の治療の特効薬として広く知られているが、実はこれ以外にも様々な疾患の治療に使われている。もともとバイアグラは、NOにより活性化されるグアニルシクラーゼにより生まれるcGMPを分解するフォスフォディエステラーゼの
阻害剤として開発され、平滑筋の緊張をとり血圧を下げる薬剤として開発されたが、同じ経路が勃起不全を改善することがわかりこの点だけが一般に知られるようになった。ただ同じ作用は様々な血管病にも効果を発揮し、例えば肺高血圧、高山病、レイノー病、妊娠中毒症などに効果が見られることが知られている。さらに2016年には赤血球内のフォスフォディエステラーゼの機能を阻害して赤血球の膜の可変性を制限することでマラリア原虫を退治する可能性まで示されている。
今日紹介するカリフォルニア大学サンタクルズ校からの論文はバイアグラを血液幹細胞を骨髄から末梢血へ動員するための刺激として使える可能性を示した論文でStem Cell Reports11月12日号に掲載された。タイトルは「Viagra Enables Efficient, Single-Day Hematopoietic Stem Cell Mobilization (バイアグラは1日という短期に血液幹細胞を効率よく動員する)」だ。
さて末梢血幹細胞移植は21世紀に入って急速に数が増えてきており、血縁者間での造血幹細胞輸血では骨髄移植よりはるかに数が多い。おそらく侵襲性が少ないためこちらを選ぶ人が多くなってきている。G-CSFを4−6日間かけて毎日注射したあと血液を採取するが、人によってはうまく幹細胞が得られない場合もある。
そこでこれまでより簡単に造血幹細胞を末梢血へ動員して採取する方法の開発が進められており、骨髄の血管内皮に働きかける様々な薬剤が一定の効果があることが示されている。この論文の著者らは、このような因子を探索するうち、バイアグラの作用を骨髄で造血幹細胞の末梢血への動員に使えるのではと着想したと思う。しかし、バイアグラをいくら大量に服用させても、マウスの幹細胞は末梢血へ動員されなかった。
そこで次に造血幹細胞と骨髄ニッチの相互作用に関わる分子CXSCR4に対する阻害剤をバイアグラを服用させた後1時間後に皮下注射する方法を試してみると、造血幹細胞が十分な数採取できることを発見する。
残念ながらG-CSFを投与する方法と比べると、未熟幹細胞数では分化した幹細胞も多く含まれており、未熟幹細胞という観点で見ると回収率は半分ぐらいといえる。その結果、放射線照射したマウスの長期造血再建は可能だが、能力はG-CSF法と比べるとはるかに劣ると断じざるを得ない。
結果は以上で、G-CSF法に取って代わる方法にはならないと思う。ただ、すべてのプロトコルが2時間で終わるという意味で何らかの理由でG-CSF法が使えない人にはやってみる価値はあるかもしれない。
ただこの論文では全く追求されなかったメカニズムについてさらに調べると面白い話が出てくるような気がする。というのも、骨髄の血管システムは類洞担っており、血管内皮に血液が通れる穴が空いており、血管外から血管へのルートができている。骨髄で作られた細胞の出入りを調節するメカニズムはあまりわかっていないが、今回のバイアグラの結果は分子標的がわかっている点で、このとっかかりになるような気がしている。今後造血だけでなく、がんの転移も含めてバイアグラの作用を調べると面白いのではないだろうか。
2019年10月22日
チェックポイント治療を確実なものにする鍵は、いうまでもなくガン抗原に対する免疫を成立させることだ。この方法の開発は、今や百家争鳴と言えるほど創意に満ちており、それぞれいつでも実際の臨床に使われてもいいといった技術が目白押しだ。
今日紹介するイェール大学からの論文はCRISPRを用いてネオ抗原の発現量を高めるという、これまで考えられているネオ抗原からペプチドワクチンを作成したり、あるいはRNAワクチンを作成するのとは全く違った面白い発想で、Nature Immunologyオンライン版に掲載された。タイトルは「Multiplexed activation of endogenous genes by CRISPRa elicits potent
antitumor immunity (遺伝子活性クリスパーにより内因性遺伝子を多元的に活性化することで強いガン免疫を誘導できる)」だ。
この研究ではクリスパーを遺伝子ノックアウトや改変に使うのではなく、特定のゲノム上で遺伝子発現を活性化する方法として用いている。実際には、ウイルスの持つ遺伝子活性化分子VP64をCas9(DNA切断能力を除去してある)に結合させて、この分子をガイドRNAで転写させたい遺伝子に連れてくることで、遺伝子発現を高める技術を用いている。
まずニワトリのアルブミン遺伝子をネオ抗原に見立てて、この発現を高めることで免疫原性が高まりガンを抑えることができることを様々な実験で確かめている。例えば培養したガン細胞の抗原発現を高めることで、ガン細胞自体をワクチンとして使えることも示している。
このような一連の検討をモデル抗原で行なった後、次にCas9―VP64をあらかじめ導入したガンを移植し、このガンが発現しているネオ抗原をガンが発現している遺伝子の突然変異をエクソーム解析で調べ、この結果から設計した1000種類を超すガイドRNAをアデノ随伴ウイルスベクターでマウスに注射することでガンの免疫を高めることができることを示している。
そして最後に、Cas9―VP64とガイドRNAをそれぞれ別のベクターで、未処理のガン細胞に導入することで、、同じようにガンの増殖を抑制できることも示している。
その上で、この方法で誘導されたガン抗原特異的T細胞は長期にガン局所で、抗原反応性を失うことなく維持されること、またエクソームによる変異解析から設計したガイドを用いると、特定の抗原受容体を持ったT細胞が増えること、そしてガン局所のT細胞が強く活性化の方向へ再プログラムされていることを単一細胞遺伝子発現を調べて示している。
結果は以上で、ワクチンを新たに作るのではなく、ガン自体のネオ抗原の発現を高めてやることでガンのネオ抗原を網羅的にカバーして免疫を誘導できるという話で、今後様々な応用が可能だと思う。実際の臨床応用を考えると、エクソーム解析からガイドの設計、ベクターへのクローニングまでどの程度の時間がかかるかが問題になると思うが、クリスパーもこんな使い方があったのかと感心した。
2019年10月21日
1型糖尿病(IDDM)は自己免疫病なので、他の自己免疫病と同じでウイルス感染が最初の引き金になる可能性についてはこれまでも議論されてきた。今日紹介するオーストラリア・ウォルター・エリザホール研究所からの論文は、小児の腸炎の最も多い原因であるロタウイルスがIDDMの引き金になる可能性を議論した意見論文でPlos Pathogen に10月10日オンライン掲載された。タイトルは「Does rotavirus turn on type 1 diabetes?(ロタウイルスはIDDMの引き金になるか?)」だ。
さてこの論文は実験論文ではないので、なぜ著者がロタウイルスがIDDMの引き金になると考えているのかについての証拠を一つ一つ紹介しよう。
これまでIDDMの自己抗原として働くことがわかっていたIA-2とGAD65ペプチドと、ロタウイルスのVP7由来ペプチドの一部が類似しており、自己抗原特異的T細胞を刺激する可能性がある。 膵島やインシュリンに対する自己抗体の上昇はロタウイルス抗原に対する抗体と相関していることが多い。 ロタウイルスの感染は膵島を障害することが、様々な動物実験で示されている。 IDDMは20世紀後半から患者さんが増えてきている。これは、保育所で子供がロタウイルスを貰う確率が高まったからとも考えられる。 50万人規模の調査で、ロタウイルスワクチンを受けた子供では、IDDMの発症が41%も低下した。特に、数種類のロタウイルスをカバーするワクチンを接種した子供の方に効果が高い。 以上が著者の考察で、リストされた証拠はかなり説得力がある。もちろん、同じ結果がわが国でも通用するかは、この病気の遺伝リスクの最も重要なものが組織適合性抗原であることを考えると、調べてみないとわからない。いずれにせよ、ロタウイルス自体膵臓の障害もあるとするなら、ワクチン接種は重要な手段として推進する方がいいだろう。
2019年10月20日
今でも、「チンパンジーと人間のゲノムはほとんど変わらないのに」という話を持ち出す人は多い。しかしこのブログでも何度か紹介したと思うが、チンパンジーと人間のゲノムをただ比べて、ただの違いを議論することは時代遅れになっている。代わりに、新しい遺伝子や機能が発生する、比較的大きな欠失や重複を(CNV)調べることの重要性が明らかになり、猿にはないが人間にある新しいCNVの研究が進んでいる。
今日紹介するワシントン大学からの論文は、CNVを人間進化での自然選択を調べるために詳しく調べた論文で10月18日号のScienceに掲載された。タイトルは「Adaptive archaic introgression of copy number variants and the
discovery of previously unknown human genes (古代人のcopy
number variantionの適応的流入を調べていくと新しい人間の遺伝子も見つかる)」だ。
統計学的手法にはもっぱら疎いので詳細は本当は理解できていないのだが、この研究では比較的自民族特有のゲノムが維持されており、またデニソーワ人から流入したゲノム領域が多いメラネシア人に焦点を置き、ネアンデルタール、デニソーワという古代人とともに、アフリカ人(サピエンス以外との交流はない)やその他の様々な人種のゲノムを比べ、それぞれのCNVをリストし、比べている。
もちろん各民族特有のCNVを見つけてそれが選択され新しい遺伝子に変化する様子を調べる研究も可能だが、著者らはこれらのCNVの中からネアンデルタール人、デニソーワ人由来のCNVを選び出し、その中からメラネシア人に高い頻度で見られるが、他の人種には稀にしか存在しないCNV、すなわちメラネシア人の民族形成で自然選択された確率が高いCNVを9種類リストしている。
この研究ではさらにこの中から、16番染色体のp11.1-p11.2領域と、8番染色体のp21.3 領域にそれぞれデニソーワ人、ネアンデルタール人から流入してきたCNVについて詳しくメラネシア人までの遺伝子の変化の歴史を調べている。
詳細は省くが、16番染色体のp11.1/2領域は100-200万年前に起こったNPIP遺伝子のこの領域への挿入により、このサイトが変異のホットサイトにかわり、デニソーワ人で重複や逆位がおこり、このCNVがデニソーワ人から我々の先祖に5万年前に流入し、他のユーラシア人では消え去っても、メラネシアでは高い確率で今も維持されていることがわかった。この領域は、自閉症スペクトラムの変異のホットスポットになっており、メラネシアに維持される変異がこの疾患とどのように関わるかは極めて面白い問題になる。
8番染色体の21.3領域に見られるTNFRSF10の重複はまず類人猿で3千万年前におこる。これによって、チンパンジーでは何種類かのこの分子が存在するが、ネアンデルタール人では新しく2つのTNFRSF10の融合した新しい遺伝子が生まれ、人類では他の遺伝子が非機能的になり、この融合遺伝子のみに集約する。ところが、ネアンデルタール人との交雑であらたに機能的な2種類のTNFRSF10が流入し、メラネシア人だけに流入した遺伝子がなんらかの機能を持って維持されているというシナリオだ。
このような精緻なゲノム解析を組み合わせることで、人間を今起こっている進化の対象として研究できることを示した力作だと思う。また、百万年ぐらいの人間の歴史の中で、新しい遺伝子が発生してくる可能性もよくわかる。もちろん、どのような選択が働いているのかはこの研究からだけでは明確でない。しかし自閉症など、今後見るべきエキサイティングなポイントはゲノムから示された。今後の大きな発展が期待できる予感がする。
2019年10月19日
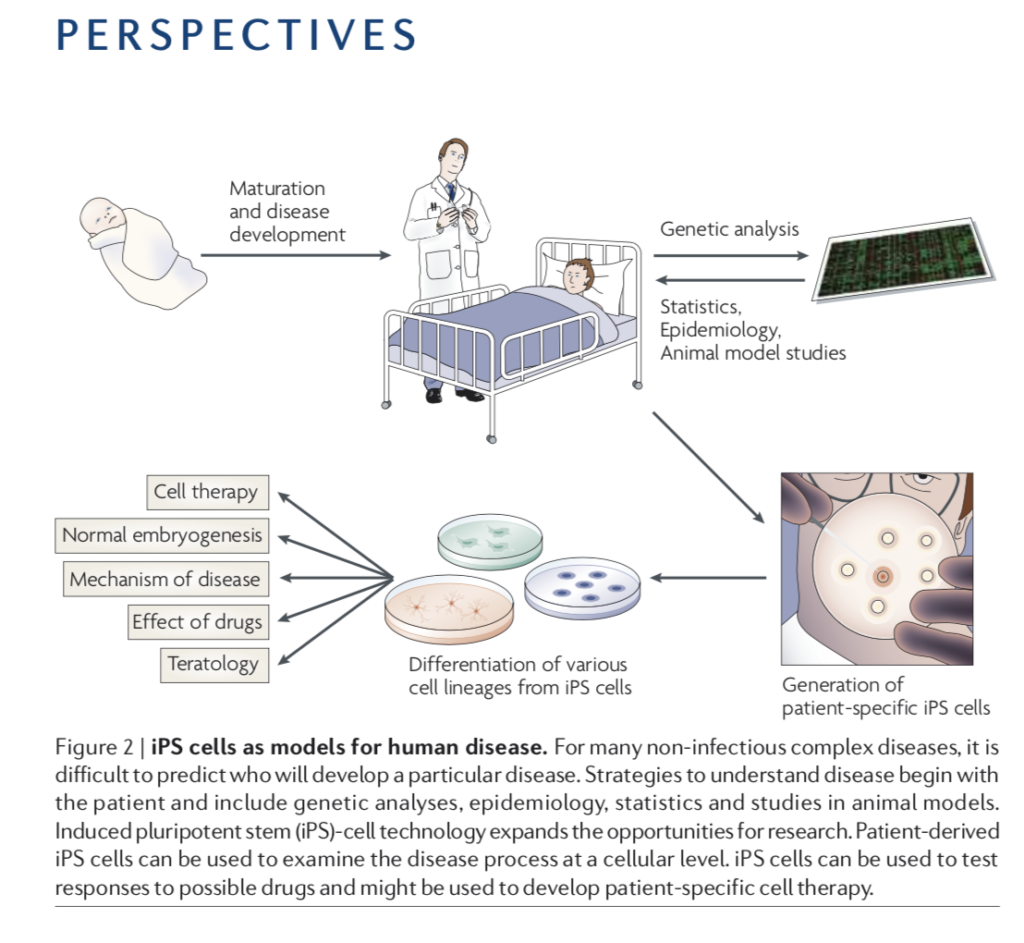
図は、山中さんがヒトiPS作成に成功したあと、私がNature Review Molecular Cell Biologyに米国の1型糖尿病患者団体JDRFの友人と一緒に描いた、iPSへの期待についての論文から転載した図だが、この時患者さんからiPSを作成し、一方でゲノム解析を行って、疾患の成立メカニズムを細胞レベルで調べる研究が大きく発展するのではないかと期待した。この時CRISPR技術は念頭になかったが、その後この技術で遺伝子変異を再構成して調べることも可能になっている。
今日紹介するニューヨーク・マウントサイナイ病院からの論文は、正常iPSに統合失調症と強く相関が見られるSNPや発現量の違いを再構成しようとする研究で疾患iPSを超える可能性にチャレンジした論文だが、読んだ後やはり病気の再構成は統合失調症のような多くの遺伝子が関わる病気については、先は長いという印象を持った。タイトルは「Synergistic effects of common schizophrenia risk variants(統合失調症リスクのコモンバリアント変異は協調的効果を持つ)」だ。
現在まで統合失調症と相関が認められる遺伝子変異は150種類に達しようとしている。異なる遺伝子でも、小さな変異が集まって共通の病気を誘導していると思われるが、さすがにこの小さな変異を集めてという点を細胞レベルで再現するのは難しい。そこで、この研究では、コモンバリアントの中でも特に遺伝子発現の差としてはっきり相関性が認められる遺伝子をまず探し、様々な前駆体タンパク質を活性化するセリンプロテアーゼFurin、およびシナプス形成に関わるSNAP91、TSNARE1に焦点を合わせることを決めている。ただ、この選択は恣意性がないとは言えないと思う。
さて、一番正しい再構成は統合失調症と相関するSNPをゲノムに導入することで、著者らもこれに挑戦しているが、これはまだまだ簡単ではない。というのも、今のところSNPを導入した細胞を選択するのは、個々の細胞の遺伝子を調べる以外に方法はなく、いくらCRISPRでも大変な実験なようだ。最終的には苦労が認められ、このサイトでAAがGGになると、細胞や分化時期で発現が大きく変化することが示され、また神経突起の伸長に異常があることを明らかにしている。すなわち、iPS を用いるとコモンバリアントの細胞レベルでの効果を確かに調べられる。
残念ながら、SNPを導入したのはfurinだけで、あとは細胞レベルの発現の違いをCRISPRで抑制したり、活性化したりする方法で、シナプス形成分子の発現を変えることで、たしかにシナプスでの興奮性が変化することが確認できる。ただ、furinのデータと比べると、インパクトは弱い。
そこで最後に、furinのSNPと、他3種類のシナプス形成分子の発現異常を組み合わせて導入した細胞を、それぞれの変異を持った細胞と比べ、統合失調症の変化を再構成されるか調べている。また、統合失調症患者をはじめとする様々な病気の患者さんの脳細胞のデータと遺伝子発現について比べている。
この再構成実験では機能的検討ができておらず、遺伝子発現のパターンで再現どを評価しているが、全てを合わせたことで、様々な疾患とより強い正の相関を得られることを示している。
結局多くのデータをうまくまとめたという印象があり、またSNP自体を導入するのはやはり大変な実験なので、遺伝子変異を細胞内に再構成するという道のりはまだまだだと思った。その意味で、2008年に期待しように、多くの遺伝子型の細胞を集めて分析することも意外と近道だと確信した。
2019年10月18日
タバコをやめるとメタボになるのは経験済みだが、タバコを吸っている人の方が2型糖尿病が多いという話は私も知らなかったし、それほどポピュラーな話ではないのではないだろうか。ただ、いくつか論文はあるようだ。
今日紹介するニューヨーク・マウントサイナイ医科大学からの論文はラットを用いてニコチンと糖尿病の関係を解析した研究で10月16日号のNatureにオンライン出版された。タイトルは「Habenular TCF7L2 links nicotine addiction to diabetes (脳内側手綱核のTCF7L2はニコチン中毒と糖尿病を結びつける)」だ。
この研究は、脳幹部の内側手綱核でまさに翻訳されつつある遺伝子を調べていたところ、TCF7L2がコリン作動性の神経に強い発現が認められるという発見がきっかけになっている。
内側手綱核はこれまでの研究でニコチン中毒に関わることが知られている。一方タイトルにあるTCF7L2は遺伝子発現を調節する転写因子の一つで、インシュリンの分泌を促すことが知られており、糖尿病に関連する遺伝子の代表として知られている。そこで、著者らはひょっとしたらTCF7L2がニコチン中毒に関わるかも知らないと着想したのだと思う。
TCF7L2 のβカテニン結合サイトを変異させたマウスを用いてニコチンに対する反応を調べると、正常マウスと比べニコチンを入った水を多く飲むようになる。また、クリスパーを用いて手綱核でのTCF7L2をノックアウトすると、やはり同じようにニコチンへの嗜好性が高まる。しかし他の嗜好性は変わらない。すなわち、ニコチン中毒が出たことになる。
この実験系で、糖尿病に関わる様々な因子の手綱核への影響を調べると、GLP-1をブロックするとニコチン嗜好性は低下するが、インシュリン自体は影響がないので、GLP-1が直接手綱核に働いて複雑なネットワークを作っていることを示している。
詳細は省くが、次に生理学的検討を行い、TCF7L2は手綱核のcAMPシグナルを抑制して、アセチルコリン受容体の刺激後の回復を遅らせる結果、TCF7L2の機能低下によりニコチン中毒が発生すると結論している。そして手綱核と糖尿に関して検討し、
手綱核の刺激は交感神経を介して血糖を高めること、 GLP-1は手綱核のTCF7L2の発現を高めて、ニコチンの影響を抑えること、 を明らかにしている。
最後に、ニコチン中毒ラットを作成して、
ニコチン中毒では、血糖が低下した時に見られる炭水化物への欲求が更新すること(Carb cravingとして知られる)、 血糖自体も手綱核のアセチルコリン受容体の作用を抑制して、フィードバックをかけること、 ニコチン中毒ではインシュリンやグルカゴンの分泌が高まっていること、 そして慢性中毒ラットでは血糖が上昇することを示している。 以上が結果で、手綱核がニコチン刺激と血糖や、GLP-1刺激のハブとして複雑なネットワークを形成しており、その結果ニコチン依存が高まると糖尿病の危険が高まることも理解できた。
2019年10月17日
田中耕一さんがノーベル賞に輝いた質量分析の分野は、地味とはいえ生命科学に大きな変革をもたらしている。例えばDNAが完全に分解してしまう恐竜時代のコラーゲンのアミノ酸配列を調べることが可能になり、古生物学や考古学に新しい分野が生まれている。同じように、様々な修飾を受けたタンパク質の定量も可能になり、これまで発現量のみで調べていた細胞内のグローバルな変化を、修飾タンパク質にも広げることができるようになった。
今日紹介するドイツ・ミュンヘンにあるルードヴィヒ・マクシミリアン大学からの論文は、質量分析技術をリン酸化タンパク質の定量に応用して、脳活動とタンパク質のリン酸化との関係を詳しく調べた論文で10月11日号のScienceに掲載された。タイトルは「Sleep-wake cycles drive daily dynamics of synaptic phosphorylation (睡眠と覚醒のサイクルが毎日のシナプスリン酸化の動態を支配している)」だ。
この研究のハイライトは12時間おきに繰り返す夜と昼のサイクルに合わせて、多くのタンパク質がリン酸化のレベルを変化させるという発見に尽きる。タンパク質でみると1600近く、リン酸化されるペプチドでいうと7200を越すサイトがリン酸化のサイクルを繰り返している。実際の図でみると本当に美しい。
また、リン酸化のサイクルも脳の活動をしっかりと反映している。これから覚醒するという時には細胞接着(シナプス)、イオンチャンネル、トランスポーター、水酸化酵素、リン酸化酵素などがリン酸化を受け、これからの電気活動に備える。一方、これから眠るという時には、軸索の伸長、細胞骨格、ユビキチン化、シナプスの細胞学的変化に備えるのにうまくフィットしている。
また、もともと500しかないリン酸化酵素のうち実に128種類が同じようなリン酸化のリズムを刻み、そのうちの65%は活動期にリン酸化される。しかもこのリン酸化のリズムはほとんどがシナプスに限定して起こっている。
最後にこれが遺伝的な概日リズムか、覚醒と睡眠行動にリンクしたものかを、マウスの眠りを妨げる実験で調べ、ほとんどが覚醒・睡眠の実際の行動にリンクしていることを示している。
話はこれだけで、データを見ていると美しいなと納得するが、よく考えると何も驚くことはないという論文だった。できれば、夜と昼で行動性が逆になっている動物などで同じような実験をして加えてくれればと思うが、まあこれだけはっきりしていると現象論でもいいだろうと許してしまう。とはいえ、何がこのリズムの引き金か、やはりフラストレーションは残る。