2019年2月22日
我が国ではもっぱら倫理問題でしか話題にならないCRISPR/Casの難病治療への臨床応用もほぼ時間の問題になってきたことを示すかのように、Nature Medicineでは新生児期に一度だけ遺伝子編集を行い病気の進行を遅らせることに成功した動物実験がなんと3編も発表された。2編は核膜分子Laminの変異の遺伝子編集、そして1編は筋ジストロフィーの遺伝子編集治療についての論文だ。要するに結論は、クリスパーシステムを組み込んだベクターを静脈注射で新生児の全身に投与すると、体細胞の一部の遺伝子を正常化し、寿命を延ばすことができるという話だ。
今日はこの中から筋ジストロフィーに関わるdmd遺伝子の編集を行なった論文を紹介する。タイトルは「Long-term
evaluation of AAV-CRISPR genome editing for Duchenne muscular dystrophy(アデノ随伴ウイルスを用いたドゥシャンヌ型筋ジストロフィーのCRISPRゲノム編集の長期経過の検証)」だ。
CRISPR/Casの力が認識された当初からデュシャンヌ型筋ジストロフィーはCRISPRを試すのに最も適した病気として考えられ、研究が続いている。というのも、すでに3年前にこのコラムで紹介したように(http://aasj.jp/news/watch/4683 )、遺伝子がX染色体にコードされており、病気になる男性では一個しか遺伝子がないこと、また変異が存在するエクソンを除いてしまっても機能的タンパク質が作られることがわかっており、すでに編集を行うためのガイドが決定されている。そしてこれらのガイドを用いて、生きたマウスの細胞の遺伝子編集が可能であることも示されている。
ただ、その後の研究で大人のマウスにCRISPR/Casを注射すると、Casに対する抗体やT細胞性反応が誘導され、副作用の元になることもわかってきていた。それなら、免疫反応を逃れやすい新生児期にCRISPR/Cas遺伝子編集を行ったらどうかを調べたのがこの研究だ。
この研究でもdmd遺伝子のエクソン23の変異モデルマウスを用いて、このエクソンを2つのガイドRNAで潰すという戦略をとっている。そして生後2日目に一つのグループは筋肉に、もう一つのグループは静脈に遺伝子編集ベクターを注射、注射後8週間と、1年後に、同じように処理した大人のマウスと比べている。
症状の改善で見ると、大人のマウスに筋注したグループでは、編集できた細胞が時間とともに減少する。一方、新生児期に静注したグループでは、8週より1年目の方が編集を受けた細胞の比率が上昇している。そして筋肉の障害を示すクレアチンキナーゼの値も低下する。実際の症状についてはあまり書かれていないので評価が難しいが、命に関わる心臓では10%近い細胞で編集がうまくいっている。一方、骨格筋の方は大体2%程度と言える。ただ、これは一回注射しただけの結果なので、今後さらに効果を高めることは可能だろう。
同じ号に掲載された他の論文と異なり、この研究では編集により起こりうる様々な問題についても詳しく検討している。まず、Casに対する免疫反応だが、大人を編集するときは筋肉注射でも、静注でも抗体が誘導されるとともに、抗原特異的T細胞も誘導される。この結果、Cas遺伝子が体内から消失するが、新生児期の静脈注射では全くこのようなことは起こらない。
さらにこの研究では実際にゲノム上で何が起こっているのかも正確に調べており、2つのガイドでエクソン23が欠落するだけではなく、逆位や挿入の他に、なんとアデノ随伴ウイルスの挿入が高い確率で起こることを示している。Casがガイド特異的に2本鎖DNAを切断することを考えると当然の結果だろう。しかしこれを見ていると、それぞれの鎖を別々の場所でカットするスティッキーエンド型の切断酵素CasXならかなりこの問題は解決するなとも思う。一方Cas9でも、ガイドとは無関係なところでは、このような変化はほとんど見つからず、完全にコントロールするということはできていないが、遺伝子機能を回復させるという点ではうまくいっており、また1年という範囲で特に重大な問題が起こっていないことを示している。
以上のことから、遺伝子の変異をうまく選べば、アデノ随伴ウイルスを用いたCRISPRによる遺伝子編集を新生児期に行い、病気を改善させる可能性はかなり高まったと言える。100%の回復を目指すのでなければ、前臨床段階はクリアされ、次のステージへの許可が出るのではと期待している。
2019年2月21日
私たちのNPOには一人だけスモーカーがいる。しかし、何年か前から、煙の出るタバコはやめて、電子タバコに代えている。実際、街を歩いていると確かにかなりの人が電子タバコに転換していることを実感する。様々なメーカーがあり、単純に結論はできないが、電子タバコの多くは、タバコの葉を燃やすことにより発生する様々な化学物質を低減し、できるだけ純粋なニコチンに近づけていることを宣伝している。
今日紹介する英国ロンドン大学からの論文はまさにこの電子タバコの特徴を生かして、電子タバコをタバコを止めるためのツールにしようとした研究で、臨床のトップジャーナルThe New England Journal of Medicineの2月14日号に掲載された。タイトルは「A Randomized Trial of E-Cigarettes versus Nicotine-Replacement Therapy(禁煙を実現するため電子タバコとニコチン置換治療を比べる無作為化試験)」だ。
私も20年前までスモーカーだったが、ニコチンパッチを使ってタバコを止めることが出来た。この時、タバコの習慣が、基本的にはニコチン中毒で、ニコチンパッチでかなり中毒症状が和らぐことがわかった。もしこのようなニコチン置換でタバコがやめられるなら、同じようにニコチンをタバコのように吸う電子タバコを、逆にタバコを止めるために使うことができるはすだ。この研究は、この可能性を着想したことが全てで、あとはできるだけ医療統計学に従う形で治験を行うだけだ。
この治験では参加者は通常の禁煙指導を受ける。ことのき、3ヶ月はニコチン置換剤か、電子タバコを中毒症状の緩和に利用するのを許可する。ただ、どちらに振り分けるかは無作為化して決める。ニコチン置換材に振り分けられた場合、ニコチンパッチか、ニコチンガムかは自由に選べるが、3ヶ月でこれも止めることを求められる。電子タバコは、日本には入ってきていないInnokinと呼ばれる純粋なニコチンを気化させて吸う電子タバコを使っている。
最初全体で2000名近いボランティアを集め、様々な条件を満たす被験者をそれぞれ350人選び出し、1年目で禁煙が続いているかどうかを調べている。結果は驚くべきもので、電子タバコを中毒緩和に利用したグループは18%が禁煙に成功し、ニコチン置換剤を使ったグループは9.9%と半数しか禁煙に成功しなかった。様々な条件を加味しても、この結論は変わらず、タバコをやめたければ電子タバコを使えという皮肉な結論になった。
ただこの結果は、被験者がタバコをやめたいと決意していること、禁煙コースに参加していること、そしてニコチンを気化する形式の電子タバコを用いたことの3つの条件での結果で、電子タバコに変えたからといって禁煙できるわけではない。実際、2割近い人は禁煙できたが、残りの多くの人はタバコには戻らなかったが、電子タバコにスイッチして喫煙は続けているようだ。
もともと電子タバコを提供しているのは、普通のタバコメーカーで、願わくば電子タバコにスウィッチしてもらって、喫煙は続けて欲しいと期待していると思う。とはいえ、辞める気のある人にとっては、ニコチン置換剤よりはるかに満足度が高くやめられるとすると、電子タバコはたばこメーカーの首を絞めかねないという皮肉な論文だった。
ただ、なぜニコチン置換剤より有効だったかについては、結局よくわからない。この研究だけで結論を出すのは早い気がする。
2019年2月20日
生命科学に関わる人でも意外と知らないのが、人間やサルに一番近い哺乳動物が、豚でも、猫でも、犬でも、羊でもなく、ネズミ、リスやうさぎの仲間だという点だ。ゲノムを比べれば一目瞭然でわかるのだが、違和感があるかもしれない。特に人間に近いモデルとして豚や犬が使われるが、これはサイズの話で、系統樹からの結論ではない。
さて、ネズミの仲間と猿の仲間が別れてから、大きく変化した組織の一つが眼だ。ネズミの眼は横についているが、猿になるとまっすぐ前を見つめるようになる。この結果、人間を含む猿は、物を正視するとき網膜の中心窩と呼ばれるたかだか1mm程度の部分だけ使うようになった。すなわち、網膜の大部分は明るさの感知や動きの感知などを除いてほとんど使わなくなっている。このように、サル以外では中心窩が存在しないため、人間の視覚を理解するためには猿を使わざるを得ない。ちょうど2年前、このコラムでサルを用いて中心窩が全く異なるアルゴリズムで興奮を伝えることを示したCellに掲載された生理学論文を紹介し、抑制性シグナルが少ないこと、光に対する反応が中心窩の錐体細胞は遅いことなどを紹介したが(http://aasj.jp/news/watch/6440 )、中心窩の研究には猿を使わざるを得ないことがよくわかる。ただ、このような生理学的違いの背景にある細胞学的違いについてはまだまだわかっていない。
今日紹介するハーバード大学からの論文は猿の中心窩と網膜周辺にある細胞の構成を今はやりの単一細胞レベルの遺伝子発現から細胞を詳細に分類した研究で、2月21日号のCellに掲載された。タイトルは「Molecular Classification and Comparative Taxonomics of Foveal and Peripheral Cells in Primate Retina(霊長類の網膜の中心窩および周辺に存在する細胞の分子分類と比較分類学)」だ。
この研究では中心窩および網膜周辺部から単一細胞を調整し、これまでなんども紹介したバーコードを用いた単一細胞レベルの遺伝子発現解析を行い、それぞれの領域の細胞の種類を遺伝子発現の違いから詳しく分類している。この方法を用いると、中心窩には4種類の神経以外の細胞も含め64種類の細胞が存在することがわかる。また、その遺伝子発現から、これまで行われてきた分類と完全な対応は可能である上に、単一細胞解析から明らかになる分子マーカーを用いて組織レベルでさらに詳しく分類が可能だ。すなわち、同じように見えても神経細胞は多様な遺伝子発現プロフィルを持っており、1mmほどの小さな場所になんと64種類もの細胞が存在している。今後、それぞれの生理的機能を対応させる方法が開発されると、さらに深い理解が可能になるだろう。
その上で、まず中心窩と網膜周辺の細胞の種類や構成の比較を手始めに、様々な比較を行っている。基本的には細胞の分類学なので、結局は退屈な話になるので、詳細は省き、結論だけを箇条書きにする。
ほぼ完全な網膜の細胞カタログが完成した。この結果、64種類の細胞を分別する分子マーカーを特定できた。 中心窩も周辺も錐体細胞の種類や性質に差はなく、基本的には赤と緑に感受性のある細胞で占められている。おそらく、赤や緑の違いを認知できるようになるのは、経験を通してで、生まれつきではない。 それで中心窩と周辺を区別する遺伝子は存在し、暗いと所で反応するOff型の双極細胞、抑制性のGABAアマクリン細胞が中心窩にほとんどないことは生理学的な所見とも一致する。 中心窩の存在しないネズミと比べてみると、細胞レベルで霊長類もネズミもほぼ同じであることがわかる。しかし一部に、ガングリオン細胞のようにマウスと霊長類で種類や数が大きく異なる細胞もある。 最後に、病気との関連が特定されている遺伝子は、発現の細胞や場所特異性が高い。例えば糖尿病性網膜症に関わる遺伝子は、中心窩の血管内皮に発現しており、緑内障に関わる遺伝子はガングリオン細胞のサブタイプに特異的に発現している。このような対応を明らかにすることで、病気のメカニズムをさらに詳しく理解できる。 などだ。結局データは多いが、驚くこともないといった論文で、しっかりと細胞のカタログが出来たことが一番重要だろう。現在世界が集まって、このような細胞カタログを作る共同研究が進んでいる。この方法だけでなく、組織内での遺伝子発現を調べる新しい方法も交えて、ゲノムプロジェクトと同じような大きなコンソーシアムとして発展するように思う。
2019年2月19日
「踊る身体のデザイン:ダンス研究か らみるポストバウハウスの100年」
日本フンボルト協会関西支部では、バウハウス1 0 0周年を記念して、ダンス研究者中島奈那子さんをお招きし、対談とダンスパーフォーマンスをあわせたコロキウムを企画しました。一般の方にも公開していますのでぜひお越しください。AASJも積極的に協力し当日の模様を記録する予定です。
日時 2月24日日曜日 3時半から
2019年2月19日
ほとんど関係がありそうにない単語が、あたかも関係しているかのように掲げられていると、ついついその理由を知りたくなる。論文のタイトルとしては、人の目を惹く意味で使いたくなる戦略だが、読んで種明かしがわかると、そんなことかと、内容はそれほどでもないことが多い。
今日紹介するマサチューセッツ総合病院からの論文は、タイトルに睡眠、造血、動脈硬化と、一見関係なさそうな単語が並んでおり、かって造血を研究していた私にとっては、この例の典型論文だと思った。タイトルは「Sleep modulates haematopoiesis and protects against atherosclerosis(睡眠が造血を変化させ動脈硬化を予防する)」だ。
この研究の発端は、動脈硬化になりやすいApoeノックアウトマウスの眠りを妨げて、眠りが途切れ途切れになるようにしたマウスでは動脈硬化巣が大きくなり、そこに単球やマクロファージが異常に集まっているという発見だ。そして、骨髄でKit陽性Sca1陽性の未熟血液細胞の増殖が亢進していることを発見する。すなわち、睡眠が断片化されると、造血が上昇することになる。もちろん造血が上昇して、単球やマクロファージの合成が増えると、動脈硬化も悪化することも理解できる。睡眠、造血、動脈硬化の3題話が出来上がった。
ただこれだけでは論文としては弱い。そこでこの変化をきたす分子メカニズムを求め、著者らがHypocretinと呼ぶ視床から分泌される分子の発現が低下することを明らかにしている。hypocretinという分子は私には馴染みが無いが、幸い括弧付きでorexinのことだとわかる。Orexinは筑波大学の柳沢さんが最初摂食行動を調節する脳内ホルモンとして発見した分子だ。その後、ナルコレプシーとの関係で、現在では睡眠を調節するホルモンとしての方が注目されている。こんなこともあって、私の紹介文では自分に馴染みのあるオレキシンという名前を使う。
さて、オレキシンの視床での発現は睡眠が断片化されると低下する。このことから、著者らは造血がオレキシンの低下により起こるのではと考え、オレキシンノックアウトマウスを調べると、末梢血、脾臓、骨髄での単球や好中球の増殖が亢進し、未熟幹細胞の数も増加している。このことから、眠りが妨げられておこる白血球増植の亢進はオレキシンの分泌が低下するからだと結論している。そして、この結果動脈硬化巣に白血球が集まり、硬化層が大きくなる。ただ、問題もある。すなわち一般的なコロニー法で単球の増殖を調べる時に、オレキシンを加えても何の変化もない。オレキシンが造血細胞に直接働いているわけではなさそうだ。
そこでオレキシン受容体の発現をとっかかりに分子メカニズムを探索し、最終的に少し複雑な以下のような結論にたどり着いている。すなわち、好中球の前駆細胞だけがオレキシン受容体を発現しており、この細胞のマクロファージ増殖因子の合成がオレキシンにより抑えられている。このため、睡眠が妨げられ、オレキシンが低下すると、好中球前駆細胞のマクロファージ増殖因子の分泌が高まり、その結果周りの未熟幹細胞からマクロファージまでの細胞が増殖するというシナリオだ。このために、マクロファージ増殖因子ノックアウトマウスの骨髄細胞をオレキシン受容体ノックアウトマウスに移植する実験を行なっている。実験としては論理的だし、データも悪くないのだが、話が複雑でなぜかしっくりこない。一つは、本当に生理的意味のある話か、本当に睡眠と動脈硬化を結びつける話なのかが腑に落ちない。
おそらくノックアウトマウスを集めて、あまりにも特殊な実験になっているからだろう。オレキシンが作られなかったり、あるいは抗体で機能が抑制されておこるナルコレプシーの患者さんを見つけることがそれほど難しいことではないので、オレキシン低下がヒトでも好中球増多症につながるのか、まずこの点から調べて、ヒトでも同じシナリオが当てはまることを示してもらわないと、このモヤモヤ感は消えない。
2019年2月18日
様々な組織の発ガンにrasの変異が関わっていることはよくわかっているが、ras自体を標的にした治療法の開発はうまくいっていない。多くの研究者がチャレンジを諦める中で、それでもこのコラムで繰り返し紹介したように、様々な角度からrasを制御するための研究を続ける研究者は世界にまだまだ存在する。今日紹介するボストン大学と中国廈門大学からの論文は、変異型N-rasの上流で働くキナーゼを特定して新しいメラノーマの治療標的可能性を示した研究で2月21日号のCellに掲載された。タイトルは「Pharmacological Targeting of STK19 Inhibits Oncogenic NRAS-Driven Melanomagenesis(発ガン性N-rasによるメラノーマ形成をSTK19を標的にした薬剤で阻害する)」だ。
これまでもファルネシル化などrasを活性化する上流過程を標的にする治療法の開発が試みられてきたが、この研究ではメラノーマに絞って、このドライバーになっている変異型N-rasの活性をさらに上流で調節しているリン酸化酵素を探すという、最初から決め打ちの、一種の一か八かを狙う研究だ。すなわち、活性化型N-rasを導入した細胞株の増殖を抑制するリン酸化酵素をsiRNAスクリーニングで探索し、STK19を発見している。要するに結果良ければ全て良しで、あとはこのSTK19がN-rasの活性にどう働き、ガン治療の標的になれるかを調べれば良い。
結果を箇条書きにすると、
STK19はN-rasの89番目のserineをリン酸化し、これがないとN-rasのガンのドライバー活性が低下する。 メラノーマの一部ではSTK19の89番目のアミノ酸に変異が起こっており、変異型STK19を導入した色素細胞株の増殖は促進される。 変異型N-rasと変異型STK19が合わさると、色素細胞の増殖が高まり、メラノーマが発生する。 施設に備わった化合物ライブラリーをスクリーニングし、STK19の機能を抑制するZT-12-037を特定した。この化合物は、N-rasのリン酸化を抑制する。 メラノーマを移植する実験で、ガンの増殖を抑制することができる。 以上が結果で、STK19は少なくともN-rasをドライバーとするメラノーマに効果を示す可能性を示唆する結果だ。他のrasについての効果、あるいはN-rasが活性化した他のガンについての効果はわからないが(なぜ実験を行わないのかよくわからない)、N-rasについて、機能をさらに上流で調節する分子を見つけたことは、私には新しい発見だった。あとは極めてオーソドックスな手法の研究で、STK19の発見が結局この研究の全てだとよくわかる。おそらく中国厦門大学が中心の研究だと思うが、阻害活性のある化合物まで到達するところは、実力があることをうかがわせる。ただ、発見された化合物の活性は効果はあっても、実用範囲とは思えない。おそらくプロのメディシナルケミストによる至適化が必要だろう。しかし、決め打ちでも果敢にrasにチャレンジする中国の層の厚さが感じられる論文だった。
2019年2月17日
筋肉を支配する運動神経が徐々に死んで麻痺が進行する、現在まで治療法がない病気ALSのほとんどは特別な遺伝的要因なしに起こってくるが、遺伝的に要因がはっきりしたALSもある。その中で最も多いのがchromosome 9 open reading frame 72 (C9orf72)と呼ばれる、まだ機能が完全に確定していない分子のイントロンにある6塩基繰り返し配列が増大するALSで、家族性がない場合もこの遺伝子の変異を認めることがある。ただ、このように遺伝的原因がわかっていても、なぜ運動神経死が起こるのかのメカニズムについてはなかなか納得いく説明が示されてこなかった。
今日紹介するメイヨークリニックからの論文はC9orf72にこだわらずに、この病気の原因と考えられる繰り返し配列だけに焦点を当てたマウスモデルを用いて神経死のメカニズムに迫った研究で2月15日号のScienceに掲載された。タイトルは「Heterochromatin
anomalies and double-stranded RNA accumulation underlie C9orf72 poly(PR)
toxicity (ヘテロクロマチンの異常と二重鎖RNAの蓄積がC9orf72polyPRの毒性の背景にある)」だ。
この遺伝子変異により多様な異常が起こることが想像されているが、この研究が成功した理由は、ともかくGGGGCCの繰り返し配列からできるプロリン、アルギニンのポリペプチド(PR-P)の効果に焦点を絞ったことと、このタンパク質をGFPで蛍光標識して、この分子が細胞のどこに存在するか、細胞学的、生化学的に追跡できるようにした点だ。
蛍光標識した繰り返し配列をアデノウイルスで新生児脳に注射すると、毒性が強く6割のマウスは死んでしまうが、残ったマウスでは進行的な神経細胞死が進むことを確認して、これがC9orf72変異によるALSや前頭側頭型認知症(FTD)モデルとして使える事を示した上で、この繰り返し配列の機能を詳しく調べている。
膨大なデータなので、詳細は割愛して、結論だけを述べる。
この繰り返し配列(PR-P)だけで、ALSやFTDの病態のほとんどを説明できる。 PR-Pは染色体構造が閉鎖したヘテロクロマチンに特異的に結合する。 この結果核膜直下に限定してい転写を抑制するマトリックスが核内部にまで侵入し、転写される遺伝子が大きく再構成される。 PR-PによりヘテロクロマチンをまとめているHP1aが分解される。 この結果ヘテロクロマちんにより抑えられていた繰り返し配列の転写が促進し、細胞毒性のある二重鎖RNAが大量に合成される。 が主な結果と言える。
PR-Pの標的がヘテロクロマチンであることを発見したことがこの研究の全てだが、その結果としては結局様々な過程の引き金が引かれ、それが組み合わさって細胞死が起こるという結論になってしまう。この中では、細胞障害性を持つ二重鎖RNAの合成が一番病態に近いところにあるプロセスだが、とはいえALSでもう一つ重要なRNA蓄積として知られているTDP-43との関連も含めて、より多くの新しい問題が出てきたと言っていいだろう。ALSを理解することがいかに難しいか、よくわかる論文だと思う。
2019年2月16日
昨日に続いて今日も軽めのダイエットメニューで行こうかと考えている。と言っても、まじめに調査が行われているとは言え、酒の飲み方に差があるのか、あるいはアルコールとしてみればワインもビールも同じなのかといった、少しふざけたような問題ではなく、もう少し重要な問題で、ダイエットで体重を落としたいとき、朝食を抜いたほうがいいのかどうかを問うた研究だ。
肥満に対するダイエット療法について書かれた多くの提言では、カロリーを減らしたいからと言って朝食を抜くのは逆効果とされているようだ。その理由は2つあり、一つは朝食を抜くことで、他の時に余分に食べてしまうという問題と、朝食を抜いて活動性が低下することでカロリー消費が落ちて逆に太るという問題だ。
今日紹介するオーストラリア モナーシュ大学からの論文は、公式な提言にも書かれているこのドグマにチャレンジした論文で、誰もが当たり前と思っていることに対するチャレンジをサポートし続けているBritish Medical Journal にオンライン掲載された。タイトルは「Effect of breakfast on weight and energy intake: systematic review and meta-analysis of randomised controlled trials (体重とエネルギー摂取に対する朝食の効果:無作為化試験についての包括的再調査とメタアナリシス)」だ。
ダイエットでも朝食を抜くなという提言も、全く根拠なく行われたわけではなく、これを裏付ける論文は存在している。この研究は、自分で調査したのではなく、これまでの論文を見直したメタアナリシスだが、著者らはドグマを裏付ける論文の多くが朝食をとるかどうかを自己の判断に任せた観察研究であることに気がつき、これだと「朝食は必要」と考える人の方が、提言に従い生活態度が最初からダイエット向きにできているため、ダイエットに成功したのではと考えた。そこで1990年から昨年1月までに発表された600を越すダイエットと朝食について記載がある論文を集め、この中から朝食をとる群ととらない群を無作為化して調べた信頼の置ける論文を12編選んでいる。この中には熊本県立大学から2017年に発表された朝食とエネルギー摂取について調べた論文も含まれている。
このようなメタアナリシスは、選んだ論文の結果を信頼できるかどうか厳密に吟味する必要がある。論文では、これについて詳しく述べているが、この点については割愛して結果についてのみ紹介する。
無作為化していることから、長期間の調査は難しく、最も長い調査で16週間だ。もちろん全ての調査で、朝食を食べるということははっきり自覚されるため、偽薬を用いると言った盲検はできないという限定がある。したがって、調査の趣旨に被験者が賛成して協力したりすると結果が狂う心配はある。ただ、この条件で行われたほぼ全ての研究で、朝食を抜くと、抜かない人よりも体重を落とすことができ、また1日のエネルギー消費も低下するという結果だ。
論文によっては、代償的に朝食以外で食べすぎないか、あるいは活動性が落ちるかなど、血液のさまざまなマーカーを使って調べている場合もあるが、これも杞憂で、結局ダイエットに対する提言として書かれているドグマは全て削除すべきと強い結論で終わっている。
もちろんこの話は成人での話で、成長期の若者は全く対象でないことは強調しておく。わが国でもブラウザーのトップに来るサイトでの提言は「朝食は抜くな」だが、さてこの論争の結末はどうなるのだろう。
2019年2月15日
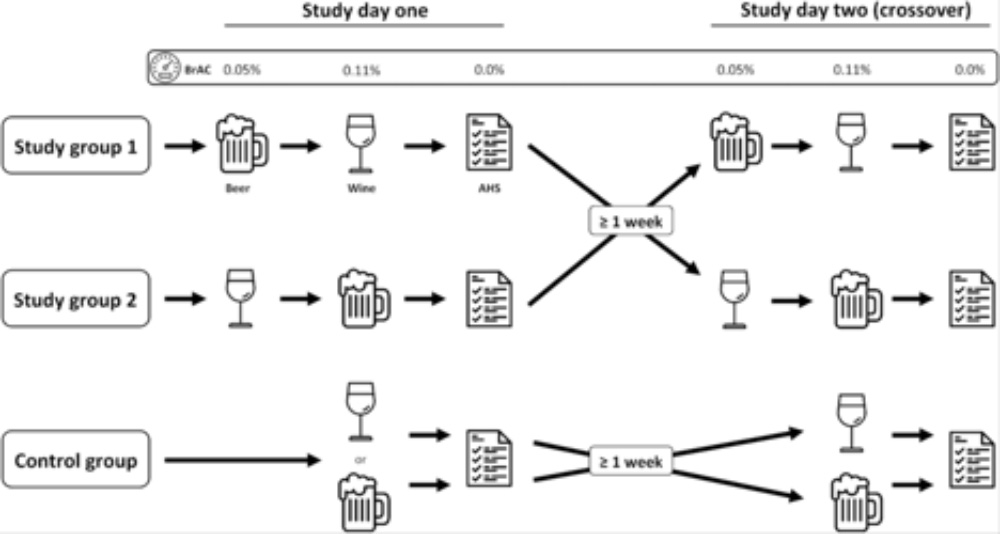
少し一般の人には理解しづらい論文が続いたので、今日はとびっきり簡単な論文を紹介することにする。ドイツ ブッパータール大学小児科からの論文で2月8日号のAmerican Journal of Clinical Nutritionに掲載された。タイトルは「Grape or grain but never the twain? A randomized controlled multiarm matched-triplet crossover trial of beer and wine (ブドウでも麦でもいいが、しかしチャンポンはだめ?ビールとワインの様々な組み合わせを試す無作為化試験)」だ。
この論文はヨーロッパの古い知恵として言い伝えられてきた「Grape or grain but never twain(ワインでもビールでもどちらでもいいが、チャンポンはダメ)という言葉をそのままタイトルに使った論文で、タイトル通りビールだけ、ワインだけ、ビールからワイン、ワインからビールという4種類の組み合わせでアルコールを十分酔うまで(呼気のアルコール濃度が0.11%)飲んで、次の日に8種類の症状(喉の渇き、倦怠感、頭いた、フラフラする、吐き気、胃痛、頻脈、食欲不振)について自己診断を行ってもらって、二日酔いになっているかどうかを調べている。さらに、タイトルのCross overから分かるように、ワインからビールを試した人は、1週間後ビールからワインというように、飲み方をスイッチする。同じように、ビールだけの人は、次の実験ではワインだけに変わる。これにより、特にワインだけに問題がある人などが結果に大きく影響しないようにしている(この論文はフリーアクセスなので、著者が実験の概要として使っている図を以下に掲載しておく)。
さて結論だが、詳しい説明は全て省く。結局上のどのような条件で飲んだとしても、次の日の二日酔いの強さは同じだったという結果で、古くからある知恵とは全く異なる結果になっている。わたしのような酒好きにとってのメッセージは、「飲むときには細々考えず、気分に合わせて酒を楽しめばいい」という結論になる。
もちろんいくつか問題もある。最終的に各グループの母数が28-31人になってしまっており、よほどの差がないと有意差が出にくくなっている。また、呼気のアルコール濃度を指標にしているが、実際には約5時間かけてビール1.4リットル、ワイン600ccを飲んでおり、ヨーロッパ人で酒に強い人なら普通にこなしてしまう量で、確かに各グループでのデータのばらつきが多い。したがって、もっと違った飲み方も同時に比べることをしないと、最終結論は出ないように思う。
とはいえ、著者には失礼だがなんとも馬鹿げた研究目的と、270人ものボランティアを募り、厳密な医療統計に基づく研究を行なっている研究手法の真面目さとのアンバランスがこの論文の最も面白い点だろう。イグ・ノーベル賞狙いではないかとすら勘ぐってしまう。アクナレッジメントをみたが、さすがにこの研究に助成金は出ていないようだ。また期待通り、論文の最後はCheers(乾杯)で締めくくっている。
2019年2月14日
エクササイズによりアルツハイマー病の発症を予防したり、あるいは病気の進行を遅らせる可能性があることは以前から指摘されている。しかし最近の研究では、発病してしまうと1週間に一回程度の運動では、ほとんど進行を遅らせることができないことも示唆されている。どちらが正しいとしても、この問題に関しては、臨床例の観察を行なった疫学研究しかなく、運動が効果があるとしても、その分子メカニズムに迫ることは難しいと考えられていた。
ところがブラジル・リオデジャネイロ大学、米国コロンビア大学、そしてカナダ西オンタリオ大学の共同チームが1月号のNature Medicineに発表した論文は、運動により誘導されアルツハイマー病の神経シナプス結合を改善させる分子を特定した点で画期的な研究だ。タイトルは「Exercise-linked FNDC5/irisin rescues synaptic plasticity and memory
defects in Alzheimer’s models (運動と連動するFNDC5/irisinがアルツハイマー病のシナプスの可塑性と記憶を回復させる)」だ。
これまでの研究で運動すると筋肉に発現しているFNDC分子が切断され、細胞外ドメインのirisinが血中に分泌されることが知られていた。著者らは、アルツハイマー病(AD)に運動が効果があるなら、このirisinがその原因ではないかと着想し、FNDCに対する抗体を用いて、筋肉だけではなくADの主要な病巣である海馬でも強くFNDCが発現してirisinを分泌していることを確認する。
次に進行したAD、初期のAD、そして正常の海馬でのirisin量を調べ、進行性ADで著明に低下していること、また脳脊髄液中のirisinがADで低下していることを明らかにする。面白いのは、正常の人では脳脊髄液中のirisinは年齢とともに上昇するが、ADになるとこの上昇が全くないか、少し低下する点だ。すなわち、正常では年齢に応じた脳の変化をirisinが抑えているような印象がある。
そこでマウスモデルを用いて、脳細胞のFNDCをノックダウンする実験を行い、脳内でのFNDC合成がなくなると、海馬のシナプスの可塑性が低下するとともに物体認識の記憶が低下することを明らかにする。
次にirisinが低下しているADマウスにirisinを投与することで記憶が回復するかどうかを調べ、期待通りシナプスの可塑性と物体認識記憶が元に戻ることを突き止めた。また、アデノウイルスを脳に注射する方法でもシナプスの可塑性を回復させることができる。この回復したマウスの脳組織を取り出して活動を調べると、興奮の低下が大きく改善されることも示している。すなわち、irisinの低下はADの記憶症状をかなり説明することができる。
次に、では脳内で合成されるirisinだけでなく、筋肉で合成されるirisinもこのようなアミロイドによる記憶低下を防ぐことができるのか調べるために、末梢からirisinをコードするアデノウイルスベクターを注射する実験を行い、末梢で合成されたirisinが脳内に移行して記憶を戻す作用があることを明らかにしている。そして最後に、ネズミを一日1時間水泳させてアミロイドによる記憶低下を抑えられるか調べ、運動により分泌されるirisinでも十分記憶力低下を抑える効果があることを示している。生化学的には、irisinはcAMP-PKA-CREBシグナル、すなわち記憶のシグナルを活性化し、irisinの作用が直接細胞に働いてシナプス可塑性を保ち、神経細胞を保護していることも明らかにされている。
irisinが人間のADで低下している以外は、まだまだ動物実験の段階で、人間もirisin投与が同じようにADに効くかを確かめる研究は必要だが、これが正しいとすると、irisinはアルツハイマー病の薬剤として使うことができるし、またしっかりした運動プロトコルを行える初期なら、記憶力低下をエクササイズで防ぐことすら出来ることになる。本当だとすると、かなり大きな貢献だと思う。