2021年11月15日
少し内容が古くなったかもしれないが、このHPに言語誕生についての研究をまとめた覚え書きを掲載している(https://aasj.jp/news/lifescience-current/10954 )。チョムスキーの最新研究から始めた後、言語を使うときの統語と、道具を使って仕事をするときの頭の中でのプランニングに関わる脳回路が共通している可能性についてもまとめておいた。この記事で、この可能性を示す証拠として挙げたのは、1)1年ぐらいでようやく意味のわかる単語の並びを話すようになるのと同じで、生後18ヶ月まで、道具とおもちゃの区別はできないこと。2)脳卒中で失語症が発症してしまう患者さんの中には、同時に道具の使い方がわからなくなる「失行症」を併発することがあること。の2点だった。
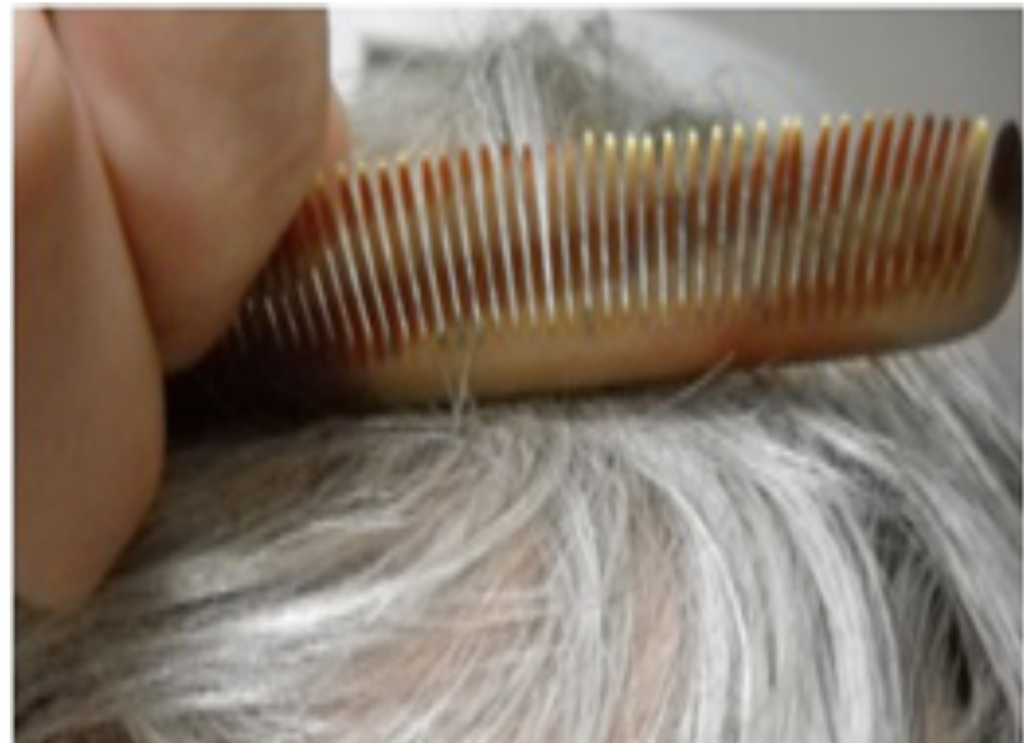
クシの使い方がわからなくなった失行症の患者さん(Wikipedia: https://en.wikipedia.org/wiki/Apraxia#/media/File:Apraxia_001.jpg) ただ、これらの研究は実際の脳回路特定までには至っていなかった。
今日紹介するフランス、リヨン神経科学研究センターからの論文は、機能MRI(fMRI)を用いて言語と道具使用の共通性に迫った面白い研究で、11月12日号Scienceに掲載された。タイトルは「Tool use and language share syntactic processes and neural patterns in the basal ganglia(道具使用と言語は統語プロセスと基底核の神経活動パターンを共有している)」だ。
この研究では、道具と言語について、2つの複雑な課題を設定している。まず言語だが、複雑な内容を単純な構文を組みあわせるだけ(CC)、主語の説明に関係代名詞を使う構文(SRC)、そして主語を目的格として説明するため関係代名詞を使う構文(ORC)を作っている。英語の例が出ているので引用すると「The writer admires the poet and writes the paper」(CC), 「The writer that admires poet writes the paper」(SRV)、「The writer that the poet admires writes the paper」(ORC)。これらの構文が正しく理解されるか調べると、少なくともフランス語の場合ORCが最も難しく、判断に時間がかかり、また失敗率も高い。
次に道具使用だが、長いピンセットを使ってボードに指してあるピンを抜いて、他の決められた場所に移動させるという課題を行っている。
この2種類の課題を行っているときに、機能的MRI(fMRI)で脳の活動を比べると、言語の統語を処理しているときと、道具を使うプランを構想しているときの基底核、特に淡蒼球の脳の活動パターンが類似していることを明らかにしている。さらに面白いことに、道具使用プランの際の脳活動と最も一致するのが、理解が難しいORC構文を処理しているときであることも示している。
普通の研究は、脳活動の共通性を特定できると、めでたしで終わるのだが、このグループの発想力はこれでとどまらない。もし同じ回路を使っているとしたら、道具を使う訓練によって、言葉の統語理解が高まる、あるいは逆もあるのではと、機能的実験を行っている。
ピンを決められたところに移すボードゲームを、ピンセットを使って、あるいは道具を使わず手を使って訓練し、先ほどのORC理解度を測定すると、期待通り、道具を使って訓練したときに最も言語構文の理解力が上がる。
また、ORC,SRCそれぞれの構文を何度も聞かせて、理解を早める訓練を行った後、道具を使ったピンを移すボードゲームを行わせると、ORCを理解するよう訓練したときのほうが、SRC理解の訓練より、ゲームのスコアが改善する。
結果は以上で、道具使用の構想過程と、言語の統語過程に同じ脳回路が利用されることを示しただけでなく、機能的にも両過程がオーバーラップしていることを示した、極めて面白い研究だと思う。
最後に一つだけ懸念するのは、私たちが道具を使うとき、言語能力に頼っている可能性がないかだ。ただ、この疑問はトートロジーになって答えるのが難しいので、気にしないでおく。
2021年11月14日
今年のノーベル医学生理学賞以来、心なしか痛みや体性感覚の論文が増えた気がするが、おそらくこれは違った目で論文を読むようになったからだろう。そんな目にとまったのが今日紹介するイスラエル工学研究所からの論文で、免疫反応を脳の島皮質神経が記憶するという話だ、タイトルは「Insular cortex neurons encode and retrieve specific immune responses(島皮質神経は免疫反応をエンコードしまたその記憶を読み出せる)」だ。
局所の炎症や免疫反応も体性感覚を誘導するから、脳に影響するのは当然で、何が面白いのかと読み始めた。ただ、イントロダクションを読むと、著者らは局所の免疫反応が脳神経に記憶され、この記憶がその後の炎症反応に影響するという大それた仮説を持っていることがわかった。
では、仮説をどう証明するかだが、興奮すると神経に一時的に発現するFos遺伝子を利用して、腸や腹腔での炎症時に興奮する神経をまず特定し、今度はFosを発現した同じ細胞を、これらの細胞だけ刺激したり、抑制したりすることができる、化学遺伝学的手法を用いて操作したとき、末梢で何が起こるかを調べる、という段取りで実験を行っている。
まず、腸に硫酸デキストランを投与して起こした炎症により興奮する神経を探すと、彼らが最初から狙っていた島皮質のグルタミン作動性錐体神経および一部のGABA作動性抑制神経がラベルされる。また、腸の神経をラベルして投射をたどると、炎症により興奮した細胞と一部オーバーラップするので、腸からの島皮質に神経投射があり、その結果神経興奮が見られることが確認されている。
ここまではなんの不思議もない。以前紹介したように炎症性サイトカインはTRPV を直接刺激することもあるから(https://aasj.jp/news/watch/18033 )、興奮した神経が島皮質に投射しておれば当然の結果だ。
ただここから先、すなわち島皮質で興奮した同じ神経を興奮させると、局所の免疫細胞や炎症細胞が変化するということは、想像だにしなかった。この研究では、Fosを発現した細胞だけが人工的リガンドで刺激できる受容体を発現するようにし、腸からの刺激に反応した島皮質神経をもう一度CNOと呼ばれる人工リガンドの注射で興奮させられるように操作したマウスを用いて、これを実現している。
驚くことに、腸の炎症により興奮した島皮質神経を再度興奮させると、今度は腸特異的にほぼ同じような炎症状態を誘導することができている。これは、自然免疫に関わる細胞だけでなく、γδT細胞や、CD4T細胞の浸潤も伴う、驚くべき再現だ。一方、島皮質神経をランダムに刺激しただけではこのような局所炎症の再現は全く見られない。また、同じ現象は、腹腔刺激でも誘導でき、この系で呼び起こされる炎症は、腹腔組織特異的で、どこで炎症が起こったのか、脳がしっかり区別していることがわかる。
そして最も驚くべき実験は、腸管の炎症を記憶した細胞の興奮を、抑制性のリガンドで今度は抑えると、硫酸デキストラン投与による炎症の程度を軽減することが可能であるという結果だ。
以上が結果で、例えばワクチン注射した炎症反応は脳でしっかり記憶され、また起こるのではと変に心配していると、副反応が持続し、さらに2回目の接種で反応が高まるといった話になる。鎮痛剤だけではこの記憶を抑制できないことも示されており、体性感覚もここまで精巧になると、制御不能になる心配がある。
2021年11月13日
メバルは100歳まで生きると何かで読んで驚いたことがある。以前紹介したキルフィッシュのように(https://aasj.jp/news/watch/4519)、寿命が5ヶ月ぐらいの短命の魚は観察するだけで寿命を特定しやすいが、長寿の魚となると、いくら耳石や鱗で年齢が推定できるとしても、サンプリングを繰り返して統計学的に調べる必要があり、地道な努力の積み重ねでわかってきたことだと思う。
今日紹介するカリフォルニア大学バークレー校からの論文は、この長寿で有名なメバルの仲間、88種類のゲノムを解読し、長寿の秘密を探った研究で11月12日号のScienceに掲載された。タイトルは「Origins and evolution of extreme life span in Pacific Ocean rockfishes(太平洋のメバル属の驚くべき長寿の起源と進化)」だ。
100歳のメバルにも驚いていたが、この論文を読んで我が国でアラメヌケと呼ばれている魚に近いS.Aleutianusではなんと200歳を超える長寿を誇る。この研究では、メバル科88種類のゲノムを解読しているが、各種で寿命は大きく異なり11年から200年まで、驚くほど多様だ。しかし解読されたゲノムのおかげではっきりとした系統関係が描ける。面白いことに、系統関係と寿命はある程度相関しているが、一方向への進化ではなく、それぞれの属の中でも多様性はある。また、系統的に長寿の多い属と離れていても、独自に長寿を獲得している種も存在する。
そこで、寿命が100年以上の種と、20年以下の種を分けてゲノムを比べ、長寿とともに選択されてきた遺伝子をリストすると、長寿とともに選択された遺伝子だけでなんと800種類近く存在し、また選択された、遺伝子は種ごとに異なっている。実際、2種類以上の種でリストされる遺伝子はたかだか15%にとどまっている。すなわち、特定の遺伝子で長寿が達成されるのではなく、それぞれの種で独自に長寿をもたらす遺伝子の進化が起こっていることがわかる。
ではどのような遺伝子が選択されているのか調べると、多くの長寿種で必ず選択される最も効果がありそうなのはDNA2重鎖切断修復に関わる遺伝子群だ。また、これ以外の長寿により選択される遺伝子には、期待通りテロメア、除去修復などに関わる遺伝子がリストされている。これらは長寿との関わりが指摘されており、北極鯨やゾウガメで特定されている遺伝子も含まれている。
もちろん他にも、代謝や炎症に関わる遺伝子もある。そこで、これら長寿遺伝子としてリストされた遺伝子を、体のサイズや、生息深度など、他の進化と関わる遺伝子との関連を調べると、ほとんどはこれらの形質とも相関していることから、生息環境に適応し様々な形質を獲得する中で長寿が達成されていくことがわかる。とはいえ、インシュリンシグナルのように、長寿特異的に残っている遺伝子も10種類ほど特定できている。
こうした中で、寿命とともに遺伝子コピー数が増大する遺伝子も特定されている。免疫チェックポイントに関わるB7と同じファミリーに属するbutyrophilinで、遺伝子コピー数と寿命が見事に相関している。
遺伝子の多様性から計算される個体数や世代時間についても調べ、長寿とともに個体数は大きく低下し、世代時間も延びることを示している。すなわち、長寿のメバルを乱獲してしまうと、取り返しのつかないことになることがわかる。
結果は以上で、ざくっといってしまうと、遺伝子レベルで見ても、長寿は一つの要因で達成できるのではなく、様々な要因が集まった結果としてあることがわかる。今回示された、DNA修復、テロメア、butyrophilinなどの炎症、mTorなどの代謝、低酸素反応などの寿命との関わりは何度も指摘されてきた。しかし、同じファミリーの魚の多様性を利用して比べた結果を見たのは初めてで、機能の確認が全くなくても十分説得力が高い、面白い論文だった。私たちも、長寿遺伝子のデパート:メバルから学ぶことは多い。
2021年11月12日
Amgenが開発したKRAS(G12C)阻害剤Sotorasibについては、長年待望されていたRAS阻害剤がG12C変異に限るとしても、臨床応用にこぎ着けた最初の薬剤として、このHPで紹介し(https://aasj.jp/news/watch/11638 )、さらに特別にYouTubeでも取り上げ(https://www.youtube.com/watch?v=xOe26eCpeoo )、個人的にも大きな期待を寄せていた。事実、この発表はAmgenの株価を大きく上昇させたことは、期待の大きさを物語る。その後、Amgenに続いて、同じメカニズムのKRAS(G12C)阻害剤が加速している。各国の承認についても、つい最近、経済性など厳しい審査の英国NHSが承認したし、我が国厚労省も希少疾患病用医薬品指定を行っており、臨床応用が加速すると考えられる。
ただ、最初の論文から、KRAS(G12C)阻害剤がガンの根治をもたらす可能性は低いことが推察されていた。確かに、KRAS(G12C)変異を持つ患者さんのガンを縮小させ、再発を平均7ヶ月程度抑えることができるが、その後はおそらく薬剤耐性ガンが現れる確率がかなり高い。
今日紹介する米国スローンケッタリング ガン研究所からの論文は、KRAS(G12C)阻害剤治療後の再発を誘導する遺伝子変異について、実際の患者さんと、動物実験系で確かめた研究で11月10日Natureにオンライン発表された。タイトルは「Diverse alterations associated with resistance to KRAS(G12C) inhibition(KRAS(G12C)阻害に対する耐性を誘導する様々な変異)」だ。
この研究では、この治療を受けた43例について、再発例は何らかの方法でガンゲノムをもう一度調べ、再発の遺伝的原因を確かめようとしている。
まずgood newsは、5%の患者さんではガンが完全に消失し、18ヶ月以上再発がない点で、部分縮小の場合でも、同じように再発がない例がさらに5%ほどいることだ。これらの患者さんの特徴を調べると、血中に流れるKRAS(G12C)の量が低く、体内のガン細胞の数が少ないことが想定される。従って、標的薬だからと、最初から使うのではなく、まず一般化学療法などでガンの量を減らしてからKRAS(G12C)阻害剤を使うプロトコルについて治験を行う重要性が示唆される。
このコホートでは、30例の再発があり、そのうち27例については遺伝子変異をキャッチすることに成功している。期待通り、最も多くの耐性につながると想定される変異は、他のRASの変異、あるいはKRAS自体の新しい変異によることが特定されている。しかし、RAS以外にも、様々な遺伝子の変異が再発の原因になっている。
今回特定された全ての変異が耐性に関わるとは思えないが、様々な変異が耐性とともに現れるというのはbad newsで、あらかじめ変異を予想して対応できないことを意味している。一方、RASと下流の変異については、最初から下流のMEKなどを抑制しておくことで、効果が長くなる可能性はある。
これを確かめる意味で、患者さんのガンを移植したマウスにKRAS(G12C)阻害剤を投与し、変異の出現を詳しく調べている。その結果、実験的な耐性獲得では、RASとその下流の新たな変異による場合が多胃ことが明らかになった。また、CRISPRを用いた遺伝子ノックアウトや、MEK阻害剤との併用で、確かにガンをより強く抑制できることが示されている。
結果は以上で、少なくとも2-3割の患者さんの場合、耐性がRASシグナル経路で起こってくることを考えると、最初からKRAS(G12C)阻害剤と、MEK阻害剤との併用は、耐性の出現を抑えるのに役立つように思える。
このように、耐性出現を丹念に追跡することで、新しい治療法が確立できる。今回のレッスンとしては、KRAS(G12C)阻害剤の前に、腫瘍細胞数をできるだけ減らす治療を先行させること、そしてできれば最初から(2-3割しか効果がないとわかっていても)、RAS経路の阻害剤を併用することがわかったと言える。
2021年11月11日
膜上に設置した穴をDNAが動くときに、電流の変化を感知して塩基の種類を判断してDNA塩基配列を決定するナノポアシークエンサーは、エラー率など様々な問題はあるが、その携帯性、簡便性、スピード、さらにディスポーザブルという面で大きなシークエンサーが使えない感染症の現場での利用価値が高まっているように感じる。
今日紹介するデルフト大学からの論文は、同じナノポアシークエンサーを用いてペプチドも読むことができる可能性を示した論文で、現実性はともかく、面白いチャレンジだと思う。タイトルは「Multiple rereads of single proteins at single–amino acid resolution using nanopores(ナノポアを用いて1アミノ酸レベルの解像度で一分子タンパク質を解読する)」で、11月4日Scienceにオンライン掲載された。
要するにナノポアを用いて電流の変化を見る方法で、アミノ酸配列も読めることを示すのが目的だが、そのままアミノ酸をナノポアに加えても何も起こらない。というのも、ナノポアでは穴に入ったDNAを少しづつ動かすためにDNA上を動くヘリカーゼなどのモータータンパク質が必要で、アミノ酸ではこれが働かない(https://www.nature.com/articles/s41598-019-41488-4/figures/1 )。
この問題を、このグループは読みたいペプチドを配列の決まったDNAと結合させ、DNAを動かすことでタンパク質の動きを作る方法を着想している。これはあくまでもアミノ酸を判別すると言うことを確かめるだけの研究なので、つないだアミノ酸はアスパラギン酸とグルタミン酸が並んだ単純な配列のペプチドにしてある。
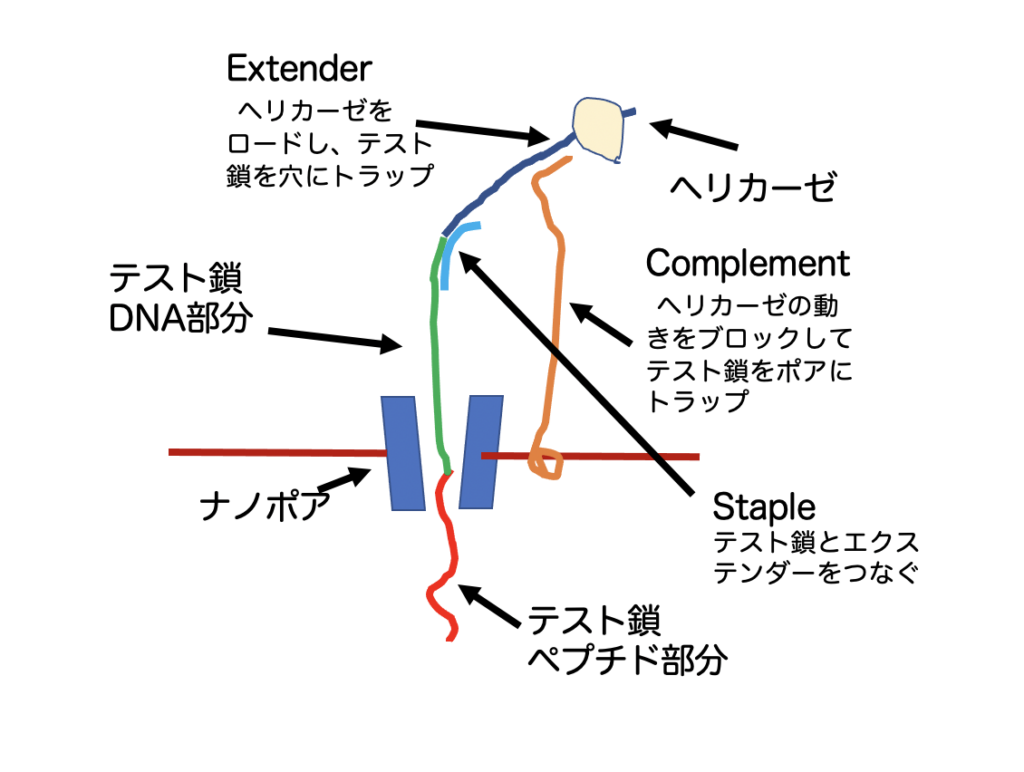
モータータンパクには一本鎖DNAを動かすヘリカーゼHel308を選びDNA部分を滑らせることでアミノ酸を動かせて配列を読むという仕掛けだが、これだけではもちろん足りず、図に示す仕掛けを組み込んでいる。DNA-ペプチド鎖(テスト鎖)をHel308にロードし、さらにナノポアを通すために、テスト鎖にExtenderと呼ぶDNA鎖を、テスト鎖、extender部分に相補的なDNA(Staple)を用いて結合させている。この複合鎖をExtender と相補的部分を持つComplementと呼んでいる、膜から突き出た一本鎖DNAでトラップする。この相補的二重鎖により、ロードされたヘリカーゼは動きを止め、穴にペプチド部分から侵入したテスト鎖が一種宙ぶらりんの状態になる。
このあと、ComplementとStapleの相補的部分を外してやると、ヘリカーゼはExtender とともにナノポアと結合し、挿入されたテスト鎖をDNA部分を用いて引っ張り上げる。このときの電流変化で核酸配列とともに、アミノ酸による電流変化が観察できるという寸法だ。
方法論文なので、図も入れて十分説明できたと思うが、結果はアミノ酸配列により規則的電流変化が見られることが確認され、アスパラギン酸とグルタミンの中に紛れ込ませた、グリシンやトリプトファンを正確に検出できることを示している。また、この変化は基本的にアミノ酸とナノポアの相互作用によるナノポアの変化に起因していることも調べている。
さらに検出の信頼性を示す目的で、同じテスト鎖を、同じナノポアで2回読める工夫をして、同じナノポアであれば、同じ変化が再現されることも確かめている。
以上が結果で、まだまだ実用化とまでは行かないが、1分子アミノ酸配列解読が可能になれば、それがもたらす可能性は計り知れない。
2021年11月10日
非小細胞性未分化ガン、トリプルネガティブ乳ガンなどは、脳転移の確立が高い。そして、脳血管関門など様々な要因で治療が難しく、脳転移は悪い予後を予測する要因となってしまう。確実にガンに届くという意味では、放射線治療が用いられるが、大きく予後を改善するところまでは行っていない。
今日紹介するコーネル大学からの論文は、脳転移腫瘍の放射線治療に対する感受性を、比較的大量に経口摂取するL-アルギニンが大きく高めることを示し、そのメカニズムを探った研究で、11月5日Science Advancesに掲載されている。
アルギニンは、NO産生を通して血流改善だけでなく、細胞の基礎代謝にも大きな影響を及ぼすことから、スポーツサプリにも使われている、明日からでも利用できる物質だ。この論文では、まず実際の臨床例の検討から行っている。
まずアルギニンからNOを合成するNOS2の発現を、非小細胞性未分化ガン、トリプルネガティブ乳ガンで調べると、9割近いガンがNOS2を発現し、そのうち19%は強く発現していること、そして機能的MRIを用いて、アルギニンを5−10g摂取した後24時間で、腫瘍中の乳酸が低下し、ガンの代謝に大きく影響していることを確認している。
この結果を基に、63人の脳転移の患者さんに、照射前にアルギニンを経口摂取させ、その後1日2回の分割照射を、最終的に54.4Gy照射を行っている。治験は無作為化偽薬試験で行っており、放射線以外の治療は受けていない。アウトカムはResponse evalutation criteria in solid tumorsガイドラインに沿ったと書いてあるだけで、長期予後を正確に調べたものではないと思うが、結果は上々で、少なくともcomplete responseが10%対30%、Partial responseが12%対48%と大きく改善し、脳転移に限れば、7割近い患者さんで、50ヶ月以上の再発なしの経過が期待できるというものだ。今後是非大規模な治験と、長期予後に関するデータをとって欲しいと思う。
この研究では、臨床データを示した上で、なぜアルギニン摂取がガンの放射線感受性を高めるのかを調べている。ガンを移植したマウスにアルギニンを投与、1時間でガンを取りだし代謝解析を行うと、解糖系がPhosphoglycerateのステップで抑制され、ピルビン酸、乳酸と合成が低下、TCAサイクルも押さえられ、ガンのエネルギー代謝が押さえられている。
重要なのはこれらの変化のほとんどが、NOを介して起こっている点で、NOS阻害剤で乳酸の合成など代謝異常は正常化する。さらにNOによる代謝異常を追求すると、PhosphoglucerateステップのGAPDHがNOを介してニトロシル化されて長期的に阻害されることを示している。
このようなエネルギー代謝抑制に加えて、同じニトロシル化による機構で、この研究では特定できていないDNA修復分子の抑制が起こる結果、放射線照射後の修復が著しく低下していることも示している。
結果は以上で、元々NOは血管新生による血流改善効果なども知られており、ガンへの薬剤の浸透も助けることから、アルギニンはメカニズムがわかった放射線療法の補助物質として期待できるのではないだろうか。
2021年11月9日
少なくとも我が国では、人間を守るために生活環境をできる限り無菌的にする方向に向かっている。除菌からダニの吸引まで、多くのコマーシャルが日常にあふれていることを見ると、一般家庭レベルでも、清潔な環境を目指す努力が払われている。今回新型コロナ禍は、この努力をさらに加速させただろう。
しかし、清潔であることの副作用も存在する。例えば、アトピーの発生率と石けんの使用量は正比例しているそうだ。今では、赤ちゃんを清潔にと、ゴシゴシ洗うことの問題は広く理解されている。特に私たちと環境をつなぐ腸内細菌叢の研究が進んで、一定の“不潔”が体内に存在することの意義が示されている。
今日紹介するロックフェラー大学からの論文は、日本人の腸から消失した寄生虫も私たちを守ることがあることを示した研究で11月11日号Cellに掲載された。タイトルは「Enteric pathogens induce tissue tolerance and prevent neuronal loss from subsequent infections(腸管の病原体は次の感染に対する組織寛容を誘導し神経喪失を防ぐ)」だ。
正直言って、論文としてはゴチャゴチャして、高いレベルとは思えない。ただ、実験の発想は面白い。
サルモネラの感染は、腸内の神経を傷害して、蠕動異常を誘導してしまうが、このグループは、サルモネラから細胞内での増殖に関わる分子をノックアウトして、病原性をなくすと、今度は次の感染から神経障害を守ること、そして筋肉叢に存在するマクロファージのアルギナーゼArg1が、次の感染から神経を守っていることを突き止めている。
ただ、病原性をエンジニアしたサルモネラの話はここまでで、あとはStrongyloides venezulenesis(Sv)と呼ばれる糞線虫を前もって投与すると、やはり筋層マクロファージのArg1発現などを介して、サルモネラ感染による神経障害を抑えることを確認した後、この過程のより詳しいメカニズムを解析している。
長い話を短くすると、糞線虫が感染すると、このとき自然免疫系を介してCD4T細胞が誘導される。このTh2型免疫反応は、マスト細胞や好中球を局所に誘導して、糞線虫の除去を図るが、このとき同時に筋層のマクロファージを活性化して神経保護作用を発揮する。
ではどの細胞が直接の神経保護作用に関わっているか調べると、T細胞から誘導されるIL-5により好酸球が局所に誘導され、この好酸球が分泌するIL-4やIL-13により、Arg1陽性マクロファージが筋層にリクルートされることが、神経保護作用の背景にあることを明らかにしている。この反応は全て寄生虫への免疫反応なので、この免疫反応が病原菌に対する神経保護作用を準備しているという話になる。
また、この効果は何ヶ月も維持されるが、これは最初のTh2型免疫反応により、骨髄での血液産生が好酸球を多く作るようにリプログラムされ、さらに腸局所の環境が好酸球のさらなる活性化を誘導するようリプログラムされるからだと結論している。
メカニズム解析としては以上が全てだが、この論文で面白かったのは、実験動物として管理されていないペットショップからのネズミを調べようと着想し、実際購入してSPFマウスと比べた実験で、ペットショップのネズミでは、寄生虫などに対する好酸球/IL-4/IL-13型の免疫が維持されており、その結果病原菌感染による神経喪失が完全に防がれていることを示している。
人間でも同じことが言えるなら、現代人からこの機能は完全に失せたことになる。とすると、人為的清潔を求めて、さらにさらに清潔を徹底させ、ひいては世界をSPF化しようとしているのが、文明かもしれない。
2021年11月8日
CD19に対する抗体を受容体に使ったCAR-Tの臨床治験のデータを見て驚いたのは2014年、ずいぶん前のことだ(https://aasj.jp/news/watch/2309 )。その後我が国でも保険収載され、現在ではNovartis以外にもいくつかの会社が細胞を提供している。とはいえ、最初期待したほどは普及していないのも確かだ。これは、ガンのみに発現する抗原がなかなか見つからず、CD19にしても正常B細胞の犠牲の上に成り立っている。
今日紹介するCAR-T研究が最も盛んなフィラデルフィア大学からの論文は、神経芽腫細胞の組織適合性抗原により提示されているペプチドの中から、正常細胞の発現がないペプチドを選び、これに対する抗体を一種のFvディスプレイ法で開発し、神経芽腫もCAR-Tで治療できる可能性を示した研究で11月3日Natureにオンライン出版された。タイトルは「Cross-HLA targeting of intracellular oncoproteins with peptide-centric CARs(HLAを超えて利用できる細胞内のガン遺伝子を標的にしたペプチドを核にしたCAR)。
CAR-Tは抗原とそれに対する抗体の開発が決め手になる。この研究では元々突然変異が少ない神経芽腫のMHCに結合しているペプチド7000種類を、質量分析を用いて特定、HLAとの結合性、正常組織での発現などで選択を繰り返し、最終的に13種類の神経芽腫特異的ペプチドの同定に成功している。重要なことは、全て正常分子由来のペプチドで、これらは全て発生初期に発現し、成熟後は正常組織から消失するいわゆる胎児分子に相当している。
最終的に5種類の胎児分子の中から、ガンが発現が持続するPHOX2B遺伝子を特定したあと、親和性の高いHLAと結合した複合体を抗原に結合する、抗体可変部を選んでいる。この目的にはretention-screeningと呼ばれる、バクテリアに10の11乗の突然変異を発現させたライブラリーを用いて、高い親和性の抗体を探している。そして、このFvをキメラT細胞受容体として持つT細胞を準備し、腫瘍個体に注射、強いガン抑制効果を持つことを確認している。
結果は以上で、
生化学的方法でペプチドを特定し、全くin silico探索を用いていない点、 Fvを用いることで、いくつかのHLAと結合したペプチドに対応できること、 など、これまでとは大きく異なるCAR-T技術が完成した。コストを考えると簡単ではないが、是非推進を期待したい。
さて、私事になるが、昨日旅先で15kmのウォーキングの後、ほぼ脱水状態で温泉につかり、湯船から出た途端に意識を失い(おそらく立ちくらみ)、そのまま転倒にいたり、救急車で病院に担がれ、顔を数針縫う怪我とともに、左膝patella断裂に至った。応急処置を受けたので、今日神戸に帰って診察を受けるつもりだが、手術は必至なので、ひょっとしたら論文ウォッチを休むことになるかもしれない。途絶えても、おそらく元気で過ごしていると心配しないでください。
2021年11月7日
元々高齢者では不眠に悩む人が多いが、アルツハイマー病認知症では初期段階から不眠を訴える頻度が高くなることが知られている。一方、眠りは脳内の記憶の整理に必要なだけでなく、覚醒時に脳内にたまった老廃物を脳外へ排出する役目も担っていることが知られている。すなわち、眠りが妨げられると、アミロイドがさらに蓄積しやすくなり、悪循環に陥る。このようにアルツハイマー病でなぜ眠りが妨げられるのか、そのメカニズムを解明することは、この病気の治療にとって重要な課題と言える。
今日紹介するテキサス・ベーラー大学からの論文は、アミロイドが蓄積し始めると覚醒や睡眠状態を調節する視床毛様体核の回路が機能的に変化を来し、睡眠を妨げること、またこの回路を回復させることでアミロイド蓄積の進行を止められることを、マウスモデルを用いて示した研究で、11月3日号Science Translational Medicineに掲載された。タイトルは「Restoring activity in the thalamic reticular nucleus improves sleep architecture and reduces Aβ accumulation in mice(視床毛様体核の活動を回復させることで睡眠が正常化しアミロイドβ(Aβ)の蓄積を抑えることができる)」だ。
この研究では遺伝的に蓄積しやすいAβ遺伝子を持つトランスジェニックマウス(APマウスと略す)を用いて行動を調べ、 APマウスでは睡眠が断片化し、REM睡眠は正常だが、Slow Wabe Sleepと呼ばれる深い睡眠で見られる脳波が低下していることを確認する。また、これらの異常は海馬や皮質でのAβ蓄積量とも相関する。
すなわち、海馬でのAβ蓄積により、睡眠を調節する視床の機能的変化が起こる可能性が示唆された。そこで、Fos遺伝子の発現を用いて視床神経の興奮状態を調べると、視床毛様体核(TRN)の抑制性神経の活動が低下していることを突き止めている。一方、海馬や皮質と異なり、神経細胞の変性は見られない。
この結果は、Aβ蓄積によりTRN抑制性神経の興奮が低下することが睡眠異常の原因ではないかと考えられる。そこで静脈注射できる薬剤(CNO)でTRN抑制性神経(GABA神経)興奮を選択的に誘導できるようにしたマウスを用いてTRN刺激を行うと、Aβ蓄積が始まったマウスのTRN神経興奮が回復し、その結果として睡眠の中断がなくなり、Slow wave睡眠も正常化することを突き止めている。
では、正常睡眠の回復は期待通りAβの蓄積を抑えることができるだろうか。このために、CNOを30日間、毎日投与して正常睡眠を維持する慢性刺激実験を行い、Aβの蓄積を40%程度抑えられることを明らかにしている。
以上の結果は、少なくともマウスモデルで、Aβ蓄積、睡眠障害、Aβ蓄積促進の相乗サイクルを、正常睡眠を回復することで断ち切れる可能性を示唆している。
最後に人間でこのモデルが適用できるか調べるため、様々なステージのアルツハイマー病の剖検例のTRNを調べ、Fosの発現から推察される神経興奮が、ステージと反比例していること、すなわちステージが進むほどTRNの興奮が低下していることを明らかにしている。
マウスモデルとはいえ、睡眠とアルツハイマー病の生理学として面白く読んだ。是非、同じような効果を示す睡眠導入法が開発されることを期待する。
2021年11月6日
Covid-19についての論文に目を通していても、最近では新鮮な驚きが減って、この分野もアカデミックになってきたなと感じるが、それでもこれまでの常識を疑う素晴らしい研究に出会うことができる。逆に言うと、30Kbと小さなウイルスでも、尽きることがない不思議があり、研究が飽和しているように見えてきたときこそ、新しい発想が必要であることを示唆している。
今日紹介する、昨年クリスパーの開発でノーベル化学賞を受賞したカリフォルニア大学サンフランシスコ校Doudnaさんの研究室、およびカリフォルニア大学バークレー校からの共同研究論文は、新しい発想の研究の重要性を示す典型で、11月4日Scienceにオンライン掲載された。タイトルは「Rapid assessment of SARS-CoV-2 evolved variants using virus-like particles(新型コロナウイルスのウイルス様粒子を用いた変異体の迅速な検定)」だ。
紹介はしなかったが、クリスパーの本家本元として、Doudnaさんは一本鎖DNAを切断するCasシステムを用いて、増幅なしのCovid-19ウイルス検出法を開発して発表している。しかし、今回の論文は、全く違う分野の話で、技術的には特に新しいとはいえない、いわば地道な研究だ。
現在ウイルス感染実験はウイルス自体か、偽ウイルスと呼ばれる他のウイルスシステムを用いた感染実験に頼っており、抗体も全てこの方法でテストされている。一方、Doudnaさんたちは、完全にウイルスゲノムを排除したウイルス粒子だけで、感染実験を可能にする条件解明にチャレンジした。
もちろん感染を定量化する必要があるので、感染量を反映できるルシフェラーゼRNAをウイルス粒子の中に取り込んで、蛍光量で感染を検知しようとしている。言ってみれば、コロナウイルスの粒子をRNAの運び屋として利用する条件設定の研究と言える。
この目的のためには、スパイク、マトリックス、エンベロープと粒子外に存在する分子と、RNAとともに粒子内にパッケージされる核(N)タンパク質が至適な割合で作られ、レポーター遺伝子を含んだウイルス粒子を排出するパッケージ細胞を作成する必要がある。
さらに、レポーターRNAがNタンパク質とともに粒子内にパッケージされるように、コロナウイルスが持っているシグナルRNAを突き止め、Nタンパク質と結合するガイドRNA、感染を定量化するためにレポーターRNA、そしてパッケージのためのシグナルRNAを設計する必要がある。これらの条件を設定するのはおそらく簡単ではない。何度も試行錯誤を繰り返して、最終的に全てを至適化し、レポーター遺伝子の発現でウイルス感染を定量できるシステムを作り上げた、まさに地道な研究だ。
見方を変えると、アデノ随伴ウイルスベクターのようなコロナウイルス粒子遺伝子ベクター系が完成したことになる。
この研究ではこの新しいウイルス粒子+レポーター遺伝子感染実験系を用いて、スパイク変異の影響、スパイクに対する抗体の中和活性、そしてNタンパク質の変異の感染への影響を調べている。
まず驚くのは、この実験系では、α株、β株、δ株特有のスパイク変異が感染の効率に反映しないことだ。もちろんこれまでの研究を否定するものではないが、感染性を全てスパイクの問題にしていたことから考えると、今後は注意が必要だ。一方、スパイク変異の抗体への感受性は良く反映されている。抗体の中和活性を簡単に調べる素晴らしい方法だと思う。
さらに驚くのは、スパイク変異と異なり、粒子内にとどまるNタンパク質の変異は、パッケージ過程の効率上昇を介して感染性を高める効果が大きく、δ株の持つ変異によりなんと10倍以上の感染効率上昇が観察される。この結果を確かめるため、Nタンパク質の変異のみが異なるウイルスを作成して実際の感染実験を行い、感染で50倍の差が見られることを確認している。
以上が結果だが、この研究の重要性を私なりに考えると次のようにまとめられる。
Doudnaさんが述べているように、構造タンパク質の変異も含めてウイルスの感染性を迅速に調べることができるシステムが完成した。 このウイルス粒子は凍結融解で安定なため、ウイルス実験が難しい企業などに提供できる、簡単安全な感染実験を可能にした。 大きなRNAを運ぶウイルスベクターへの道を開いた。現在のlipid nanoparticleは簡単だが、コストが高い。このパッケージャーを用いて、アデノウイルスワクチン並みのコストで、コロナウイルス感染標的細胞(例えば気道上皮)を狙ったワクチンも可能になるかもしれない。 以上、さすがDoudnaさんと思える、ユニークな研究だと思う。