2025年6月30日
現在のトルコに位置するアナトリア地方はヨーロッパの農耕の始まったところで、ヨーロッパの民族形成には現ウクライナのヤムナ民族と並んで重要な位置を占めている。特に農耕がメソポタミアから渡ってきた新石器時代にアナトリアの民族や文化が形成されていることから、研究が進んでいる。この文化を象徴すると考えられているのがアンカラ博物館の女性像で、(https://www.worldhistory.org/image/13585/seated-woman-of-catalhoyuk/ :是非クリックしていてほしい)王座を思わせる椅子に妊婦らしい太った女性の座像で、女性が高い地位にあった文化であることが想像される。
今日紹介するアンカラ大学からの論文は、トルコ中央部に位置するチャタル・ホユクの発掘現場から出土した人骨のゲノム解析を様々な数理的手法を駆使して分析し、当時の家族や社会構造を明らかにした研究で、6月26日 Science に掲載された。タイトルは「Female lineages and changing kinship patterns in Neolithic Çatalhöyük(新石器時代チャタル・ホユクの女性系統と変遷する家族形態)」だ。
この論文とサイドバイサイドで、同じグループはメソポタミアからエーゲ海まで1万年にわたる遺跡のゲノム解析を行い、アナトリアのゲノムが極めて安定に維持されていること、即ち民族の移動ではなく、知識の移動によりアナトリア農耕文化が形成されたことを明らかにしている。
その上で、チャタル・ホユク地区のそれぞれの家から発掘されたゲノムの解析を行っている。この地区では家の敷地に生活を共にした人たちが何代にもわたって埋葬されるのが特徴で、このおかげで家を中心とする家族の遺伝的関係を明確にすることができる。
まず、もう一編の論文から明らかになっていたように、この地域のゲノムも安定しており、他の民族が移動してきた証拠はない。とはいえ、交流も盛んで、10%ぐらいは他の地域から来た人たちであることがわかる。この交流を通して農耕などの知識が導入されたと考えられる。また、農耕文化が根付く過程では、男系を中心とする家族関係が発展するが、チャタル・ホユクも同じで、埋葬されている男性は遺伝的関係が強いが、女性は低い。即ちこのブログでも何度も紹介したように、女性が家から外へ嫁ぐというしきたりが維持されていた。
ところが驚くことに、このような男系の選択性は農耕が定着した紀元前6500年前後になると低下し始め、6400年ぐらいではほとんど見られなくなる。即ち同じ場所に埋葬されている人たちの遺伝的つながりでの男系優位は消失していく。代わりに女系優位になるというわけでもなく、一つの家族に男性も女性も同じように参加する形態に変化している。
さらに驚くのは、同じ地域に埋葬されている人たちの遺伝的関係性が時代とともに低下し続けることで、同じ家には遺伝的つながりのない人たちが一緒に暮らし、おそらく外との交流も自由で、死後は同じ場所に埋葬されたことになる。アイソトープを使って生きていたときの食べ物を調べると、同じ家で暮らしていた人たちは、遺伝的つながりがなくても同じ釜の飯を食っていたことも証明される。日本でも、いくつかの家族が一つ屋根で共同生活をして農耕に従事するという活動があるが、誤解を恐れずに言うと、こんなイメージがチャタル・ホユクの家族に当たるように思う。もちろん、養子縁組をとおして血縁のない子供が家族として引き受けられてたのかもしれない。
ではアンカラ博物館を始めこの文化の特徴である女性優位は存在しなかったのか?実際には、女性を大事にする文化は強く、特に大人になる前に死亡した子供の埋葬のされ方を見ると、女性の場合は装飾品などより丁寧に埋葬されていることがわかる。即ち、出産という大事業を成し遂げる女性への強い尊敬を通して、血縁関係とは別の女性優位社会が形成されていたのかもしれない。
結果は以上で、このアナトリア社会が西に進んだとき、どう変遷したのか、面白い話が今後も出てきそうだ。
この研究グループを率いている Somel さんは学位をライプチヒのペーボさんの研究室で受けている。最近の古代ゲノム論文を見ると、ペーボさんの弟子たちが新しいアイデアをもって、新しい領域を開発し続けているのがわかる。ペーボさんは人を育てるという意味でもノーベル賞にふさわしい震源地になっている。
2025年6月29日
凡人から見るとノーベル賞を受賞するプレッシャーは大変なものだと推察する。すでにキャリアをほとんど終えている場合は別として、現役で受賞すると、さすがノーベル賞と言えるような研究を発表し続けることが要求される。しかし、そんなプレッシャーをものともしない「すごい」と思える受賞者が何人かいる。その一人が2014年グリッド細胞でノーベル賞を受賞したモザー夫妻で、専門外の私でも読んでいて面白い論文が多く、ここでも2-3回紹介した。
モザー夫妻はグリッド細胞のような内的な空間認識だけでなく、内的な時間の脳回路についても研究を進めており、2018年このブログで紹介した Nature 論文で、グリッド細胞が働いている内側嗅内皮質 (MEC) ではなく、外側嗅内皮質 (LEC) に様々な時間感覚で発火する神経細胞が存在し、これがエピソード記憶で働いていることを示していた(https://aasj.jp/news/watch/8870 )。
今日紹介する論文はこの続きで、脳内 LEC、MEC、そして海馬の CA1 にそれぞれ1000近い電極を設置されたラットで、LEC で刻まれる内的な時間と外界の経験との関わりを調べた面白い研究で、6月26日号 Science に掲載された。タイトルは「Event structure sculpts neural population dynamics in the lateral entorhinal cortex(出来事の構造が外側嗅内皮質の神経集団の動態を決める)」だ。
まずケージの中で自由に動いているラットについて、10分間 LEC で記録された電極の活動を多次元空間にプロットして、これを2次元圧縮してみると、時間とともに一方向へ移動しているのがわかる。一方、グリッド細胞が存在するMECではこ時間に合わせたこのような変動は全く検出できない。
面白いことに、同じパターンの移動が REM 睡眠時の LEC の活動からも見られることから、起きているときも、寝ているときも LEC では独自の時間が刻まれているのがわかる。この原因を一個一個の神経の活動を分析して調べると、グリッド細胞のように特定の座標にロックされるのではなく、個々の神経がフレキシブルに様々な時間を生み出すとともに、全体に合わせるようにできている。
このフレキシビリティーが重要で、時間の経過中ラットに様々な課題を行わせると、時間経過に従うものの、課題を始めるときには同期した神経細胞の活動が始まるため、時間の刻みが断裂して見えるが、実際には多くの細胞が変化を吸収し、課題が行われている間も同じように時間が刻まれる。このように時間の流れの中に、新しい経験を明確に境界を持った活動にまとめることで、経験の新しい時間を提供している。
これは一つの流れの中に、様々なイベントが経験されるときも同じで、それぞれのイベントは別々の塊にまとめられるが、全体の時間の中で明確に順番が決められる。以上の変化はすべて LEC で起こっており、MEC や CA1 では時間経過を神経活動から抽出することはできない。
以上が結果で、2018年の研究と比べると、現象論ではあるが、より明確に LEC の時間を定義できるようになっている。
個人的な話になるが、モザー夫妻の面白さは、カントのアプリオリの総合判断を脳科学的に説明している点にある。実際、彼のノーベル賞受賞理由の説明文にカント哲学が登場する。その意味で、アプリオリの総合判断の基本、内的な空間座標と時間座標の脳科学はもっと哲学者も学ぶべきだと思っている。
2025年6月28日
今週号のサイエンスを見て最も驚いたのは、同じ号にイカに関する論文がなんと2報も掲載されていたことだ。これまでイカについての論文をサイエンスで見たことがあるかと考えてみてもほとんど思い出せない。あらゆる科学分野を扱うサイエンスの編集方針を考えると、イカが取り上げられる確率は極めて低いのが当然だ。それが2報同時とは、ほぼ奇跡に遭遇したようなものなので紹介することにした。
最初の論文は北海道大学からの論文で、化石発掘の常識を破ることで、これまで不可能だったイカの古生物学が大きく発展させられることを示した素晴らしい研究だ。タイトルは「Origin and radiation of squids revealed by digital fossil-mining(デジタル化石発掘法によりイカの起原と放散が明らかになる)」だ。
これまで化石発掘というと、博物館で見るように岩石の中から実際の化石を掘り出すことが基本だった。ただ、化石として残るところの少ないイカのような軟体動物では、残った化石を削り出すのが難しいため、それが可能になった一部のイカだけが記載されてきた。
この化石部分を残すという発想を改め、化石は捨てて形を記録として正確に残すという発想の転換をした点がこの研究のハイライトだ。方法は、断層写真を撮るように、化石が含まれる岩石を少しづつ削って、出てきた表面の写真を撮影。これを繰り返すと写真から化石の3次元画像が再現できるという点だ。議論されていないが、化石部分のマテリアルも写真撮影後に採取できるので、化石が残らない以外は古生物学的には問題ない気がする。また将来、それぞれの層に存在している石の粉を残しておけば、化石由来の粉だけ選択して化石を再現することすらできるだろう。素晴らしい発想だと思う。
この発想のおかげで、250個40種類ものイカの嘴を再現することに成功し、形態学的系統学からイカが白亜紀後期に進化し急速に多様化し、さらに6600万年前白亜紀と第3紀の間に起こった大量絶滅期を境に、ベレムナイトのような大きなからを持った種類の絶滅とともに、現在にみられるイカの多様化が起こったことが示されている。実際、ほぼ全時期を通してアンモナイトより遙かに多くのイカが存在し、硬骨魚に匹敵する数が存在し続けていることを示している。
将来は嘴の部分の石粉からタンパク質を抽出することも可能になるかもしれない。
次のカリフォルニア大学アーバイン校からの論文はガラッと変わって、イカの持つ七変化とも言うべき美しい色彩の原理を探って、それを再現しようとした研究で、タイトルは「Gradient refractive indices enable squid structural color and inspire multispectral materials(段階的な反射がイカの構造的色彩を可能にしており、多重スペクトラムを有するマテリアルのヒントを与える)」だ。
北大の研究からわかるように、イカが多様化しつつ現在まで生きていることは、様々な新しいメカニズムを開発したということを意味しており、その一つが多彩な色彩を発することができるiridophore といえる。これによりイカは多様な色彩の模様を体表に表現するが、必要なときには全く光を反射することなく透明になれる。
この研究ではまずこの iridophore の多くが小さな板状の結晶が集まった構造を持っており、それぞれの結晶は場所に応じて異なる波長の光を反射する Braggs reflector を形成し、それがS字状に波打つことで、透明から異なる色彩を反射していることを明らかにしている。
この分析を基礎に、同じような特性を持った色素斑を人工的に作れるかチャレンジしている。機械的力で結晶の向きを変えることで、透明からいくつかの色の反射が可能な材質を特定し、さらにこれを化学的にオンオフ可能なように変化させて、イカの iridophore と同じようなパッチを形成することに成功している。
面白いのは、このパッチが異なる光を反射しているときは、遠赤外光も遮断することから、断熱材としても使えることで、必要に応じて熱を通したり、熱を遮ったりする面白いシートが可能になっている。
工学的なことはよくわからないのでこのぐらいにしておくが、イカの特徴をしっかり学ぶことができた今週号のサイエンスだった。
2025年6月27日
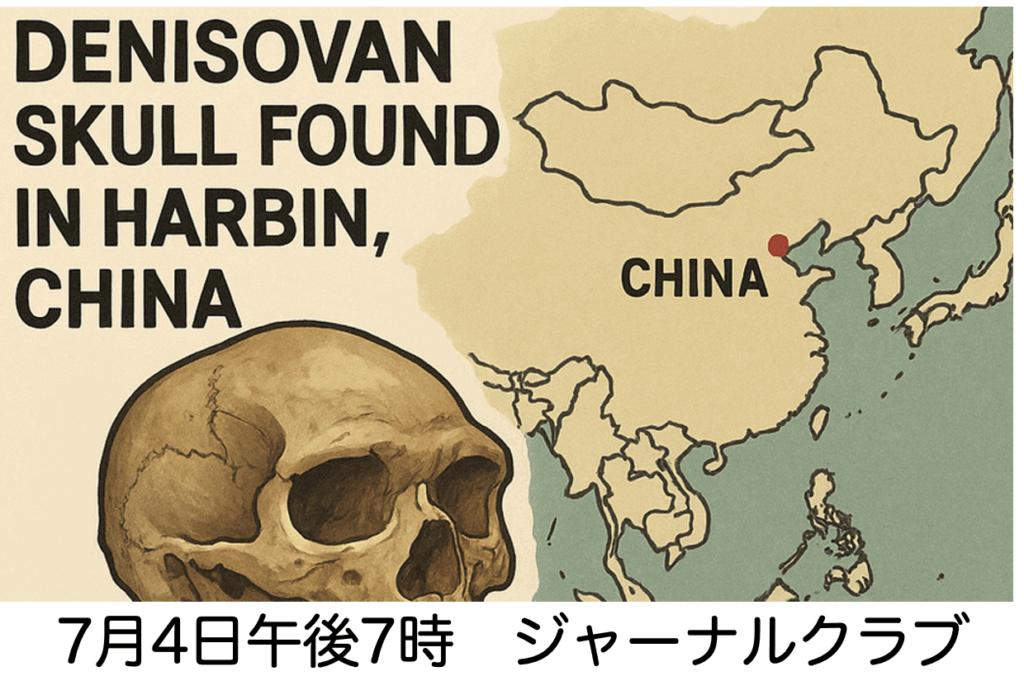
論文ウォッチでも紹介したように、中国黒竜江省ハルビンで発掘された中期更新世期のほぼ完全な頭蓋がDenisova人由来であることが証明されました。Paeboさんたちがホモサピエンス、ネアンデルタールに続く第三のホミニンとして報告してから15年が経って、ついにDenisova人の総合的な研究が始まるように感じます。Denisova人は特にアジアやポリネシアとの関わりが深く、最近台湾から発見された下顎についての論文には我が国の 蔦屋(筆頭著者)、太田、海部が名を連ねており、個人的にも期待しています。そこでPaeboさんの発見以来、Denisova人についてどのようなことがわかってきたのか15年を振り返るジャーナルクラブを7月4日金曜日夜7時からZoom開催します。例によって直接参加したい方は連絡いただければURLを送ります。内容は終わり次第Youtube配信しますので、そちらをご覧ください。
2025年6月27日
GLP-1 アゴニストや SGLT2 阻害剤の開発で、2型糖尿病 (T2D) の包括劇な管理が可能になり病気の進行を抑えることが可能になったが、T2D の背景にある組織のインシュリン抵抗性を改善する薬剤は進んでいない。武田薬品が開発した PPARγ 作動薬ピオグリタゾンはインシュリン感受性を改善すると期待されたが、副作用のために利用されていない。最近紹介したノボ・ノルディスクからの NK2R 作動薬はインシュリン分泌に影響せず食欲を落として脂肪を燃焼させてインシュリン感受性を上げるので少しは期待できるが、筋肉に対する作用は期待できないように思う。
これに対し今日紹介するカロリンスカ大学からの論文は、インシュリン感受性を高める王道と言える筋肉の β2 受容体を標的にして、cAMP 合成を上昇させずにグルコースの取り込みだけを高める薬剤を開発し、すでに第1相治験まで終えて発表された研究で、6月23日 Cell にオンライン掲載された。タイトルは「GRK-biased adrenergic agonists for the treatment of type 2 diabetes and obesity(GRKを選択的に活性化するアドレナリンアゴニストは2型糖尿病と肥満を治療できる)」だ。
β2 受容体のアゴニストは喘息の吸入剤として使われるが、ボディービルダーの間では筋肉増強剤として密かに使われている薬剤だ。このような使い方がされているのは、β2 受容体が Gタンパク質と結合してcAMP 合成を高めるクラッシック経路に加えて、β2 受容体をリン酸化する GRK を介する別の経路が存在し、特に骨格筋に介してはグルコースの取り込みを高めることが知られているからだ。ただ、両方が存在してしまうと、心拍数が上がり、心筋肥大が起こるといった重篤な副作用が起こる。
この研究では心臓への作用の中心である cAMP 合成活性が低く GRK 活性化の作用が強いことが知られている Bamethane を化学的に変えて、GRK 経路にできるだけ選択的な薬剤を設計する中で、目的に合ったいくつかの化合物を見出している。
この薬剤を含む様々な β2 受容体作動薬を Gタンパク質との共役、グルコース取り込み、そして arrestinとの結合による β2 受容体不活性化などを指標に評価し、新しい化合物が期待通り GRK 活性化とグルコース取り込みへの選択性が高いことを確認する。
次にこのような選択性が生まれる原因を構造学的に解析し(といっても AlphaFold を用いる理論的検討で、クライオ電顕のような方法は用いていない)、選択制を持つ化合物が特定のアミノ酸と水素結合を形成することで選択制が生まれることを示唆している。
下流のシグナルについても調べ、新しい化合物が mTORC2 という、インシュリン受容体下流の Akt 分子の活性化に関わる分子を通して GLUT4 トランスポーターを細胞膜にリクルートし、グルコース取り込みに関与することを明らかにしている。
あとは高脂肪食で肥満とインシュリン抵抗性を発生させたマウスに投与し、グルコーストレランスが著しく改善する一方、他の β2 受容体作動薬と異なり、長期に投与しても不整脈や新肥大を起こさないことを確認している。驚くのは、現在抗糖尿病として利用されている GLP-1 アゴニストと併用実験を行い、GLP-1 阻害薬により脂肪現象とともに起こる筋肉量の減少を完全に止めるどころか、上昇させることを示したことで、まさに完璧な糖尿病治療が可能になることを示している。
その上ですでに6ヶ月投与し続ける第1相試験も済ませており、最初心拍数の上昇を認めるが、これはすぐ正常化し、あとは安全に服用可能であることを述べているが、これについては臨床の雑誌に出てくるのだろう。
以上、糖尿病薬だけでなく、ボディービルダーにとっても安全な筋肉増強剤としても使われることは間違いない。また、GLP-1 アゴニストは筋肉減少を誘導するので高齢者には使えないが、この薬剤と併用するとこれが可能になるかもしれない。もちろんサルコペニアなどにも利用可能で、新しいブロックバスター誕生かもしれない。
2025年6月26日
寝る子は育つという言い伝えは日本だけではない。Chatに聞いてみると、ドイツでは “Kinder wachsen im Schlaf” 、フランスでは “Le sommeil fait grandir les enfants” 、そして中国では「小孩子要多睡觉、长得快」と、全く同じ言い伝えがある。即ち万国共通の観察だが、この原因は1969年成長ホルモン (GH) のほとんどは睡眠時に分泌されているという論文が Science に発表され、この GH の分泌パターンを先人が観察していた結果であることがわかっている。ただ、夜に GH を分泌するメカニズムについてはわかっていなかったようだ
今日紹介するカリフォルニア大学バークレイ校からの論文は、睡眠と GH分泌の関係を神経回路レベルで詳しく解析した研究で、6月24日 Cell にオンライン掲載された。タイトルは「Neuroendocrine circuit for sleep-dependent growth hormone release(睡眠で成長ホルモンが分泌される神経内分泌回路)」だ。
成長ホルモンは成長ホルモン放出ホルモン (GHRH) と GH分泌を抑制するソマトスタチン (SST) により調節されているが、この研究では GHRH を分泌する視床下部・弓状核を光遺伝学的に刺激できるマウスを作成、この神経細胞を同じように刺激しても GH分泌は睡眠中の方が高いことを発見する。
次に GHRH を抑制して分泌抑制に働く STT神経について探索し、一つは脳室周囲核から直接下垂体に投射する回路と、弓状核で同じ領域の GHRH神経に投射している回路を特定する。それぞれは GABA 作動性の抑制神経で、刺激により前者は直接 GH分泌を抑制し、一方後者は GHRH神経に働いて強く GHRH、続く GH を抑制することを確認している。
次に、SST神経と睡眠の関係を調べると、睡眠時に活動が低下していることがわかった。即ち覚醒時には GHRH や GH の分泌を SST神経が抑制しており、この抑制が外れることが睡眠時の GH分泌上昇に関わることが明らかになった。
最後に、視床下部内で GH受容体を発現する細胞を探索し、GH分泌に応じてこの回路を制御できるフィードバックループを探索し、睡眠を妨げる働きを持つとされている青班核内のノルアドレナリン神経が GHに反応して興奮することを発見し、睡眠と連動した GH分泌回路が、睡眠自体も調節することを明らかにしている。
以上が結果で、寝る子は育つ→睡眠中の GH分泌→視床下部弓状核、脳室周囲核、青班核をつなぐ神経分泌回路というつながりが明らかになった。神経研究としてはオーソドックスだが、寝る子が育つ回路を特定しようという着想がこの研究のハイライトだと言える。
2025年6月25日
ALSは進行すると字を書くための骨格筋だけでなく、言葉を話す筋肉の麻痺が進み話せなくなる。このため視線や瞬きでコミュニケーションをとるための技術が進んできた。最近になって脳内に留置できるクラスター電極が可能になり、頭の中で字を書くことで画面上に伝えたい文章を書く方法が開発され、2021年 Nature に発表された(https://aasj.jp/news/watch/15671) 。250個の電極の興奮情報だけでほぼ完璧に考えていることを文字表現できるのは本当に驚きだ。ただ、文字を書くという作業と言葉を話すという作業は、伝えたい内容を決めるまでは一緒でも、使われる回路は大きく異なっている。また話して伝える場合、発話の一定のスピードが必要で、さらに調子やアクセントも加える必要があり、脳内留置電極を使う場合でも実現にはハードルが高い。
今日紹介するカリフォルニア大学デービス校からの論文は、一人の ALS 患者さんの脳内言語運動野にクラスター電極を設置、この活動をトランスフォーマーを基盤にする LLM に学習させたモデルを作成し、このモデルにセンテンスを考えている患者さんの脳活動をインプットすると、即座にそれに対応する言葉が、しかも前もって録音しておいた自分の声として出てくる新しい脳・機械インターフェース (BMI) の開発で、6月12日 Nature にオンライン出版された。タイトルは「An instantaneous voice-synthesis neuroprosthesis(考えると即座に声を合成できる神経装置)」だ。
神経科学では脳活動を GPT などトランスフォーマーモデルを使って文章化するということが、ChatGPTなどが普及する前から行われており、脳活動を単語と相関させていくこれまでの機械学習とは異なるレベルの脳活動のデコーディングが可能であることはわかっていた。とはいえ、実際の ALS 患者さんが、このシステムを使って自然に話せるようになるかは別問題で、一人の患者さんとおそらく長い時間をかけて、モデルのトレーニングやチューニングを繰り返して、できあがってきた結果が示されたのがこの論文になる。
モデルのプレトレーニングは画面に表示された文章を患者さんに頭の中で復唱してもらって、それをトランスフォーマーデコーダーに学習させている。その上で、話そうとしたときの脳活動インプットし、それが言葉として発話できるかについてのモデルのパーフォーマンスを反応スピードや意味が通じるかなどを指標にして評価している。これまでの機械学習とことなり、考えるとすぐに言葉として表現できる。
その上で、言葉のピッチやアクセントについても別にデコードして重ねる方法をまず用いて、発話時にピッチや強さなどが表現できるか検討している。このとき言葉のニュアンスを表現できるようにモデルをトレーニングする方法が詳しく述べられており、様々な可能性が試されたことがわかる。
最後に、二つのデコーダーを使うのではなく、一つのモデルでニュアンスも単語やセンテンスも同時に学習できるモデルが可能か調べ、我々の脳が全体を同時に処理して発話している活動を、そのままデコードできるモデルを完成させている。このモデルではメロディーを思い浮かべてもらうことでそれを表現できる。
実用上の結果は以上で、患者さんはまだニュアンスの表現については満足できないと正直に評価しているようだが、素晴らしいモデルができあがってきたと思うし、現在の LLM の発展を考えると、これをもっと自然の発話に近づけるのは時間の問題だろう。
ただ、読んでいて驚くのは、この研究自体が言葉を話す脳活動自体の研究になっている点だ。このモデルではもう一度脳活動と発話された結果を対応させることができるが、脳活動は最終的に発話に集約していない活動が多く存在している。これが話そうとするときの準備や次の言葉を探す過程に相当していると考えると、発話する脳の活動を高い分解能で調べた膨大なデータが得られたことを意味する。このように、脳とトランスフォーマー LLM を並列させて調べる研究が大きく発展すると思う。
2025年6月24日
時差がない限り、睡眠不足はあとでぐっすり寝ると取り返せる。即ち睡眠不足を感知して、深く長い眠りを誘導し、すっきり感じさせてくれる脳回路が存在することになる。これまで、ノンレム睡眠 (NREMS) やレム睡眠 (RES) を誘導する神経領域が特定されているが、神経刺激がすぐに睡眠に繋がる回路で、睡眠せずに頑張っているときに興奮して眠りの質を変化させる回路は知られていなかった。
今日紹介するジョンズホプキンス大学からの論文は、眠りが妨げられると興奮して続く眠りの質を高める回路を特定した面白い研究で、読んでいても自分のことのように感じられる論文だ。6月19日 Science に掲載された。タイトルは「Sleep need–dependent plasticity of a thalamic circuit promotes homeostatic recovery sleep(睡眠の必要に応じた視床回路の可塑性が寝不足を回復させる睡眠のホメオスターシスを促進する)」だ。
これまでどこを刺激すると睡眠に落ちるかといった研究は多かったが、睡眠不足で睡眠の質が変化するという我々の日常感覚を確かめてみようと着想したことがこの研究のハイライトだと思う。この目的で、刺激により NREMS が誘導される領域に結合して、NREMS を調節する領域を一つづつ刺激してNREMSへの影響を調べ、視床の会合核 (RE) のグルタミン酸作動性興奮ニューロンを化学化合物で刺激することで、数時間遅れて NREMS 時間が伸びることを観察する。即ち、興奮が時間をおいて NREMS に繋がる神経回路の起点を発見したことになる。
次に光遺伝学的方法で RE を20Hzパルスで30分刺激すると、6時間以上の NREMS が誘導できること、また刺激が短いと NREMS の長さも短くなることからまさに睡眠の質を調節していることを明らかにする。面白いのは、ほとんど NREMS を延長しない短い刺激でも、ネズミの寝支度(床を作り、グルーミングする)を誘導できる点で、RE は様々な領域に枝を伸ばして、寝るまでのプロセスを進めていることがわかる。
では睡眠が妨げられると RE の興奮は高まるのか?これを調べるため、RE領域の活動を連続的に記録すると、RE は起きているときに興奮が維持されることが確認された。このとき興奮した神経だけを TRAP法で操作すると、この興奮により眠りの質が変化させられること、さらに光遺伝学的にこのとき興奮した神経が NREMS を延長することも確認し、RE こそが起きている間に睡眠不足を感知しそれを NREMS調節領域に伝えて睡眠を延長する神経であることがわかった。
そのあとさらに詳しい実験を重ねて、投射回路の特定、興奮により起こる生化学的、細胞学的変化について解析しているが、すべて割愛して最終的な結果だけをまとめて紹介する。
これまで見てきたように、起きている時間に RE は興奮し続ける。RE はやはり視床で NREMS を直接調節している不確帯に投射しているが、RE が刺激を受け続けることで不確帯トのシナプス形成に関わる樹状突起が時間とともに広がっていく。即ち起きている時間に合わせてシナプスの細胞学的構造が変化し、興奮頻度が高まる。この構造学的変化は、刺激を受け続けることで起こる CAMKII の活性化により媒介されており、これにより起きている時間に応じて NREMS を直接調節する不確帯の活動を変化させることができる。この細胞学的変化はぐっする眠ることで完全に元通りになるので、同じ感度で睡眠不足を検出できることになる。即ち、ついに起きている時間に応じて次の睡眠の質を決める回路が明らかになった。
このように我々は覚醒時と睡眠時のホメオスターシスを維持していることになるが、最後にこれに関して最近面白いと思ったカナダのビクトリア大学が米国アカデミー紀要に発表した論文を短く紹介する。
睡眠が妨げられると健康に悪いことははっきりしている。では睡眠時間が短い国では病気が多いのか?こんな素朴な疑問を確かめた研究で、まず各国の睡眠時間を比較すると、調べた中で一番短いのが日本で、一番長いのがフランスで、なんとなく納得できる結果だ。ただその差は一時間を超える。
次に各国で睡眠時間と健康指標を調べると、確かに睡眠時間が短いと健康指標が低下するが、それぞれの健康指標のピークは、それぞれの国の平均睡眠時間に一致するという結果だ。即ち、それぞれの国で睡眠覚醒のホメオスターシスを調節している回路の特性が異なっているようだ。
こんな結果を見ると、健康障害はこのホメオスターシスの破れが問題で、単純な睡眠時間だけの問題ではないことがわかる。今後 RE の特性を変化させて短くてもバランスが維持できる時代が来るかもしれない。
2025年6月23日
今月は変わった臨床検査についての2論文から始める。
最初は6月12日Current Biology に掲載された(図)。
タイトルにあるように、左右の鼻孔に吸気と呼気の圧の微妙な違いを(24種類のパラメータ)検出できるセンサーをつけ、24時間呼吸を記録して、それを AI に学習させたモデルを作成している。このモデルを用いると、新しくインプットした呼吸パターンからほぼ完全に個人を特定できる。寝ているときより、起きているときのパターンの方が正確に個人を特定できる。また、測定日を変えてもほぼ同じパターンが維持されることも確認されている。
次に、このパターンから身体の状態を予測できるか調べて、身体的計測では BMI と高い相関が示されている。睡眠時無呼吸症候群など肥満と関わる呼吸状態はよく知られているが、覚醒時の長期記録で BMI が予測できるのは面白く、詳しい原因を知りたいところだ。
また、自己申告から判断した、ムードや不安、さらに人付き合いなどのスコア(うつ病、不安症、自閉症診断に用いられる)もそれぞれ明確な相関を示していた。
以上が結果で、これで難しい診断が可能になるというものではないが、呼吸のパターンに精神や新多状況が反映されていることを知るだけで十分だと思う。
次は5月28日 Analytical Chemistry にオンライン掲載された中国浙江大学からの論文で、パーキンソン病 (PD) を耳垢の揮発性有機化合物から診断できるという論文だ。
研究では PD と健常人の耳垢を採取、その中に含まれる揮発性物質の種類をガスクロマトグラフィーと質量分析を組み合わせて測定している。また人工的匂いセンサーを用いた測定も行い、それらをやはりニューラルネットに機械学習させ、診断が可能かを調べている。
揮発性の物質を検出しているので、要するに耳垢の匂いから診断が可能かという課題だ。詳細は省くが、検出された4種類の揮発物質が最も PD 診断と相関が高い。しかし、それだけではなく結果全体をインプットし、さらに匂いセンサーデータを統合することで、ROC で98%という診断率が可能になっている。
結果は以上で、面白い着想だが、相関の高い分子をさらに探索し直すことで、PD の新しい病態を理解できるようになるかもしれない。
最後は末梢血中の DNA からガンを診断する liquid biopsy について5月22日 Cancer Discovery にオンライン掲載された論文で、話題としては何を今更という感があるが、日本賞も受賞しているガンゲノミックスの大御所 Bert Vogelstein の研究室からということで取り上げた。
研究では動脈硬化の経過を調べるための小さな地方コホートを利用して、登録時からガンの発見に至るまでの血液サンプルから DNA ライブラリーを作成し、シークエンスベースで特定の変異を探索している。即ち、全ゲノムを解読するのではなく、40種類の変異に絞って変異があるかを調べている。方法としてはさすが Vogelstein と思う完全かつ簡便な方法になる。
結果だが、52人のうち26人がコホートスタートから6ヶ月でガンと診断されている。このうち8人で最初の採血サンプルでガンの変異を持つ DNA が発見されている。即ち診断率は3割ぐらいになり、診断率は低いと片付けられる可能性はある。しかし、ガンを発症しなかった残りの26例では、全く擬陽性がなく、またその後のフォローでも陰性のまま経過していることを考えると、陽性率は低くても、ガンの特異診断法としては価値があると思う。
では早期診断かというと、発見された患者さんのうち5例が亡くなっていることを考えると、早期診断に役立っているとは結論できないようだ。
最後に、ガンと診断された患者さんたちが残していたさらに以前の血清について、すでに特定された変異であれば何年も前からガンの DNA が血中に存在するか調べている。0.2% 以上の頻度で見つかる例が2例存在し、さらに0.1%程度が2例存在することから、感度さえ上げれば早期診断も可能かもしれない。
いずれにせよ、Vogelstein が集大成として早期診断に真面目に取り組んでいるのに頭が下がる。
2025年6月22日
アフリカのシクリッドは口の中で子供を育てることやクエの口の中を掃除する代わりに敵から守ってもらうベラの仲間が存在することはよく知られているが、視覚の及ばない場所で餌と間違わない認識が行われているはずだ。
今日紹介するハーバード大学からの論文は、タコが視覚が効かない夜の海や岩の隙間を長い足を伸ばしてサーチし、餌とそれ以外を区別する仕組みの一端を明らかにした研究で、6月17日 Cell にオンライン掲載された。タイトルは「Environmental microbiomes drive chemotactile sensation in octopus(環境の細菌叢がタコの化学的触覚感覚を決める)」だ。
このグループは2020年にタコの足に存在して海中で特定の化学物質を感知する感覚受容体 (CR) を明らかにする論文を発表していた。26種類の CR がゲノム上に存在するようだが、この研究では最初に遺伝子クローニングされ、研究が進んでいる CR1 に焦点を当てている。
また、触覚の機能として、生きたカニと死んだカニを区別する行動、及び卵を守るとき死んだ卵を区別して排除する行動を選んで、このときの区別に CR1 がどう関わるかを研究している。
CR は匂いと同じで化学化合物を認識するので、区別に繋がる化合物を明らかにする必要があるが、死んだカニの甲羅や卵の殻に多くの細菌叢がとりついて分解を始めることに着目し、細菌叢の構成成分のなかの100種類近くを個別に培養し、細菌の分泌化合物を含む上清の刺激活性を、CR1 遺伝子を導入したヒト細胞株を用いて、パッチクランプ法で調べている。
大変な実験だが、結果は予想通りでかにの甲羅由来のバクテリアではシュードモナス・アルカリゲンスが、排除された卵の殻からはビブリオ・アルギノリティクスの上清が刺激効果があることがわかった。そして、それぞれから最も強い反応を誘導する2種類の有機化合物 H3C と LUM を単離している。切り離したタコの足に添加する実験でも、反応パターンは異なるものの、強い足の反応を誘導することに成功している。
次に、CR1 と H3C 、 LUM を含む様々な化合物との結合を構造学的に調べ、CR1 は水に溶けない非親水性化合物と結合するポケットを持っているが、非親水性化合物であれば同じように反応するわけではなく、構造的にはポケット周辺にある異なるアミノ酸残基と水素結合の仕方で、異なる化合物と結合していることがわかった。カルシウムの流入に関わるチャンネル構造との関係で見ると、LUM や H3C はチャンネルを閉じているアミノ酸のポジションを変化させて、カルシウムの流入を高めることを示している。
以上の構造学的知識の上に、もう一度死んだ甲羅や排除された卵を見るとそれぞれ H3C や LUMg が死亡とともに濃縮し始め、さらにこれらの化合物により吸盤による結合が抑えられていることを確認している。
タコの感覚についてこれほど大々的に真面目に研究を進めたことに脱帽するが、これほどの研究を支えている今迫害にも負けずトランプと闘っているハーバード大学にも敬意を表したい。