2025年7月5日
自動車の自動運転は機械学習の一つのゴールだが、最近では大規模言語モデルや視覚言語モデルを活用する研究が急速に進んでいるようだ。おそらくLLMの導入の一つの狙いは運転時のベテランドライバーの判断を再現することにあると思うが、そのためには人間の判断や意志決定を正確に再現できるLLMの開発が必要になる。
今日紹介するドイツ ミュンヘン ヘルムホルツセンターからの論文は、人間の意志決定を予測できる、即ち人間の判断を再現できる言語モデルの開発についての研究で、7月2日 Nature にオンライン掲載された。タイトルは「A foundation model to predict and capture human cognition(人間の意志決定を予測できるファウンデーションモデルの作成)」だ。
碁や将棋といった特定のルールの中での判断を競う場合は強化学習の方法が確立しているが、人間はゲームだけしているわけではなく、様々な問題に対して判断していく必要がある。こんな場合は、人間の行動ではないが人間の作成したセンテンスを学習したLLMが向いていると直感的に感じるし、現在皆さんが使っているLLMでも状況に合わせて判断することができる。ただ、このグループはファインチューニングを通して、人間の行動予測により強いLLMが形成できるのではと着想して研究を始めている。
そのためのLLMプラットフォームとしてメタが開発して Llama 7B をダウンロードした一つのGPUを持つPCに実装し、研究に使っている。大きな研究室レベルというより、比較的小さなモデルを目指している。
この研究のハイライトは、人間の判断に近づけるためのファインチューニングに、100種類以上の人間の行動心理実験の結果を網羅した大規模データを用いているという着想だ。即ち人間の判断の集まりともいえるこのデータベースを言語化してファインチューニングに用いることで、通常の言語モデル Llama を判断に強いモデルへと変えられると考えた。
小さいマシンなので、GPUメモリを消費しないよう Quantized Low-Rank Adaptation という新しい方法でファインチューニングを行っている。このとき、あとでモデルをテストするため、敢えて全てのデータを学習させず、一部のデータをテスト用にとっている。大変そうだが、実際には5日でファインチューニングが完成しているようだ。
結論は期待通りで、様々な課題を Llama や強化学習モデルに溶かせたときと比べると、かなり高いレベルで人間の行動様式を予測できる。また、通常の行動心理テストに、新たな内容を加えて解かしても、高いパーフォーマンスを示す。そして、全くチューニングに用いなかった論理的行動に関しても、高精度に予測できることから、教えたことをただ繰り返すのではなく、新しいしかも多様な状況に応じた判断を予測できるようになっている。もちろん、データをあたえれば個人レベルの判断傾向も予測することができる。即ち、課題を問わない人間の判断を予測するファウンデーションモデルができた。
この研究のもう一つの面白さは、小さなモデルなので、LLM内での処理についても解釈することができる点で、これを利用して実際の人間が判断を行っているときの fMRI画像(=脳活動)とLLMの処理とを比較することができることを示している。すなわち、人間の脳内での活動をLLMと比べることも可能だ。
最後に、新しい課題に対して適切な判断を繰り返すことで、人間のように仮説に基づいた新しい実験が可能かといった一歩進んだ課題を予測できることも実験的に示しており、現在問題になっているLLMが自分で実験を行い新しい概念を出しうると言う可能性も示唆している。
完全に理解できたわけではないが、極めて面白いチャレンジで、当然自動運転やロボット手術も同じようなモデルが導入されるのではと思う。何よりも、テキストによるファインチューニングで、人間により近づいたのに驚く。
以前も正しいデータだけで学習させることの重要性を示したフライブルグ大学からの論文を紹介したが(https://aasj.jp/news/watch/25974 )、ドイツは新しいLLM時代の研究方向に十分適応しているように思える。
2025年7月4日
毎日分化細胞を生産する必要がある幹細胞システムは、当然変異が発生する頻度も高く、その結果他の幹細胞より増殖優位性を獲得するクローンが発生する危険をはらんでいる。このような変化を見つけやすい造血系でクローン性増殖として研究が進んでおり、年齢とともに頻度が増え、動脈硬化などの疾患を促進し、死亡率を高めることがわかっている。
これに対し今日紹介するベイラー医科大学からの論文は、クローン性増殖も悪い話ばかりではなく、アルツハイマー病に関しては進行を抑える可能性を示した研究で、7月2日 Cell Stem Cell にオンライン掲載された。タイトルは「TET2-mutant myeloid cells mitigate Alzheimer’s disease progression via CNS infiltration and enhanced phagocytosis in mice(TET2変異を持つ骨髄細胞は脳に浸潤し貪食を亢進させてアルツハイマー病を抑える)」だ。
この論文を読むまで気がつかなかったのだが、2023年にスタンフォード大学のグループが血液のクローン性増殖とアルツハイマー病 (AD) リスクが逆相関するという論文を Nature Medicine に掲載していた (Vo.29, 1662) 。オッズ比で0.65と低下しているのでかなりの効果だ。
この研究ではこの結果の再検討をUKバイオバンクデータを使って行っている。ところが期待に反し、クローン性造血との相関を見ると、ほとんどリスク低減効果は見られなかった。ただ、UKバイオバンクでは血液細胞のゲノムを解析したグループが存在し、この結果を基にクローン増殖に繋がる遺伝子変異を調べると、6割のクローン性増殖を占めるDNAメチル化酵素 DNMT3a の変異を持つ人の場合はオッズ比で1.11と逆にリスクを高めているが、クローン性増殖の2割で見られる TET2変異を持つ場合は、オッズ比で0.53とリスクが半減することがわかった。
あとはマウスで DNMT3a欠損血液幹細胞と、TET2 欠損血液幹細胞をそれぞれ移植した ADモデルマウスで TET2変異を持つ血液細胞のAD進行を遅らせるメカニズムを探っている。残念ながら、放射線照射マウスへの幹細胞移植、さらには全身炎症を誘導するための LPS投与など、鎖を明確化するための様々な処理が行われているので、完全にヒトのモデルと言っていいかは難しい。
しかし、この条件下で TET2欠損血液はケモカインレベルなど強い炎症活性化状態を示し、脳への浸潤性が高い。しかも脳内で、活性化されたミクログリアと同じような遺伝子発現パターンを示し、その結果貪食活性が高まっており、おそらくアミロイドプラークを除去する活性が高い。一方で DNMT3a が欠損した白血球では LPSで炎症を誘導しても、このような性質は全く示さない。
以上が結果で、少し凝った条件を用いてはいるが、ヒトでの統計的調査を実験的に裏付けた事は間違いないと思う。TET2 は DNAメチル化を外す方向に働くため、これが欠損するとメチル化DNAが増加する。一方 DNMT3a は新たな DNAメチル化に関わる酵素なので、これが欠損すると DNAメチル化は低下する。今後この違いが具体的にどのような機能の違いになっているのかを調べることが必要になるだろう。一方、動脈硬化症などクローン性増殖が関わる様々な疾患も、変異により層別化し直して、ADと比べることも重要だと思う。確かに現象論にとどまる研究だが、将来の治療可能性も示唆するので、是非末梢からのマクロファージで AD は治療できるかという課題として、研究が進むことを願う。
2025年7月3日
腸は第二の脳と呼ばれるほど神経系が張り巡らされている。また、熊本大学時代研究していた腸管のペースメーカー細胞も存在し、速い動きとゆっくりした動きを調整している。このおかげで、食べた食事を上から下へ順番に消化管を通過させ、栄養を吸収したあと残りを排泄することができる。この腸管神経システム (ENS) は様々な種類の神経から形成されるネットワークだが、全ては神経管から発生する神経堤細胞由来で、消化管のほとんどは頸椎 (C4-C7) から発生する神経堤細胞が長い道のりを移動して腸管に分布しネットワークを形成する。肛門部の神経は仙骨神経堤由来で、移動距離は短い。ESN発生異常で最も有名なのはヒルシュプルング病だが、変異遺伝子に応じて到達距離が異なり、ほぼ全ての消化管に異常が見られるケースから下部消化管だけの運動異常まで、様々な現れ方をする。このように、組織を移動してネットワークを形成できる性質を利用して、ENSの前駆細胞を移植して遺伝的な消化管運動異常を治す試みが行われている。
今日紹介するカリフォルニア大学サンフランシスコ校からの論文は、ヒト多能性幹細胞から様々なENS神経細胞を誘導する方法を開発し、それを薬剤スクリーニングや細胞移植治療に使う可能性を示した研究で、6月25日に Nature にオンライン掲載された。タイトルは「Engrafted nitrergic neurons derived from hPSCs improve gut dysmotility in mice(ヒト多能性幹細胞由来 Nitrergic 神経をマウスに移植すると腸の運動異常を治療できる)」だ。
ヒト多能性幹細胞分化の研究者は数多くいるが、ENSへの分化をの研究者は極めて少なく、責任著者の Fattahi はずいぶん昔からENSに集中して分化誘導方法を開発してきた。
この研究では、これまで10年以上かけて確立してきた培養方法で、ヒトの腸管に見られる様々な種類の神経細胞が形成でき、それらはちゃんと刺激に応じて興奮できる神経細胞であることを確認している。中でも平滑筋をリラックスさせる重要な役割を演じているNOを合成分泌できる Nitrergic 神経細胞に注目し、5種類のNO分泌神経細胞が誘導・維持できることを明らかにしている。
その上で、形成されたENSオルガノイドでのNO産生を指標に小分子化合物をスクリーニングし、ENSシステムの運動を上昇させる化合物を特定している。セロトニン刺激系など様々な経路が確認されているが、それぞれについての詳しい解析は行われていない。
代わりにENSへの分化を促進できる小分子化合物PP121を特定し、この分子を使うことでENSへの分化を高められること、そしてこの機能がPDGFRの阻害を介していることが示されている。以上のように、分化及び成熟後のネットワークを使って腸の動きを正常化する薬剤の開発が可能であることが示された。
そしてこの研究のハイライト、試験管内でほぼ完全に分化したNO産生神経細胞を、NO合成が欠損したマウスの下部腸管にこの細胞を移植し経過を見ると、腸内でのNO産生が高まるとともに、腸管の通過時間が短くなることを示している。また移植された腸管を取り出し、腸の蠕動運動が回復していること、組織の緊張が軽減されていること、など完全に分化した細胞でもNO分泌神経を含んでおれば、腸の運動異常を治せることを示している。
ENS一筋という強い印象の研究だが、トランスレーションナル研究としては期待できる。
2025年7月2日
ヒストンのメチル化が染色体の構造決定に重要で、例えばN末端にある3番目のリジンがメチル化されたヒストン H3 (H3K4me) が結合している部位は染色体が開いており、逆に H3K27me が結合している場合は染色体が閉じていることがわかっている。多能性幹細胞の分化がエピジェネティック視点で研究されるようになった2006年、Bradley Bernstein が、細胞の自己再生と分化のバランスが必要な遺伝子調節領域には H3K4me と H3K27me の両方が結合しており、いわばオンとオフに二股がかかった臨戦態勢にある少し違った染色体構造をとっている可能性を示して、Bivalent 染色体と名付けた。この仕事は私も強い印象を持って読んだのを覚えている。
ただその後の研究で、臨戦態勢というのは言い過ぎで、DNAメチル化からの保護機能として重要であると考えられるようになってきていた。
今日紹介するハーバード大学からの論文は、H3K4 や H3K27 のメチル化をブロックする方法を用いて、造血細胞では Bivalent 染色体がメチル化保護ではなく、分化と自己再生のバランスをとる重要な機構であることを示した面白い研究で、6月17日 Cell にオンライン掲載された。タイトルは「Bivalent chromatin instructs lineage specification during hematopoiesis( Bivalent 染色体は造血過程で系統分化を指示する)」だ。
Bivalent 染色体を研究するためには、ヒストンのメチル化をブロックする実験系が必要で、ヒストンのメチル化に関わる遺伝子ノックアウトを用いて研究が行われてきたが、メチル化に関わる酵素が複数存在するため、なかなか明確な実験ができなかった。ところがヒトの突然変異の解析から H3 のリジンをメチオニンに変換することで(例えば H3K4 を H3M4 に変えた遺伝子を過剰発現させると)、H3K4 のメチル化が阻害されることがわかり、様々なリジン残基のメチル化を阻害することが可能になった。
この研究では H3M4 遺伝子をテトラサイクリン投与で誘導できるようにしたマウスを作成し、生後薬剤投与で H3K4me を特異的に除去すると、マウスは血液を作れなくなり20日を超すと完全に死亡することをまず観察している。
面白いのは、H3K4 のメチル化を阻害した場合、分化細胞が消失してしまうが、最も未熟な造血幹細胞から少し分化した幹細胞まで、いわゆる未分化細胞は正常に維持され、少し分化した前駆細胞の骨髄内での割合は拡大することがわかった。さらに、移植実験で長期に分化を抑制したあと、薬剤投与をやめると直ちに分化細胞が回復する事も確認している。即ち H3K4me は幹細胞の分化と自己再生を決める重要な役割を持っている。
H3K4me と H3K27me が結合している領域を調べると、H3K4 メチル化を阻害することで、特に Bivalent 染色体構造を持つプロモーター領域で、K4me と K27me のバランスが、K27me へと大きく傾いていることを明らかにしている。まさに二股をかけて臨戦態勢にあるというイメージだ。
これがバランスであることをさらに明確にするため、H3M4 マウスに H3M27 をさらに導入して、H3K4me とともに H3K27me も両方阻害する実験を行うと、バランスは元に戻り、分化血液細胞が現れ、マウスの生存期間が20日前後から150日程度に延びる。もちろん、Bivalent 染色体だけでなく、それぞれのメチル化ヒストンは単独で機能しているので、最終的にはマウスは死亡する。
いずれにせよ、K4 と K27 のバランスが重要な遺伝子調節が存在し、これが血液の自己再生と分化のバランスを決めていることがわかったので、どの領域がメチル化阻害の影響が出るのか解析し、Bivalent の領域でも血液分化に関わる遺伝子の多くがこのバランス型調節を受けていることを明らかにしている。
実際には、染色体構造を単一細胞レベルで調べる大変な実験が行われているのだが、結果は最初に Bradley たちがイメージした Bivalent 染色体のイメージに近いメカニズムが、少なくとも造血では明らかになったと言える。おそらくこれをきっかけに、他の幹細胞でも研究が進むだろう。また、白血病の中には大きなレベルのヒストン調節を行うポリコム遺伝子が点在しているケースもあることから、おそらくヒストンメチル化調節に強く依存する病態の研究も再検討されるように思う。
筆頭著者は八木さんという日本人だが、研究は Bernstein の論文に名を連ねていた Jaenisch のお弟子さん Hochdelinger さんのラボからで、研究が面々と続いているのも感じた。
2025年7月1日
タイトルを見てもらえばわかるように、今日はもっぱら医師向けの論文紹介になる。タイトルにあるシタラビン、ゲムシタビンは代謝拮抗剤と呼ばれる抗ガン剤で、両者とも核酸の一つシトシンに似た構造を持っており、複製時にシトシンの代わりにDNAに取り込まれ、そこで複製を止める役割をすると考えられている。では両者で作用機序や効き方が同じかというと、多くの点で異なっている。例えば白血病の場合、静止期にある幹細胞まで完全に殺せる可能性はシタラビンの方が優れていると考えられ、薬剤による白血病の完全寛解を目指す場合シタラビンが用いられる。これを裏返せば、増殖していない細胞を傷害することを意味しており、実際シタラビンは小脳失調症など脳に現れる特徴的副作用がある。
今日紹介する米国・国立衛生研究所からの論文は、シタラビンの神経毒性のメカニズムについて調べたプロの仕事で、代謝拮抗剤というカテゴリーにひとくくりにしないで、専門でない医師もしっかり副作用のメカニズムを知ることの重要性を示す研究で、6月25日 Nature にオンライン掲載された。タイトルは「Mechanism of cytarabine-induced neurotoxicity(シタラビンによる神経毒性のメカニズム)」だ。
責任著者の Andre Nussenzweig は、免疫系での遺伝子再構成の研究の第一人者 Michel Nussenzweig の弟さんだと思う。しかし、兄弟で DNA 修復がらみの研究を行っているのも面白い。
この研究以前に、シタラビンもゲムシタビンもDNAメチル化が TET により脱メチル化されるときに DNA 一本鎖に切断が入る (SSB) ことがわかっていた。しかし、二本鎖に切断が入る DSB はシタラビンだけで起こる。
そこで DNA 脱メチル化時にシタラビンが存在すると DSB が入るのか探索し、シタラビンによる DSS 誘導には TET 及び脱メチル化が必須で、TET や TDT による脱メチル化プロセスをシタラビンが阻害する結果であることをまず明らかにする。即ち、DSB は脱メチル化反応が起こっている場所に選択的に起こり、多くの遺伝子調節領域とオーバーラップしている。そして、シタラビンによる DSB は通常の non-homologous end-joining で修復され、このときに染色体転座も多発することをシタラビン処理した細胞について確認している。
問題は、同じように TET が働いている場所で SSB を誘導できるゲムシタビンが DSB 誘導しないメカニズムだが、試験管内の生化学実験などを組み合わせて、SSB が起こった片方の DNA 鎖を除去修復しながら、もう片方のメチル基を除去する過程で、ゲムシタビンを取り込んだ一本鎖では効率よく修復しやすいために、もう片方の脱メチル化過程が止まって DSB が起こりにくいが、シタラビンが取り込まれると修復が遅れて、最終的にもう片方の脱メチル化サイトも切断される DSB が起こりやすくなることを示している。
即ち、DNA 複製だけでなく、脱メチル化過程で起こる修復過程の障害が DNA の DBS をシタラビンがより効率に誘導することが明らかになった。
即ち、増殖ではなく脱メチル化過程が進んでいる細胞ではシタラビンによる毒性が強く出ることを示している。実際、神経細胞では常に刺激による転写が起こっており、分裂とは無関係に転写のプログラムが変化する。即ち、DNA 脱メチル化による染色体の変化は神経活動に必須と言える。このことから、分裂しない脳細胞でもシタラビンの副作用が出ることになる。さらに、小脳失調症の原因についても調べ、小脳プルキンエ細胞では他の神経細胞に比べて TET の発現が高く、脱メチル化に強く依存していることがわかった。その結果、シタラビンではプルキンエ細胞が強く傷害され、小脳失調症が発症することになる。
以上、「薬の構造が違うから当然でしょう」と適当に理解していたよく似た代謝拮抗剤の作用の違いを理解する良い機会を与えてくれた論文だ。シタラビン以外にも 5FU など脳症状を誘導する代謝拮抗剤が存在することから、それぞれのメカニズムを詳しく調べることで、抗ガン剤治療の質を高めることができると思う。
2025年6月30日
現在のトルコに位置するアナトリア地方はヨーロッパの農耕の始まったところで、ヨーロッパの民族形成には現ウクライナのヤムナ民族と並んで重要な位置を占めている。特に農耕がメソポタミアから渡ってきた新石器時代にアナトリアの民族や文化が形成されていることから、研究が進んでいる。この文化を象徴すると考えられているのがアンカラ博物館の女性像で、(https://www.worldhistory.org/image/13585/seated-woman-of-catalhoyuk/ :是非クリックしていてほしい)王座を思わせる椅子に妊婦らしい太った女性の座像で、女性が高い地位にあった文化であることが想像される。
今日紹介するアンカラ大学からの論文は、トルコ中央部に位置するチャタル・ホユクの発掘現場から出土した人骨のゲノム解析を様々な数理的手法を駆使して分析し、当時の家族や社会構造を明らかにした研究で、6月26日 Science に掲載された。タイトルは「Female lineages and changing kinship patterns in Neolithic Çatalhöyük(新石器時代チャタル・ホユクの女性系統と変遷する家族形態)」だ。
この論文とサイドバイサイドで、同じグループはメソポタミアからエーゲ海まで1万年にわたる遺跡のゲノム解析を行い、アナトリアのゲノムが極めて安定に維持されていること、即ち民族の移動ではなく、知識の移動によりアナトリア農耕文化が形成されたことを明らかにしている。
その上で、チャタル・ホユク地区のそれぞれの家から発掘されたゲノムの解析を行っている。この地区では家の敷地に生活を共にした人たちが何代にもわたって埋葬されるのが特徴で、このおかげで家を中心とする家族の遺伝的関係を明確にすることができる。
まず、もう一編の論文から明らかになっていたように、この地域のゲノムも安定しており、他の民族が移動してきた証拠はない。とはいえ、交流も盛んで、10%ぐらいは他の地域から来た人たちであることがわかる。この交流を通して農耕などの知識が導入されたと考えられる。また、農耕文化が根付く過程では、男系を中心とする家族関係が発展するが、チャタル・ホユクも同じで、埋葬されている男性は遺伝的関係が強いが、女性は低い。即ちこのブログでも何度も紹介したように、女性が家から外へ嫁ぐというしきたりが維持されていた。
ところが驚くことに、このような男系の選択性は農耕が定着した紀元前6500年前後になると低下し始め、6400年ぐらいではほとんど見られなくなる。即ち同じ場所に埋葬されている人たちの遺伝的つながりでの男系優位は消失していく。代わりに女系優位になるというわけでもなく、一つの家族に男性も女性も同じように参加する形態に変化している。
さらに驚くのは、同じ地域に埋葬されている人たちの遺伝的関係性が時代とともに低下し続けることで、同じ家には遺伝的つながりのない人たちが一緒に暮らし、おそらく外との交流も自由で、死後は同じ場所に埋葬されたことになる。アイソトープを使って生きていたときの食べ物を調べると、同じ家で暮らしていた人たちは、遺伝的つながりがなくても同じ釜の飯を食っていたことも証明される。日本でも、いくつかの家族が一つ屋根で共同生活をして農耕に従事するという活動があるが、誤解を恐れずに言うと、こんなイメージがチャタル・ホユクの家族に当たるように思う。もちろん、養子縁組をとおして血縁のない子供が家族として引き受けられてたのかもしれない。
ではアンカラ博物館を始めこの文化の特徴である女性優位は存在しなかったのか?実際には、女性を大事にする文化は強く、特に大人になる前に死亡した子供の埋葬のされ方を見ると、女性の場合は装飾品などより丁寧に埋葬されていることがわかる。即ち、出産という大事業を成し遂げる女性への強い尊敬を通して、血縁関係とは別の女性優位社会が形成されていたのかもしれない。
結果は以上で、このアナトリア社会が西に進んだとき、どう変遷したのか、面白い話が今後も出てきそうだ。
この研究グループを率いている Somel さんは学位をライプチヒのペーボさんの研究室で受けている。最近の古代ゲノム論文を見ると、ペーボさんの弟子たちが新しいアイデアをもって、新しい領域を開発し続けているのがわかる。ペーボさんは人を育てるという意味でもノーベル賞にふさわしい震源地になっている。
2025年6月29日
凡人から見るとノーベル賞を受賞するプレッシャーは大変なものだと推察する。すでにキャリアをほとんど終えている場合は別として、現役で受賞すると、さすがノーベル賞と言えるような研究を発表し続けることが要求される。しかし、そんなプレッシャーをものともしない「すごい」と思える受賞者が何人かいる。その一人が2014年グリッド細胞でノーベル賞を受賞したモザー夫妻で、専門外の私でも読んでいて面白い論文が多く、ここでも2-3回紹介した。
モザー夫妻はグリッド細胞のような内的な空間認識だけでなく、内的な時間の脳回路についても研究を進めており、2018年このブログで紹介した Nature 論文で、グリッド細胞が働いている内側嗅内皮質 (MEC) ではなく、外側嗅内皮質 (LEC) に様々な時間感覚で発火する神経細胞が存在し、これがエピソード記憶で働いていることを示していた(https://aasj.jp/news/watch/8870 )。
今日紹介する論文はこの続きで、脳内 LEC、MEC、そして海馬の CA1 にそれぞれ1000近い電極を設置されたラットで、LEC で刻まれる内的な時間と外界の経験との関わりを調べた面白い研究で、6月26日号 Science に掲載された。タイトルは「Event structure sculpts neural population dynamics in the lateral entorhinal cortex(出来事の構造が外側嗅内皮質の神経集団の動態を決める)」だ。
まずケージの中で自由に動いているラットについて、10分間 LEC で記録された電極の活動を多次元空間にプロットして、これを2次元圧縮してみると、時間とともに一方向へ移動しているのがわかる。一方、グリッド細胞が存在するMECではこ時間に合わせたこのような変動は全く検出できない。
面白いことに、同じパターンの移動が REM 睡眠時の LEC の活動からも見られることから、起きているときも、寝ているときも LEC では独自の時間が刻まれているのがわかる。この原因を一個一個の神経の活動を分析して調べると、グリッド細胞のように特定の座標にロックされるのではなく、個々の神経がフレキシブルに様々な時間を生み出すとともに、全体に合わせるようにできている。
このフレキシビリティーが重要で、時間の経過中ラットに様々な課題を行わせると、時間経過に従うものの、課題を始めるときには同期した神経細胞の活動が始まるため、時間の刻みが断裂して見えるが、実際には多くの細胞が変化を吸収し、課題が行われている間も同じように時間が刻まれる。このように時間の流れの中に、新しい経験を明確に境界を持った活動にまとめることで、経験の新しい時間を提供している。
これは一つの流れの中に、様々なイベントが経験されるときも同じで、それぞれのイベントは別々の塊にまとめられるが、全体の時間の中で明確に順番が決められる。以上の変化はすべて LEC で起こっており、MEC や CA1 では時間経過を神経活動から抽出することはできない。
以上が結果で、2018年の研究と比べると、現象論ではあるが、より明確に LEC の時間を定義できるようになっている。
個人的な話になるが、モザー夫妻の面白さは、カントのアプリオリの総合判断を脳科学的に説明している点にある。実際、彼のノーベル賞受賞理由の説明文にカント哲学が登場する。その意味で、アプリオリの総合判断の基本、内的な空間座標と時間座標の脳科学はもっと哲学者も学ぶべきだと思っている。
2025年6月28日
今週号のサイエンスを見て最も驚いたのは、同じ号にイカに関する論文がなんと2報も掲載されていたことだ。これまでイカについての論文をサイエンスで見たことがあるかと考えてみてもほとんど思い出せない。あらゆる科学分野を扱うサイエンスの編集方針を考えると、イカが取り上げられる確率は極めて低いのが当然だ。それが2報同時とは、ほぼ奇跡に遭遇したようなものなので紹介することにした。
最初の論文は北海道大学からの論文で、化石発掘の常識を破ることで、これまで不可能だったイカの古生物学が大きく発展させられることを示した素晴らしい研究だ。タイトルは「Origin and radiation of squids revealed by digital fossil-mining(デジタル化石発掘法によりイカの起原と放散が明らかになる)」だ。
これまで化石発掘というと、博物館で見るように岩石の中から実際の化石を掘り出すことが基本だった。ただ、化石として残るところの少ないイカのような軟体動物では、残った化石を削り出すのが難しいため、それが可能になった一部のイカだけが記載されてきた。
この化石部分を残すという発想を改め、化石は捨てて形を記録として正確に残すという発想の転換をした点がこの研究のハイライトだ。方法は、断層写真を撮るように、化石が含まれる岩石を少しづつ削って、出てきた表面の写真を撮影。これを繰り返すと写真から化石の3次元画像が再現できるという点だ。議論されていないが、化石部分のマテリアルも写真撮影後に採取できるので、化石が残らない以外は古生物学的には問題ない気がする。また将来、それぞれの層に存在している石の粉を残しておけば、化石由来の粉だけ選択して化石を再現することすらできるだろう。素晴らしい発想だと思う。
この発想のおかげで、250個40種類ものイカの嘴を再現することに成功し、形態学的系統学からイカが白亜紀後期に進化し急速に多様化し、さらに6600万年前白亜紀と第3紀の間に起こった大量絶滅期を境に、ベレムナイトのような大きなからを持った種類の絶滅とともに、現在にみられるイカの多様化が起こったことが示されている。実際、ほぼ全時期を通してアンモナイトより遙かに多くのイカが存在し、硬骨魚に匹敵する数が存在し続けていることを示している。
将来は嘴の部分の石粉からタンパク質を抽出することも可能になるかもしれない。
次のカリフォルニア大学アーバイン校からの論文はガラッと変わって、イカの持つ七変化とも言うべき美しい色彩の原理を探って、それを再現しようとした研究で、タイトルは「Gradient refractive indices enable squid structural color and inspire multispectral materials(段階的な反射がイカの構造的色彩を可能にしており、多重スペクトラムを有するマテリアルのヒントを与える)」だ。
北大の研究からわかるように、イカが多様化しつつ現在まで生きていることは、様々な新しいメカニズムを開発したということを意味しており、その一つが多彩な色彩を発することができるiridophore といえる。これによりイカは多様な色彩の模様を体表に表現するが、必要なときには全く光を反射することなく透明になれる。
この研究ではまずこの iridophore の多くが小さな板状の結晶が集まった構造を持っており、それぞれの結晶は場所に応じて異なる波長の光を反射する Braggs reflector を形成し、それがS字状に波打つことで、透明から異なる色彩を反射していることを明らかにしている。
この分析を基礎に、同じような特性を持った色素斑を人工的に作れるかチャレンジしている。機械的力で結晶の向きを変えることで、透明からいくつかの色の反射が可能な材質を特定し、さらにこれを化学的にオンオフ可能なように変化させて、イカの iridophore と同じようなパッチを形成することに成功している。
面白いのは、このパッチが異なる光を反射しているときは、遠赤外光も遮断することから、断熱材としても使えることで、必要に応じて熱を通したり、熱を遮ったりする面白いシートが可能になっている。
工学的なことはよくわからないのでこのぐらいにしておくが、イカの特徴をしっかり学ぶことができた今週号のサイエンスだった。
2025年6月27日
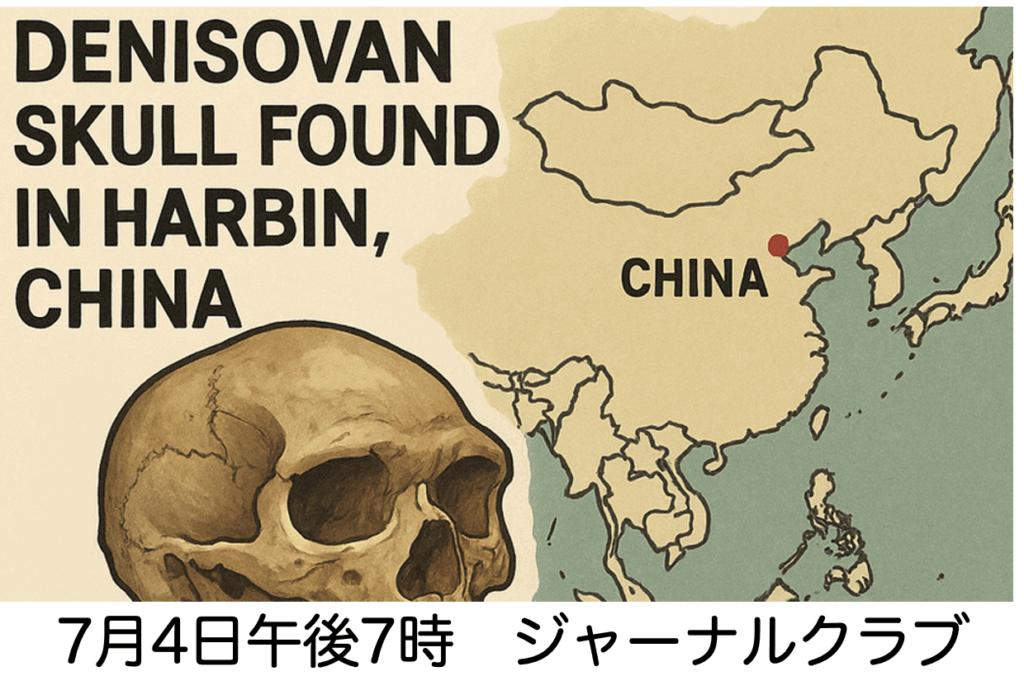
論文ウォッチでも紹介したように、中国黒竜江省ハルビンで発掘された中期更新世期のほぼ完全な頭蓋がDenisova人由来であることが証明されました。Paeboさんたちがホモサピエンス、ネアンデルタールに続く第三のホミニンとして報告してから15年が経って、ついにDenisova人の総合的な研究が始まるように感じます。Denisova人は特にアジアやポリネシアとの関わりが深く、最近台湾から発見された下顎についての論文には我が国の 蔦屋(筆頭著者)、太田、海部が名を連ねており、個人的にも期待しています。そこでPaeboさんの発見以来、Denisova人についてどのようなことがわかってきたのか15年を振り返るジャーナルクラブを7月4日金曜日夜7時からZoom開催します。例によって直接参加したい方は連絡いただければURLを送ります。内容は終わり次第Youtube配信しますので、そちらをご覧ください。
2025年6月27日
GLP-1 アゴニストや SGLT2 阻害剤の開発で、2型糖尿病 (T2D) の包括劇な管理が可能になり病気の進行を抑えることが可能になったが、T2D の背景にある組織のインシュリン抵抗性を改善する薬剤は進んでいない。武田薬品が開発した PPARγ 作動薬ピオグリタゾンはインシュリン感受性を改善すると期待されたが、副作用のために利用されていない。最近紹介したノボ・ノルディスクからの NK2R 作動薬はインシュリン分泌に影響せず食欲を落として脂肪を燃焼させてインシュリン感受性を上げるので少しは期待できるが、筋肉に対する作用は期待できないように思う。
これに対し今日紹介するカロリンスカ大学からの論文は、インシュリン感受性を高める王道と言える筋肉の β2 受容体を標的にして、cAMP 合成を上昇させずにグルコースの取り込みだけを高める薬剤を開発し、すでに第1相治験まで終えて発表された研究で、6月23日 Cell にオンライン掲載された。タイトルは「GRK-biased adrenergic agonists for the treatment of type 2 diabetes and obesity(GRKを選択的に活性化するアドレナリンアゴニストは2型糖尿病と肥満を治療できる)」だ。
β2 受容体のアゴニストは喘息の吸入剤として使われるが、ボディービルダーの間では筋肉増強剤として密かに使われている薬剤だ。このような使い方がされているのは、β2 受容体が Gタンパク質と結合してcAMP 合成を高めるクラッシック経路に加えて、β2 受容体をリン酸化する GRK を介する別の経路が存在し、特に骨格筋に介してはグルコースの取り込みを高めることが知られているからだ。ただ、両方が存在してしまうと、心拍数が上がり、心筋肥大が起こるといった重篤な副作用が起こる。
この研究では心臓への作用の中心である cAMP 合成活性が低く GRK 活性化の作用が強いことが知られている Bamethane を化学的に変えて、GRK 経路にできるだけ選択的な薬剤を設計する中で、目的に合ったいくつかの化合物を見出している。
この薬剤を含む様々な β2 受容体作動薬を Gタンパク質との共役、グルコース取り込み、そして arrestinとの結合による β2 受容体不活性化などを指標に評価し、新しい化合物が期待通り GRK 活性化とグルコース取り込みへの選択性が高いことを確認する。
次にこのような選択性が生まれる原因を構造学的に解析し(といっても AlphaFold を用いる理論的検討で、クライオ電顕のような方法は用いていない)、選択制を持つ化合物が特定のアミノ酸と水素結合を形成することで選択制が生まれることを示唆している。
下流のシグナルについても調べ、新しい化合物が mTORC2 という、インシュリン受容体下流の Akt 分子の活性化に関わる分子を通して GLUT4 トランスポーターを細胞膜にリクルートし、グルコース取り込みに関与することを明らかにしている。
あとは高脂肪食で肥満とインシュリン抵抗性を発生させたマウスに投与し、グルコーストレランスが著しく改善する一方、他の β2 受容体作動薬と異なり、長期に投与しても不整脈や新肥大を起こさないことを確認している。驚くのは、現在抗糖尿病として利用されている GLP-1 アゴニストと併用実験を行い、GLP-1 阻害薬により脂肪現象とともに起こる筋肉量の減少を完全に止めるどころか、上昇させることを示したことで、まさに完璧な糖尿病治療が可能になることを示している。
その上ですでに6ヶ月投与し続ける第1相試験も済ませており、最初心拍数の上昇を認めるが、これはすぐ正常化し、あとは安全に服用可能であることを述べているが、これについては臨床の雑誌に出てくるのだろう。
以上、糖尿病薬だけでなく、ボディービルダーにとっても安全な筋肉増強剤としても使われることは間違いない。また、GLP-1 アゴニストは筋肉減少を誘導するので高齢者には使えないが、この薬剤と併用するとこれが可能になるかもしれない。もちろんサルコペニアなどにも利用可能で、新しいブロックバスター誕生かもしれない。