2021年4月30日
どんな生物でも外界から障害を受ける危険に晒されている。障害によって生じた損傷を治すのが、再生過程で、爬虫類に至るまで失われた元の組織を再生する能力を有している。ところが、私たち哺乳動物となると、このような能力はほとんど失われている。代わりに、線維芽細胞中心の修復が行われるため、元どおりの組織が回復されることができなくなっている。
なぜ進化過程でこのような修復方法が選ばれたのか理解できていないが、現役時代に設立に当たった、京大の再生研や、神戸理研の発生再生科学総合研究センターの一つの目標は、私たちに正常な組織を再生させる能力を取り戻す方法の開発だった。ただ、線維芽細胞中心の修復が起こりやすい哺乳動物では、まずこの過程を抑えることが重要になる。
今日紹介するスタンフォード大学からの論文は、マウスモデルではあるがいわゆる瘢痕化として知られる線維芽細胞中心の修復機構を理解し、それをコントロールする目的に一歩迫った重要な研究で、4月23日号のScienceに掲載された。タイトルは「Preventing Engrailed-1 activation in fibroblasts yields wound regeneration without scarring (線維芽細胞のEngrail-1活性化を抑えることで瘢痕化のない皮膚再生が可能になる)」だ。
このグループは、皮膚損傷により転写因子Engrail1(Eng)が線維芽細胞で発現し、コラーゲンなどのマトリックスを分泌する細胞へと再プログラムされることで、瘢痕が形成されることを示してきた。この研究では、皮膚でEngが活性化するとGFPタンパク質が発現するようにしたマウスを用いて、
損傷部位でEngが活性化した線維芽細胞が特異的に増殖し、瘢痕を形成する。これらの再プログラム過程のほとんどは、Engにより誘導される。 Engが活性化される線維芽細胞は、皮膚深部のreticular層に存在しており、機械的な刺激により活性化される。活性化されると、胎児で見られる線維芽細胞と同じ性質を示す。 機械刺激は、Yapシグナル経路を介してEngを活性化する。 Yapシグナル阻害剤verteporfinを損傷部位に注射すると、Engの活性化が抑えられ、瘢痕化が起こらない。この結果、修復された皮膚には、正常と同じ毛根の形成が行われ、ほぼ元どおりの皮膚が再生する。 同じことは、線維芽細胞でYapをノックアウトしたマウスでも見られる。また、Engを活性化した線維芽細胞をジフテリアトキシンで除去できるノックインマウスでも同じように瘢痕化は起こらず、元どおりの皮膚が回復する。 以上が結果で、マウスではあるが瘢痕化に関わる主役の線維芽細胞を特定し、この細胞の刺激を抑制することで、線維芽細胞中心から、再生中心の損傷治癒が可能であることを示しており、人間でどうかは今後の問題だが、瘢痕化のないしかも毛根の再生が見られる損傷治癒の可能性を示した画期的な結果だと思う。
2021年4月29日
小胞体(ER)で合成されたタンパク質は極めて巧妙な輸送システムを使ってGolgi体へと移送される。この過程は、遺伝子ノックアウトなどの遺伝学的技術、細胞内の分子局在を高分解能で観察する顕微鏡技術の進展により、1編の総説ぐらいでは足りないほど詳しく調べられている。しかし、最後のところでまだ霧に閉ざされた部分が存在していた。その中の一つがER/Golgi輸送過程で、それに関わる分子はわかっていても、どうそれらが組織化され、合成されたタンパク質を輸送しているのか「絵を描くこと」は難しかった。
今日紹介するハワードヒューズ財団自身が持つ研究施設Janelia Research Campusからの論文は、この霧に閉ざされた過程を新しい顕微鏡技術を用いて眼に見えるようにした研究で、新しい技術のパワーに目を見張る。タイトルは「ER-to-Golgi protein delivery through an interwoven, tubular network extending from ER (ERからゴルジへのタンパク質移送はERから突き出した管状構造が編み合わさったネットワークを通して行われる)」。
この研究で用いられたのは、同じ細胞を一種のクライオ電子顕微鏡と超高解像度顕微鏡の両方を用いて観察する技術で、細胞を蛍光染色した後、超低温でタンパク質が壊されないようにして電子顕微鏡で観察し、そのままレジンで包埋して超高解像度顕微鏡で細胞の形態や蛍光標識した分子の局在を可視化、両方を重ねて、さらに3次元に再構築する技術だ。これにより、細胞全体という大きな対象を電子顕微鏡レベルの解像度で、観察が可能になる。読めば読むほど、我が国の光学メーカーからこのような技術が生まれなかったことが残念に思えるし、我が国の科学技術力の低下を思い知らされる。
愚痴はこのぐらいにするが、見えたものは素晴らしいが、美しい景色をその通り描写するのが難しいのと同じで、結局興味がある人は是非論文を見てほしい。
もちろん、この技術では生きたままタイムラプスで観察するのは不可能だ。代わりに、タンパク質がある場所に一度止めておいて、そこから移動を再スタートさせたあとの分単位の経過を見ることができるRUSH技術を用いて、ERからGolgiに輸送されるタンパク質の動態を分刻みで追跡している。また、ERからGolgi輸送に関わる様々なシグナルを阻害して、輸送を止める方法も利用している。すなわち、これまでの細胞学的知識を総動員し、ERからゴルジまでの過程を目で見ることに集中したのがこの研究だ。幸い見てきた結果がまとめられた図はCellのサイトで公開されているのでこれを参考にしてもらえればよい (https://www.cell.com/cell/fulltext/S0092-8674(21)00366-4?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS0092867421003664%3Fshowall%3Dtrue#undfig1 )。
実際の論文は、細胞科学の勝利とも言うべき感動に満ちたものだが、全部割愛して、結果だけを以下にまとめておく。
ERからゴルジに至るためには、タンパク質を積んだカーゴはERから離れる必要があるが、これはERからERESと呼んでいる管状の構造が伸びる新しい輸送基地へタンパク質を濃縮することで始まる。 このERESが伸びているERとの結合部位にはCOPIIと呼ばれる輸送の鍵を握る分子が集まって、おそらくGタンパク質シグナルと協調してERES構造の形成に関わっている。 タンパク質を積んだカーゴはここからERESに移動するが、これにはおそらくERESにコレステロールが濃縮することで、膜のダイナミックスを変化させて方向性が与えられる。 ERESに輸送されたタンパク質は、次にそこからCOPIの作用により形成されGolgiへと伸びるさらに細長い管を通ってGolgiに運ばれる。この時、このような細長い構造を支えるのが微小管で、これにより安定にゴルジまでの配管が可能になる。 結果は以上で、最後の細長い管状の構造などは、見ることでしかわからないことがあることをはっきりと認識させてくれる。今後、この研究で見た結果をもとに、さらにメカニズムの研究が進むだろう。
このテクノロジーについては、昨年Scienceに発表されていたようで、早速ダウンロードして読んでみたが、感動の論文で、見落としたのを恥いるが、コロナ論文が多すぎてミスってしまったと反省している。しかし、今度はこのテクノロジーを用いたコロナウイルス増殖過程解析をぜひ見てみたいと思う。コロナウイルスは、細胞内小器官の膜を支配する方法を備えている。おそらくそれをみてみることで、新しい創薬も可能になるのではないだろうか。おそらく近々そんな論文が発表されることは間違い無いと思う。
2021年4月28日
腸上皮を覆う粘液は、便通を助けるだけでなく、バクテリアに対するバリアーとして働き、腸を炎症から守っている。実際、慶應の本田さん達の総説では、特殊なsegmented filamentous bacteriumと分類される細菌や、上皮と接着できるようなバクテリアを除くと、粘膜は細菌の侵入を跳ね返していることが示されている(Nature 535, 75, 2016)。
今日紹介するスウェーデン ヨーテボリ大学からの論文は、大腸ではこの粘液が決して均一な単純な分泌物ではなく、2種類の異なるゴブレット細胞から分泌される粘液が組織化されていることを示した面白い研究で、腸の粘液について理解するという意味でも重要な論文だと思う。タイトルは「An intercrypt subpopulation of goblet cells is essential for colonic mucus barrier function(
クリプト間に存在するゴブレット細胞の亜集団は大腸の粘液バリアー機能に必須)」で、4月16日号のScienceに掲載された。
ヒトとマウスを行き来しながら実験を重ねていった力作で、この論文を読んで初めて、ただベタっとした均質な粘液層というイメージが、細胞内マトリックスと同じように違う成分が複雑に絡み合った構造のイメージへと変わった。
研究の目的は最初から腸内粘液層の生成過程を調べることで、そのためまず粘液を分泌するゴブレット細胞を分離し、ゴブレット細胞特異的遺伝子をリストした上で、分離したゴブレット細胞をsingle cell RNAseqで解析、大腸だけで増殖性の前駆細胞から2種類の異なる系列のゴブレット細胞が形成されることを示している。私自身ゴブレット細胞と言うと一種類の細胞をイメージするので、共通の前駆細胞から2系統が分化すると言うのは新鮮で、single cell RNAseqのパワーをまたまた再認識した。
こうして明確になった2種類のゴブレット細胞の局在を調べると、クリプト内に存在する通常のゴブレット細胞と(cGC)、より上皮に近い遺伝子発現を示すクリプト間の上皮内に存在するゴブレット細胞(icGC)。すなわち、腸管腔に直接出ているのがicGCで、組織内に陥没しているクリプト内に存在するのがcGCになる。
それぞれの細胞の遺伝子発現の違いから、粘液合成に重要な糖添加過程に関わる遺伝子を調べると、両者を区別する経路が存在し、その結果糖に結合するレクチンのうち、WGAはcGCに、UEA1はicGCに見られることが明らかになった。すなわち、レクチンの結合の違いで簡単に両者を区別できる。また、粘液自体も同じレクチンの結合の違いで区別できることがわかった。
このおかげで、クリプト内で合成され管腔へと出てくる粘液と、icGCで作られた粘液が、上皮直上では別々の場所に局在し、それが内腔側へ成長する過程で混じり合っていくことを見事に示している。
機能的には、icGC由来の粘液は、バクテリアなど1ミクロン単位の分子をブロックするが、クリプト内の粘液はさらに小さな分子もブロックして幹細胞を守っていることもわかる。また、完全に特異的ではないが、遺伝子操作でicGCの数が年齢とともに急速に低下するマウスを作成し、クリプト内のバリアー機能は守られていても、歳とともに管腔の粘膜層が薄くなり、バクテリアが上皮近くに迫っており、腸炎の危険性も高まっていることを示している。
最後に、人間の潰瘍性大腸炎の患者さんの大腸のバイオプシーを行い、活動期だけでなく、寛解期でもクリプト間に存在するGCの数が低下していることを示している。
以上、腸内の粘液層についてしっかり勉強できたと言う満足の読後感のある論文だった。
2021年4月27日
ALSは、運動神経が進行的に変性する神経特異的疾患として考えられてきた。ただ、遺伝子変異が原因として特定できるALS(人間の場合5−10%がこれにあたる)の研究から、同じ変異遺伝子を発現する運動神経以外の細胞、ミクログリア、オリゴデンドロサイト、そして血管細胞なども、病気の進行に関わるのではと考えられるようになってきた。
きょう紹介するスウェーデン王立研究所からの論文は、運動神経とは別に血管に接して存在するperivascular cellと呼ばれる細胞がALSで異常に活性化されることがALSの進行に初期段階から関わっていることを示した重要な研究で、4月15日号Nature Medicineにオンライン掲載された。タイトルは「Altered perivascular fibroblast activity precedes ALS disease onset(変化したperivascular fibroblast活性がASL発症に先行する)」だ。
この研究では、特発性のALS患者さんの解剖によって得られた脳や脊髄組織、およびSOD変異などマウスALSモデルの様々な時期の脳脊髄組織から細胞を取り出し、single cell RNA sequencing (scRNAseq)を行い、正常個体の組織と比べることで、ALSで遺伝子発現が変化する細胞を特定している。
その結果、予想通り神経興奮に関わる遺伝子発現が低下する一方、ミクログリアやアストロサイトなどでは炎症関連遺伝子の発現が上昇する。これらはすでに知られていたことだが、この研究ではさらに血管に接して存在する一種の多能性幹細胞として知られるperivascular fibroblast(PF)の細胞外マトリックスの発現が上昇していることを発見する。しかも、SOD遺伝子変異を用いるマウスALSモデルでは、病気の発症より先にこの変化がPFに見られる。
これらの遺伝子発現を手掛かりに脳の末梢血管を調べると、アストロサイトと周囲細胞に挟まれてPFが存在しており、血管周囲に独自の基底膜を形成していることがわかった。
通常この基底膜は血管自体の基底膜と合体しているが、ALSではマトリックス分泌量が増え、しかも血管の基底膜とは完全に分離した基底膜を形成し、その間に特にコラーゲン6Aとオステオポンチンからなるマトリックスが蓄積したスペースができる。また、マウスモデルで見ると、病気の発症前にこの変化を見ることができる。以上のことから、ALSでは発症前からPVが活性化してマトリックスの分泌が高まり、微小血管の構造異常がおこっていることになる。
最後に、PV活性化により分泌されるコラーゲン6Aやオステオポンチンが何らかの診断マーカーとして利用できるか調べる目的で、ALSコホート研究に集まったデータを調べ、これまで早期診断に用いられてきた字が書けなくなる症状(失書)や髄液中のニューロフィラメントと比べても、血中オステオポンチン量の上昇は、生存期間と強く相関していることを発見している。
結果は以上で、早期から神経細胞以外に見られる病変を特定できたこと、またこの現象を反映するオステオポンチンというバイオマーカーを発見できたことは極めて重要で、今後多くの患者さんで検証されていくだろう。この研究だけではPFの活性化が、結果か原因かなどは分からないが、病気の経過に大きく影響していることは確かそうで、PF特異的に介入する方法の開発も期待できると思う。
2021年4月26日
アルツハイマー病(AD)発症にTauタンパク質が関わっていることを疑う人はもういないが、私も含めて多くの人は、Tauのリン酸化が神経細胞毒性につながると理解して来た。ただ、他にもTauの翻訳後修飾がいろいろあることがわかっており、最近はアセチル化されたTauも神経変性に関わるのではと考えられている。
今日紹介するClevelandにあるCase-Western Reserve大学からの論文は、脳損傷によりTauがアセチル化されることもTauの神経毒性の原因になり、AD発症に寄与することを示した論文で、このプロセスを標的にすることでさまざまな治療可能性が生まれる点で重要な論文だ。タイトルは「Reducing acetylated tau is neuroprotective in brain injury (脳障害時のtauアセチル化を抑えることは神経保護につながる)」で、4月26日号のCellに掲載された。
この研究は初めから脳損傷によるTauのアセチル化がADの危険因子になっているという仮説に立って研究を進めている。まず、マウスに激しい物理的振動を加えて脳震盪を起こして損傷を誘導するモデルを用い、損傷の度合いに応じて神経特異的にTauがアセチル化される事を確認している。
以上が結果で、発想はシンプルで、調べられた分子メカニズムも単純だが、介入のための様々な薬剤が提案できたことは重要だと思う。今後どこまで一般的なADにも適用できるのか検討が必要だが、すくなくとも脳損傷後にはTauのアセチル化を予防するため、非ステロイド系抗炎症剤を服用させることは考慮してもいいのではないだろうか。
2021年4月25日
Nicotinamide adenine dinucleotide (NAD)は、ほぼあらゆる生物に存在する補酵素で、エネルギー受け渡しの一種の通貨として生命の基礎となっている。ただ、NADはシグナル分子合成、タンパク質のADPリボシル化、ヒストンなどのタンパク質脱アセチル化を通して、DNA修復や転写の調節に必須であることがわかり、ミトコンドリアにあるNADプールの現象が老化に関与することが示唆されている。
実際ミトコンドリアのNADプールは老化とともに低下し、この低下をその前駆体NMNなどを投与することで筋肉機能の低下が改善するとする動物実験が発表されたため、NMNは科学性が証明された抗老化サプリメントとして広く使われている。ただNADレベルを高めることが、人間に効果があるかについては、有効、無効の結果が両方発表されていると言っていい。
今日紹介するワシントン大学からの論文は、筋肉のインシュリン感受性に関してはNMN内服が確かに効果があることを示す偽薬を用いた無作為化臨床治験で4月22日Scienceにオンライン掲載された。タイトルは「Nicotinamide mononucleotide increases muscle insulin sensitivity in prediabetic women (Nicotinamide mononucleotideは糖尿病予備軍の女性のインシュリン感受性を上昇させる)」だ。
この研究ではNMN投与の効果が現れやすい対象として、閉経後の肥満の女性に狙いをあてて、半分を偽薬、半分をNMN250mg投与群を無作為的に選び、NMN服用10週間後の全身の状態、および筋肉バイオプシーで得られた筋肉細胞でのインシュリンに対する反応を調べている。
まずNMN服用で確かにNADプールが上昇することを、血清中代謝物の量とともに、白血球細胞内、および筋肉細胞内の代謝物の量から確認している。
面白いことに、全身状態としては体重や脂肪量、あるいは血糖など、ほとんど変化がない。これに対し、バイオプシーした筋肉細胞を用いてインシュリンに対する反応をグルコース処理能で調べると上昇している。また、インシュリンの下流のシグナル分子AKTおよびmTORのリン酸化が高まっていることを明らかにしている。しかし、ADPプールであるミトコンドリア機能については変化が見られていない。
このインシュリンに対する筋肉細胞の反応性の上昇は、インシュリンにより誘導される遺伝子の数がNMNで大きく増加し、その中には筋肉の維持に関わるPDGFR βなどの遺伝子が含まれており、おそらくエピジェネティックな再プログラムが起こっていることを示している。NADがサーチュインの活性化に関わることを暗に示す結果と言える。
以上、筋肉のインシュリン感受性だけが変化するという印象を受けてしまったが、ともかくNMN服用が効果があることを示す研究だと思う。栄養食品やサプリの華々しい宣伝を見ると、本当にこれでいいのかといつも思ってしまうが、このような地道な治験が今後も行われていくことを期待する意味で、重要な研究だと思う。
2021年4月24日
何度も相分離についての研究を紹介してきたが、基本的には難解な話として大学院生以上に向けて書いてきた。今日も同じように相分離による細胞内シグナル活性化の話だが、最近専門向けの論文紹介が続いたので、今日は相分離に関わるテーマをなるべくわかりやすく説明したいと考えている。わかりやすく説明するために、かなり詳細は飛ばしているので、詳しく知りたい専門知識のある方々はぜひ元の文献を読んでいただきたい。
紹介したいのはカリフォルニア大学サンフランシスコ校から発表された研究で、一部の発ガン遺伝子の活性化メカニズムを探る中で、相分離により発ガンのシグナル発生拠点が形成されることを示した、ガン治療を考える上でも重要な発見だ。タイトルは「Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules(RASシグナルを、細胞膜の関与なしに形成される細胞質のタンパク質粒子が媒介する)」だ。
一般の方はタイトルを見ても何を言っているのかわからないと思うので、気にせず読み続けてほしい。
さて、RAS分子は発ガンの鍵になる分子で、多くのガンに関与している。一つの関与の仕方は、RAS自体に突然変異が入り、本来なら外界のシグナルでコントロールされるところが、RAS自体が暴走して発ガンのシグナルが入る場合で、例えば膵臓ガンなどは半分以上がこのタイプになっている。
もう一つは、RASの活性を調節している膜型チロシンキナーゼ受容体が、周りのコントロールを受け付けずに暴走してしまうケースで、例えばEGF受容体の変異により発生する肺ガンなどはその例だ。
この研究では、RASを外界のシグナルに応じて調節しているチロシンキナーゼ受容体遺伝子が、何らかのきっかけで他の遺伝子とゲノム上で結合してしまって、両者が合体したキメラ分子を形成することで、チロシンキナーゼ受容体が暴走するケースについて調べている。実際には、肺ガンを発生させる、微小管結合タンパク質EML4とチロシンキナーゼ受容体ALKが合体したタンパク質が、なぜRASシグナルを活性化できるのかを調べている。
こうしてできたEML4-ALKキメラタンパク質は、膜上で発現する部位が欠損して細胞質内に存在することがわかっている。これまでの考えは、合体した側のEML4部位でいくつかのキメラ蛋白がまとめられると、ALKが暴走を始め、RASを活性化するというものだった。
これに対し、この研究では、ただいくつかのキメラ分子が結合し合うというような単純なものではなく、相分離という現象が起こって、多くのEML4-ALKが濃縮された塊を作ることで、その塊の中にRASを活性化するための様々な分子を集合させ、発ガンのシグナルを発生する拠点になることを証明している。
ここでいう相分離とは、白紙の液晶板に、急に様々な字が現れる現象を考えて貰えばいい。この場合は電気シグナルで相分離を起こすことで、目に見える凝集を起こしている。これと同じことが、細胞内の様々なところで起こることで、関連する分子だけがうまく集まれるようになっていることが急速に明らかになってきている。
EML4-ALKの場合、濃度の濃い凝集は、分子同士が絡まり合うことで形成され、その中にRASやRASとALKをつなぐ分子などが凝集する。実際、これらの分子の細胞内の局在を調べると、膜とは別の場所で粒子状の目に見える点として集まっている、すなわち相分離していることがわかる。
この研究ではどのような条件でEML4-ALKが相分離に至るかを詳しく調べているが、全て割愛する。大事なことは、人工的に相分離を作りやすいタグ(HOtag)を結合させる系で、相分離を人工的に起こしてやると、ALKシグナルは暴走して、RASを活性化することがわかっている。
また、様々なタイプのEML4-ALKキメラガン遺伝子を実際のガンから取り出し調べると、ほとんどの場合相分離を起こすことも確認している。そして、このような凝集体を処理する細胞システムのオートファジーを抑制すると、凝集体が処理されずに残って、シグナルが高まることが示されている。すなわちオートファジーを高めて凝集体を処理するとか、あるいは凝集そのものを抑制する方法も、将来のガン治療につながることを示している。
結果は以上で、他にも同じようなキメラガン遺伝子でも同じことが起こっていることも示しているが、割愛する。
猫も杓子も相分離という皮肉な見方もあるが、この観点で新しいガン治療法が開発されることを期待して、一般の方にも伝えたいと思った。理解していただければ本望だ。
2021年4月23日
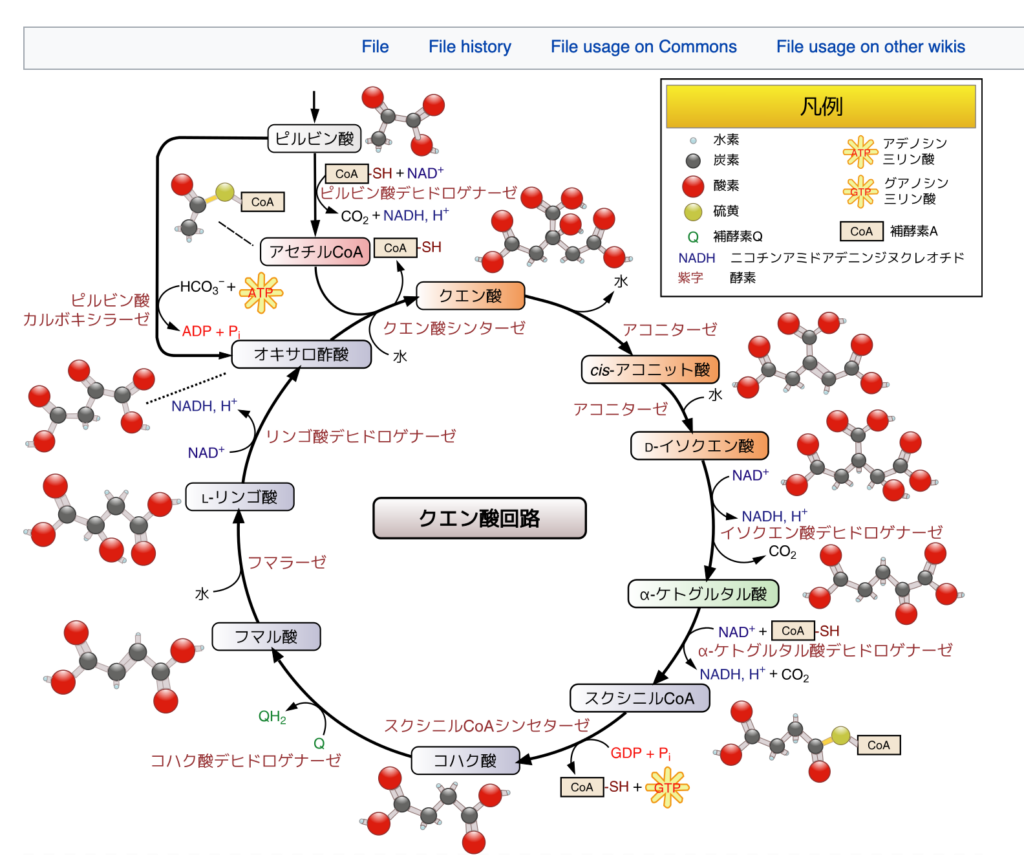
まずWikipedia Creative Commons 掲載のTCAサイクルの過程を見てみよう。
Wikipedia :https://commons.wikimedia.org/wiki/File:Citric_acid_cycle_with_aconitate_2_ja.svg より転載。
おそらく高校、大学で習ったように、細菌から人間まで、物質からエネルギーを合成するための最も基本的回路だ。ここでの矢印を見てもらうと、糖や脂質の参加により生成されたアセチルCoAがオキザロ酢酸からクエン酸への転換経路に組み込まれ、ぐるっと回ってくるうちにNADHなどが生成される。
これが無生物から生物の誕生過程(Abiogenesis)の早くから物質を作る基本過程になっていたのではと考える証拠がいくつか存在する。その一つは、この回路の中間生成物は、酵素が存在しない条件でも鉱物の触媒作用により合成されサイクルを形成できることを示す論文が報告されている。
Abiogenesisに興味がある私にとっては驚くべき論文だったので、今も講義で利用している。
もう一つの証拠は、光合成なしに有機物を自分で合成できるAutotorophでは、TCAサイクルの方向性を決める不可逆過程を異なる酵素過程で置き換えて、クエン酸からアセチルCoAを介してピルビン酸を合成する逆の過程を動かし、無機物の炭酸ガスの炭素を同化することができることがわかっている。
実際、鉱物触媒で形成されるTCAサイクルでも矢印はピルビン酸合成の方向に向いている。
今日紹介する論文は、Autotorophの中には、単純にTCAサイクル逆回しではなく、どちらにでも回転させられる古細菌が存在していることを示した論文で4月21日Natureにオンライン掲載された。タイトルは「High CO 2 levels drive the TCA cycle backwards towards autotrophy (高いCO2濃度がTCAサイクルを逆回しして自己栄養を可能にする)」だ。
この研究では、データベースの解析とTCAサイクルに関わる酵素の検討から、逆回しのシステムではなく、一般的なTCAサイクルにクエン酸合成酵素を組み入れることで、逆回しが可能であることを明らかにしている。実験としては、炭酸ガスの炭素をアイソトープ標識し、それがTCAサイクル由来のアミノ酸のどの部位に組み込まれるかを調べ、分解の酸化サイクル、合成の参加サイクルのどちらも稼働することを示している。
その上で、逆回しするための自由エネルギーの壁を越える方法に、このような酵素がCO2そのものを使っていることを実験的に明らかにしている。すなわちCO2が高い環境では、合成型のTCA サイクル逆回りが起こり、物質が合成される。その結果、外部から栄養がなくても、生存できることを示している。
実験的にはこれだけだが、生命誕生のあとのCO2の高い地球環境を考えると、還元酸化両方のサイクルがCO2濃度に応じてバランスを取るという話は、確かに魅力的だ。そして、このような生物が現在もなお、サーマルベントのような条件で生きていることに深い感動を覚えてしまう。
2021年4月22日
一度は行ってみたいと思うが、ニューギニアからソロモン諸島、そしてバヌアツまで、南太平洋の島々は独自の民族が形成されている。以前紹介したように(https://aasj.jp/news/watch/10041 )、この民族にはユーラシア人とは異なるタイプのデニソーワ人ゲノムの流入が見られること、しかもこの遺伝子流入が2万年前後と、ユーラシアではデニソーワ人、ネアンデルタール人が滅んだ後に起こっていることから、デニソーワ人の末裔がこれらの島々にかなり最近まで生きていた可能性が示され、俄然研究が進み始めた。
今日紹介するパストゥール研究所からの論文は、台湾の現地民族からインドネシアやニューギニア人、そしてバヌアツの人たち、317人の全ゲノムを平均36カバレージの精度で解読し、今生きている民族のゲノムから、南太平洋での民族形成の歴史を解き明かそうとした研究で4月15日Natureにオンライン出版された。タイトルは「Genomic insights into population history and biological adaptation in Oceania(オセアニアでの民族形成と生物学的適応についてゲノムから考える)」だ。
要するに多くの個体のゲノムを出来る限り詳しく調べることで明らかになった3500万箇所にものぼる多型の分布を元に、各人のゲノム形成史を、今回調べた個体及び、これまで知られている古代人ゲノムも含めたゲノムと比較して明らかにすることで、今回の場合南太平洋各島の民族の歴史的関係を明らかにしている。技術的には特に新しい話があるわけではなく、また古代人の骨が新たに発見されたというわけでもないので、解析から見えてきたいくつかの面白いシナリオをまとめておく。
南太平洋の民族は、a)台湾現地人など東南アジア人、b)パプアニューギニア高地人、c)ビスマルク諸島、ソロモン諸島、バヌアツの住人、そしてd)ポリネシア人由来のグループ、の交雑により形成された。 パプアニューギニア高地人とビスマルク、ソロモン、バヌアツ諸島の民族は、なんとホモサピエンスが南太平洋に展開する前後4万年前にすでに分かれていた。 またソロモン諸島とビスマルク諸島の民族間も、南太平洋展開直後の2万年前に分かれ、原則的に孤立して生きてきた。 なんと約3000年前に、台湾現地人はソロモン諸島、バヌアツへ渡ってきて、交雑した可能性がある。一方で、台湾現地人がポリネシア民族を形成して、ポリネシア人を通して南太平洋諸国に台湾現地人のゲノムが入った可能性もある。 ネアンデルタール人ゲノムについては、ほぼ共通のオリジンを持ってるが、デニソーワ人ゲノムの流入を調べると、それぞれの地域で異なるパターンが見られ、それぞれの民族は、当時南太平洋に展開していたデニソーワ人と独自に交雑を繰り返した。 デニソーワ人由来で、自然免疫に関わる遺伝子や代謝に関わる遺伝子のいくつかが、環境により強く選択を受けたことがわかる。なかでも、HDL代謝に関わる遺伝子は、現在西欧化した食事の影響が、それぞれの島で大きく異なっていることを説明する可能性がある。 以上で、骨が出土するほどの興奮は覚えないが、このような結果を積み重ねて、古代デニソーワ人ゲノムの発掘を静かに待つのも面白い。
2021年4月21日
生命科学へのCRISPR/CAS最大の貢献はなんだろうと考えてみると、希望する場所で遺伝子を切断するという機能より、ガイドRNA により希望するゲノムサイトにCasタンパク質をリクルートできることだろう。Casに蛍光物質を結合させると、生きた細胞核内で見たい遺伝子の位置を調べることができるし、希望する遺伝子の転写のon/offが可能になる。他にもデアミナーゼを用いた一塩基編集など、ゲノムを正に編集するための技術が続々開発されている。
中でも期待しているのが、エピジェネティックな制御を自由に行う方法の開発で、事実、様々な論文がすでに発表されてきた。DNAメチル化を標的にする場合、素人から見るとCasにDNMT3をキメラにすればそれでいいと思ってしまうし、そのような論文も発表されてはいるが、使い物になる技術になるためには様々な改良が必要だったようで、今日紹介するスタンフォード大学とマサチューセッツ工科大学からの共同論文は、使いやすいDNAメチル化コントロール法開発には、かなり時間がかかったことを示している。論文のタイトルは「Genome-wide programmable transcriptional memory by CRISPR-based epigenome editing(全ゲノムレベルで転写の記憶をプログラムできるCRISPRを基盤とするエピゲノム編集)」だ。
エピゲノムをプログラムするということは、一過性の遺伝子導入によりエピジェネティックな変化を誘導した後、編集に用いた遺伝子が消失しても、編集結果が維持される必要がある。この基準で見ると、例えばCasにDNMT3aを結合しただけのコンストラクトでは、メチル化で抑制された遺伝子も、時間が経つとすぐに発現することがわかっていた。この問題を解決するため、Dnmt3AとCas9に加えて様々な分子を組み合わせる研究が進んでいたが、この研究ではDnmt3a,Dnmt3L Cas9.ZNF10 KRABドメイン(KRABの効果はすでに報告されてきた)の順番で結合させたベクターを用いることで、ガイドとともに一過性の遺伝子導入を行うだけで、50日以上遺伝子発現を抑制する、理想的エピジェネティック編集を可能にしている。
この方法で誘導されるDNAメチル化部位も、極めてガイド特異的で、これにより全ゲノムのどの部位も自由にメチル基を導入できることを示している。
これとセットにして、希望する場所のメチル化されたDNAからメチル基を取り除くTET分子とCas9をXTENと呼ばれる長いポリペプチド・スキャフォールドで繋いだコンストラクトを完成させ、これによりゲノムのどの部位のメチル化も外せることを明らかにしている。例えばこの技術を使えば、山中因子をわざわざ導入しなくとも、その遺伝子のメチル化を同時に外すという工夫も可能になる。
今後の標準となる技術開発としては、これで十分で、ガイドプールを用いて、細胞の増殖に必要な遺伝子をスクリーニングしたり、あるいは様々な遺伝子のエピジェネティックな状態を自由に編集できるなど、応用分野の可能性を示しているが、私自身は基礎生命科学へのポテンシャルに最も感心した。
まず、CpGアイランドが全くプロモーター部位に存在しない遺伝子でも、転写開始点の近くにメチル化されることで転写が抑制される部位を持っていることを示している。このことは、メチル化による制御がCpGアイランドに現局していると考えるのは間違いで、今回発見されたCpGアイランド以外のメチル化による遺伝子発現抑制の研究から、新たな可能性が生まれるのではと期待する。
それとも関係するが、実際どの部分がメチル化されると遺伝子発現が抑制されるのかを、プロモーター前後をカバーするガイドRNAを用いて、転写開始点前後の領域に部分的にメチル化を導入する実験で調べることができる。面白いことに、転写開始点前後かなり広い領域で、メチル化導入が遺伝子転写に大きな影響を持つことも示している。すなわち、任意の部分にメチル化を導入する技術により、部分的なメチル化がヒストン(H3K9)のメチル化を通して、クロマチン変化が導入され遺伝子転写が抑制される過程を、かなり正確に研究できるようになったと思う。
以上、メチル化による制御というと、黒丸が並んだ大きな領域による制御と考えてきたのが、一つの黒丸からスタートする制御として考えることが可能になり、DNAメチル化研究を大きく発展させる予感がする技術だった。