2025年11月18日
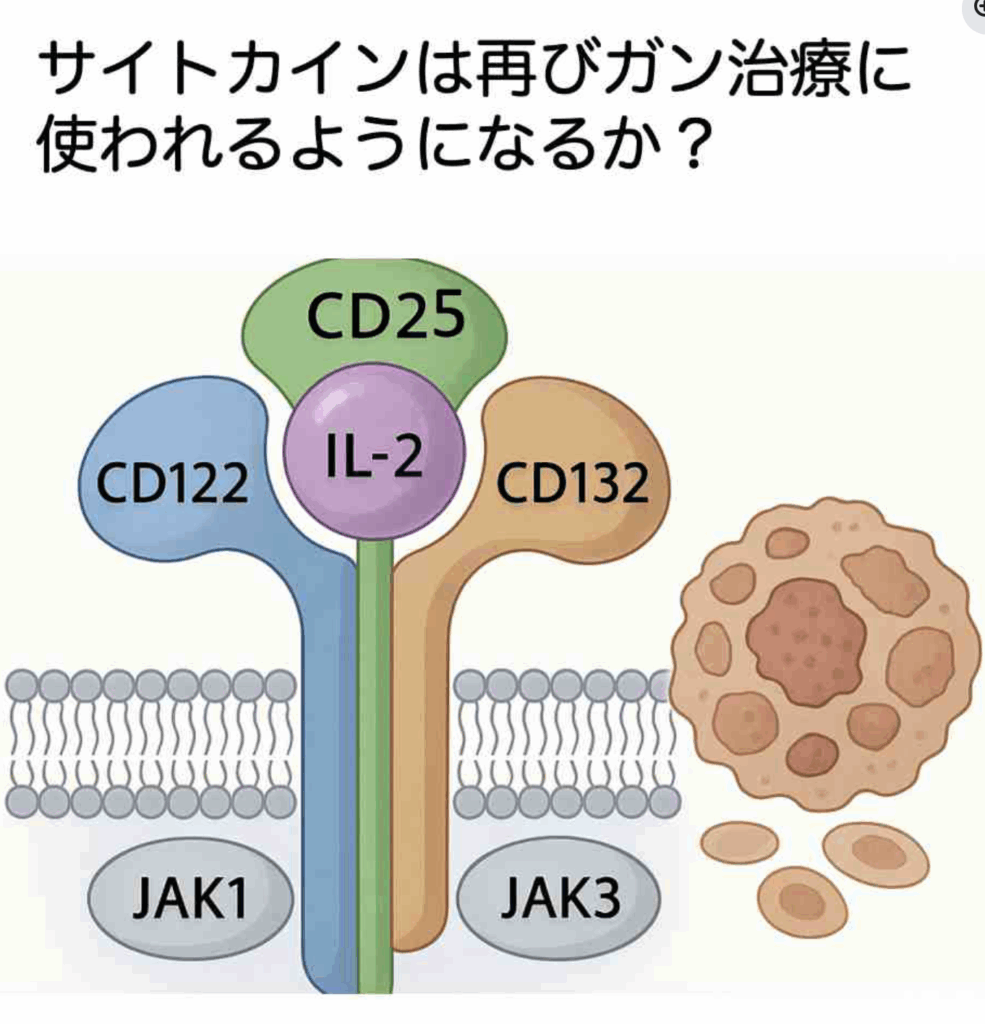
欠かさずコメントを寄せてくれる岡崎さんのリクエストで、サイトカインを用いたガン治療についてのジャーナルクラブを開催します。21世紀が始まる前、サイトカインのクローニングが続き、エリスロポイエチンやG-CSFが臨床で大成功を収めた頃、インターフェロンやIL-2もガン治療に利用できるのではと期待し、また臨床治験も行われました。しかし、21世紀に入ってからの他の治療法の発展に伴い、当時の熱気は冷めたように思えます。しかし実際には新しい技術を取り込んで、ガンのサイトカイン治療は復活を始めており、現状について解説したいと思っています。いつも通りYouTube配信しますが、直接参加したい方はリクエストしてください。
2025年11月18日
ES細胞やiPS細胞の分化能力を一般の人に示すのに、分化した心筋細胞が動いているのを見せるのは、子供だましと言われても昔から行われてきた。神戸ポートアイランドに設立したCDBでは視察・見学には再生するプラナリアとともに最も重要なアトラクションだった。しかし、試験管の中でまとまって拍動している細胞は、失った心筋を補充してくれるかもしれないが、勝手に拍動すると不整脈の巣を作ってしまう問題がある。既に心筋シートや心筋細胞球の移植が我が国でも始まっているが、これらの方法では幸いホストの心筋システムに統合されやすいのかもしれない。
いずれにせよ、移植した心筋細胞とホストの心臓への統合は今後も最重要課題だが、今日紹介するハーバード大学からの論文は、我が国でもすでに局所止血剤として使われている RADA16(製品名PuraStat)を移植時に使うことで、移植領域への血管新生を促し、また心筋の完全な成熟を誘導することでホスト心臓への統合を促進することを示した興味ある研究で、11月13日 Science に掲載された。タイトルは「Flexible nanoelectronics reveal arrhythmogenesis in transplanted human cardiomyocytes(フレキシブルナノエレクトロニクスにより人間の心筋細胞の不整脈発生が検出できる)」だ。
タイトルを読むと、フレキシブルな電極の研究に思えるのだが、実際には RADA16 の新しい可能性についての研究になる。RADA16 はMITのグループにより開発されたアルギニン (R) 、アラニン (A) 、アスパラギン (D) 、アルギニン (A) 配列が4回繰り返す16ペプチドを含むハイドロゲルで、これを出血局所に置くとpHの変化で RADA が自己組織化で βシートを形成して組織を強化する素材で、現在は止血剤として使われている。しかし、生体との親和性から細胞の足場として様々な利用方法が開発されてきた。創傷治癒、粘膜再生、骨再生、軟骨再生、更には脊髄損傷にまで利用が可能か研究が進んでいる。
今日紹介するハーバード大学からの論文では、ヒ iPSから心筋細胞を誘導するとき、RADA16 を足場にすることで心筋細胞の成熟が進む一方、不整脈の原因となるHCN4チャンネルの発現が低下することを発見する。
元々様々な組織再生の足場としての可能性が研究されているだけに後は早い。試験管内で誘導した iPS由来心筋細胞を、正常ラットの心臓に移植するとき、RADA16 とともに移植する群と、心筋細胞だけの群を比べている。
まず最も重要な違いは、心筋細胞を RADA16 とともに注射すると人間の心筋細胞に対する血管新生が誘導され、実際の血流が維持されることが観察される。
次に、心筋細胞の分化度については RADA16 があると成熟のスピードが速まるが、他には大きな変化はない。しかし、心筋細胞がラットの心臓と統合されたかどうかを調べると、RADA16 存在下では組織化される度合い格段に高く、心筋細胞だけでは組織化は進みにくい。
最後に心臓の動きに邪魔されないフレキシブルなシート電極を取り出した移植心臓に設置し36電極での同時記録を行うと、RADA16 非存在下で心筋を移植した心臓でははっきりと不整脈を起こす小さな領域が発生しているのが検出できるが、RADA16 と一緒に移植するとこのような不整脈の巣は全く検出できない。
以上が結果で、ラットにヒト心筋細胞を移植するという特殊な系だけの話かもしれないが、ヒトでの応用もやってみる価値はある。例えば福田さんたちが進めている心筋球などはかなり相性がいいかもしれない。
2025年11月17日
何万年も前のDNAを回収して遺伝子配列を解読するのが普通に行われるようになったことでも、我々のような門外漢には驚くことだが、古代RNAとなるとほとんど不可能だと思っていた。というのも、通常でもDNAと比べてRNAは壊れやすく、さらにある程度組織が残っている必要がある。ただ科学の世界では不可能に挑戦することもまた常識で、2017年ぐらいからデンマークやスウェーデンの様な寒い国から古代RNAを回収し解読したという論文が発表され始めている。さらにこの技術は凍結動物だけでなく、博物館に残されていたタスマニアタイガーの剥製からもRNAを回収して解読できることが示されている。
凍土から発掘された1万5千年前のイヌ科の動物や、タスマニアタイガーRNAを分離したストックフォルム大学のグループが今度はほぼ4万年前の凍結されていたマンモスの筋肉から、タンパク質をコードしていたRNAを含む様々なRNAを分離解読したのが今日紹介するCellの論文で、11月14日オンライン掲載されている。タイトルは「Ancient RNA expression profiles from the extinct woolly mammoth(絶滅したマンモスの古代RNA発現プロファイル)」だ。
様々なサンプルで順番に腕を磨いて、解析対象をついに5万年前まで拡張したことになる。シベリアの永久凍土は6万年ぐらい前から形成が始まったとされており、これにトラップされた動植物はそのまま凍結して保存されていると考えられる。この研究では39000年から55000年前に永久凍土に閉じ込められた10頭のマンモスから皮下の筋肉を採取し、ここからRNAを分離し、配列解読を行っている。ただ、DNAも含めて十分な核酸の回収ができたのが3頭で、中でもYukaとなづけた39000年以上前の個体から配列解析可能なRNAを得ることができている。従って、データのほとんどはYuka由来のRNAを使っている。
この個体は近大の入谷さんたちが核(のようなもの)を抽出してマウス卵に移植し、紡錘糸の形成が起こったことを報告した個体で、さらに昨年このブログで皮膚の核のクロマチン構造を解析するのにも使われている(https://aasj.jp/news/watch/24826 )。即ち、様々な条件が重なって圧倒的な保存状態が実現されたと考えられる。
論文のほとんどは、得られたRNAの質及びDNAの混じり込みの問題についての実験になっている。特に得られた配列データの情報処理方法が重要で、様々な処理方法を比べ、将来の標準を形成していこうとする努力が示されている。いずれにせよ、得られた最も長い配列が97bという状態で、23bより大きい断片を選んで解析している。
方法論を飛ばして、RNAの解析による新しい発見についてまとめておく。
YukaはDNAではオスと判定されるが、発見された時の外見からメスとされていた。遺伝的な性不一致が考えられるが、筋肉でオスを決めるSRY遺伝子の発現が認められており、遺伝子型と同じオスである事をサポートしている。
核酸はデアミネーション等の経年変化を示すが、RNAの場合一本鎖DNAと同じレベルの変化が起こることがわかる。即ち2本鎖と比べると経年変化が早い。このことから、mRNAより、複雑な構造をとるノンコーディングのRNAのほうが経年変化は遅くなると期待できる。
YukaのDNA配列と比べた結果、RNAも同じマンモス型多型を有していることが確認された。
昨年のノーベル賞の対象になったマイクロRNAだが、現在のアジア象には存在せずマンモスにだけ存在している新しいマイクロRNAが発見されている。もちろんこれがマイクロRNAとして機能していることは確認する必要があるが、ヘアピン構造をとるマイクロRNAはより保存が良いと考えられ、古代RNAの機能を調べる鍵になり得る。
経年変化が早いとは言え、YukaからのRNAのなかには342種類のタンパク質をコードする遺伝子が含まれている(ノンコーディングRNAは902種類)。これらのRNAの発現量を調べるのは難しいが、発現パターンから筋肉由来のRNAを代表していることがわかる。
筋肉組織として発現マイクロRNAを調べると、ほとんどの動物で筋肉特異的機能を示すマイクロRNAも存在するが、人間では脳で見つかるマイクロRNAが筋肉で見つかっており、今後古代マイクロRNAの機能検索は面白い分野になる可能性がある。
以上が結果で、まだまだ入り口で将来の発展性は闇の中という段階だが、ともかく4-5万年前のRNA を解析できたという世界記録を評価しよう。
2025年11月16日
我々の腸内に存在する様々な細菌の遺伝子を改変することは遺伝子編集の重要なゴールになっている。細菌の遺伝子改変など楽勝と考える人もいるかもしれないが、何千何万種類の細菌が存在する腸にどのように遺伝子を運んでどのように選択するのかと考えてみると、並大抵の課題でないことがわかる。それでも、少しづつ技術開発は進展しており、このブログでも何回か紹介してきた((https://aasj.jp/news/watch/6765 )(https://aasj.jp/news/watch/27611 )。
今日紹介するコロンビア大学からの論文は、細菌叢の遺伝子操作としては一段階高いレベルに到達できたことを実感させる研究で、11月13日 Science に掲載された。タイトルは「Metagenomic editing of commensal bacteria in vivo using CRISPR-associated transposases(常在菌ゲノムを対象とするCRISPRに連関するトランスポゼースを用いる遺伝子編集)。
この研究ではCASTと呼ばれるCasの切断活性をトランスポゼース活性に置き換えたCRISPRシステムを用いている。このシステムでは特定の配列を持つバクテリアの領域を、CRISPRで認識し、そこに同じプラスミドに組み込んだ新しい遺伝子配列をトランスポゼースで組み込むことができる。
次にこれらのシステムを、このグループが開発してきた様々な細菌に対して水平遺伝子伝搬を可能にする IncPα-family RP4 system と呼ばれるプラスミドに組み込んで大腸菌に導入し、これを腸内に送り込んで他のバクテリアに遺伝子を届けるという戦略をとっている。即ち、このプラスミドを用いて特定のバクテリアの特定のゲノム部位を狙ったCASTシステムを送り込めると、その部位に遺伝子が組み込めることになる。
遺伝子配列はバクテリアごとに特異的配列を選べるので、遺伝子伝搬には特異性はないが、組み込まれるとバクテリア特異的に遺伝子を発現させることができる。これを腸内に最も多く存在するBacterioidesの5系統を移植した無菌マウスに、それぞれの系統特異的配列を標的にして遺伝子導入を行うと、見事に系統特異的遺伝子導入が可能になることを示している。また、SPFマウスに常在するBacterioidesにも同じように遺伝子導入を行えることを示している。
次は、遺伝子導入されたバクテリアを長期間維持できるシステムの開発で、水溶性植物繊維を分解して利用できる酵素を一緒に導入し、食事の中にイヌリンを混ぜることで、遺伝子を新たにくみこんだ細菌がBacterioides全体のなかの30%を占めるまでになり、イヌリンが存在する限り長期間増殖を続けることを明らかにしている。
最後に粘膜と直接相互作用して腸内免疫に強い影響を持つセグメント細菌 (SFB) も、朝刊内で遺伝子組み込み可能かについて調べている。まだまだ通常の細菌叢が存在する条件で遺伝子組み換えを誘導するまでには至っていないが、SFB菌のみを移植した無菌マウスを用いて3%ぐらいの効率で蛍光遺伝子を導入できることを示している。
以上が結果で、一般の人から見るとわかりにくいと思うが、腸内細菌叢の遺伝子改変の困難についてよく認識できている立場から見ると、かなり大きな進展があったと感じる。さらに、今回示されたシステムはまだまだ改良の余地がある。その点で、ようやく狙った細菌を腸内で操作できる時代が近づいたと思う。
2025年11月15日
イヌはオオカミが家畜化されて生まれた種だと考えられているが、このHPで紹介しているように(https://aasj.jp/news/autism-science/11104 )、オオカミとイヌのゲノムを比べると、「天使の笑顔」と称される人なつっこさを持つ遺伝子疾患ウイリアムズ症候群で欠損しているのと同じ領域の構造変化がイヌで起こっていることが2017年報告された。即ち家畜化の過程で人になつく動物が選択されたのだろう。その後、特にビクトリア朝時代のブリーダーの手によってサイズから形態まで現在見られる大きな変化が誘導されることになるが、家畜化の初期にはどの程度の変化が生まれていたのかを知ることは重要だ。
今日紹介する最初の論文、フランスモンペリエ大学と英国エクセター大学からの論文は、様々な時代に出土したイヌの頭蓋骨の形態をオオカミや現代のイヌの頭蓋と精密に比べた研究で、11月13日 Science に掲載された。タイトルは「The emergence and diversification of dog morphology(イヌの形態の出現と多様化)」だ。
研究では5万年前から現代まで、イヌ科の頭蓋を集めて比較している。更新世の頭蓋骨はほとんど現代のオオカミと同じ大きさで、その後1万年ぐらいの完新世になると多様性が大きくなり、平均値は低下する。この多様性は現代のイヌの多様性と似ているが、現代のオオカミではほとんど多様性がない。
様々な計測を元に主成分分析をすると、現代のイヌは広く分布し、サイズ以上の多様性が見られる。これに対しオオカミや更新世のイヌ科の頭蓋は重なる小さな領域に分布する。そして、完新世になると急に多様化が進むことがわかる。
詳細は省くが、このような詳細な形態学的解析から、オオカミから分離した頭蓋と特定できるのは、ロシアの中石器時代の頭蓋で、その後、完新世に入ると大きな形態学的多様性が生まれることから、この変化はもっぱら人間の好みに合わせて発生したのではないかと結論している。
同じ Science に掲載された中国昆明動物研究所とミュンヘン大学を含む国際チームからの論文は、1万年の完新世以降の世界から出土したイヌの骨のゲノム解析と人間のゲノム解析に重ね合わせて人間との関係を調べた研究で、タイトルは「Genomic evidence for the Holocene codispersal of dogs and humans across Eastern Eurasia(ゲノム解析から東ユーラシアの人間とイヌは一緒に異動したことがわかる)」だ。
最初の論文でわかるように、イヌが家畜化されたのはロシアのシベリア地区と考えられているが、この研究では Zhokhov で発見されたイヌのゲノムをイヌの起原として考えていいことをまず確認している。
これを元に、既に報告されているゲノムも含めて、イヌのゲノムの多様化を時代と地域にプロットした後、ゲノム研究から明らかになっている人間の移動と重ね合わせている。特に中国は、西からの農耕民の移動と北からの狩猟採取民の移動が混じり合う地点で、イヌの移動と重ね合わせるには最適の領域になっている。
結果だが、中国では5000年より前には西からイヌが持ち込まれているが、5000年以降に北西ロシアから、そしてシベリアからのイヌとの交雑が見られる。このパターンは、中国での民族形成過程とオーバーラップすることから、イヌの移動はほぼ民族の移動と重なると結論している。
詳細はほとんどすっ飛ばして紹介したが、イヌの歴史を見ることは人類の歴史を見ることに他ならない。例えばシェパードのようなオオカミに近い形態を好んだ人間の生活はおそらく狩猟採取民の生活と重なるだろう。しかし、農耕が進むのと並行して草食が中心になると、顔は大きく変化したはずだ。そして極めつけはビクトリア王朝で始まった、人間の趣味に合わせた形や性質の変化の誘導で、ペット時代が始まることになる。ある意味で、イヌは受難の動物かもしれない。
2025年11月14日
昨日に続いて抗うつ剤開発研究。それも中国の研究を紹介することにする。この研究を見ると中国の創薬力を実感することができるし、日本の創薬企業が相次いで中国企業と提携していることもわかる。
さて、昨日の中国アカデミー北京研究所からの論文は、ケタミンの作用をアデノシンシグナル増強と特定し、この機能だけを取り出すケタミン由来化合物の設計だったが、今日は抗うつ薬の本家本元、セロトニン受容体 (5HT1aR) 刺激剤の開発についての合肥大学からの論文で、11月12日 Cell にオンライン掲載された。タイトルは「Pathway-selective 5-HT1AR agonist as a rapid antidepressant strategy(シグナル経路を選択する5HT1aRアゴニストは即効性の抗うつ剤になる)」だ。
うつ病ではセロトニン再吸収阻害剤が治療のスタンダードになるが、うつ病で活性が低下する大脳皮質や辺縁系のセロトニンの濃度を高めることで治療する方法だ。ただ2014年にこのブログで紹介したように(https://aasj.jp/news/watch/2657 )、セロトニンシナプスには調節ループが存在し、セロトニンを分泌する前シナプス細胞にも5HT1aRが発現して、セロトニンの作用で興奮が抑制される仕組みがある。このため、再吸収阻害剤や5HT1aRアゴニストの投与では、初期前シナプス作用の結果、ほしいセロトニンの効果が遅れるだけでなく、同じ神経のグルタミン酸シグナルも低下して自殺願望などを高めてしまう副作用があった。
この問題を根本的に解決するためには前シナプス細胞の5HT1aRに作用せず、後シナプス細胞の5HT1aRだけに作用する薬剤があるといいのだが、全く同じ受容体を区別するのは簡単ではない。一つの方法は先日紹介したこ論文(https://aasj.jp/news/watch/27708 )のように、受容体と共役するGタンパク質を選択的に抑制して前シナプス5HT1aRを働かなくすることだが、5HT1aRについては報告はない。もう一つの方法は5HT1aRの構造を理解して、特定のGタンパク質との選択性を高める方法で、今年6月に紹介したスウェーデンからの論文(https://aasj.jp/news/watch/27009 )はそれを代表している。ただ、この研究でも異なるタイプのGタンパクとの特異性を捜査するところまではいっていない。
この研究ではセロトニン再吸収阻害剤とβ遮断薬ピンドロールを併用すると、前シナプスの興奮が抑えられ、効果が遅れるのを防げるという現象に着目した。即ち、ピンドロールが5HT1aRに弱く結合し、前シナプスではHT1aR抑制に、後シナプスではHT1aR活性化に働くという現象で、ピンドロールがHT1aRの下流シグナルを操作できる可能性を示唆している。
そこで、これまで開発されたHT1aRアゴニストで刺激したときにリクルートされるGタンパク質の種類とピンドロール刺激によるGタンパク質を比較し、ピンドロールだけがG0選択性を持っていることを発見する。
次に、それぞれのアゴニストやピンドロールとHT1aRの結合状態をクライオ電顕や、HT1aRへの変異導入実験から詳しく調べ、Gタンパク質選択性が生まれる構造基盤を明らかにし、α4-β6ループとして知られる構造とN末端のα5ヘリックスがG0選択性に関わることを発見する。
この構造解析に基づき、ピンドロールを起点によりHT1aRへの特異性を高めつつ、他のGタンパク質のリクルートを誘導しないリガンドTMU4142を完成させている。TMU4142でHT1aRを刺激すると、他のリガンドと比べG0Aの活性化が10-20倍程度上昇、一方Gi3の活性化は10-20倍低下すること、そしてアレスチンのリクルートは全く起こらないことを確認している。
最後にマウスのうつ病モデルでこの薬剤を腹腔注射すると、前シナプスの刺激がほとんど起こらず、その結果後シナプス刺激が遅れなく発揮され、うつ状態を抑えられる事を示している。
以上が結果で、ピンドロールというお手本はあったにせよ、同じ受容体のGタンパク選択性を操作する薬剤を開発した力量は高く評価できる。これまでうつ病に関する創薬研究を何度も紹介してきているが、少なくとも5回は中国の研究だった。すなわち、うつ病という最もホットな精神疾患創薬領域で、アカデミアがこれほどの力を発揮できているのを見ると、我が国も虚心坦懐に学ぶ必要があると思う。
2025年11月13日
2000年に、麻酔に必要とされる量より低い用量を静脈注射すると、投与後数時間から効果が現れ、数日効果が持続することが発見され大きな注目を集めたケタミンは、また自由診療として多くの国で使われているが、麻酔に使うケタミンは正式な抗うつ病治療薬としては米国FDAでも日本でも認可されていない。おそらく依存症など多くの副作用を考慮してのことだと思うが、効果を考えると作用メカニズムを明らかにし、新しい薬剤の開発につなげることは重要だ。このブログでも、作用機序についての研究をすでに5報紹介している。逆に5報も異なる論文が出ているということは、作用機序について完全な解明ができていないことを意味する。
今日紹介する中国科学アカデミー北京脳研究所からの論文は、これまでとは異なる視点でメカニズムを解析した研究で、11月5日 Nature にオンライン掲載された。タイトルは「Adenosine signalling drives antidepressant actions of ketamine and ECT(アデノシンシグナルがケタミンと電気的けいれん療法の抗うつ効果を媒介している)」だ。
うつ病に対してはケタミンだけでなく、電気的刺激で脳内のけいれんを誘導する治療 (ECT) が行われることがある。この研究ではアデノシンによる神経細胞への刺激がうつ病抑制に関わる可能性を示した過去の研究に基づき、ケタミンと ECT 共通に脳内でのアデノシンシグナル増強が見られるかを調べるところから始めている。このために、アデノシンシグナルが発生すると蛍光発色するトランスジェニックマウスを作成し、ケタミン投与あるいは ECT 刺激を行っている。この結果、いずれの刺激も脳内のいくつかの領域でアデノシンシグナルの上昇が観察されることがわかった。
アデノシンシグナルは細胞外のアデノシンが2種類の受容体に結合することで発生するが、この受容体をノックアウトするとマウスモデルのうつ病の改善が見られなくなることがわかった。即ちケタミン作用はアデノシンシグナルを媒介としており、A1、A2 両方のシグナルが関わっている。
ではケタミンはアデノシンシグナル刺激にどう関わっているのか。様々な可能性を検討した結果、様々な細胞で細胞内の ATP/ADP 比が低下する。即ちケタミンは細胞内の代謝システムを変化させ細胞内でのアデノシン合成と細胞外への輸送を高めている可能性が高い。事実、ケタミン刺激でピルビン酸が蓄積する一方、他のTCAサイクル中間体が低下することから、ミトコンドリアの代謝を変化させ、ピルビン酸の利用が抑制され、ATP/ADP 比が低下し、アデノシン合成と細胞外以降が高まる。面白いことに、この作用はケタミンのグルタミン酸受容体刺激作用とは異なっている。
そこで、神経作用が低いがアデノシンシグナルを高められるケタミンを設計できないか、有機化学的修飾をケタミンに加えて調べると、塩素を除去したケタミンで代謝を変化させてアデノシンシグナルを高める一方、神経的作用が抑えられる事がわかった。こうして設計したDCKをうつ病モデルマウスに用いると、ケタミンより高い効果を示し、運動異常は見られなかった。
グルタミン酸受容体阻害実験も行い、ケタミンのアデノシンシグナル上昇作用がグルタミン酸受容体とは別であることを確認しており、今後の神経作用のないケタミン由来化合物の設計に道を開いた。
最後に、これまでうつ病に効果があるとされてきた人工的低酸素治療、すなわち5分間9%酸素濃度の環境にさらすサイクルを繰り返す治療についてもアデノシン刺激との関係を調べ、この方法でもアデノシン刺激を誘導できることを示している。心肺機能が正常な人では、様々な副作用が予想されるECTと比べ低酸素療法は安全性が高いので、治療法として定着させる価値があることを示している。
結果は以上で、ケタミンに関するまた新しい説の一つと見ることもできるが、新しい薬剤の可能性や、治療方法について示せた点で、かなり進歩したと言える。
2025年11月12日
川崎病やギランバレー症候群などの自己免疫性炎症に健康人から精製した免疫グロブリンを大量に注入する治療が標準治療として行われる。FDAでは80を超す自己免疫病で効果的と認めている。ただ、1回の点滴注射で1-2g/Kgと大量の免疫グロブリンが必要で、1回に4万円近いコストだけでなく、供給の問題も大きい。
今日紹介するロックフェラー大学からの論文は、ガンマグロブリンが炎症を抑えるメカニズムを詳細に調べて、将来リコンビナント製剤を可能にするための条件を調べた研究で、11月6日 Science に掲載された。タイトルは「The anti-inflammatory activity of IgG is enhanced by co-engagement of type I and II Fc receptors(IgGの持つ抗炎症効果はtypeIとtypeII Fc受容体の両方が関わっている)」だ。
以前は免疫グロブリンを注射する目的は、その中に特異抗体があるからと考えられていたが、感染症を除くと、免疫グルブリンの抗炎症効果の大半はFc受容体を介して発揮されることが知られている。このFc受容体研究の第一人者が Ravetch でこの研究もこの研究室から発表されている。
この研究では炎症を抑えるFcの設計をまず行っている。抗原結合部分が必要無いことを明確にするため、抗原結合部を除いたFc部分を精製して用いている。またこれまでの研究で免疫グロブリンFc部分に糖鎖が結合してシアル化されている必要があることが知られており、この点を調べるために糖鎖を酵素で除去したFcも作成している。この効果を確かめる炎症モデルとして、リュウマチモデルマウスの血清を注射したときに起こる炎症を用いている。
この炎症を抑えるために免疫グロブリンは2.5g/Kg必要だが、Fc部分にすると100mgで効果があり、25倍活性が上がる。しかし糖鎖を除去すると、この効果は見られない。
ここからは Ravetch さんの得意分野になるが、Fcが結合するFc受容体は数多く存在し、しかも炎症を高めるシグナルドメインを持つタイプと、炎症を抑えるシグナルドメインを持つタイプに分かれている。そこで、Fcに突然変異を導入してそれぞれのタイプへの親和性を変化させて、より炎症を抑えるタイプのFcγRIIBに親和性を持つV11Fcを作成し、これが通常のFcと比べてさらに10倍活性が上がり、10mg/kg で効果が見られることを示している。
残るは、FcγIIBへの結合だけを見ると糖鎖の結合は無関係なのに、なぜ糖鎖が結合しているFcだけに抗炎症作用があるのかという問題だが、これについては細胞膜上に存在するtype II Fcγ受容体として知られる細胞膜上のレクチン(糖鎖結合タンパク質)がFcγIIBと結合することが鍵になることを示している。即ち、type II FcγRはレクチン機能を介してFcγIIBと細胞膜上で安定なコンプレックスを形成することでFcγIIBの発現量が上昇し、さらにこのレクチンにより糖鎖修飾を受けたFcがFcγIIB上に濃縮され易くなるという2重の効果によって、FcγIIB刺激が高まり、これが自然免疫を抑えるというシナリオになる。
おそらく合成させる細胞を選べば変異を導入してシアル化されたリコンビナントの製剤を作ることは可能になる。ただ、コストの面で人から精製するのとどちらが安いかという問題になるが、少なくとも供給の不安はなくなるように思う。
2025年11月11日
生成AIを用いたタンパク質デザイン分野では昨年のノーベル賞を受賞した David Baker さんが理論から応用まで圧倒的なパーフォーマンスを示しているが、決して独占状態ではなく、様々な研究室から多様なアイデアが生まれているホットな分野になっている。この状況については「AIx生物学勉強会」で紹介したので参考にしてほしい(https://www.youtube.com/watch?v=hBFr9aVoXIQ )。
今日まず紹介したいのは David Baker さんのグループが11月5日 Nature にオンライン掲載した論文で、Bakerさんたちが開発した RDdiffusion によるタンパク質設計法を特定の抗原に対する抗体作成に利用する方法の開発で、タイトルは「Atomically accurate de novo design of antibodies with RFdiffusion(原子レベルで正確な抗体の新たな設計を RFdiffusion で行う)」だ。
何度も紹介しているが、データベース由来のタンパク質構造の物理学的構造を学習させた RFdiffusion は、RoseTTAFold (RF) 構造予測ネットから得られる重みを拡散モデルのノイズ消去に使って特定の機能を保つペプチドを設計する方法だが、どうしても抗体結合部の持つ界面の構造の問題や、一つのタンパク質表面の様々な領域に結合する抗体のデザインは苦手としていた。
今日紹介する新しいモデルは、RFdiffusion を抗体のデザインに至適化するため、データベースに存在する抗原と抗体の配列セットをそのまま学習させるのではなく、大きなバリエーションのある抗体CDR領域以外のフレームワークを固定テンプレートとし、CDR領域の配置のみ変化させた抗体に置き換えてファインチューニングに用いている。このとき、エピトープの一部残基をホットスポットとして学習させることで、様々なエピトームにデザインが向くようにしている。こうして設計された抗体をRFで評価しフィルターをかけることで、特異的結合力の高い抗体を最終的に得られるようにしている。
抗体はH鎖とL鎖のダイマーだが、この枠組みではVHのみだけでなく、VH/VLを持つ抗体の設計が可能で、後者の場合最終的アウトプットは両方の可変部分をつないだ大きなペプチドが設計されてくる。
主に学習に使った抗原に対してデザインした抗体を評価しているが、まだアフィニティーは高くない抗体ができてしまう問題がある。そのため、遺伝的に変異を繰り返させて進化させる方法を用いて有用な抗体に仕上げる必要があり実用化という点ではまだ改良が必要だ。またデザインされた抗体の歩留まりが悪い点も問題で、分子構造を予測する Diffusion を用いることの困難を示しているが、有用な抗体を選ぶフィルタリングを新しい AlphaFold3 に変えることで、より歩留まりを高められる可能性も示している。
実用化にはまだまだという段階だが、面白いのはMHC+ペプチドというT細胞が認識するエピトープに対する抗体を設計できる点で、高いアフィニティーが必要無い場合、CAR-Tのキメラ抗体を設計できる可能性がある。
もう一編の論文は、テキサスバンダービルト大学からで、Bakerさんのように物理化学的構造を指示することには全くこだわらず、ただVHVL抗体配列と抗原エピトープの組み合わせで、ProGen2と呼ばれるタンパク質構造を学習したモデルをファインチューニングして抗体がデザインできるか調べた研究で、11月4日 Cell にオンライン掲載された。タイトルは「Generation of antigen-specific paired-chain antibodies using large language models(抗原特異的VHVL抗体を大規模言語モデルで作成する)」だ。
ファインチューニングに1万を超すコロナ抗体を中心に、2万弱のウイルスに対する抗体と抗原のセットを用いており、抗原エピトープ配列を入力すると抗体配列が出てくるようになっている。
この研究の面白い点は、構造上の可能性をフィルターに用いるのではなく、人間が持っている変異前の抗体遺伝子と比較して新しい抗体配列が発生するかに焦点を絞っている点だ。結果コロナウイルスRBDに対してデザインされた抗体のほとんどが、学習に用いた抗体とは異なる配列を持っており、決して学習した配列を吐き出しているわけではないことがわかる。学習に用いた抗体と新しく設計された抗体をトークン化した多次元空間に分布させることで、デザインがどのように行われているのかも調べることができる。このモデルはアフィニティーという実用性には縛られないようにできているので、デザインされた抗体を実用性でフィルターして比べることで、高アフィニティーが達成されるまでに必要だった変異をたどることができ、抗体設計の戦略に役立てることもできる。
この研究の最大の目標は、抗体設計のために作成されてきた大規模言語モデルでは難しかった、ゼロショットのデザイン、すなわち経験したことのない抗原のエピトープ配列を入れたとき、それに対する抗体が設計できるかを調べている点だ。インフルエンザのHAに対して調べているが、本来生殖系列にコードされているVH/VL遺伝子のCDR領域に変異が入ったHAに対する抗体が設計できることを示している。
以上の結果は、抗体と抗原セットだけでファインチューニングを繰り返すだけで、抗体生成に必要なコンテクストが抽出され、抗原によってはモデルが全く経験していない抗体の生成が行えることを示している。留学して最初に行った研究が抗体レパートリーの形成だったので、生成AIが当然とは言え抗体産生という生物学的側面を見事にコンテクスト化しているのに驚いた。抗体デザインは決して実用化だけのためではない。
2025年11月10日
フェロトーシスはストレスにより細胞が死ぬメカニズムの一つで、細胞膜の脂肪(フォスフォリピッド)の中に存在する多価不飽和脂肪酸が過酸化(即ち脂質から電子が奪われる)され、細胞膜が破綻することで起こる。高いストレスの中で増殖するガンは特にフェロトーシスを予防する機構が働いており、これをブロックしてガン増殖を抑える薬剤の開発が続けられている。このブログでもいくつか論文を紹介したが、過酸化された多価不飽和脂肪酸を還元する酵素 GPX4 を標的にしていた。しかし、GPX4 はノックアウトするとマウスは生まれてこず、また T細胞の活性はこの分子で守られており、ガン免疫も低下する。実際、GPX4 阻害剤は造血を抑制し毒性が強いため、抗ガン剤として使える可能性は低い。
GPX4 の他にももう一つフェロトーシスを抑える仕組みが存在する。FSP1 と呼ばれるコエンザイムQ (CoQ) を還元化して脂肪ラディカルをトラップする一種の抗酸化システムだ。今日紹介するニューヨーク大からの論文は、ガンでは GPX4 が存在していても FSP1 の発現が高まるほどフェロトーシスの危険性が高まっており、これを阻害することで比較的ガン細胞特異的なフェロトーシスを誘導できることを示した研究で、11月5日 Nature にオンライン掲載された。タイトルは「Targeting FSP1 triggers ferroptosis in lung cancer(FSP1 を標的にすることで肺ガンのフェロトーシスを誘導できる)」だ。
この研究では肺の腺ガン細胞がフェロトーシス防御機構を必要としていることを、ガン細胞の GPX4遺伝子をノックアウトする実験で示した後、FSP1 も腺ガン細胞のフェロトーシス防御に GPX4 に匹敵する重要な働きをしていることを、やはりノックアウト実験で示している。即ち腺ガンに関しては、GPX4ノックアウトも、FSP1ノックアウトも同じぐらいガンのフェロトーシスを誘導することを示している。また、実際の腺ガンの患者さんで FSP1 が高いほど予後が悪いことも示している。
次に FSP1 の依存性についてガン遺伝子が異なるガンや、あるいは発生場所の異なるガンで調べ、発ガンとともに FSP1 は上昇しフェロトーシスを抑制しており、この機能を外すと細胞の増殖を抑えることができることになる。
次にガンを移植したマウスで、例えばビタミンE や LIP1 のようなフェロトーシスを抑える処理がガンの増殖を抑えることを確認した後、現在手に入る FSP1 阻害剤をマウスに投与する実験を行い、ガン特異的に増殖を一定程度抑えることを明らかにしている。
結果は以上で、発ガンにとってフェロトーシスの抑制は必須の条件で、GPX4 の発現があったとしても、ガンの FSP1 阻害や、多価不飽和脂肪酸の過酸化を防ぐ処理により、完全ではないにせよガンの増殖を止められることから、他の抗ガン剤と併用する薬剤になるのではと期待する。
FSP1 のガンでの機能を調べたハーバード大学からの研究が同じ号の Nature に掲載されているのでこちらも簡単に紹介する。タイトルは「Lymph node environment drives FSP1 targetability in metastasizing melanoma(リンパ節の微小環境は転移メラノーマの FSP1 を治療標的にする)」だ。
この研究ではメラノーマがリンパ節に転移したとき GPX4 の依存性が低下することに着目して研究を始めている。結果をまとめると、リンパ節内ではオレイン酸のような多価不飽和脂肪酸が高まっている一方、フェロトーシスニ関わる鉄の濃度は低く、低酸素状態といえる環境が作られている。特に低酸素は GPX4 のユビキチン化を高め、GPX4 の量が低下することから、リンパ節内でガンはよりフェロトーシスの危険性にさらされることになる。これを防ぐ為、FSP1 の発現が高めることでガンはフェロトーシスから逃れている。
このシナリオを確かめるため、マウスの皮下とリンパ節にガンを移植してFSP-1 阻害剤を投与すると、リンパ節でのガン増殖だけが選択的に低下することを示している。
両方の論文を眺めてみると、FSP-1 阻害剤の臨床応用にはガンや条件を選ぶ必要があるとは思うが、GPX4 阻害剤よりは一歩フェロトーシス誘導治療に進んだ感じがする。