2019年8月22日
シモンズ財団
自閉症スペクトラム(ASD)に関する論文を読んでいて、研究の多くがSimons Foundation (写真は会長のMarilyn Simmons)の助成を受けていることに気づきました。この財団のことは全く知りませんでしたが、Webで調べると、数学者で天才ディーラーと呼ばれたJames Simonsとその妻Marilynにより1994年に設立された財団で、Simons氏の専門だった数学やコンピューターサイエンスを中心に基礎科学を支援している財団のようです。2015年の支出が4.3億ドルという規模は、東大の全収入約2000億円と比べて、かなり大きな財団であることがわかります。
中でもASD研究はこの財団が焦点を当てている分野の3本の柱の一つになっています。おかげで、財団のホームページの論文のリストを見るだけで、ASDの基礎研究の現状がよく分かるようになっており大変重宝です。この財団が助成する活動の中で最も注目したいのが、SPARKと名付けられた新しい発想のコホート研究です。これについては2月号のNeuronに現状報告が掲載されているので、今日はそれを紹介します(SPARK: A US cohort of 50,000 families to accelerate autism research
(SPARK: 自閉症研究を加速するための50000家族のコホート研究), Neuron 97:488, 2018)。
このレポートはSPARKプロジェクトのコンソーシアムから発表されており、SPARKの目的や現状、そして解決すべき困難などが率直に述べられています。読み通してみるとよく練られた計画で、このような計画が民間財団のサポートで実現するところが米国の活力だと感銘を受けました。
コホート研究の困難
コホート研究とは、特定の集団を長期にわたって追跡する研究で、例えば肥満の児童は将来心臓発作を起こしやすいかなどを調べるとき、児童の時期に対象を選び、成人になるまで心臓発作の発症を追いかけるような研究です。私が読んだ最も長いコホート研究は、スコットランドで始められた2ヶ国語環境で育つと認知症になりにくいかという研究で、スタートしたのが1936年、調査が行われたのが2010年という80年近い追跡研究でした。
ただこのようなコホート研究は、対象に呼びかけ、登録してもらい、さらにコホート期間中に様々なデータを提供してもらう事が大変で、膨大な労力とコストがかかります。我が国では、研究のほとんどが公的な資金で行われるため、本当に長期の研究を支え続けるのが難しくなっています。
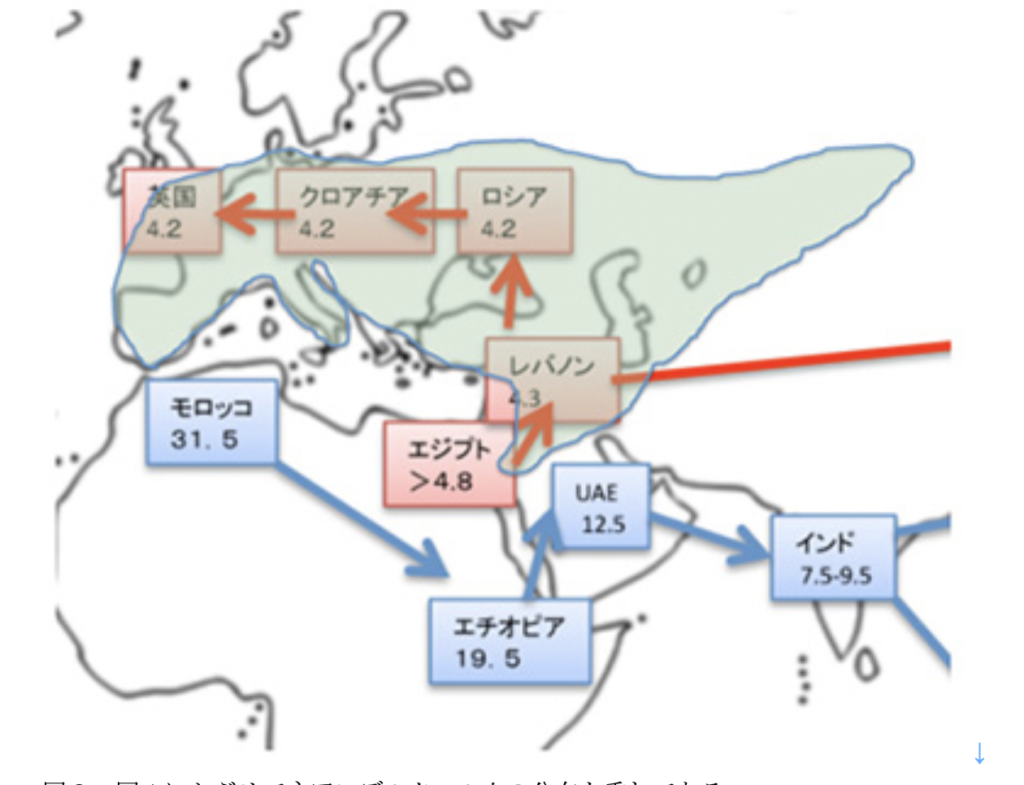
SPARKの概要
SPARK研究は、コホート研究の困難に、様々な新しい方法を用いて挑戦しようとする斬新な取り組みだと思います。何よりも、私的な財団支援することで、例えば政策変更で研究が中断する心配がありません。この安定した助成を基盤として目指しているのが、遺伝と症状の詳細な相関関係を明らかにする事です。
ASDは多様な脳の状態(neurodiversity)として捉えられるようになっています。というのも、400-1000もの遺伝子が関連する複雑な状態で、一つとして同じ状態はないのです。ただ、こう割り切ってしまうと話が終わってしまいます。Neurodiversityを認めた上で重要なのが、本人と家族の詳しいゲノム検査に、症状や生活についてのできるだけ詳しい情報を関連づける作業です。極めて多様な状態がありますから、このような関連づけが可能になるためには最低5万家族以上のデータが必要になります。しかし言うは易く行うは難しで、コホート研究について少しでも知識があると、とてつもないプロジェクトだと尻込みしてしまいます。
SPARKも困難を理解した上で、21世紀に進む個人と個人が直接つながる(ピア・ツー・ピア)ネットワークを利用して、患者さん、主治医、研究者をつなぐことでより少ない労力でこれを実現する様々な工夫を凝らしています。
まず感心するのが、最適な構築を最初から決めることは不可能で、様々な試行錯誤を繰り返しながら発展させるしかないと割り切っている点です。多くのコホート研究では、科学性を盾に最初から計画しすぎて、計画倒れに終わることが多いように思いますが、SPARKではともかくASDの子供、家族および主治医をSPARKとネットで双方的につないでデータを蓄積するとともに、SPARKをハブとして、外部のすべての研究者とネットで結合する構造の構築を進めているようです。
次に感心するのが、このネットワークを構築するため、当然のようにゲノム検査の結果を参加者に戻すことを決めていることです。児童に関わるゲノムデータを本人や家族に戻すことは、我が国でも議論になっていると思いますが、詳しい理由は述べませんが、私はこれなしに双方向性のネット構築はないと思っています。
また、ゲノムデータの戻し方もよく計画されています。最初に調べた結果を一回きりで戻すのではなく、メンバーのデータを毎年最新の研究に基づいて解析し直し、そこで何か見つかった場合に関係する家族に連絡するという方法を採用しています。家族とSPARKが長年にわたって対話するという意味では素晴らしい方法だと思います。すでに500家族のパイロットゲノム研究が行われ、5%の家族に結果を知らせることができたようで、計画の検証も着々と行っているようです。
もちろん遺伝子解析だけではこのプロジェクトは完成しません。最も重要なのが遺伝子の違いに関連する行動などの変化を可能な限り集める事です。考えるだけで大変だと思いますが、ネットを利用して、様々な可能性が試されると期待します。事実、問診票の結果や、行動解析などSPARK拠点で集めた個人データは、ほかの人のデータおよびゲノムと関連づけた後、家族に返す仕組みになっています。これもネットワークの活動性を維持するために重要なことだと思います。
とはいえ、行動をデータ化するのは簡単なことではありません。SPARKは最初から高望みはしないという戦略で、データは時間をかけて集めればいいと割り切っているようです。例えばいくつかの決まった質問票で簡単に得られるデータを核にして、そこに主治医からのデータや、米国では患者さんと研究者をつなごうと進んでいるSync for Science のような外部のデータシェアサイトからもデータを集められるオープンな構造にしているようです。Sync for
Scienceについてはこのレポートを読むまで、全く知りませんでしたが、我が国のこの分野の政策に関わる人にどのぐらい周知されているのでしょうか。研究者や医師と患者さんや家族の関係を根本的に見直すチャレンジですから、後追いでも、マネでもいいので、我が国でも進めてもらいたいものです。
できるだけ少ない労力でこうして立ち上げたネットワークを維持する様々な工夫も紹介されています。このために最も重要なことが、参加者に常にコミットしているという気持ちを持ってもらうことだというのは、納得です。そのため例えば、ASDについて学ぶことのできるスマートフォンプログラム、あるいは最近の注目すべき研究成果、そして何よりもSPARKから生まれた成果をスマートフォンやPCで知らせることを重視しています。
まだスタートしたばかりだと思いますが検証の目的で様々な研究を進めているようです。たとえば、ASDと診断された子供を妊娠していた時の環境暴露についてアンケート調査がすでに行われています。実際2000人近い対象に回答をお願いしたところ、なんと60%ものお母さんが妊娠時に暴露された様々な物質に対する回答を寄せており、現在のところメンバーとSPARKの対話が維持できていることを伺わせます。
現在約2万家族の登録が集まっているようですが、参加者がコミットメントする気持ちを維持するためのノウハウの蓄積も貴重です。例えば、登録の意思はあっても、必要項目を完全に書き入れ、またインフォームドコンセントを終えるのは面倒なものです。どうしても時間がかかっていたこの作業を、ユーモアたっぷりにお願いするSNSのメッセージを流す事で登録が72%まで上昇したこと、あるいは遺伝子検査のサンプル提出を抽選でiPadを提供するというプログラムで、3割から6割にアップさせたことなどが紹介されています。今後新しく計画するウェブを用いたコホート研究には本当に貴重な情報になると思います。
感想
さすが民間助成ならではの、長期的視野を持ちながら柔軟な、未来型のコホート研究だと感銘を受けました。何事も官に頼ってしまう我が国では、願うべくもない取り組みですが、ASD研究に国境はありません。SPARKから生まれる様々な成果が、我が国のASD診療にも生かされることは間違いないと思います。個人的にはシモンズ財団ウォッチを続けて、面白い話があればまた紹介したいと思っています。
2019年8月22日
「目は口ほどに物を言う」と言われているように、瞳孔は私たちに様々な事を教えてくれます。医師が死亡診断を下す時、必ず瞳孔反射を調べるのがその例ですが、実際には私たちが見ているものに興味を持っているかどうか、どのように物を認識しているのかどうかなど、様々な事を知る科学的手段として使われています。例えば、言葉でのコミュニケーションが取れない赤ちゃんの場合、興味を示しているかどうかは瞳孔の大きさで判断します。
とすると、当然外界への関心が低下するASDでも瞳孔の反応に何らかの変化が起こると考えられます。実際そのような研究がこれまでも行われ、ASDの児童や成人では瞳孔反射が遅くなっていることが報告されています。
今日紹介する論文を発表したウプサラ大学のグループも同じようにASDリスクと瞳孔反射の関係に興味を持ち、乳児期という早い段階にASDのリスクを予測する手段として使えないか調べていたようです。そして、2015年に発表した論文で、家族歴からASDのリスクが高いと推定される10ヶ月齢の乳児では、児童や大人とは逆に、光に対する瞳孔反射が早いことを報告しています(Nystrom et al, Molecular Autism, 6:10, 2015 )。
しかしこの論文で調べられた乳児は、あくまでもASDリスクが高いと想定されるだけで、本当にASDが発症するかどうかは追跡しないとわかりません。そこで最初の研究で調べた乳児をASDと診断できる3歳児まで追跡したのが今日紹介したい論文です(Nystrom et
al, Enhanced pupillary light reflex in infancy is associated with autism
diagnosis in toddlerhood (乳児期の瞳孔反射の亢進は幼児期の自閉症診断と相関する)Nature
Communications 9:1678, 2018, DOI: 10.1038/s41467-018-03985-4)。
乳児が自然に行動している間に瞳孔反射を調べるのは簡単ではありません。この研究ではトビー社の視線追跡装置を用いて、自然状態で反射を繰り返し測定するのに成功しています。
最初の論文では、先に生まれた兄弟がASDと診断されている場合をハイリスク群、全くASDの家族歴がない群を通常群としてデータを比べ、ハイリスク群で瞳孔反射が高まっていることを報告していますが、この研究では147人のハイリスク群の中から3歳時でASDを発症した29人(20%)、ハイリスク群でもASDが発症しなかった118人、そして通常リスクで発症もなかった3群に分けています。
まず10ヶ月時の瞳孔反射をこの3群でプロットし直し、瞳孔反射とASD発症の相関を調べています。結果はシンプルで、ASDを発症した乳児は、ASDを発症しなかったハイリスク群の乳児と比べても瞳孔反射速度が高まっており、通常児と比べるとその差はさらにはっきりし、平均で20%ぐらい反射速度が上がっています。また瞳孔反射の数値は、2種類のASD診断指標を用いた重症度と正の相関を示します。そして、ASDの子供だけ発達に伴い瞳孔反射が大きく変化します。
もちろん他の臨床検査と同じで、実際には通常児とASDの間での検査値のオーバーラップは大きく、傾向は見られても、これだけで診断するとなると、かなりな異常値を示す乳児に限られるように思います。しかし、「瞳孔反射が高めで、次の年に変化が大きい場合は要注意」といった具合に一つの指標として使っていくことは可能だと思います。おそらく、個人差の原因を取り除いた検査の開発ができると、もっと正確な診断が可能になるかもしれません。
いずれにせよこの研究は、1)ASDという複雑な状態が、様々な神経活動の変化が総合された結果であること、2)ASDでは瞳孔反射のような感覚系の変化が強く見られること、3)このような変化は生まれた時には用意されており、発達を通して特徴的な状態が形成されること、を教えてくれます。
今後乳児期のこのような単純な反応がASD発症に関わるという発見を、現在進むMRIなどの脳構造研究と相関させることができると、ASDのメカニズム理解や診断に大きく貢献する予感がします。今後に期待したい研究です。
2019年8月22日
現役を退いてすでに5年を超えたが、分野を問わず論文を読んでいて実感するのが、自閉症スペクトラム(ASD)についての研究の進展だ。私が門外漢であるためより興味を惹かれることもあるが、最新のテクノロジーが集められて研究が進んでいる領域であることは間違いない。ただ、実際の治療に携わる医師や心理士、教育者は、なかなか最新の研究をフォローするだけの余裕がないと思う。そんな人たちにわかりやすく最近の研究を紹介したのが今日紹介する総説だ。もちろん、一般の研究者にとっても、あるいはASDの子供を持つ家族の方にとっても、神経科学から浮き上がってくるASDの輪郭を掴むには良い総説だと思い紹介することにした(Muhle et al, The emerging clinical neuroscience of autism spectrum disorder (新しく現れてきた自閉症スペクトラムの臨床神経科学) JAMA Psychiatry 75:514, 2018)。
ASDは症状も、原因も極めて多様な病気で、その数も米国では1-2%と驚くべき数に達している。重要なのは多様性にもかかわらずASDとしてまとめられる症状を共有していることだ。しかしこのことは、ASDと診断して満足してしまうと、多様性を見失い治療の可能性を失う事すらありうることを意味する。この総説では冒頭に16p11.2欠失症候群とASDの併発している症例を例にあげ、生物学的原因を丹念に調べれば、この遺伝的変化に認可されているリスペリドンやアリピプラゾールによる治療も可能であることを強調し、ASDの生物学についての知識を持つことの重要性を説いている。その上で、1)遺伝要因、2)環境要因、3)脳イメージング、4)疾患モデル、の各項目にわけ、最近の研究状況をまとめている。
1) 遺伝要因
一卵性双生児で発症の一致率が50-80%、兄弟では25%という数字は、ASDが多様であっても特定の遺伝子の組み合わせを反映した状態であることを示している。このため、遺伝的変異をゲノム全体について特定できる新しいゲノムテクノロジー(マイクロアレー、エクソーム解析、全ゲノム解析)に大きな期待が集まり、多くの研究が行われた。
この結果、数多くの神経機能に直接関わる分子や、その分子の発現に関わる分子の変異(点突然変異、欠失、重複)などがASDと相関していることがわかった。しかし、欠失など大きな遺伝子変異が200種類、一塩基レベルの小さな変異に至っては何百もの変異がASDと相関することがわかり、最初の期待は戸惑いに変わってしまった。すなわち、多くの遺伝病のように単純な分子レベルの因果性を構想することができない点だ。
このことは、ASDを遺伝性が高いが、分子メカニズムが多様である状態として理解する必要性を示唆している。すなわち、症状は同じでも、各人の遺伝的条件に応じて、その症状を考え、治療を計画する必要がある。とすると、ASDのゲノム検査の重要性は明らかで、てんかんや知能の低下がある場合はいうに及ばす、ASDの疑いがある場合はほぼ全員にゲノム検査が行われることが必要になる。
2) 環境要因
一卵性双生児の場合ですら必ずしも発症が一致しないことは、生前・生後の環境要因も無視できないことを示している。このすきまに、「はしかワクチンが自閉症を誘発する」というWakefieldの世紀の大捏造が生まれたわけだが、例えば早産でASDのリスクが高まることは統計学的に証明されており、このことは脳発生に影響を及ぼすあらゆる外的要因がASDの誘因になることを意味している。事実、科学的な疫学調査で、早産、低酸素、虚血、母親の肥満、糖尿など内的要因がASDリスクを高める ことが証明されている。
食品や環境に存在する化学物質のような外的要因のリストも膨大になっている。ただ神経細胞の発達に影響を持つことの明らかな薬剤を除くと、内因性の要因と比べて因果性の特定が難しく、細胞や動物レベルの研究で因果性を調べることが必要になる。
3) 脳のイメージング
MRIをはじめ様々な機器を使う脳イメージングのテクノロジーは急速に発展し、これまで測定が難しかった幼児でも検査が可能になっている。この結果、脳内の変化の多くが生まれる前の発達期に起こっていることがわかってきた。このおかげで、場合によっては6ヶ月という速さで診断する可能性も生まれている。
イメージング技術を使って明らかになった最も重要な発見は、ASDの子供は生後6ヶ月から12ヶ月にかけて脳皮質が拡大することで、シナプスの剪定の低下などが議論されているが、解釈のためには研究が必要だ。同じように、2-4歳までの発達期でも、扁桃体をはじめ社会性に関わる様々な脳領域が大きくなる一方、各領域の間の結合性は逆に低下する場合が多い。これとは逆に、皮質下の神経結合は高まっているという報告があり、総合すると脳の局所的な回路が高まる一方、広い領域を統合する回路の結合性が低下するのがASDの特徴ではないかと考えられている。
しかし、これらの検査でASDを他の病気から区別して診断できるかというと、脳の構造の多様性は大きく、イメージングだけで診断するのはまだ難しいことも現実だ。
4) 疾患モデル
コンピュータで病気を再構成するインシリコのバーチャルモデルから試験管内の細胞を用いるモデルまで、様々なASDモデルが開発されてきた。特に遺伝的要因によるASDモデル動物は、脆弱性X、Rett症候群、MECP2重複症など多くが作成され、研究に用いられている。最近では、MECP2欠損のサルのモデルも開発され、より人間に近い動物での研究に期待が集まっている。
もちろんASDを多様な症状の集まりとして考える場合、それぞれの症状に対応する動物モデルはマウスであっても十分役に立つ。特に、薬剤や遺伝子治療の可能性を試すときには動物モデルは必須で、「動物の脳は人の脳とは異なる」と片付けず、地道にモデルを開発する努力が必要だと思う。
もう一つ重要な領域は、情報科学分野を用いた疾患モデル研究で、遺伝子データと、症状や、イメージング、さらにはiPS由来の神経細胞反応性などを統合した人工知能を開発すべく、研究が加速している。
以上がこの総説の内容だが、最終的メッセージは、Kannerが自閉症を定義した時代には考えられなかった、ASDの生物学が急速に進んでいることに尽きる。そして、ゲノム診断や、イメージング解析など、新しい展開に即応した検査を行うことが、将来の治療法開発につながる。
この総説に書かれていることは、自閉症についての個々の論文として、これまでなんども紹介してきたが、この総説は本当によくまとまっているので、この分野に関わる方にぜひ読んでほしい。
2019年8月22日
今日のタイトルを見て、「自閉症と考古学?」と驚かれる読者も多いと思います。私も、Penny Spikinsさんの本や論文を読むまで、考古学と自閉症が関係するなんて考えたこともありませんでした。
Penny Spikinsさんは現在ヨーク大学考古学の講師で、石器時代の遺物から人間の優しさや道徳性といった「美しい心の存在」を読み解くという、大変ユニークな研究にチャレンジしています。私自身は、最初彼女が2015年に出版した「How compassion made us human(どのように思いやりの心が私たちを人間にしたのか?)」という著書を読んで以来、彼女の考えに魅せられました。
最近彼女は、現代の自閉症スペクトラム(ASD)の人たちを、石器時代の遺物を通して考える研究を精力的に行なっています。2016年にTime and Mindに掲載された論文では 、自閉症をneurodiversity(神経の多様性)と捉える現代の主流となった考え方をさらに進めて、自閉症傾向こそ人類の進化に欠かせない重要な性質として積極的に捉えるべきだという主張を展開しています。
これについて紹介した私のブログを引用しておきましょう。
「なぜ社会性に問題があるとされる自閉症が、今も淘汰されず1-2%という高い頻度で存在しているのか?」という問いに対して、「共同的道徳性の誕生が人類進化の必要条件だが、これには多様な人材を擁することが重要になる。自閉症的傾向を持つ人材は、一つのタイプとして社会に必要とされ、また尊敬されたとしても、進化で淘汰されることはなかった」という答えが結論になっている。
Spikinsさんの新しい論文
そのSpikinsさんが年一回発行されるオープンアクセスの雑誌Open Archeologyに、またまた意欲的な論文を発表したので、自閉症の科学7として紹介することにしました(Spikins et
al, How Do We Explain Autistic Traits in European Upper Palaeolithic Art(ヨーロッパの旧石器時代の美術に見られる自閉症的特徴をどう説明すればいいのか)Open Archaeology 4: 262-279,
2018 )。
ほとんど同じ内容が、彼女が最近ウェッブに発表した新しいオンラインブック「Prehistory of Autism(自閉症の先史学)」 にさらに詳しく述べられているので、併せて紹介しておきます
研究の概要
多くの自閉症児は社会性が低下しているためどうしても言葉の発達が遅れることが多いのですが、知能は正常な場合が大半です。なかには、以前アスペルガー症候群と診断されていた、様々な分野で高い能力を発揮する人たちもいます。例えば、一度見た景色をはっきりと記憶し、絵として正確に描くことができる人がいます(有名なStephen Wiltshireの絵が紹介されているサイトをご覧ください )。この高い視覚認知能力を持つ子供については多くの研究が行われてきましたが、Drake& WinnerのScientific Americanに発表した論文で紹介されているASDの子供たちの絵を見ると、たしかにこの子供たちは世界を違う目で見る能力を持っているのがよくわかります(Mind Scientific American Special edition, Spring 2017)。
特殊な例の話と思われるかもしれません。しかし、Block designやFigure Disembeddingと呼ばれる(説明は省きます)視覚テストで調べると、明らかに自閉症児のほうが一般児より優れていることを示す報告があります(J.Autism Dev. Disord 44:3245, 2014)。間違いなく、ASDの人たちは、一般人には出来ない世界の見方をしているようです。
さてSpikinsさんの新しい論文では、ASDの人たちが示す特殊な視覚認知能力の背景には、local processing bias (部分的情報処理バイアス:LPB)とよばれる、全体にとらわれることなく細部を表現する能力があると分析しています。この能力は決してASDに限られるわけではないのですが、ASDを多くの遺伝子が関わる一つの状態と捉えると、ASDの人たちにLPBを支える遺伝子プールがより多く集まっていると言っていいでしょう。
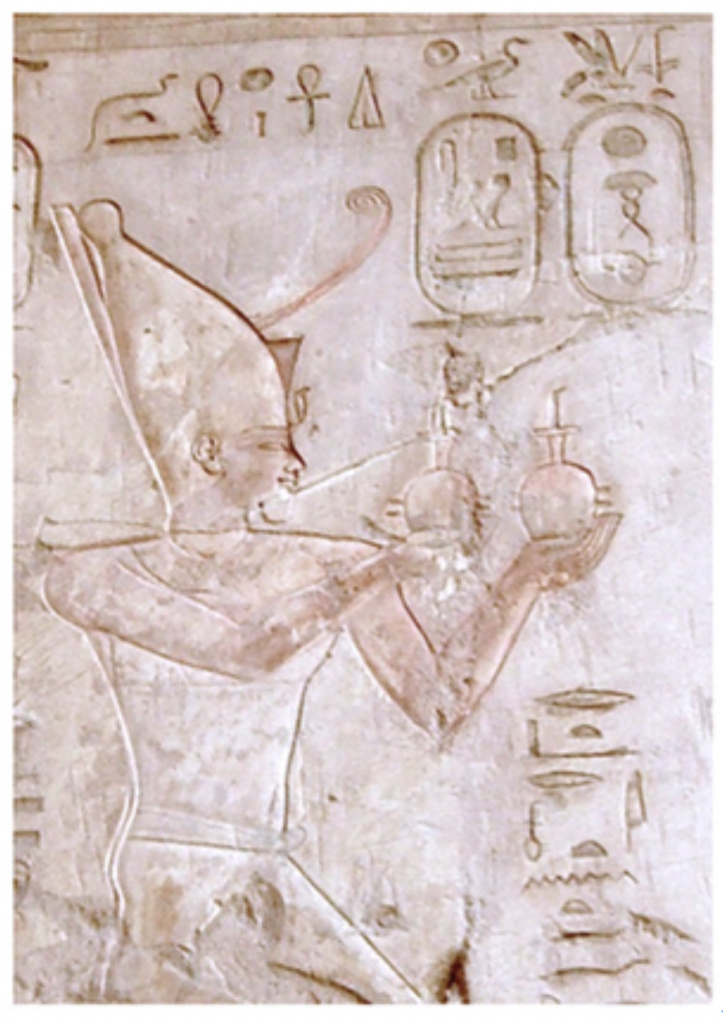
ASDの人の絵には一般人にはない高い空間認識能力に基づくリアリズムが現れていることを確認した上で、Spikinsさんは次にフランス・ショーべ洞窟で発見された世界最古の壁画や(冒頭の写真に示した)、ドイツ・シュターデル洞窟で発見されたライオンマン のフィギャーのように、現代から見てもリアリズムの粋と言える作品は、誰が作成したのかと問います。
彼女にとって、答えは明白です。壁画やフィギャーに現れるリアリズム、すなわちlocal processing biasの強い作品は決して旧石器時代の人類一般の特徴ではなく、特殊な能力を支える遺伝子プールを持っていた一部の人に限られいたと考えています。そして、この能力を支える遺伝子プールが、ASDの人たちにより強く受け継がれ、ASDの人たちが示す優れた表現能力に結実しているというわけです。
現代のASDと3万年以上前の石器時代のアートを比べるというとてつもない発想ですが、言われてみると高い説得力があります。そしてこの結果は、人類進化の早い時期から脳に生まれたneurodiversity(多様性)を大事に育む思いやりこそが、人類成功のカギだったことを示しています。
ASDがもつ能力を理解しつつも、社会への適応性の欠如を理由に、アスペルガーやナチスは子供たちを排除しました。それに対しSpikinsさんは、ASDの持つ可能性をもっと発掘し、石器時代の人類が行ったように、ASDの能力を活かせる社会を作ることこそ、21世紀の目指すべき社会だと主張しています。これからも頑張ってほしい研究者だと期待しています。
2019年8月22日
おそらく人類誕生以来、人間は戦争を繰り返してきた。確かに、未開民族の研究では、多くの戦争は相手を殲滅させる全面戦争というより、できるだけ生命の犠牲が少ない形で白黒をつける儀式と考えられているが、数千年前、帝国が誕生し国家間の戦争が始まると、全面戦争が普通になっていったことは、多くの資料が物語っている。
この生存を重視する自制に基づく限定戦争から、全面戦争への転換がいつ起こったのか、それぞれの文化や民族が持つ国家観によるところが大きいが、マヤ文化では9−10世紀の古典時代の終期以前には、集団の間で争っても、全面戦争を防ぐ合意が存在していたと考えられてきた。
ところが最近米国地質学研究所のグループは、マヤ文明でも7世紀にはすでに相手を殲滅する目的の全面戦争が行われていたことを碑文と発掘資料から明らかにしNature Human Behaviourに発表した (Wahl et al, Palaeoenvironmental, epigraphic and archaeological evidence of total warfare among the Classic Maya , Nature Human Behaviour :https://doi.org/10.1038/s41562-019-0671-x )。
全て詳細は省くが、この研究では碑文に書かれた「(西暦に換算して)696年5月21日にがWitznaがPuluuy(燃え尽きた)」という表現が、どの程度の破壊であったのかを、Witzna近くの湖の炭素沈殿物から推察している。
結果は碑文と一致して、400年から650年まで何回か大きな火事が起こったこと、650年に最大の火事が起こって、その後人間の活動がこの地域からほとんど消滅したことを発見している。
この結果は、Puluuyという単語が、単純な火事を指すのではなく、全面戦争という意味を持っており、650年の戦争で、その地域は人間が生活できないところまで完全に破壊されたことを物語っている。
これまでマヤ古代文明では、わが国と同じでその地域の支配者やその一族が犠牲になることで、戦争は終わると考えられてきたが、そうではなかったという結論だ。
これと比較すると、わが国で多くの争いを終わらせた切腹という儀式がいかに人道的なものであったのかよく理解できるが、ひょっとしたらこの背景には、天皇という、独立した国家観が君臨していたおかげかも知れない。
2019年8月22日
年をとると頭が固くなるとよく言われるが、機能を支える脳組織までが固くなっているとは、今日紹介するケンブリッジ大学幹細胞研究所からの論文を読むまで想像だにしなかった。タイトルは「Niche stiffness underlies the ageing of central nervous system
progenitor cells (ニッチが固くなることが神経前駆細胞の老化の背景にある)」だ。
もともと著者らはOPCと呼ばれる脳に存在する多能性の幹細胞の老化について研究していた様だ。新生児と老化マウスから採取したOPCを通常の条件で培養すると、たしかに老化OPCの増殖は遅い。ただ、この性質が老化した脳という環境によって誘導された結果なのか、OPC自体の老化なのかを調べるために、老化OPCを新生児の脳に移植すると、若返って増殖能を回復することを発見する。すなわち、脳の環境が違っている。
このニッチによるOPCの老化の分子メカニズムを探るべく、老化脳と新生児脳の組織から全て細胞を取り除き、マトリックスだけにしてOPCを培養すると、ニッチは細胞ではなく、マトリックスにより形成されていること、そして実際にはマトリックスが硬いとOPCの老化が進むことを、コンドロイチナーゼでマトリックスを分解して柔らかくする実験で確かめる。すなわち、老化マトリックスも酵素処理で柔らかくすると、老化OPCが若返る。
そこで、ただOPCを培養する基質の硬さを変えるだけで同じことが起こるかどうか、硬さの違うハイドロゲルの上でOPCを培養すると、柔らかいハイドロゲルの上で培養した老化OPCが若返る一方、硬いハイドロゲルの上で培養した新生児OPCが老化することを発見する。
ここまでくると、細胞が硬さを認識するメカニズムが老化を決めていると想像できるので、メカノセンサー分子PIEZO1に焦点を絞って研究を行い、老化OPC ではPIEZO1の発現が高まっていることを確認し、さらにこのセンサーの発現を落とすと、老化した環境でもOPCの増殖が維持できることを明らかにする。
最後に老化マウスの脳内のPIEZO1をCRISPRシステムを利用して発現量を落とすと、増殖が高まり、さらにミエリンの再生能も高まることを明らかにし、老化によって固くなった頭を認識している機構がOPC上のPIEZOであることを明らかにする。
最後に、PIEZOの正常での機能を確かめる目的で、この分子を新生児期にノックダウンすると、OPCの数が5倍に増えることがわかり、この分子がOPCの脳内での数を決める分子であると確認している。
話はこれだけで、PIEZOが上昇するのが、頭が固くなった結果なのかがはっきりしない点は問題だが、文字通り頭が固いことについての研究だと思うと、面白い。
2019年8月21日
胆石はビリルビンとコレステロールが混ざり合って胆嚢のなかで結晶化することで起こる。胆嚢内に存在するだけでは問題ないのだが、胆汁の流れを止めると炎症を起こして痛みの発作をおこす。脂肪の摂取が増えて、コレステロールが析出しやすくなったために、引き金が引かれるのだろうと漠然と考えていたが、厳密にいうと、何が胆石の核になって結晶化の引き金を引くのかはよくわかっていなかった様だ。
今日紹介するドイツ のフリードリッヒ アレキサンダー大学からの論文は、胆石の結晶化の引き金になるのが白血球のDNAであることを示した研究でImmunityのオンライン版に掲載された。タイトルは「Neutrophil Extracellular Traps Initiate Gallstone Formation(好中球の細胞外分泌物が胆石形成を開始させる)」だ。
このグループは胆石形成の核になる物質を探す目的で、胆汁の中の小さな沈殿物を調べ、その中にDNAと好中球のエラスターゼが存在することを発見、また好中球の存在下に胆石を加えるとエラスターゼが吸着すること、そして好中球のDNAトラップがコレステロールとカルシウムの凝集を促進することを調べ、胆石形成の最初の過程に好中球が関わると結論した。
この発見がまさにこの研究のハイライトで、あとは好中球がどの様にコレステロールなどの胆石の成分を集めて胆石を形成するのかを順を追って調べている。詳細を省いて結論をまとめると次の様になる。
コレステロールが析出してできた結晶と好中球とが触れると、マクロピノサイトーシスと呼ばれる過程が誘導され、結晶が細胞内に取り込まれ、これにより活性酸素が誘導され、またリソゾームからカテプシンなどの酵素が細胞質に漏れて、クロマチンを破壊、粘着性のDNAが組織に発生し、これがコレステロールとカルシウムの凝集を誘導して胆石が形成されることを示している。そして、それぞれの過程を遺伝的、あるいは薬剤で阻害すると、この発生を抑制して、胆石を抑えることができる。
話はこれだけだが、マウスモデルでこの過程に関わるaruginin deaminaseを抑制すると、胆石形成を抑制できることも示しており、さらにすでにできている胆石の成長を遅らせることができることも示している。その意味で単純だが、根本治療が開発されることも期待できる面白い仕事だと思った。ただ、どうしてImmunityに掲載されるのか、それは謎だ。
2019年8月20日
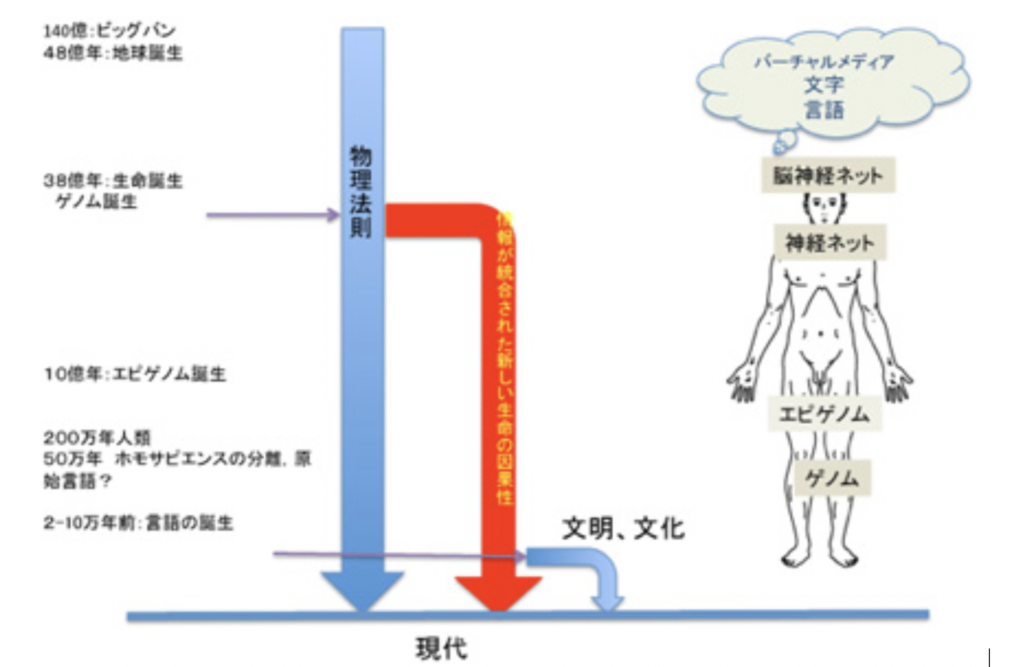
言語の起源 I
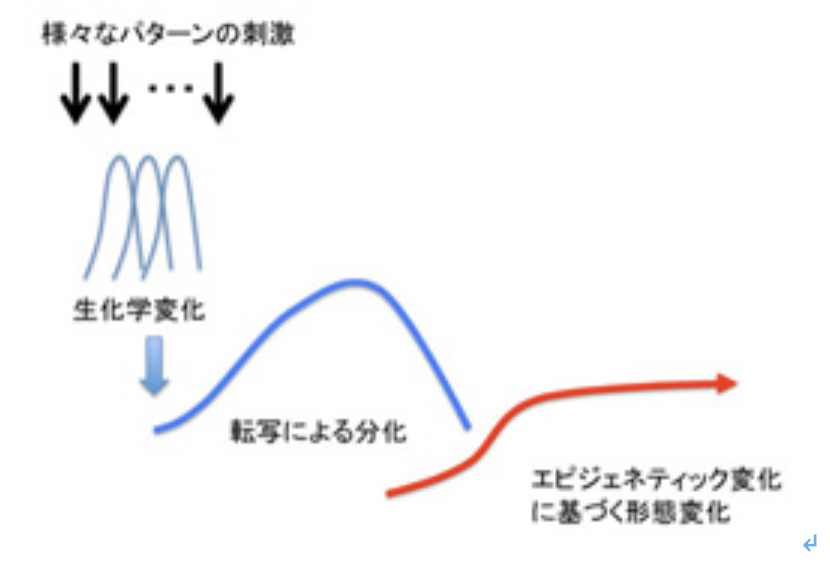
図1:人間には様々な情報がかたまって存在している。説明文中
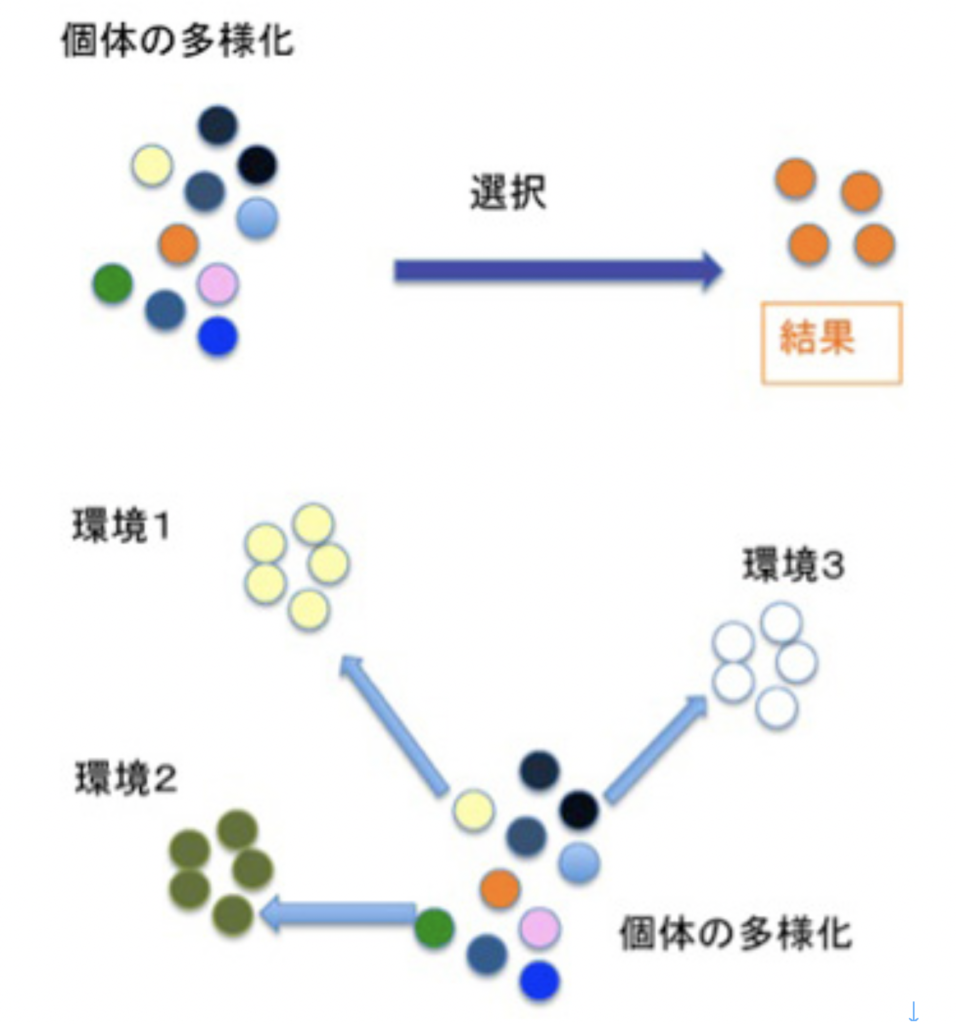
図2:環境が限られると、自然選択によって生物多様性は減じると考えられる(上段)。しかし、自分のゲノムにフィットする新しい環境を求めて移動できれば、当然個体の多様化に応じて種も多様化できる(下段)。
図3:言語情報の生物学的研究の困難
チョムスキーから始めよう
図1 出典:wikipedia
チョムスキーらの最近の論文
図2 今回紹介する2012年に書かれた総説
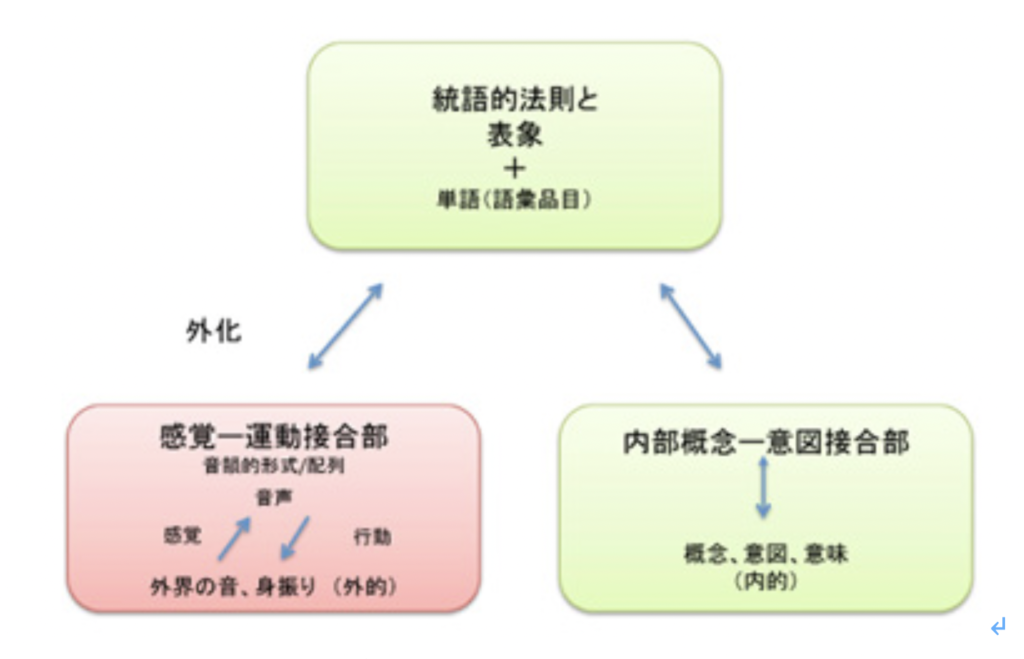
図3 総説の図1を改変して再掲している。内容は本文参照。
脳に普遍文法を探る
図3を確かめる実験
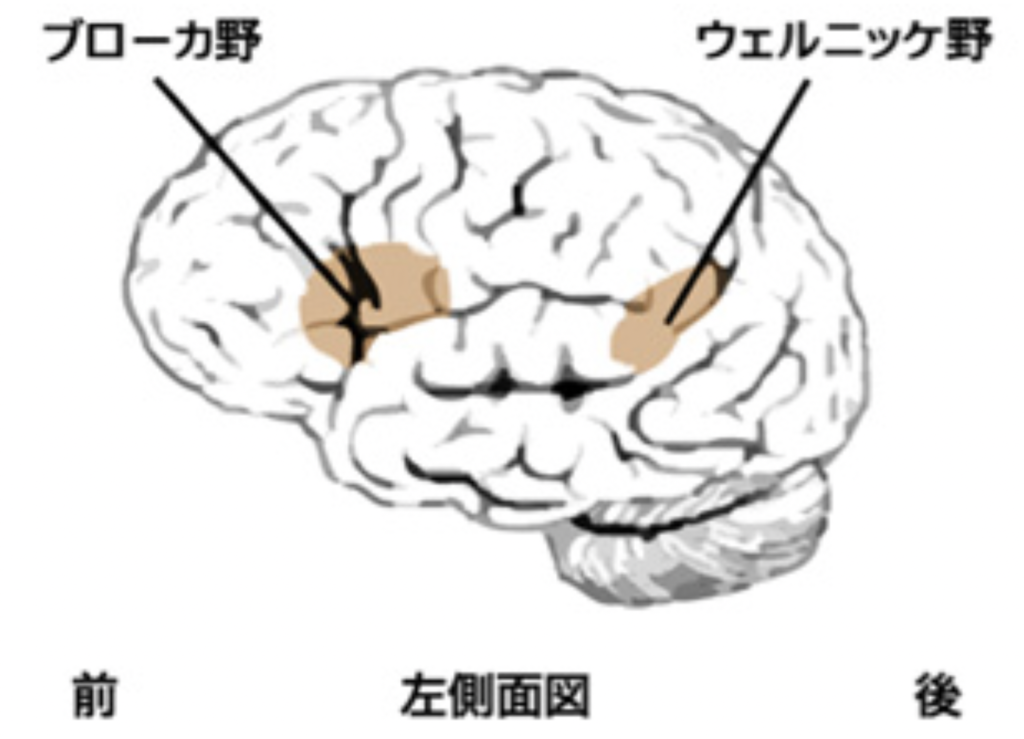
図4 ブローカ領域のウェルニッケ領域の脳内での位置。失語症の研究から、ブローカ領域に障害が起こると文法的に整った文章の発話が困難になる。一方ウェルニッケ領域が障害されると、言葉を聞いて理解するのが困難になる。ただ実際にはもっと複雑で、改めて紹介する。
1)言語能力の進化と人類学、
2)チョムスキーは言語が進化するのではなく、言語能力が進化すると明快に断じているが、本当に言語自体は進化しないのか?
道具と言葉
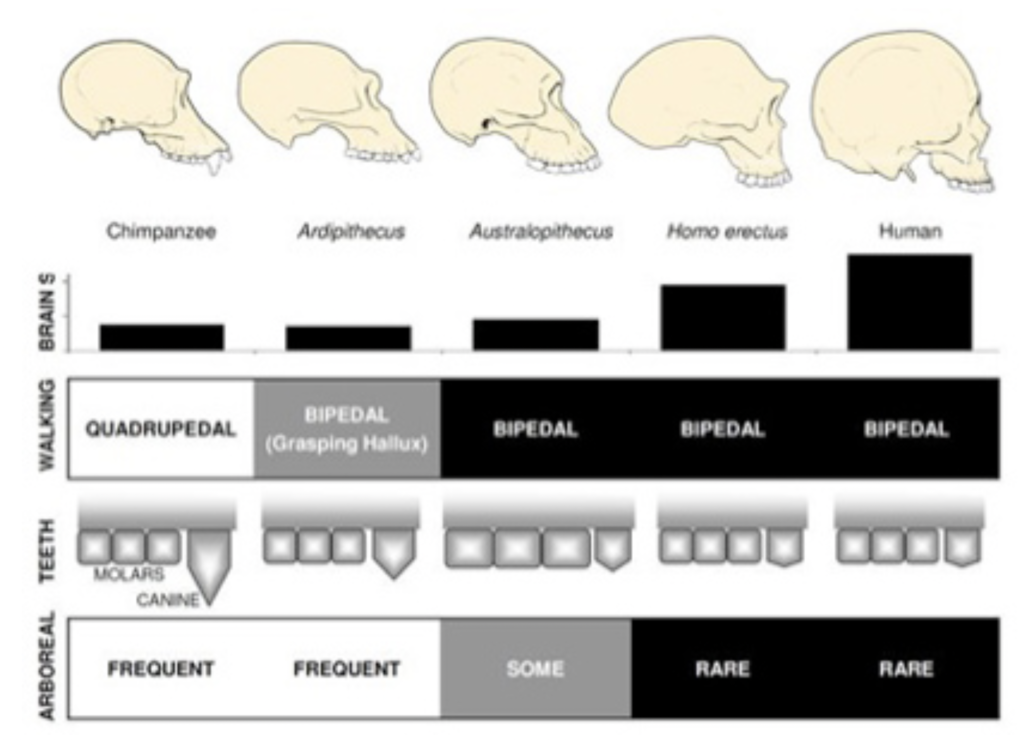
図1 チンパンジーから現代人までの頭蓋、脳容積、歩行様式、歯、樹上生活の変化。石器が見つかるアウストラロピテクスから急速に犬歯が退化する。肉を道具で切り分ける社会が生まれ、個体間の関係も大きく変化した。その意味で、一夫一婦制も石器による起こった変化だとすら考えられる。(Nature Knowledge Project, Pontzer et al, Overview of hominin evokutionより引用:https://www.nature.com/scitable/knowledge/library/overview-of-hominin-evolution-89010983)
https://www.youtube.com/watch?v=ZOUyrtWeW4Q )。
http://www.nature.com/nature/journal/v537/n7620/abs/nature19103.html )),この小枝を使う行動がカラスに生まれつき備わった遺伝的なものか、あるいは学習により獲得されるものかを調べる目的で、7羽のカラスを道具を使う他の個体から隔離した環境でヒナから育て、教えなくても道具を使うようになるかを調べている。結論は明確で、全てのカラスが他の個体から習うことなく、道具を使えるようになるという結果だ。
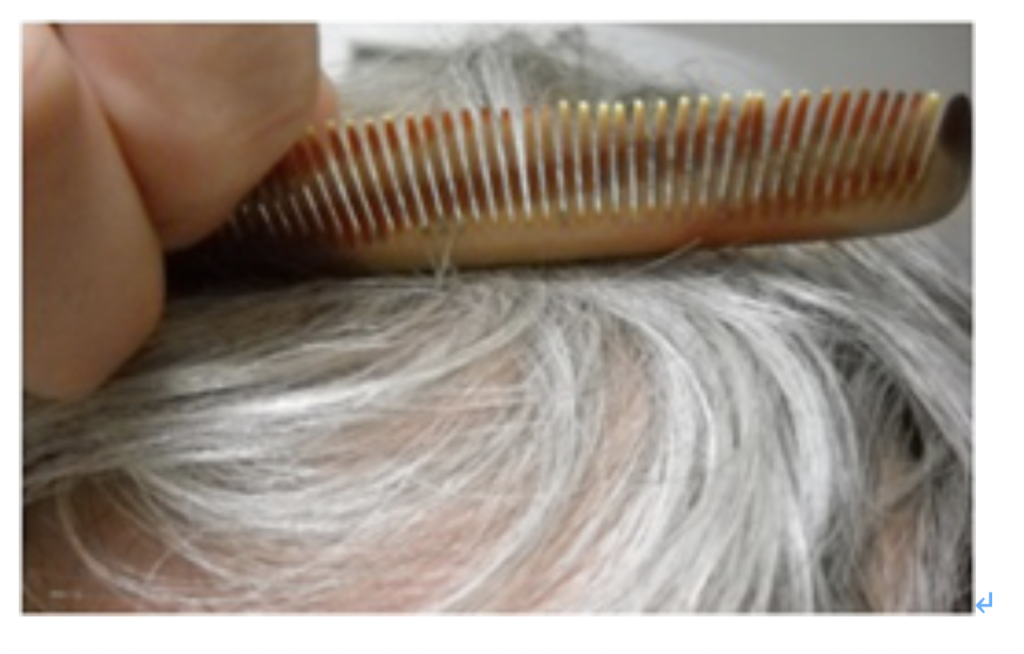
図2 失行症の患者さんが櫛を逆さまに向けて使おうとしているところ(出典:Wikipedia)
音楽と言語
図1 引用元、説明などは本文参照
図2 最古の楽器。(出典:Wikipedia)
図3 Steven Mithen著『The Singing Neanderthals』のカバー。
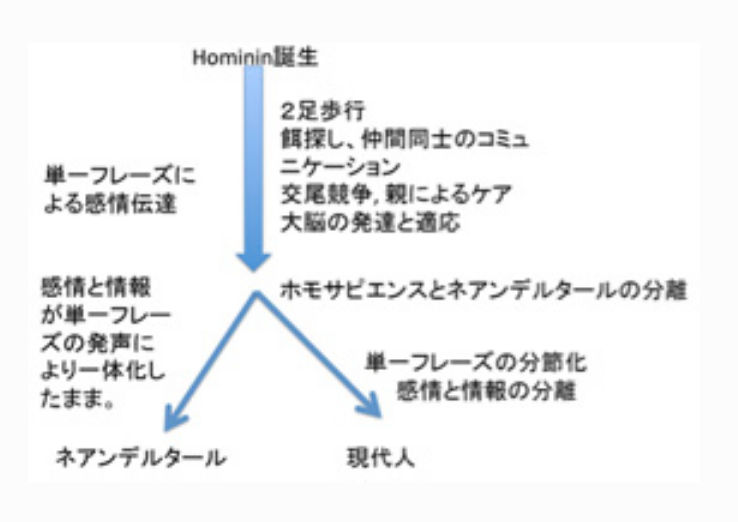
図4 Steven Mithenの提案する言語発生に至る過程
https://www.youtube.com/watch?v=JLOn8F0p96s 参照)。そして伝達できるものは感情と一体化した情報だけだ。例えば、乳児と母親とのコミュニケーションを見てみれば、そこで行われている伝達が、専ら感情の伝達に限られているのがわかる。そしてこのために生まれるのが、彼がholistic languageとよぶ、一つのシラブルで伝えたいことの全てを表現する言葉だ。赤ちゃん言葉を例として説明すると、母親の乳房を求めて「mamama」と声を発した赤ちゃんに、お母さんもそれに合わせた赤ちゃん語で答えているとき使っている言葉がholistic languageになる。
言語の二重構造
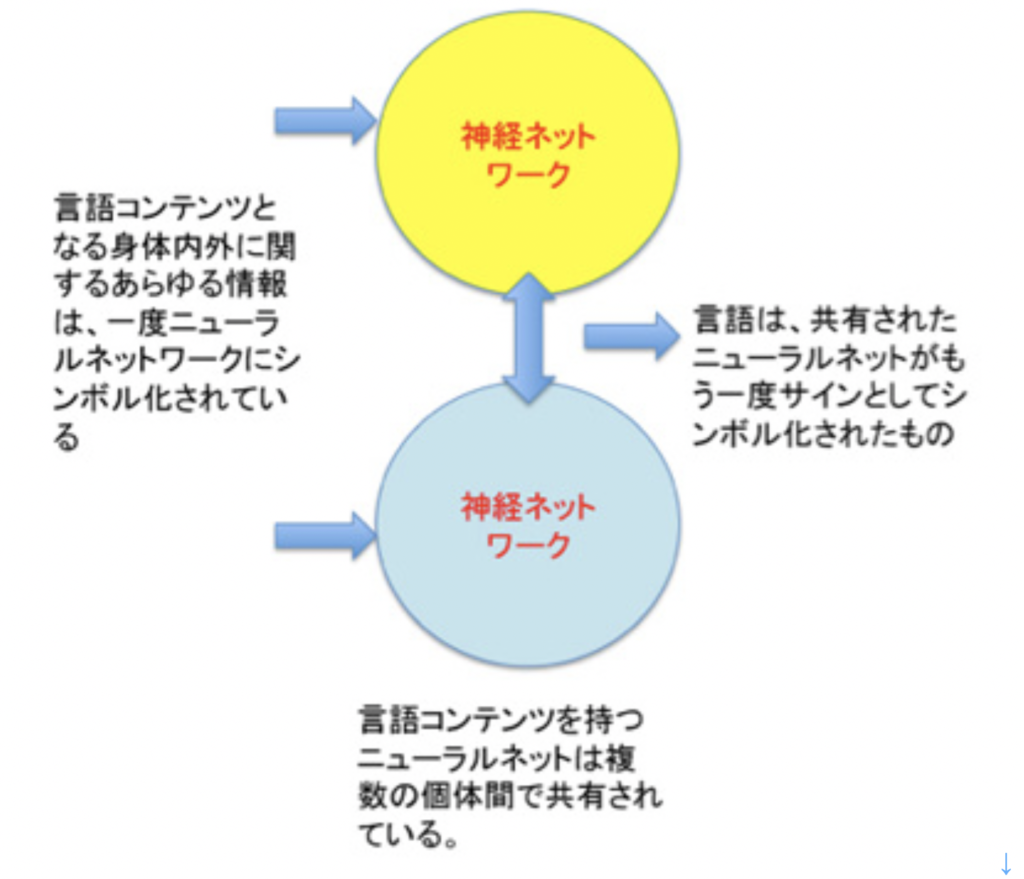
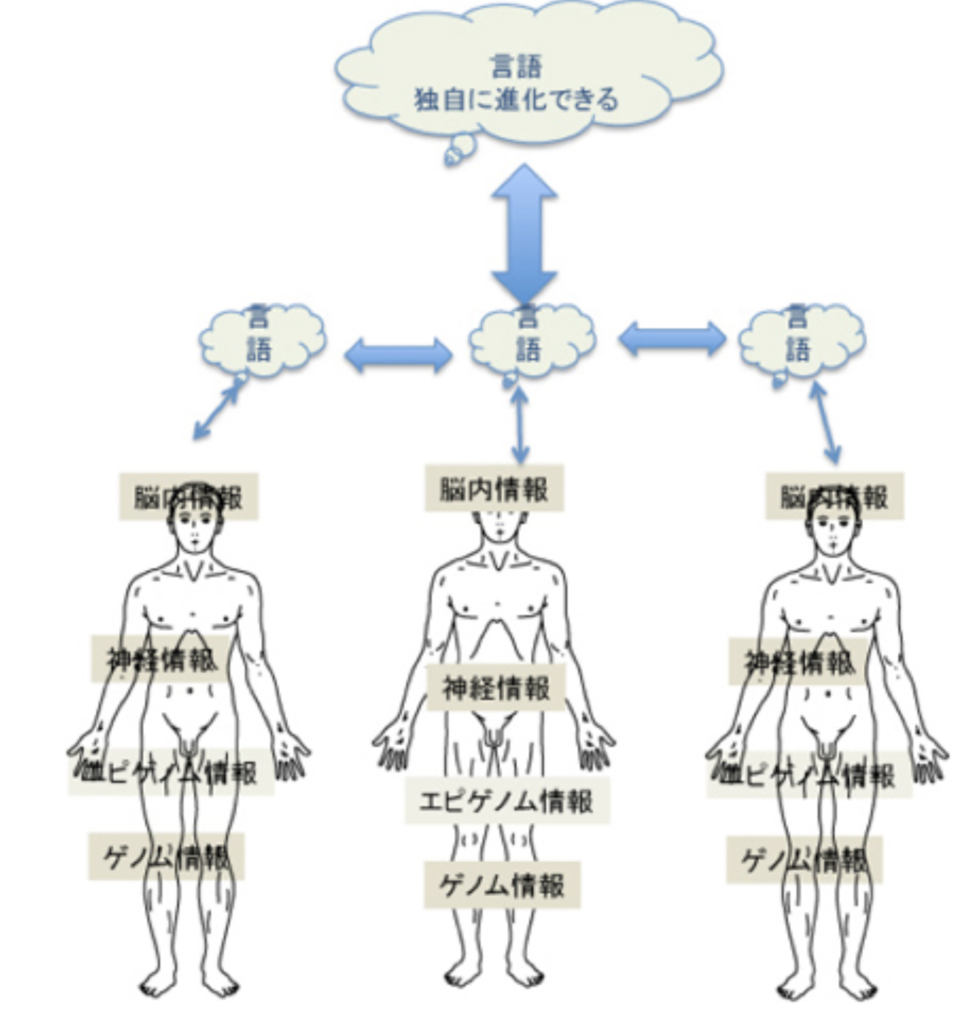
図1 言語以外の情報(この図ではゲノム、エピゲノム、神経情報を挙げている)は全て身体に拘束されており、身体とともに消滅する運命にある。言語も最初は脳内の活動の一つとして生まれるが、コミュニケーションのために発達し、複数(社会)で共有できる部分を形成したおかげで、この部分は個人の身体から独立した体系として成立できている。この体系は、常に変化しており新しくなっている。生まれてきた人間は、この新しい体系を習得する必要がある。従って、個々の個人から独立した体系自体も、私たちの脳とは無関係に存在するわけではなく、一生を通して学習され、また共通部分に一部がフィードバックされるという関係を保っている。おそらくこの言語の2重構造が、クオリアといった主観と客観の2元論の背景にある。個人から独立し、社会で共有できる言語の体系は現代文明のルーツで、今やその成果としてのゲノムプロジェクトを介して、本来なら身体に拘束されているゲノムやエピゲノムを身体から離して保存することに成功している。
図2:Mithenの考え方に従った言語発生の2段階。
https://www.youtube.com/watch?v=hEzT-85gEdA )、それを聞いた仲間を適切な場所に逃がすためのmanipulative callの典型例だ。この鳴き声は一見ワシ、ヒョウと特定の危険の原因を参照(referential)しているように見えるが、声が単語として特定の動物を表象しているかどうかはかなり疑問だ。実際には、「空から危険が迫っているので地下に潜れ」のような、一言で全てを命令するholisticな内容を持つ鳴き声と言える。同じように、赤ちゃんの発声も「お腹が減った、おっぱいが欲しい」のようにひとつのフレーズが分節されないで表現されるholisticな言語だ。
言語・社会性・Theory of Mind
図1:米国疾病予防管理センターから出ている、発達障害早期発見のためのチェックリスト。
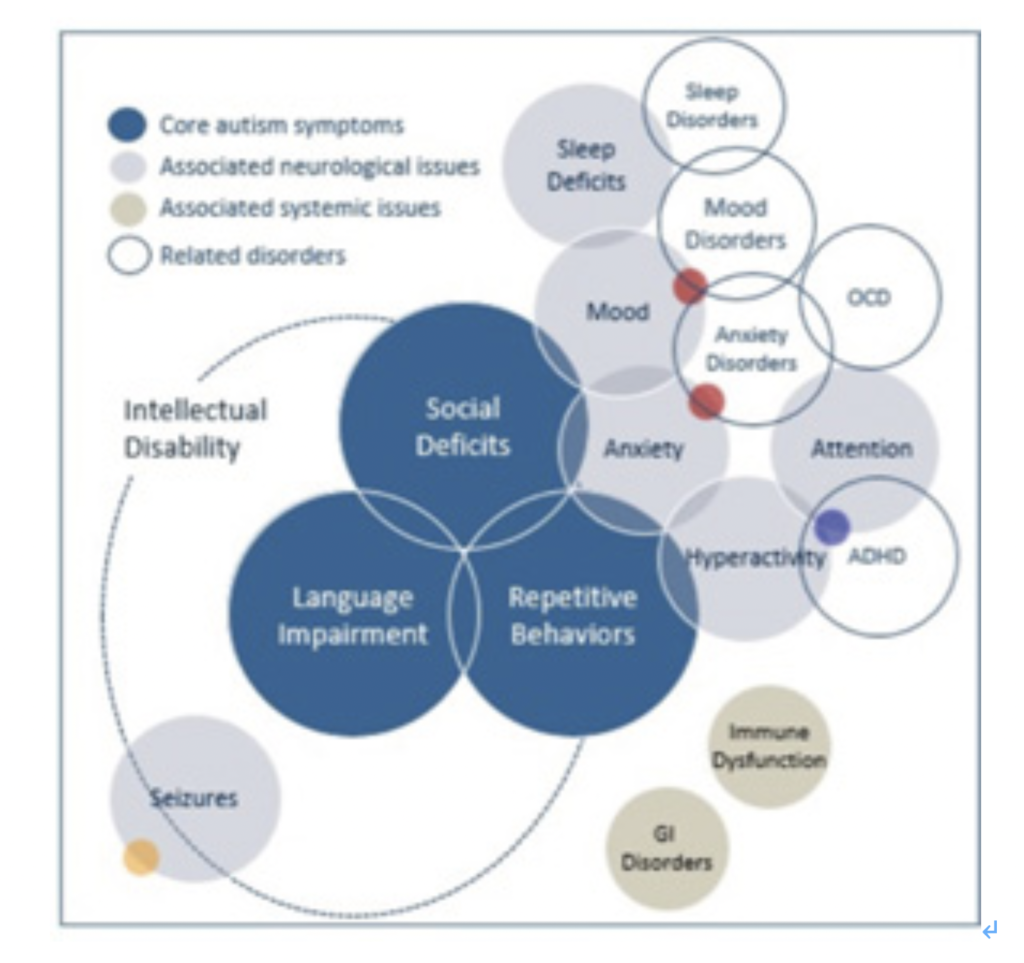
図2:自閉症最大の患者さん支援団体Autism Speaksが示している自閉症の主要症状と、他の様々な異常との関係を描いた図。
1)ボールはどこにあるでしょうか? 2)サリーはどこにボールがあると思っていますか? 図3:ToMの能力を知るための定番都なっているサリーとアンのテスト。フランス語版Wikipediaの図を改変して示している。
https://www.youtube.com/watch?v=1s0dO_h7q7Q )。
言語の発達と社会性 II
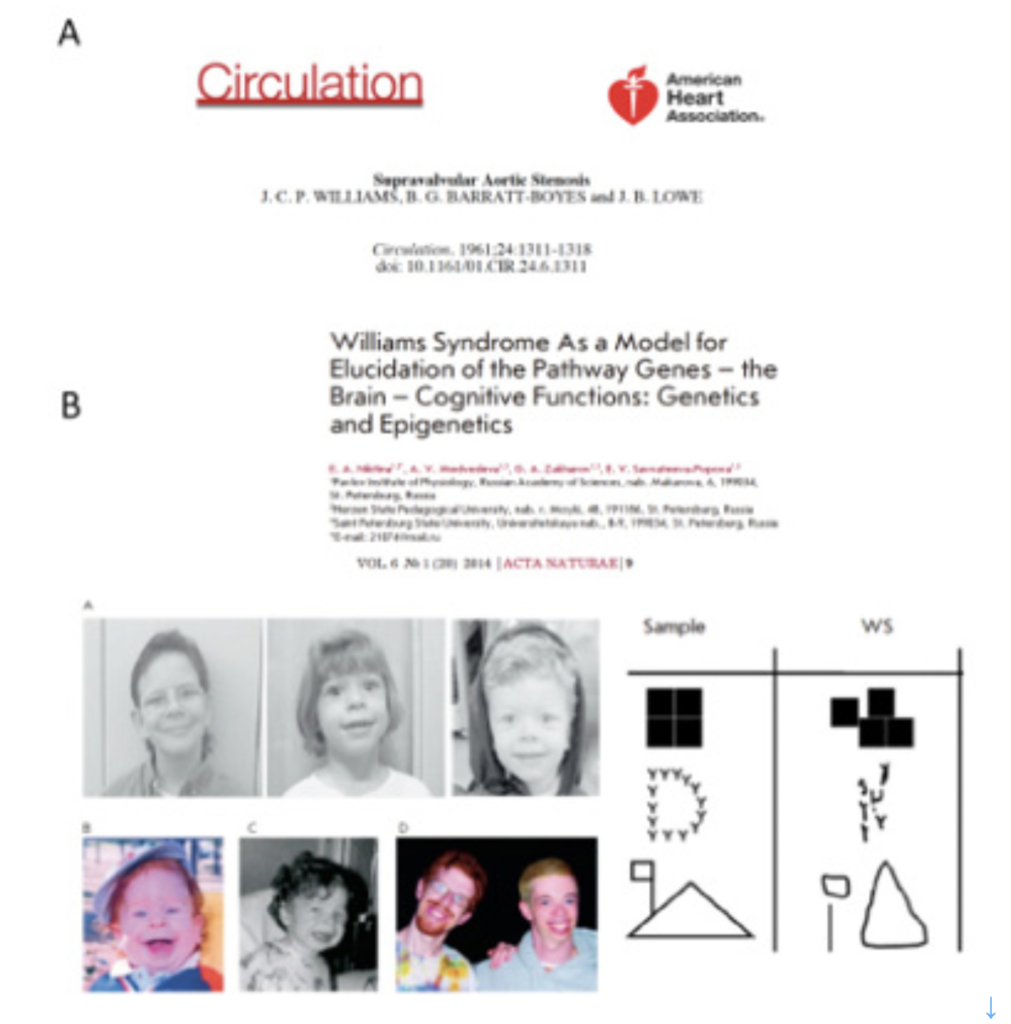
図1 A) Williams症候群が初めて疾患として定義されたCirculation の論文。 B) Creative Commonsとして登録されているNikitina等がActa Naturaeに掲載した総説論文。写真は全てこの論文から転載している。右端には、WSの子供による手本になる絵の模写を示している。一つ一つのアイテムは認識できても、その空間的位置関係の理解が失われているのがわかる。(Nikitina et al, Acta Naturae, 6,9, 2014)
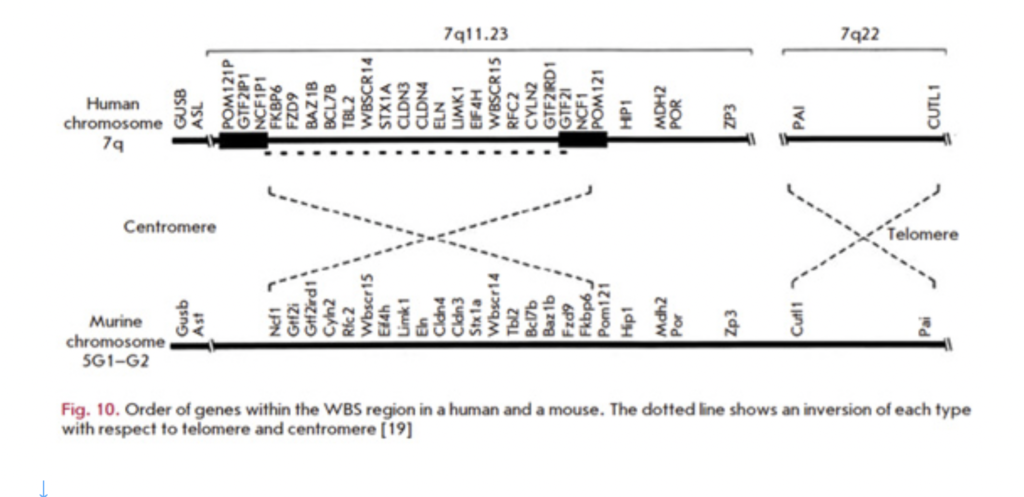
図2:7q11.23上にあるWSで欠損する領域(破線で欠損部分を示している)と、対応するマウスゲノム領域。NIkitinaの総説から転載。
図3 WSで欠損する遺伝子のマウスでの機能。
図4:犬とオオカミを比べて、犬の社交性に関わる遺伝子がWSで欠損している遺伝子であることを示した論文(vonHolt et al, Science Advances e1700398, 2017)。
1)言葉の理解や発達は遅れる(これはIQが60前後であることを考えると当然と思える)。 2)赤ちゃん言葉やジェスチャーなど、外へ働きかける行動の発達は正常で遅れはない。 3)遅れて始まっても、言語の発達は急速で、特に流暢に言葉を使う。 4)ボキャブラリー、特に感覚と直接対応できる単語の記憶は普通の子供より優れている。 5)話し言葉の文法についてはおおよそ一般児と同じだが、ラテン系の屈折語で単語の性の区別が上手くできないなど、苦手な部分も存在する。
言語と社会性 III
プサメティコス王の禁じられた実験
図1ミルクを作るプサメティコス1世のレリーフ(出典:Wikipedia)
野生児
図2インドで発見された野生児Kamala。最終的には2本足で立ち、普通の食事をするようになったが、単語は50語を覚えるのがやっとだったとされている。(出典:Wikipedia)
図3:動物に育てられた子供についての本は数多く出版されている。他にも、親のネグレクトで社会から隔離された育ったGenieについてのノンフィクションも読むことができる。(出典:Amazon.co.jp)
ろうあ者とSign Language(手話)
ニカラグアの手話
1)ろうあ者が単独で健常者の中で生活する限り体系的な手話は生まれる確率が低いこと、 2)しかし一定の数のろうあ者が集まると、それ以前には存在しなかった体系的な手話が発生すること、 3)おそらく最初は1−2語からなる叫びのような発話とほとんど区別できない構造を持った言語でも、異なる個体で使われるシンボルの意味が共有されると(すなわち社会共有部分が発生すると)、あとは使用するメンバーの増加に応じて、進化を遂げ体系的な言語になること、 図4: 見ると払うの文法的変化を体の向きを変えることで加えている例。このような新しいルールは一旦発生すると、瞬く間に全体で共有されるようになる。(Senghas and Coppola, Children creating language, Psychological Science, 12:323, 2001に掲載されている図。出典:Wikipedia)
情報としての言語
1、情報は受け手で決まる
2、情報は物質ではないが、働くために情報媒体(物質)が必要
図1 クロードシャノンと、彼の課題をまとめた図
3、情報は生物とともに地球上に生まれた
4、DNAと言語の比較
図2 言語とDNAを媒体とした情報の比較
5、DNAも言語も、媒介する情報は部分と全体が常に一体化している。
図3 メタボリックマップと、分子ネットワーク
もともと生物学では、一つの遺伝子にコードされている分子も、大きなネットワークの中で様々な分子と関係を持って存在するとして研究が行われてきた。例えば、ある分子が加わる代謝マップに存在しないということすら情報になる。(Wiki Commonsより)
図3に代謝マップと、分子ネットワークの例を示したが、情報媒体としてのDNAから学ぶことができるもう一つの重要な点は、一つの情報は決してそれ自身で存在していないことだ。これまで、生命の情報を扱ってきた分子生物学は、どうしても個々の遺伝子に焦点を絞って研究してきた。このため、ともするとDNA媒体により表現されている情報が、特定のタンパク質についての情報であると思ってしまう。しかし、研究対象に選んだ遺伝子が一種類のタンパク質だけをコードしているとしても、その分子は生物の中で他の分子と直接結合するだけでなく、多くの分子と直接間接に相互作用を行っている。すなわち、一つの分子の情報の背景にはその分子だけでなく、多くの過程が背景として存在している。更にある細胞にこの分子が発現しているということだけではなく、例えばアルブミン分子をコードする情報には、赤血球や多くの細胞にはアルブミンが存在しないということも含まれている。結局個々の情報も、全てのゲノム情報と関連している。このことは生物学者なら肝に銘じていることで、生物のもつ部分と全体の特別な関係として研究者の頭を悩ませてきた。
脳と言語を情報の観点から比べる
図1:ノーベル財団の今年の医学生理学賞の受賞理由に掲載されている図。
図2:神経系はすべてのシグナルを、膜の興奮に収束させている
図3:短期記憶と長期記憶のメカニズム(ノーベル財団2000年ノーベル医学生理学受賞理由:https://www.nobelprize.org/nobel_prizes/medicine/laureates/2000/press.html) (C) The Nobel Assembly at Karolinska Institute
図4:情報媒体の進化の階層性
図5 単純なアメフラシの水管反射に関わる回路。(BRHホームページ参照:http://www.brh.co.jp/communication/shinka/2016/post_000024.html)
人間の記憶
図1 細胞の短期変化から細胞の安定な分化が細胞レベルで記憶を支える。前回の図3も参照
図2 アントワープ王立美術館所蔵のジャン・フーケの「ムランの聖母子像」、1981年に一度訪れた後は訪れる機会がないが、イメージは鮮明に残っている。
図3: 視覚の表象形成と作業記憶。
コミュニケーションと言語
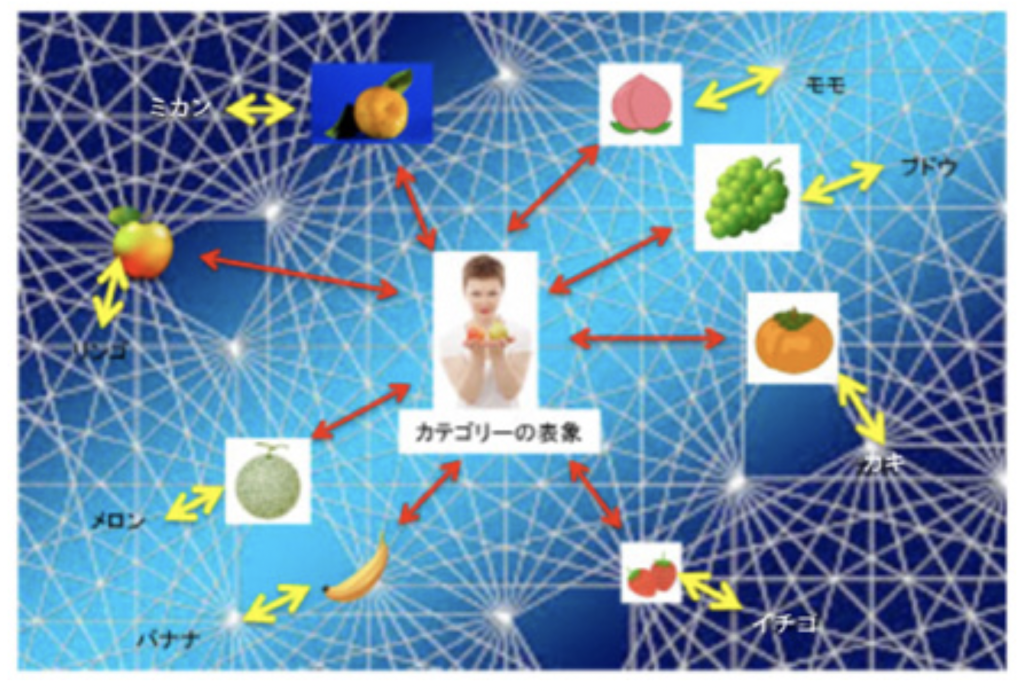
図1:メモ代わりの標識表象としての言語が脳内の表象のネットワークに組み込まれて、言語が成立する。言語としての統語は、それぞれの表象が属する様々なカテゴリーによって決まる。例えば、食べるという表象が最初から果物には属している。このような言語の構造のおかげで、新しい単語を学ぶとそれは実物についての表象を介して脳全体の表象ネットワークの中に位置付けられる。これが、私たちが急速に単語を覚えることのできる基盤だと私は思っている。
図2:鳥の縄張り主張のための、モズの高鳴き(左)と、Victoria’s rifle birdのメーティング(左)。出典:Wikipedia
図3:バイソンに立ち向かう狼の群れ:MacNulty DR, Tallian A, Stahler DR, Smith DW (2014) Influence of Group Size on the Success of Wolves Hunting Bison.
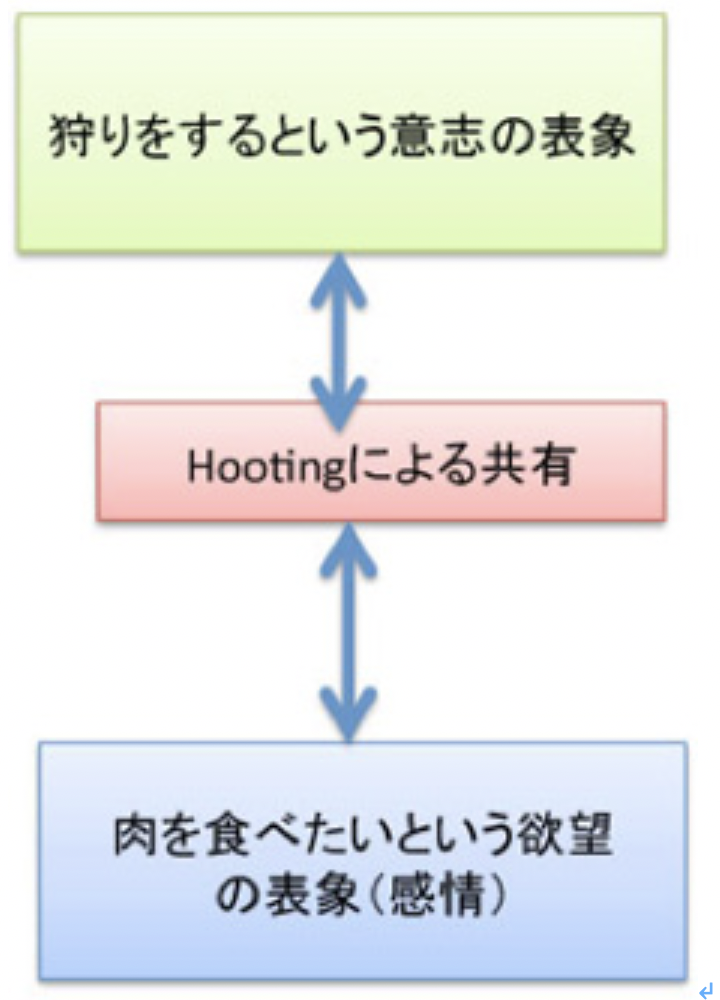
図4:感情と意志の関係を、hootingの音で他の個体と共有できる。感情の伝達はコミュニケーションの原点。
「人類と利他性」
図1 Michael Tomaselloが2014年に出版した著作で、ここで説明している意図の共有を契機とした人間特有の能力の進化について書いている。
図2:子育ても利他的だが、本能的と断じていいだろう。(写真はWikipediaより)
図3: サルの協力関係を調べる課題。この図は、本文で説明している実験とは異なるが、紐を同時に引かせて協力させるという点では本文で説明しているPsychological Scienceの論文と共通してる。
結果は明瞭で、5歳児ペアの場合、実験開始直後からほぼ100%協力しあう戦略が成立する。すなわち、相手だけがボールを手に入れることを認め、交互に獲物が手に入るよう順番を決める戦略を立てる。ところが同じ戦略関係が成立する確率は、3.5歳児では62%に落ちる。この時の様子を観察すると、5歳児では積極的な方が声をかけて、順番にボールを手に入れようと指示しているのがわかる。一方、3.5歳児ではこの戦略が成立するまでに試行錯誤が必要で、結局うまく協力が成立しないペアもある。すなわち、この利他的能力の発達は3.5歳がちょうど境界上にあると言える。それでも、最終的には順番にボールを手にするための戦略を見つけるペアは何組か生まれる。これに反し、チンパンジーで同じ実験を行うと、偶然協力してボールを手に入れることは観察できても、順番にボールを手にするための安定した協力関係が成立することはない。
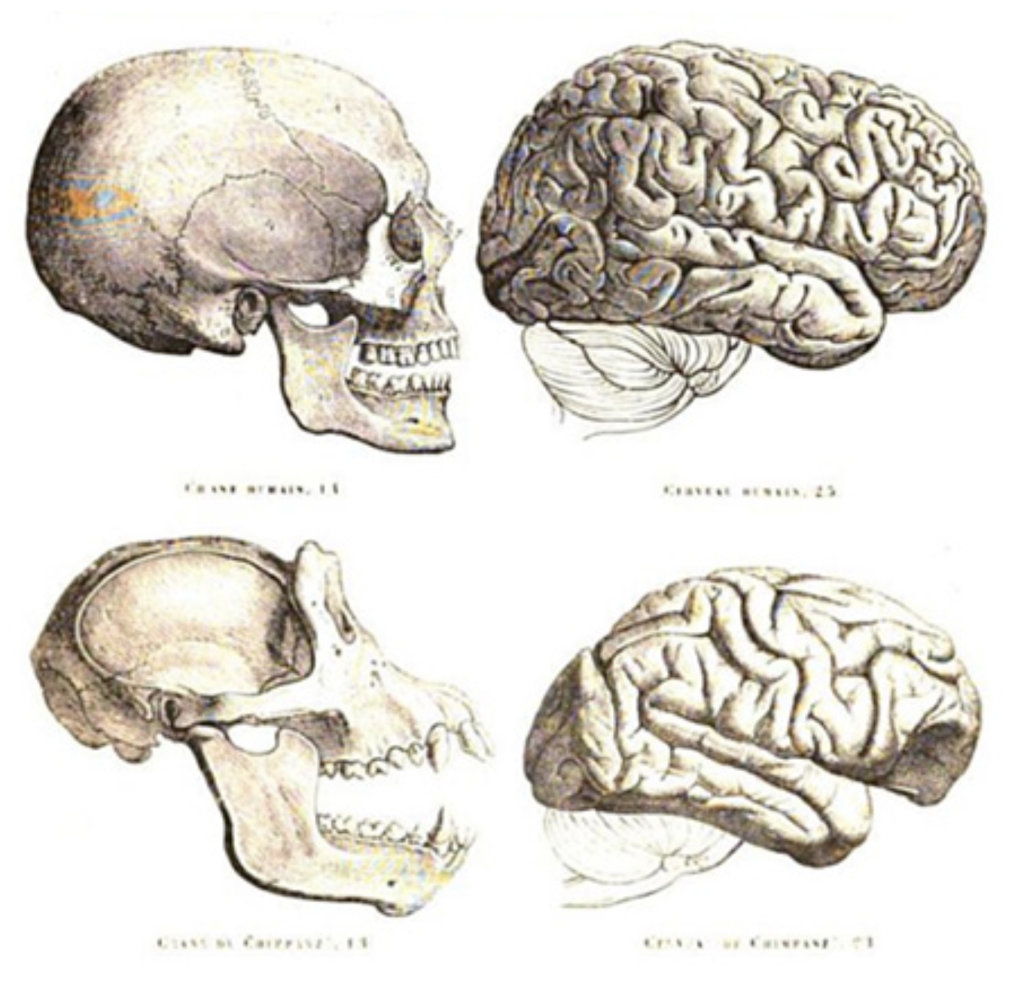
1)まず肉を食べたいという欲望の共有が必要で、これはサルの狩りでも観察できる。 2)生きた鹿を見ているだけでは欲望は満たせない。欲望を満たすには、殺された鹿をゴールとしてともにイメージする必要がある。これも恐らくサルでもできる。 3)難しいのは、一人が石を投げ、もう一人が棒で叩くというプランニングを可能する過程だ。感情とゴールを共有した上で、鹿をハントするという明確な意図を共有し、私が石、君が棒と取り決めることで初めて効率のいい狩りが成立する。 図4 人間とチンパンジーの脳。構造は同じだが、前頭葉が人間では著しく発達しているのがわかる。この差は、人類が類人猿から別れた後、急速に進化してきたものだ。(出典:Wikipedia)
個体発生と系統発生
図1:エルンスト・ヘッケルとKunstform der Naturに描かれた図。(出典:Wikipedia)
図2:プレーリーハタネズミ。(出典:Wikipedia)
図3 米国アカデミー紀要に掲載されたPare bondingに関わる3編の論文。
言語誕生を促す2つの契機
互盛央さんの「言語起源論の系譜」(図1)を読むと、人間は言語を話す自分に気がついてからすぐ、自分の使っている言語はどのように生まれたのか考え続けてきたようで、この問題は少なくとも2500年の歴史がある。しかし、人間の脳との関わりで議論が始まったのはやはり20世紀で、中でも私たちの言語能力は決して学習するものではなく、生まれつき備わっているものだとしたチョムスキーのUniversal Grammar仮説は影響力が大きく、言語の起源をめぐる議論の中心になった。
比較進化学として言語誕生を考える
図2:Tomaselloが2014年に出版した人間の思考についての著作『Natural History of Human Thinking』(Harvard University Press)。多くの実験事実の裏付けられており、アカデミックな読み物。
図3 Dunbarが2014年に出版した『Human Evolution』(Pelican)。何が我々人間の進化を後押ししたのか、言語誕生に至るまでわかりやすく書かれている。
1)自分の身体や内的自己を他人から区別し自分のものとして認識する能力、 2)他人の行動の目的について表象する能力、 3)他人も自分と同じように考えていることについての理解(Theory of Mindと呼ばれている) 4)自分が相手と同じであると相手が認識していることを理解する能力 図4 Mithenが2005年に出版した歌うネアンデルタール『The Singing Neanderthals』(Harvard University Press)。言語誕生に音楽が果たした役割を示す面白い考え。
言語誕生のマイスタージンガーモデル(後編)
音節と記憶の連合(Lexicon:語彙は、連合させて記憶を高めるメモとして
始まった。)
連合による明瞭な記憶は自己自身の表象の確立に始まった。
図1 昨年出版された、Murray, Wise, Grahamの3人の共著による記憶の進化についての著書『The evolution of memory system』。進化という観点で記憶を捉えた本としては初めてではないだろうか。
行動の表象が文法を決める
ニュルンベルグのマイスタージンガー
図2:靴屋のマイスターハンスザックス。ニュルンベルグのマイスタージンガーの主役は騎士ウォルターではなく、間違いなくザックスだ。
マイスタージンガーモデルに関する補足I
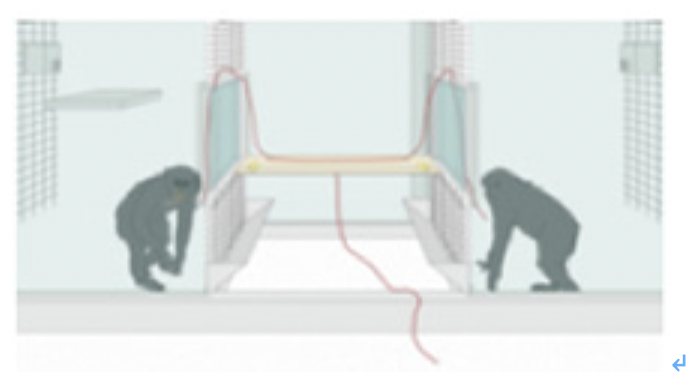
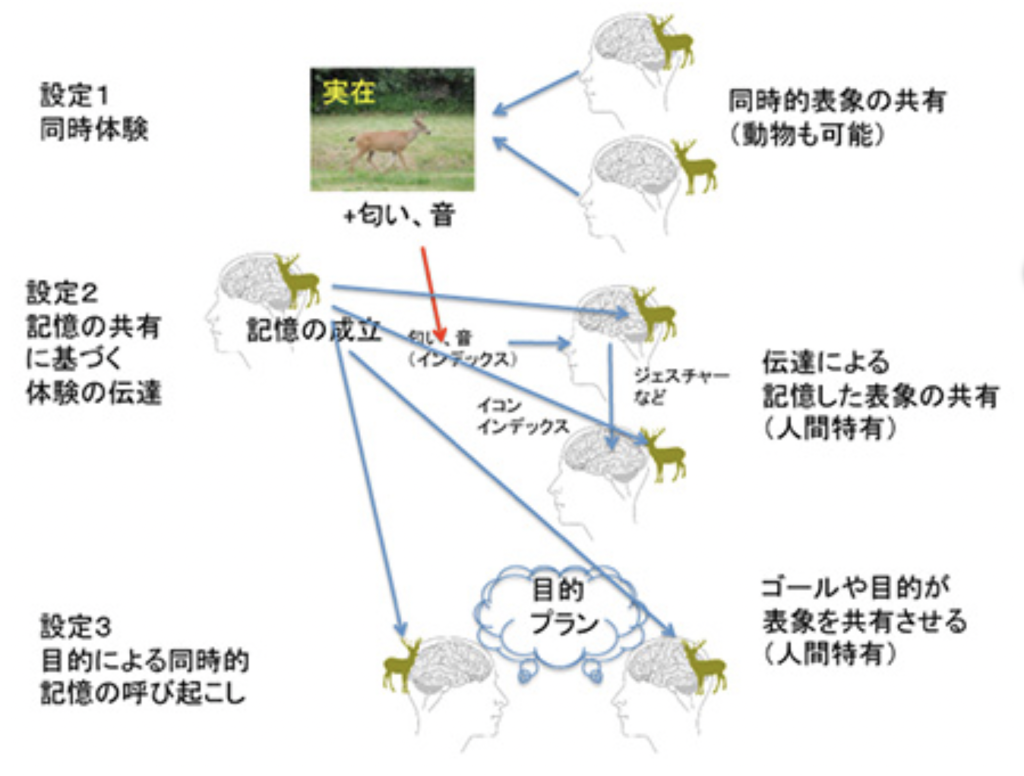
図1 シカ狩りを例に言語の条件を考える(説明は文中)
1)鹿の視覚的表象と、匂いや音の表象を連合し、記憶する(人類・動物共通)
2)匂いや音の表象から、鹿の視覚的表象を呼び起こす(人類・動物共通:表象の鮮明度は人類がすぐれている?)。
3)鹿の視覚的表象を、ジェスチャーで形態模写し、それを他の個体も理解する(人類特有)。
1)ゴールを共有する協力を可能にする人間特有の能力、
2)explicit memoryの形成能力、
1)情報を共有したいという強い欲求、
2)レベルの高いexplicit memory(高い表象間の連合能力)
3)実物に依存しない表象の呼び起こし
4)これらをストーリーに仕上げる統語能力に必要な、身体的行動の表象能力
なぜ言語の発生時期を5万年前後と考えるのか?
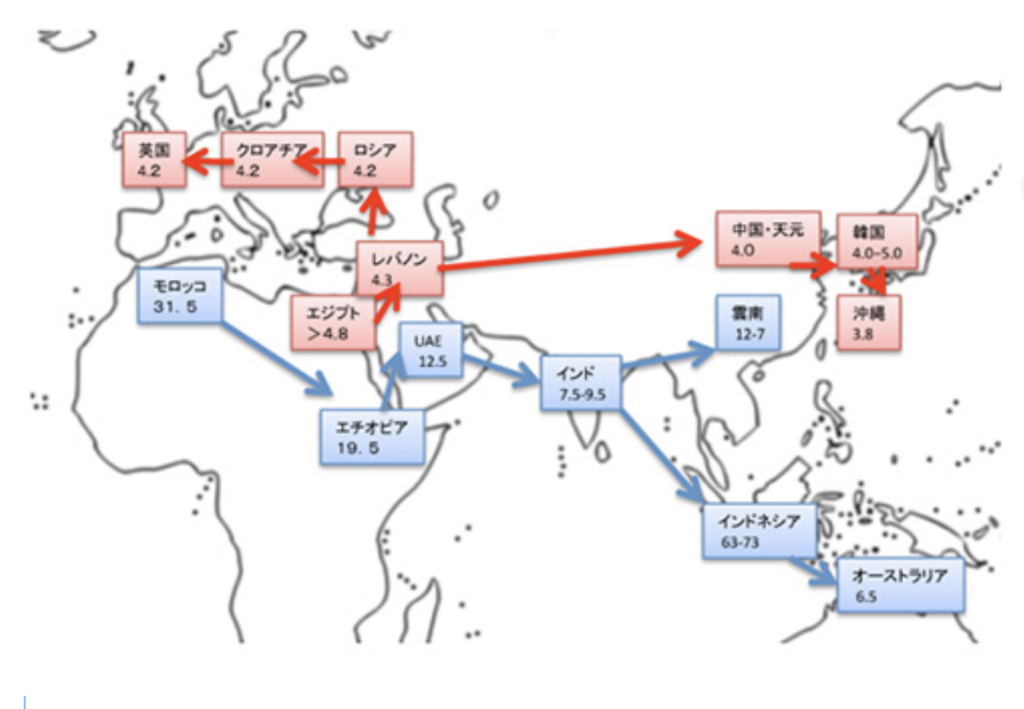
図1: 『Science』に掲載された総説をもとに(Science 358: DOI: 10.1126/science.aai9067, 2017)筆者が作り直したもの。サピエンスと確認できる遺跡が存在する場所とその年代をつないで移動ルートを割り出している。
閉ざされたシナイ半島ルート
図2:図1にかぶせてネアンデルタール人の分布を重ねてある。
図3『Nature』 に掲載された記事(Mellars et al.Nature 479:483, 2011)をもとに、筆者が作り直した図で、サピエンスのヨーロッパ進出の3本のルートを示している。
ではなぜ5万年前にこの均衡が破れたのか?
1)サピエンスの遺跡に残された石器(オーリナシアン石器など)は、ネアンデルタール人の遺跡に残される石器(ムスティエ石器)と比べると、機能的に凌駕している。 2)この結果として、武器のイノベーションもネアンデルタール人はサピエンスに劣っていた。 3)ネアンデルタールの集団はサピエンスと比べると少人数だった。 4)ネアンデルタール人の遺跡には、絵画や装飾がなく、言語能力が発達していなかった。 5)サピエンスと比べて、より少人数の集団しか形成していなかった。 なぜ言語が石器作りを教える過程で誕生したと思うのか?
図1 John J Sheaの著書。
図2 石器の発達。Sheaの著書を参考にして、筆者が作り直した。
図3 具体的なモノの共有、上下関係、様々な音がある現場でこそモノと音節の対応が共有される
イラストの出典:無料サイトPixabay
言葉の流れに対する脳の反応
2019年8月20日
アルツハイマー病研究の基本は現在も、異常アミロイド(Aβ)とTauの制御だが、この上流、下流についての研究は多様性が増して、あらゆる可能性が試されるという新しいフェーズに入った感がある。
今日紹介するテキサス大学からの論文は、Aβとグレリン受容体との関係を追求した研究で8月14日号のScience Translational Medicineに掲載された。タイトルは「Disrupted hippocampal growth hormone secretagogue receptor 1a interaction with dopamine receptor D1 plays a role in Alzheimer′s disease (海馬でのsecretagogue受容体(GHSR1a)とドーパミンD1受容体(DRD1a)の相互作用の阻害がアルツハイマー病の発症に関わる)」だ。
タイトルにあるsecretagogue受容体は、国立循環器病センターの寒川さんらによって発見されたグレリンの受容体で、下垂体の成長ホルモンの分泌に関わるが、海馬ではドーパミン受容体と相互作用を起こして、シナプス活性を促進することが知られていた。この研究は、この GHSR1a と DRD1 の相互作用をAβが阻害して、アルツハイマー病の記憶障害が起こるのではと仮説をたて、これを検証している。
まず、アルツハイマー病(AD)モデルマウスを用い、ADでは海馬のGHSR1aの発現が上昇していること、そしてGHSR1aがAβと結合していることを発見する。そこでGHSR1aを培養細胞に発現させてAβとの結合を見ると、切断されたAβ42のみGHSR1aと結合できることを明らかにしている。
次に、同じ細胞を用いてAβによりGHSR1aとDRD1との相互作用が抑制されること、そしてADマウスでは時間とともに海馬での両者の結合が低下しており、この結果海馬のシナプス密度と機能が低下し、記憶障害が起こっている可能性を示している。
以上の結果は、AβによりGHSR1a/DRD1相互作用が拮抗的に抑制されていることを示しているので、これをそれぞれの受容体に対する刺激剤で高められるか、まず海馬のスライス培養で調べると、GHSR1a,DRD1それぞれの刺激剤では効果がみられないが、両方を同時に加えるとAβとGHSR1aの結合を抑制できることを確認する。
この結果を受けて、両方の刺激剤をアルツハイマーモデルマウスに投与すると、AβとGHSR1aの結合が低下、シナプスの密度が上昇し、記憶が正常化することを明らかにしている。この様に薬剤で機能的回復が誘導できるが、AβやTauの蓄積自体にはこの治療法はなんの効果もないことも示している。
以上、根本原因は除去できておらず、その結果としての神経変性については抑制できない可能性が大きいが、記憶の低下を防げるだけでも患者さんは助かる。相手が大きいと、一つでも対策が多い方がいいのは当然だ。
2019年8月19日
神経ネットワーク情報システムの発展
2017年2月1日
神経系もゲノム進化の産物だし、脳を含む神経ネットワークの発生には、ゲノムの指示と一体化して展開するクロマチン情報の変化が必要だ。当然、「心は身体に依存している」と同じ意味で、神経ネットワークは身体に依存し、またゲノムやクロマチン情報に依存している。それでも前回 述べたように、膜電位の脱分極の伝搬による興奮の伝達および、シナプスを介する方向性を持った細胞から細胞への興奮伝達という原理を共有する細胞のネットワークは、作動原理から見たとき、身体、ゲノム、クロマチン情報など、神経系誕生前に生物を支えてきた情報システムから大幅な自由度を勝ち得ている。ともすると私たちが簡単に心身2元論の罠に落ち、「心と体」を分けて考えるのも、この神経系の独立性のゆえんだろう。
この様に、独自の原理を持ち、他の情報から大幅に独立した神経ネットワークは、それに参加する神経細胞数さえ増やせば、ほぼ無限に解剖学的・生理学的に複雑化することが可能で、事実これまで質的にも、量的にも複雑化する方向に進化を続け、カンブリア大爆発、そして現在の地球上での人間の繁栄の原動力となってきた。そこで、この過程で身体から大幅な独立を果たした神経系に加わった幾つかの重要な性質について順に考えてみたいと思う。
この進化が到達した地点は例えば次の文章を読めばよくわかる。
「星野温泉行のバスが、千ヶ滝(せんがたき)道から右に切れると、どこともなくぷんと強い松の匂いがする。小松のみどりが強烈な日光に照らされて樹脂中の揮発成分を放散するのであろう。この匂いを嗅ぐと、少年時代に遊び歩いた郷里の北山の夏の日の記憶が、一度に爆発的に甦って来るのを感じる。」
寺田寅彦の随筆「浅間山麓より」(青空文庫掲載)の一節だが、私たちは森の緑を目にし、松の匂いを感じたとき、遠い少年時代の思い出を鮮明に呼び起こすことができる。
いうまでもなく、ここに書かれた現象は全て神経細胞同士の結合が可能にしている過程だ。
今回は、このような地点に到達するまでに神経ネットワークが獲得してきた幾つかの重要な特徴について考えてみたい。ただ、神経や脳の特性について詳細な説明をしようと思うと、まさに脳科学の教科書を書くことになり、私の任ではない。ここでは、神経系を情報の観点から整理しなおすとき、私が押さえておきたいと思う点について、独断を交えて短くまとめてみようと思っている。
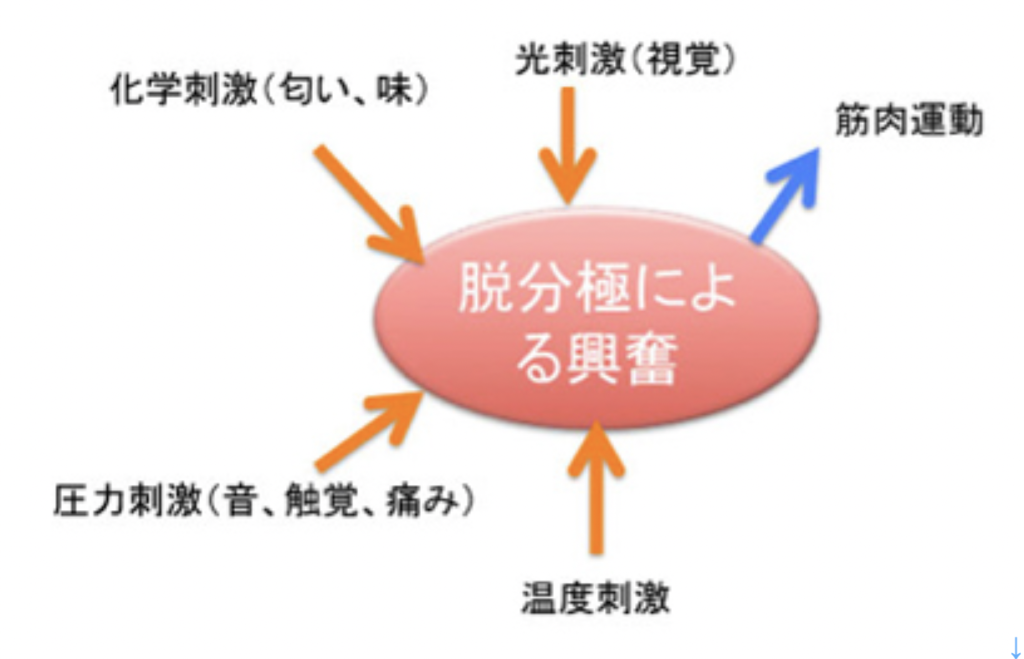
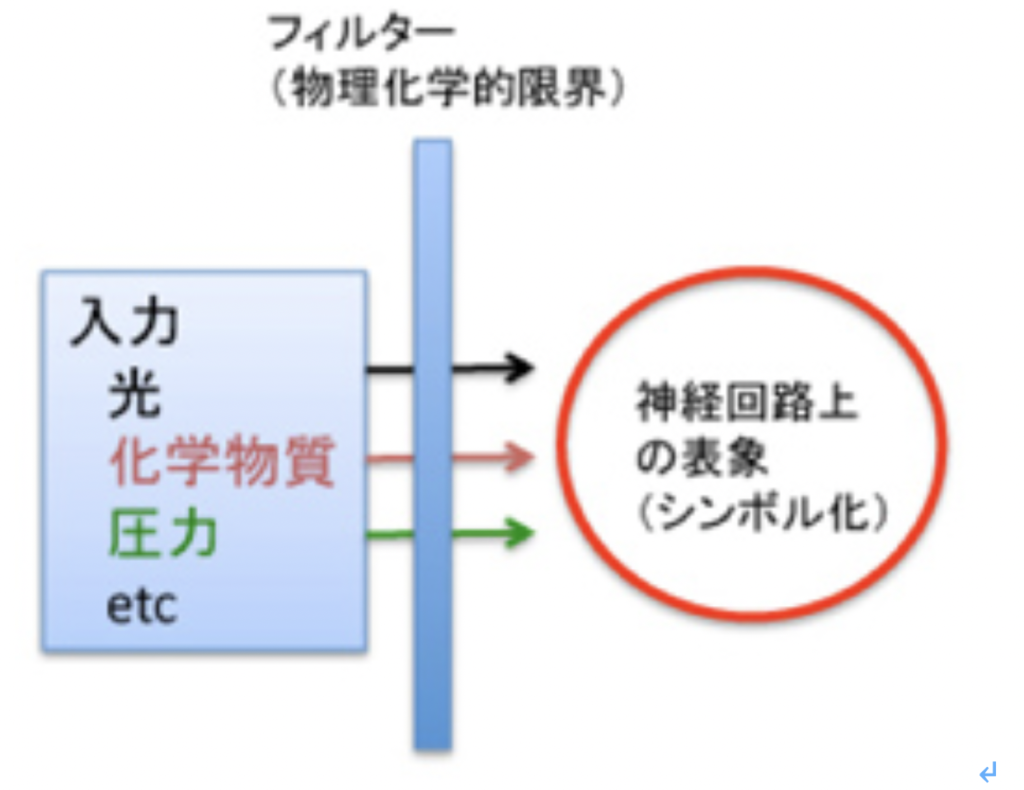
物理刺激の受容
私たちは、視覚、触覚、聴覚、温覚、嗅覚、味覚の6種類の感覚を持っていおり、どの刺激であれ感覚細胞が共通に使っている陽イオンチャンネルは原核生物から存在する。また、光合成に見られる光を化学反応に変化させる仕組や、鞭毛などの運動メカニズムに見られる仕組みは、光や圧力といった物理的刺激の受容に準備が整っていたことを意味している。
以前「神経細胞の誕生」について説明した時にも議論したように、(http://www.brh.co.jp/communication/shinka/2016/post_000021.html )、視覚、触覚、聴覚、温覚など物理刺激を受容できる能力の獲得は、自己と関わる環境の範囲を大きく拡大させ、生物進化を多様化、複雑化への方向へ進める原動力になった。すでに光合成で色素を使い、鞭毛など細胞運動のメカニズムが存在する生物界で、これに陽イオンチャンネルがリンクするのは当然だろうが、この結果が生物に与えた影響は想像以上に大きい。
例えば視覚を考えると、この重要性がよくわかる。人間の存在しない地球では、光刺激の起源はほとんどが地球から遠く離れた太陽や月で、ここから発する光は生物が生きる環境からの刺激として最も重要なもので、実際多くの生物が光に支配されて活動している。この光の変化に合わせて活動しやすい様、環境をゲノムへと自己化した慨日周期をほとんどの生物が持っていることはこの証拠と言っていいだろう。しかし、この光の元は遥か離れた空の上の、生物が到達できない場所にある。すなわち、視覚は私たちの周りの環境の範囲を急激に拡大させた。
物理刺激のもう一つの特徴は、変化が早いことだ。太陽の光は持続的でも、あっという間に遮ることができる。光のスペクトル(色)の変化になると、反射する物体が変化することで刻々変化する。
このように物理的刺激の受容が可能になることで、環境として生物が受容できる領域は無限の空間範囲へと拡大し、また変化のスピードも速くなった。この結果、(認識するしないに関わらず)生物は空間的・時間的に膨大な環境の変化によく言えばアクセスできるようになり、悪く言えばさらされ続けることになった。
この結果、生物は膨大な物理的刺激に関する情報が溢れる中で生活することを運命づけられる。これに対し、味覚や嗅覚は広がりがない。この差は、感覚が脳のマッピング能力と結合した時大きな違いとして現れるが、これは後で議論する。
脳の発達:トップダウンの神経細胞形成
以前に(http://www.brh.co.jp/communication/shinka/2016/post_000021.html )述べた様に、神経系が特定できる最も下等な動物はイソギンチャクなどの刺胞動物や、クシクラゲに代表される有櫛動物だが、これらに認められる神経細胞は、階層性のない分散型ネットワークを形成している(図1トップ)。このような動物では神経細胞は腹側の上皮層でバラバラに分化し、身体中に広がりネットワークを形成する。系統上もう少し進んだアメフラシになると神経系の階層化が始まり、神経細胞が集まった神経節がうまれ、そこから伸びる神経軸索は束ねられる。神経節では、様々なインプット、アウトプットを連結することで、ネットワークを複雑化することが容易になる。そしてこの究極に、神経系の全てと結合した脳が現れる。
こう述べると、神経節や脳の進化が、ポリプのように分散して存在する神経細胞をまず神経節へとまとめ、最後に神経系全体が結合し合う脳へとまとめていく、ボトムアップの過程を想像してしまう。しかし実際には、分散型の神経ネットワークと、脳を持つ神経系の発生様式は根本的に異なっている。
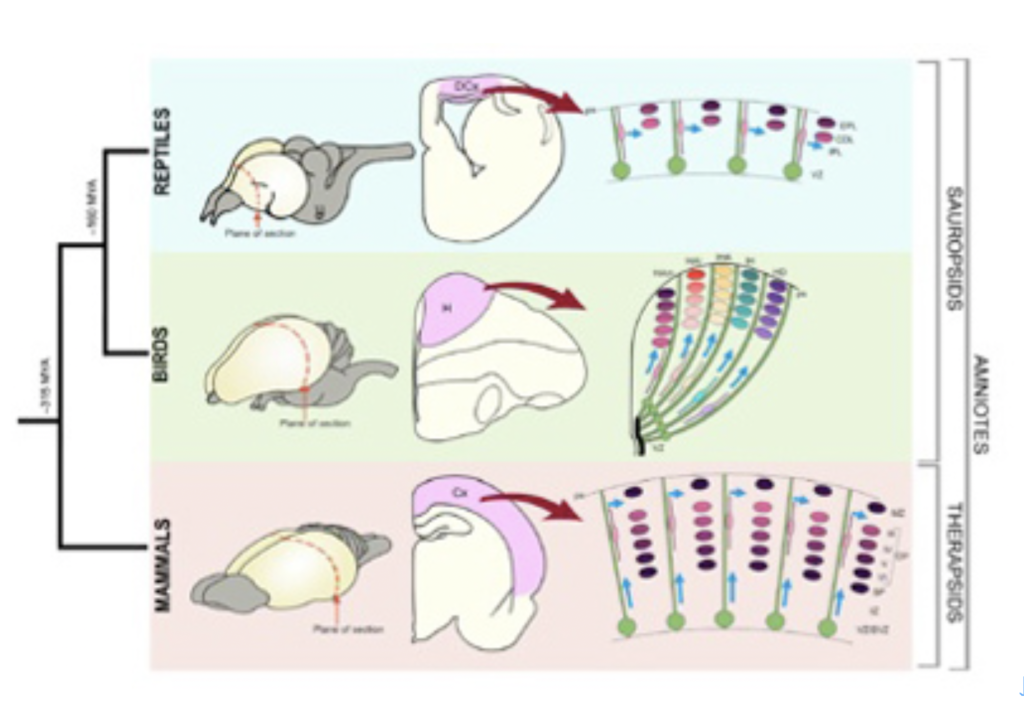
脳を持つ動物の代表は、昆虫と、脊椎動物で、図1からわかる様に、昆虫に代表される旧口動物と脊椎動物に代表される新口動物は、それぞれ独立して進化したと考えられている。にもかかわらず、脳、神経節、神経束、そして末梢神経と続く神経系の階層構造はよく似ている。しかも、この類似性は構造だけではなく、それぞれの神経領域を決定する遺伝子群の発現にも見ることができる(図2)。
これら階層化された神経系の発生では、ポリプのように神経細胞が個別に上皮から分化することはない。昆虫についてはショウジョウバエしか知識はないが、神経はすでに領域化されたそれぞれの体節で上皮から分化した神経芽細胞が、広がることなく局所で分裂し神経細胞塊をまず形成する。脳は、体節のない頭部に神経芽細胞の集団が現れ、分裂して将来脳になる塊を形成する。
すでに領域化した上皮細胞から神経細胞が形成されるのは脊髄動物も同じだ。脊椎動物の場合、上皮からまず神経管が形成され、神経管の中に神経細胞が分化増殖して細胞集団を形成する。また、頭部も同じ様に、領域化した上皮が陥入し、それが神経細胞へと分化することで形成される。このように昆虫も脊椎動物も、神経が分化する前にボディープランに合わせた上皮の領域化が起こり、領域化された細胞が神経細胞へと分化することで領域性と階層性をうまく両立させたトップダウン方式の神経発生が行われる。この方式は、体節を基礎とする分節化したボディープラン形成という新しい発生過程の進化にあわせて新たに生まれた神経発生様式といっていいだろう。
新口動物と旧口動物は独自に進化したと考えられているが、両者に見られる神経系の類似性から、両者の分岐点に、神経発生をボトムアップ型からトップダウン型へとシフトさせた共通祖先がいるのではと考える人が多い(図2)。
これに対し、ギボシムシ に代表される、脳を持たない半索動物(図2、3列目)も新口動物に分類されることから、この類似性は偶然の産物で、脳のような究極の階層性を実現するためには、まず上皮の領域化として現れたボディープランの助けを借りる以外の方法はなかったからだと考える人たちもいる。
いずれにせよ、脳の誕生により、脳に全てを集中し、また脳から全てが出ていくという階層を誕生させることが、神経系が新しい機能を続々と開発した最も大きな基礎となった。
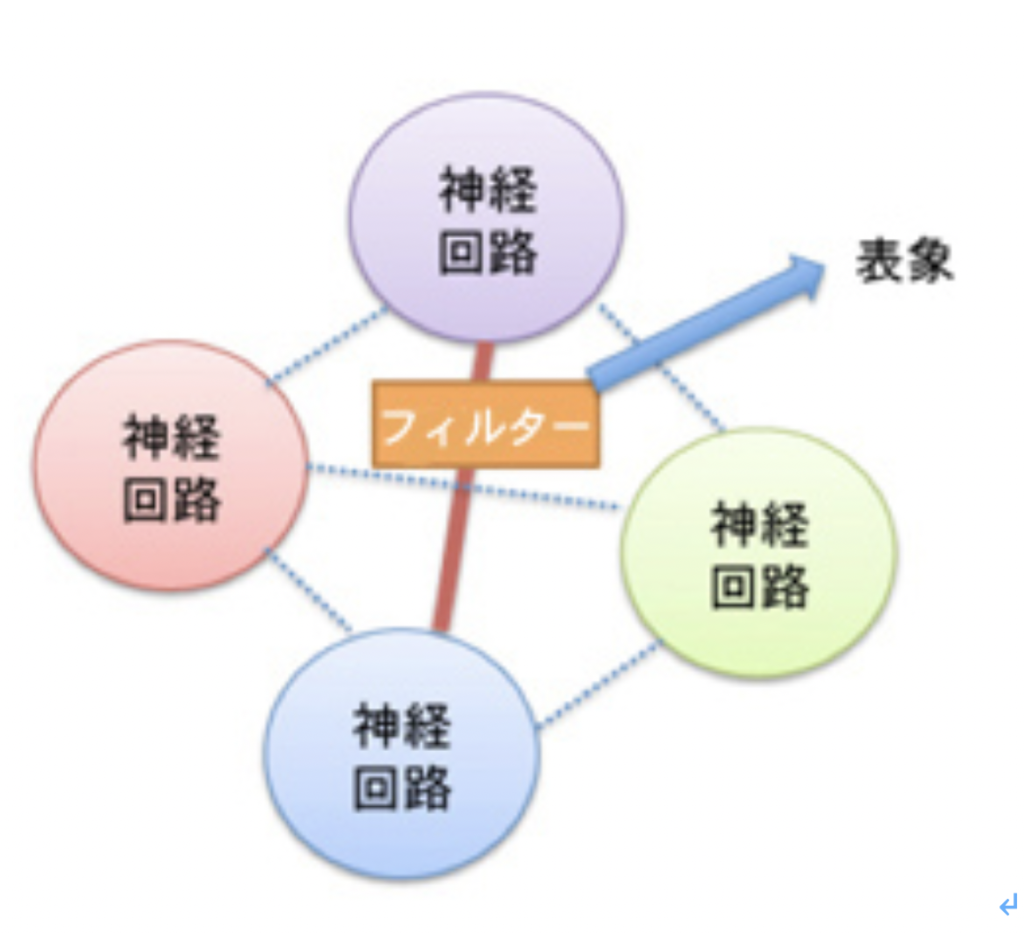
表象とマッピング
脳という神経ネットワークの集中が可能にした最も偉大な機能は、身体や環境の変化を神経ネットワーク情報に転換し(表象し)、対象の空間や時間関係をマッピングする機能だと言える。少し抽象的でわかりにくいと思うので、具体的例を見ながら説明しよう。
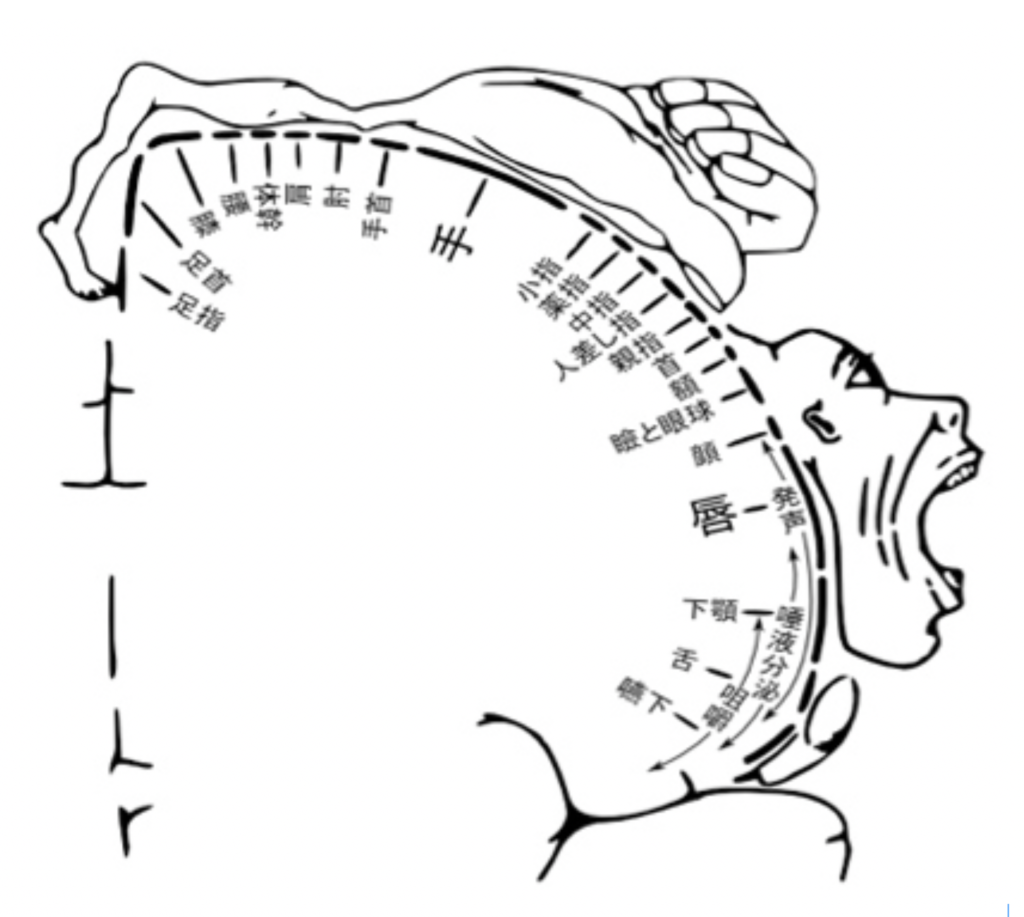
まず図3を見てもらおう。これは、私たちの体各部位の運動・感覚神経が、脳のどの部分と結合しているかをマッピングしたもので、ペンフィールドのホムンクルスとしてよく知られている図だ。この図は最初、カナダの脳外科医ペンフィールドが、意識を保ったままの開頭手術の際に、脳を刺激して体の各部位と脳の領域の関連を記録した研究に基づいて描かれた。大脳皮質の運動野と、感覚野にほぼ同じ様な小人の図を書くことができる。
末梢と中枢の神経投射が脳皮質上に一定のパターンで分布するのは当然だと考える人は多いはずだ。しかし、この図は決して末梢との連結だけを反映しているのではない。末梢から刺激が繰り返されると、今度は脳自体の回路に体の各部からの刺激が記憶され、神経連絡がなくなってもこのパターンを保存することができる。すなわち脳回路の特性へと転換された表象は、末梢からの刺激が途絶えても、末梢の感覚として維持される。このことは、何らかの原因で急に腕が切断された人たちが、あたかもまだ腕がある様に錯覚する幻肢という現象を経験することからわかる。この現象は当初、切断された断端に残った神経から直接脳へ信号が送られるため生じると考えられていた。しかしその後の研究で、私たちの脳内に形成された腕の各部に対応する脳内の刺激の記憶が、末梢からの信号が途絶えた後も、自発的な興奮を続けることで、錯覚を発生させると考えられる様になっている。すなわち、末梢と直接的連結が失われても腕の記憶を呼び起こせるということは、脳自体の神経ネットワークの特性として、腕が表象できていることを示している。
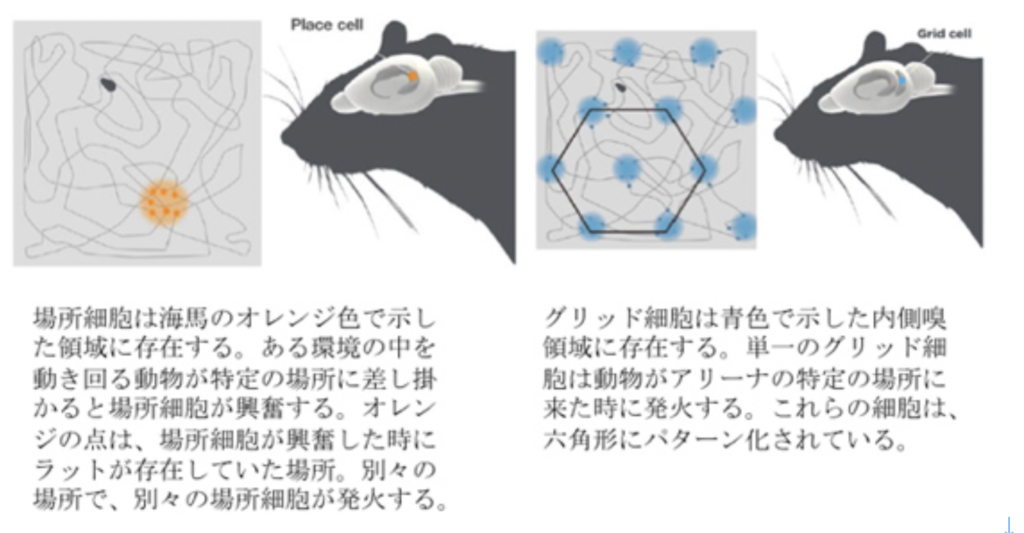
幻肢では、私たち自身の体が脳に表象されるが、脳が表象できるのは体にとどまらず、私たちの周りの環境も同じように表象されていることを明確に示したのは、2014年のノーベル賞に輝いたオキーフ及びモザー夫妻による、場所細胞とグリッド細胞の発見だろう。図4はノーベル賞受賞理由に使われた図1、2を和訳してそのまま転載したものだが、私たちの体と物理的結合や関係のない場所情報が、脳内の場所細胞やグリッド細胞の空間的配置として表象されていることを示した。
このように脳が誕生したことで、様々なインプットやアウトプットを脳内の神経ネットワークのパターンとして表象することが初めて可能になった。
ここで大事なことは、環境の空間的時間的変化を、脳内の神経回路の特性として表象することができるということは、まさに以前紹介したチャールズ・サンダース・パースのシンボル記号関係を環境や身体と脳回路の間で形成することができるようになっている点だ(http://www.brh.co.jp/communication/shinka/2016/post_000012.html )。
このマッピング能力、表象能力に、記憶が合わさると、自己や意識が始まるが、これについては次回に回す。
[
西川 伸一 ]
脳の自己
2017年2月15日
脳を頂点とする階層的な神経回路による新しい情報システムの誕生で可能になったことについて書いた前回 の内容をまとめると、
1)様々な物理的刺激を受容することが可能になり、個体が経験する環境の範囲が急速に拡大する。 2)結果、生物はほぼ無限とも言える刻々(ms単位で)変化する情報にアクセスし、またそれに対する迅速な反応が可能になった。 3)神経回路に対する体内・体外からの様々な刺激を脳内の神経回路内に表象し、そのイメージを記憶することが可能になった。 になる。
古来人間の最大関心事である自己や意識はこれを基盤として新たに生まれた高次情報だが、その発生のためには、脊椎動物の脳構造の大きな変化が必要だったので、まず構造の進化を簡単に確認しておこう。
脳の急速な増大
脳神経回路を媒体とする新しい情報システムの進化過程では、一貫して脳の神経細胞数が増え続けてきた。例えばマウスは約2億個のニューロンがあるが、人間ではその数は1600億個にのぼる。闇雲に回路を複雑にすれば高次機能が生まれるわけではないが、素子数を増やすことで発展してきたコンピュータを見れば、まず細胞数を増やすことが必要であることは直感できる。実際全く異なる情報システムであるゲノムも進化の過程で塩基数が増大し、ゲノム内の構造も複雑化してきた。
脳は大きく分けて、後脳、中脳、前脳、および嗅球に分けることができるが、図に示したように脊椎動物進化では、もっぱら前脳を拡大させてきた(図1)。
前脳皮質の神経細胞を増加させるメカニズムだが、脳室のsubventricular zone (SVZ)で水平に幹細胞を未分化なまま増殖させて皮質面積を拡大するとともに、増殖している幹細胞が今度はradial glial cellに沿って縦に細胞を供給し、順番に異なるタイプの神経細胞へと分化することで縦に厚みが増すことで達成されている(図2 Montiel et al, Journal of Comparative Neurology,
524:630, 2016 より転載)。
ただ脳の表面をそのまま増大させるだけでは、脳のサイズという物理的限界に当たる。そこで脳進化の過程で、皮質が立体的に陥入するいわゆる脳のシワ(脳溝)が形成される様になり、このおかげで、サルから人間の進化の過程で脳の皮質面積は急速に増大する(脳溝は図1の人間の脳参照)。
同じ幹細胞に由来する異なるタイプの神経細胞が縦に並ぶことで脳皮質の層構造(6層)ができる。この縦に並んだ細胞からできる層構造が最小セットとなり、この単位が横に束ねられ、細胞同士がネットワークを作ると、カラムと呼ばれる脳の最小機能単位が出来上がる。このカラム構造では、各層の神経細胞の反応性は似通っている(例えば同じ方向の動きに反応するなど)。この様に、脳では細胞数がただ増えるのではなく、小さな単位のネットワークが集まってモジュールができ、それがまた集まってという様に、ネットワークは階層的に拡大していく。
以上が脳のサイズ拡大を支える解剖学・細胞学的の知識の基本だ。この基盤の上に、自己や意識が生まれる。
自己の誕生
自分の行動を他の動物と比べ、また自分の過去を振り返れば、自己や意識が脳の進化とともに現れ、また「物心つく」と言うように、自己や意識が一人一人生まれてから新たに発生することがわかる。もちろん古来、自己や意識は人類にとっての最大の謎で、哲学から生物科学、神経生物学、心理学まで多岐にわたる議論が続けられてきた。当然この話題についてのすぐれた著作は多く、本当は私の出る幕ではない。しかし脳神経回路を媒体にする情報の理解なしに、生物の情報の進化を構想することはできないので、この問題についても私なりの理解をまとめておくことにした。
まず問題は、自己から始めるか、意識から始めるか、あるいは同時に扱うかだが、両者は脳の最も高次の機能として密接に関連し合っているため、どちらがより重要とか、どちらが高次とか決めることはできない。
脳神経系以外の自己
そこで「エイヤ!」と「自己の誕生」から始めることにした。というのも、自己という言葉は、脳神経回路情報だけでなく、様々なレベルの生物活動に対して使われる。私自身も原始ゲノム誕生について説明した時、「ゲノムの自己性」と、この言葉を用いた。実際、私たちは「細胞の自己」のように脳神経系が存在しない生物に自己を使っている。例えば自己複製という言葉は最もポピュラーだろう。他にも、昨年のノーベル賞に輝いた大隅良典さん の「オートファジー」も、細胞の自己を想定した使い方だ。
これらの場合で、「自己」の意味する内容を考えてみよう。ゲノムの自己と私が呼んだ場合はひと塊りの核酸が周りから完全に分離し、その上で自律的な複製能力を持つことが条件となっている。これが単細胞動物となると、内と外を隔てる細胞膜が存在するため周りからの分離はさらに明確になる。ただ、シャボン玉のように膜で周りから分離される状態が維持できても、自己性があるとは思わない。周りの環境から完全に分離するとともに(自己と外とに境界線を引くことができる)、同じ細胞(境界の内側)を自律的に複製できる能力があって初めて自己性があると言える (熱力学的条件などは自己複製で全て表現できている)。周りから完全に分離して、自己複製能を持つことが、「自己性」成立の条件だ。
多細胞動物になっても、個体の内と外ははっきりと分けることができるため、細胞と同じ意味で「個体の自己」を使うことができる。ただ場合によって「個体の自己」と「細胞の自己」が分離することがある。最も分かりやすいのがガン細胞で、個体から独立して勝手に増殖すると同時に、ゲノムも個体とは異なっていると言える。この極端な例が、ハマグリやタスマニア・デビルに見られる、個体から個体へと伝搬するガン細胞だろう。このようなガン細胞は自己性が高いと言えるかもしれない。
他に「自己」が定義されている分野が免疫学だ。
免疫学はジェンナーによる種痘の成功により認識された「2度なし現象」(一度感染すると次に感染しない)についての研究がはじまりで、パストゥールの狂犬病ワクチン(抗原の概念)、そして北里・ベーリングによる免疫血清療法(抗体の概念)の開発により、外来抗原に対する特異的な抗体反応という概念が確立する。
このように最初、外部から侵入する病原体への防御反応機構として始まった免疫学は、ランドシュタイナーらによる血液型の発見により、免疫系が自己の成分と非自己の成分を区別できることが明らかになる。その後、臓器や組織の移植研究から、移植抗原が(MHC)が異なる他人からの組織に対してだけ強い免疫反応が誘導されることが明らかになると、「自己と非自己の区別」は免疫学の最重要課題になる。
20世紀後半に始まる免疫学の大きな進展により、免疫系が自己成分とそれ以外をどう区別するかについてはすでに詳しくわかっている。詳細を省いてこのメカニズムを見てみよう。
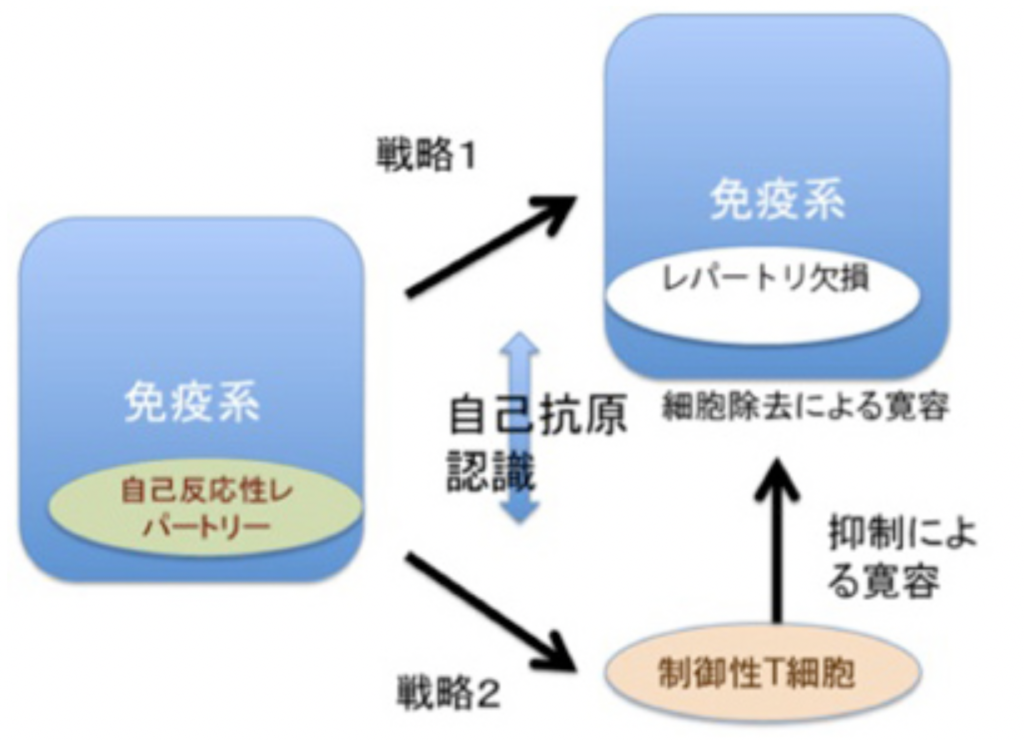
免疫反応にはT細胞とB細胞が関わっているが、原則的にはどちらの細胞も自己の成分に対しては反応しない。これを、自己成分に対する免疫寛容と称している。この寛容には2種類の戦略が存在している。最初の戦略は、リンパ球の分化がまだ未熟な段階で抗原刺激を受けると、成熟後におこる細胞増殖や分化の代わりに細胞死が誘導される。発生初期から体内に存在する自己抗原は、未熟な段階のリンパ球と反応することができこの結果自己の抗原に反応するリンパ球の細胞死を誘導して免疫システムから除去している(図3)。この過程は、T細胞では胸腺内、B細胞は骨髄内で行われる。
もう一つは我が国の坂口志文ら により明らかにされた戦略で、細胞死による寛容とは逆の戦略と言える(図3)。この戦略は制御性T細胞と呼ばれる特別なポピュレーションだけで見られる。制御性T細胞が自己抗原と出会うと、細胞死の代わりに活性化され、長期間体内で生存できるようになる。これにより後にキラーT細胞のような他のリンパ球集団が同じ自己抗原に反応しようとするとき、その細胞を抑制し、自己抗原に対する反応を抑制する。
このように免疫系の多様な認識システムは、発生過程で生成的に形成される。こうして生成される免疫系の自己とは、免疫系の抗原受容体が認識できる自己抗原の総体と定義でき、これらの抗原は免疫系が反応できないレパートリーとして免疫系に表象される。言い換えると、自己抗原は発生初期の選択の結果、細胞死による「レパートリー欠損」として、あるいは自己反応性抑制性T細胞レパートリーの長期維持として表象されている。自己の範囲に境界線を引くとすると、免疫の自己とは、成熟後の免疫系が反応できない抗原として線引きができる。
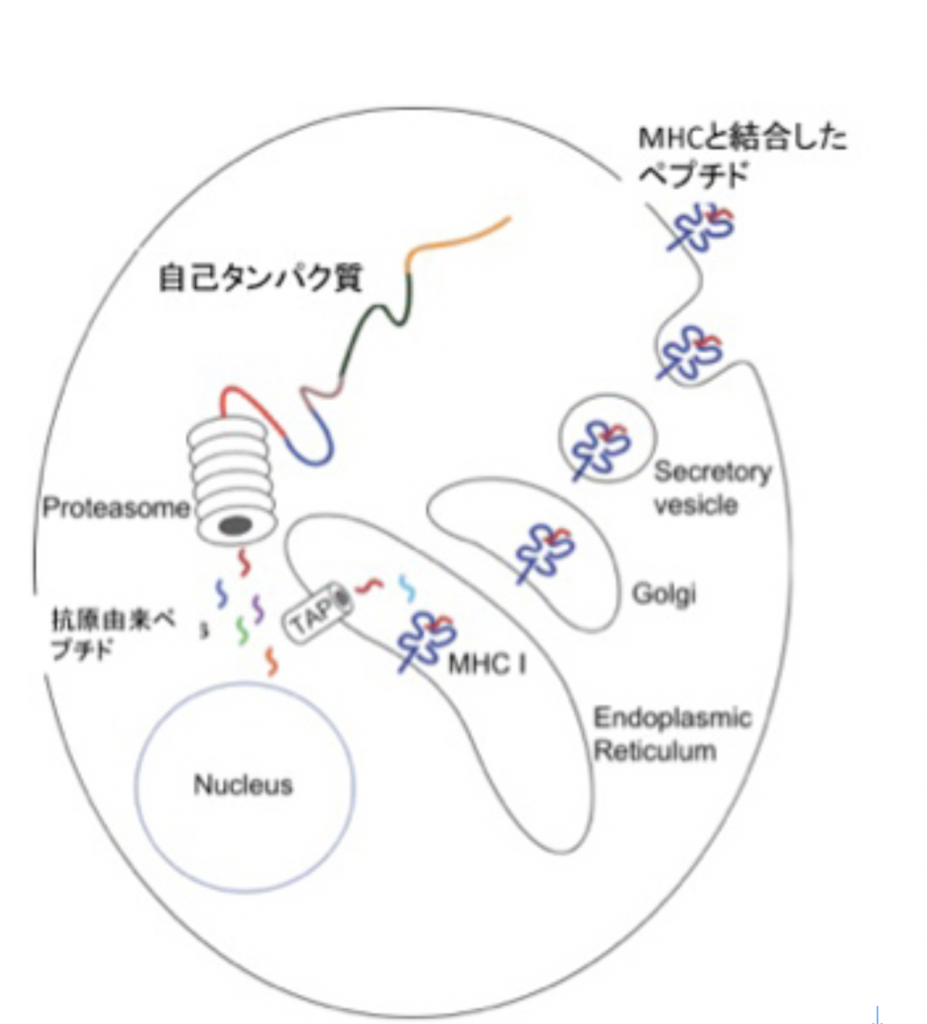
実は免疫システムにはもう一つの自己認識がある。それはMHC restriction(組織適合抗原拘束性)と呼ばれるT細胞の認識方法だ。抗体と違ってT細胞の抗原受容体は、抗原をそのまま認識することまずない。代わりに、図4に示すように、まずタンパク質はプロテアソーム(タンパク質分解酵素複合体)でペプチドへと分解され、それが自己のMHCと結合したときに新たに生まれる分子構造を認識している。
言い換えると、自己、非自己を問わず、T細胞抗原受容体に対する抗原は小さなペプチド+自己MHCで、抗原は自己のMHCと結合するかふるいにかけられた後、T細胞抗原受容体で認識できるようになる。すなわち、抗原の段階でまず自己に参照される。ただこの場合も、免疫側にとって自己ペプチド+自己MHCを含む、T細胞抗原受容体が反応できない全ての抗原が自己と認識され、これは抗原に反応できるT細胞受容体のレパートリー中にぽっかりと空いた欠損として表象される。
以上、脳神経系の自己に行き着く前に、脳神経系とは異なる2種類の自己の定義について見てきた。この2つの自己をまとめておくと、
1)外界との境界を設け、境界内を複製できることで生まれる自己、 2)生成的に形成される認識系に区別して表象されることにより定義される自己 の2種類があることがわかってもらえたと思う。
一見これらは、脳神経系の自己とは接点がないように思えるかもしれないが、脳神経系に生まれる自己性は、この2種類の自己と多くの共通性を持っている。次回はいよいよ、脳神経系に生まれた自己について見てみよう。
[
西川 伸一 ]
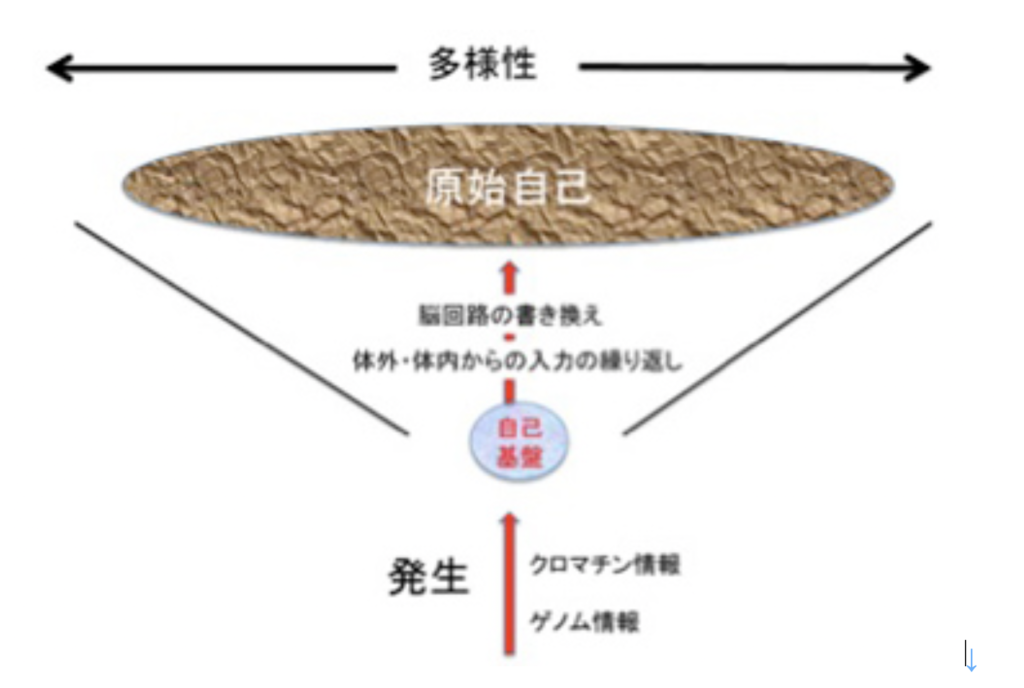
脳神経系の自己基盤と原始自己
2017年3月1日
個体が生まれた時自己としてのゲノムは既に決まっており、生きている間ほぼ変わることはない。しかし免疫系の自己のように、生まれたときから決まっていないものもある。前回 説明したように、免疫システムの自己は、発生・発達過程で、外界、内界からの刺激に応じて生成的に形成される。
免疫系の自己と同じで、脳神経系に生まれる自己も、脳の機能がほぼ完成した後、体の内側、外側から受け続ける脳神経系への入力(経験)の結果として生成的に形成される。注意しておきたいのは、免疫系の自己とは異なり、脳神経系では、脳が受容できる入力の情報量、表象能力、情報の連合能力などは動物ごとに大きく異なっている点で、この結果、入力に応じた脳の受動的変化が積み重なった原始的な自己から、後に議論する意識も関わる能動的に形成される高次の自己まで、自己に大きな多様性が存在する。人間の脳神経系の自己はこの全てのレベルの自己が統合されて形成されているが、最初はまず内外からの入力の影響が積み重なって受動的に生成する最も原始的な自己の形成から考えてみよう。
まず脳神経系の自己を発生させるためには、それを可能にする脳の構造・機能的基盤の発生が必要になる。この脳神経系の構築に関わる最も重要な情報がゲノムで、進化、あるいは種内の個体間の多様性として生まれるゲノム情報の違いは、脳神経系の構造や機能の違いに反映される。
例えば、魚から人間まで、脊椎動物はゲノムの違い(進化の結果)に応じて、構造的・機能的に異なる脳を持っている。当然脳神経系に発生する自己にはこの構造的、機能的違いが反映される。ゲノム進化で生まれる大きな違いほどではないが、個体間に小さなゲノム変化が生じただけで脳機能の異常が生じ、様々なレベルの自己の発達障害が起こることが、人間のゲノム解析や、遺伝子操作動物を用いた研究から明らかになっている。とはいえ、自己や意識の形成に関わるゲノム進化に関するリストが増えても、構造や機能と対応付けて説明することは今なお難しい。
さて、脳神経の自己が生成的に形成されるということは、イギリス経験論を説明するのに例えとして使われる、「人生は何も書いてない白紙から始まる」ことを認めることだ。この白紙が入力を経験したことがない生まれたばかりの脳で、この白紙に刻々かわる経験の表象が記録されることで、独自の自己が形成されると考えればいい。
これまで見てきたように、脳を持つ神経系は、
1)入力を神経回路の活動へと転換し、表象する機能、 2)回路同士をつなぎ、多くの表象を関連させる機能、 3)回路の構造や機能を変化させて、表象を短期、長期に安定化させる機能(記憶) を持っている。
これらの機能のおかげで、もし全く同じ構造の脳神経系が発生したとしても、経験する入力が違えば、それによって誘導される脳の回路の特性も異なることになる。このように、最も原始的な脳神経系の自己とは、ゲノム情報に強く支配された発生過程で形成された基盤(「自己基盤」)が、異なる経験を重ね、その一部を記憶することで、独自の構造的・機能的特性を持つ脳神経系へと変化することだと言える。
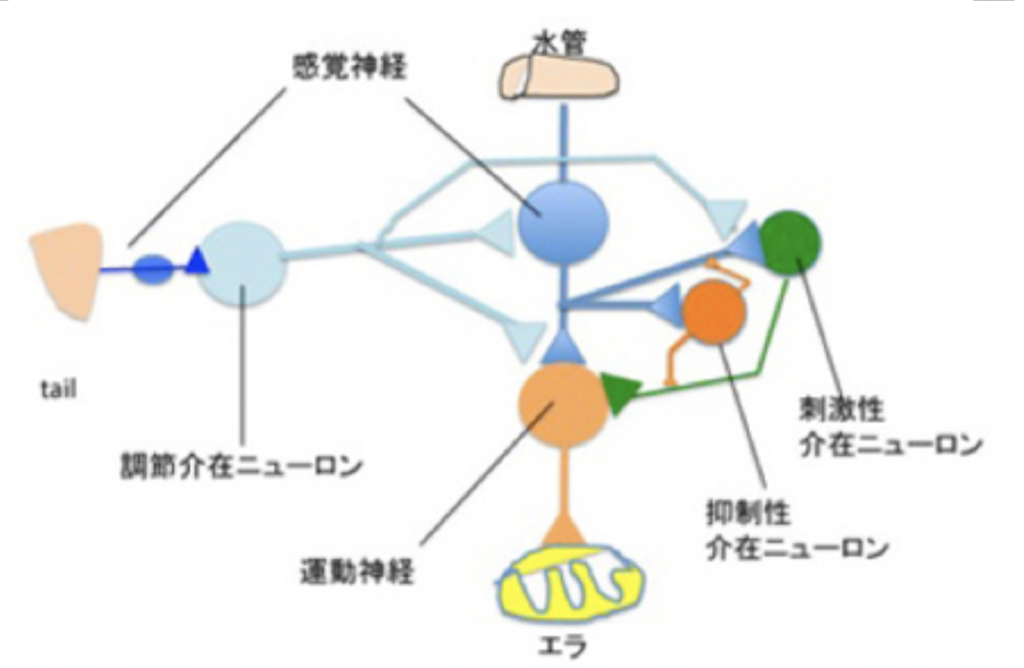
この意味で、アメフラシのような単純な脳神経系の自己基盤も、刺激を神経興奮に転換して表象し記憶することができることから、原始的自己を持っていると言える。経験したエラの刺激の強さや回数で、水管反応の特性が変わるが、この結果を我々が外から観察する時、アメフラシの間に個性が生まれると考える。これをアメフラシの側から見ると、他の個体とは異なる自己ができたことになる。もちろん、アメフラシは自己が誕生したと認識はできていないが、この点については次回以降に考察したいと思っている。
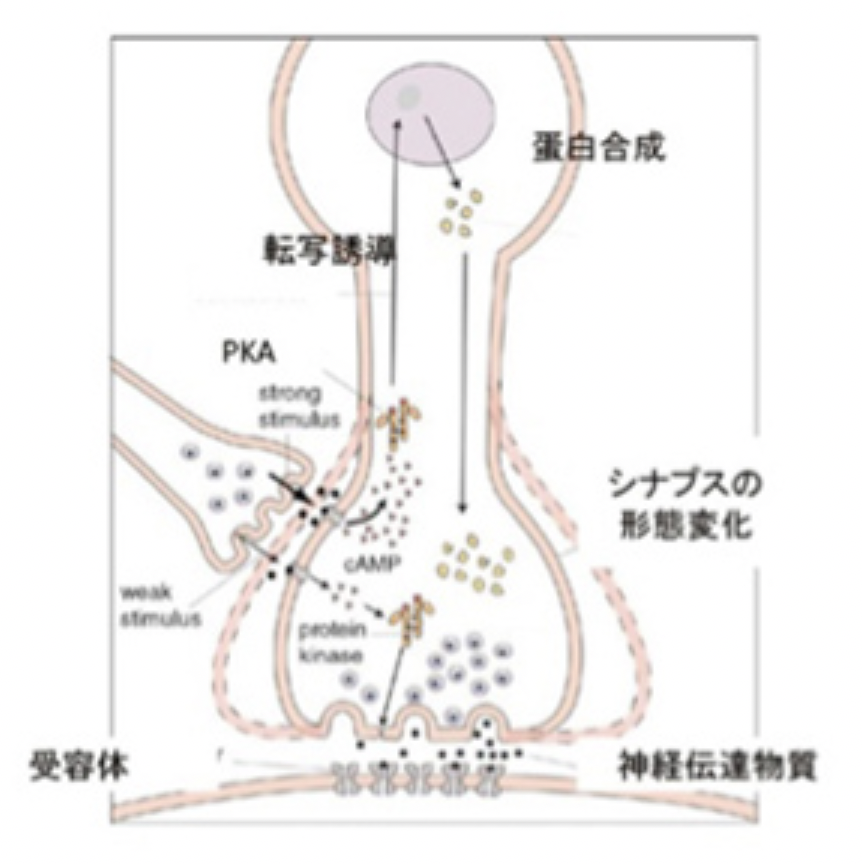
このように経験と記憶を重ねることで積み重なる神経回路の変化が原始的自己形成と考えることができる。実際以前紹介したように(http://www.brh.co.jp/communication/shinka/2016/post_000024.html )、記憶過程は神経細胞のシグナル伝達経路や、遺伝子発現を変化させ、神経伝達因子に対する反応特性を変化させるとともに、シナプスの形態学的変化を誘導して、神経の結合性の長期変化を誘導できることがエリック・カンデルたちにより示された。もちろん、哺乳動物の脳のようにはるかに高次な脳神経系でも基本的に同じメカニズムを共有している。
最近になって神経同士の結合を支えるシナプス構造のダイナミックな変化を直接観察する研究が進んでいる。この分野の研究を知ると、私たちの脳でいかに膨大な変化が刻々起こっているのかを実感できるので、すこしだけ最近の論文を紹介する。
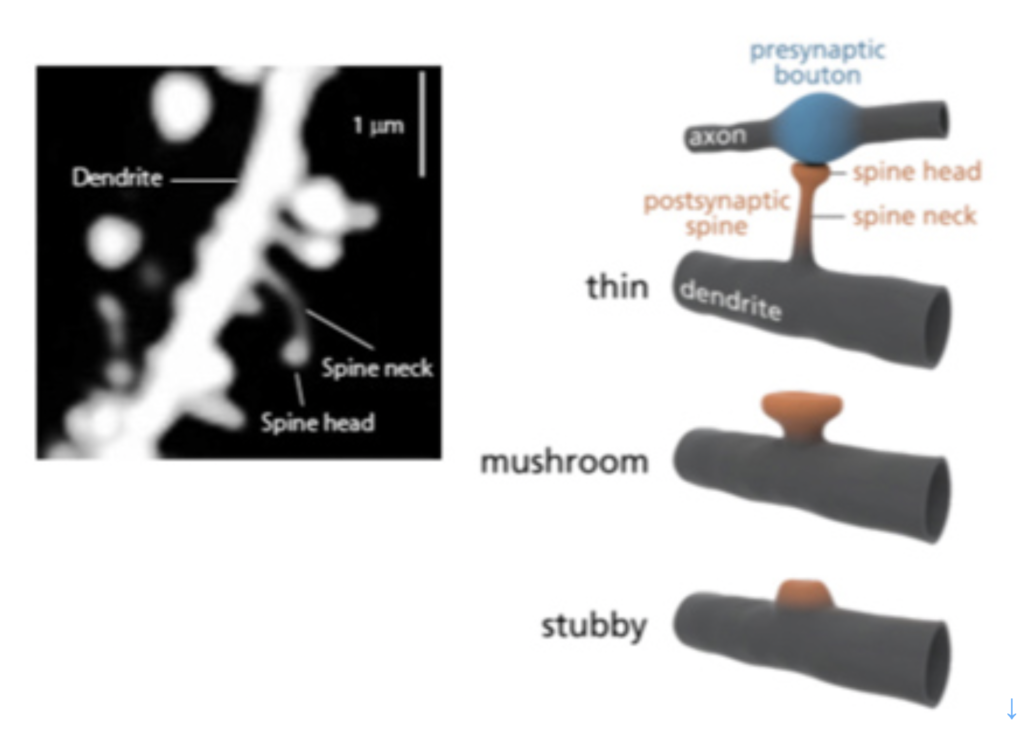
哺乳動物の脳でのシナプス形成の中心は、神経細胞の樹状突起から飛び出たスパインと呼ばれる構造と神経軸索との接合により担われている(図1)。この時、刺激は必ず神経軸索からスパインへと伝達される。
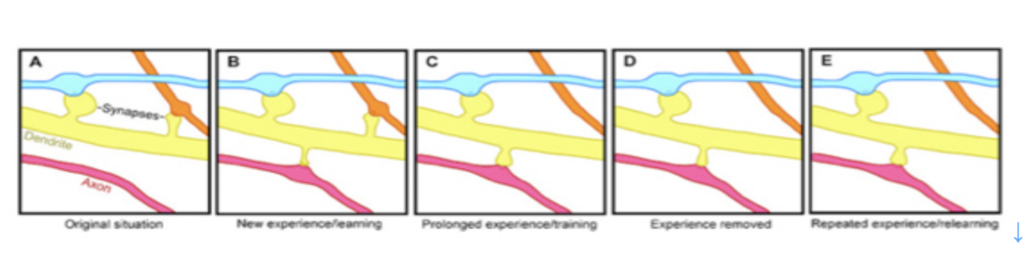
同じくウィキペディアから転載した図2を使ってスパインのダイナミズムを説明しよう。図2のAからEは一本の樹状突起から出るスパインの変遷が示されているが、樹状突起はスパインを伸ばして、複数の神経軸索と結合し、興奮を受け取ることができる。図に示されているように、学習によりスパインと軸索の結合はダイナミックに変化し、回路の特性が変化すると考えられてきたが、スパインの消長を実際に観察することは難しかった。
ところが2015年夏スタンフォード大学から、生きたマウスの脳内の樹状突起から飛び出すスパインをなんと22日間にもわたって観察し続けた論文が発表された(Attardo et al, Nature, 523:592-596, 2015:論文はウェッブからアクセスできる:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4648621/ )。
この研究では、樹状突起の細胞膜が蛍光を発するように操作したマウスの脳に一種の内視鏡のような長焦点レンズを挿入して、樹状突起のスパインの消長を22日間観察している。実際の像については論文を参照してほしいが、図2で示したよりはるかにダイナミックなスパインの消長が起こっている。また、中には極めて安定なシナプスを形成しているスパインが存在することもわかる。
同じ方法を用いて、学習から睡眠中という短い時間サイクルで大脳皮質のスパインがダイナミックに変化することを示した論文も最近発表された。(Ma et al, Nature Neuroscience, doi:10.1038/nn.4479)。この研究から、学習時によって一本の樹状突起から軸索に伸びるスパインの数は増加するが、睡眠(REM睡眠:睡眠中も盛んに目が動いており、夢を見ている時はこの睡眠時期にある。覚醒中に学習した記憶を整理して必要な記憶を固定化する過程に関わると考えられている)に入るとスパインは剪定され数が減る。しかし、一部のスパインではより大きな終末をもつスパインへと構造変化が起こり、このようなシナプスは長く維持されることが明らかにされた。
これはマウスの大脳皮質での観察だが、一回覚醒と眠りのサイクルを繰り返すうちに、一本の樹状突起のスパインに、目に見えない生化学的変化だけでなく、シナプスの数や構造といった目に見える形態的な変化が刻々起こっていることが明らかになった。スパインの数は1000兆を越すと考えられているが、毎日これらのスパインが発生、剪定を繰り返し、その中から長期間安定なシナプスが形成されている。このダイナミックな過程を直接観察できるとは、今後の解析が楽しみだ。
脳を持つ生物が生きている間様々な経験を繰り返すと、その入力により脳回路は不断に作り直される。この結果経験が異なれば、まったく同じ脳構造から始めても、それぞれの個体の脳構造は自ずと違ってくる。すなわち、独自の個性が発生する。重要なことは、この違いを生み出す原理は単純で、入力により神経回路を構成する神経細胞のスパインの数や構造を変化させておこる神経細胞同士の結合の強さの違いが生まれるだけだ。しかし、脳の細胞数が増大するにつれて、異なる強さで結合した神経同士から形成される回路は、ほぼ無限の多様性を持つことができ、無限の個性、無限の原始的自己が発生する。
私の勝手な定義と断った上で、以上をまとめると、脳神経系の原始的自己とは、生物個体の脳神経の個性のことで、経験入力により回路が書き換えられた後の脳神経系だ。従って、脳神経の原始的自己も刻々変化する(図3)。重要なことは、この脳神経系が経験する入力は必ずしも個体外からの刺激だけではなく、体の表面、内部からの刺激も入力として扱われ、原始自己の形成に関わっている。これは、免疫の自己も同じと言える。ただ私たち人間の脳と比べると、こうしてできた原始的自己は、自分で自己として認識されることはない。すなわち、脳神経システムが、脳神経システム内の自己を認識できるようになるためには大きな転換が必要になる。これについては次回以降考えることにする。
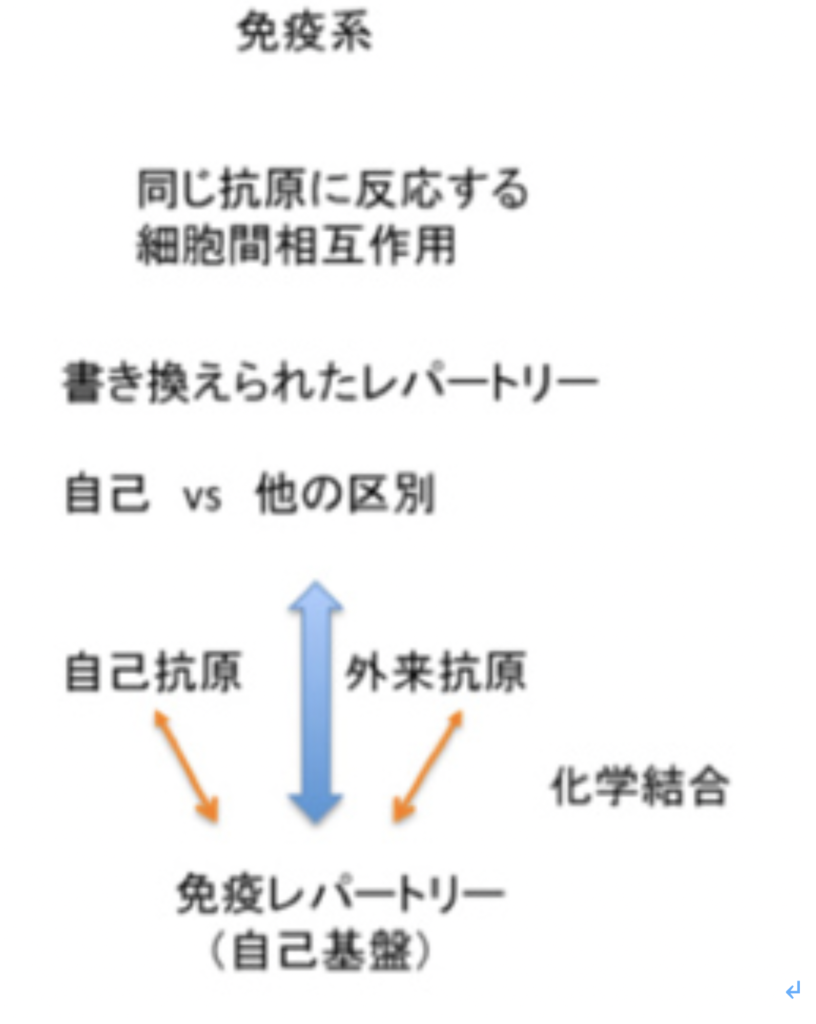
その代わり、最後に免疫系と脳神経系を比べて終わりたい。免疫系も、ほぼ無限と言っていい抗原に対して反応することができ、自己と他を区別できる。しかし、神経系と比べるとその複雑性には限界がある。この原因として、脳神経系と免疫系の情報を扱う形式が異なっていることがあげられる。
図3で示した脳神経系の原始自己と比べた時、免疫系では抗原(T細胞抗原としてのペプチドも含めて)は、抗原受容体を刺激し、刺激された細胞の特異的な増殖、生存、細胞死を誘導して、免疫担当細胞のレパートリーを書き換えることで経験が表象され、記憶される(図4)。
図4 免疫系では外来と自己抗原の区別は、反応性抗原受容体のレパートリーの差として表現されている。
レパートリーと表現したのは、個々の免疫担当細胞が異なる抗原受容体を持っており、この細胞が様々な比で集まったものが免疫系だからだ。抗原と抗原受容体は化学的に結合し、免疫担当細胞のレパートリーも抗原との化学的結合可能性と表現することができる。また、免疫システムの反応も、抗原との化学的結合を必ず前提として行われる(図5)。
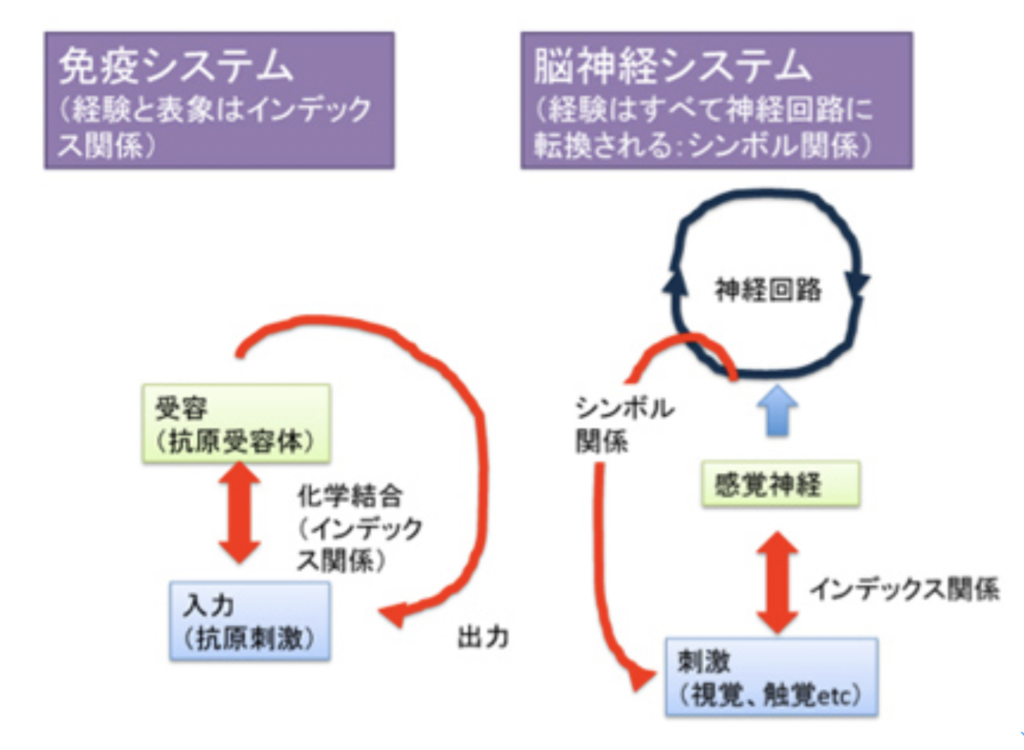
ぜひここで思い出していただきたいのは、パースの記号論だ(http://www.brh.co.jp/communication/shinka/2016/post_000011.html )。抗原刺激という経験と、その表象、記憶、反応が、抗原vs抗原受容体との化学結合を基盤として持っている点で、免疫系はパースのいうインデックス記号関係を基盤にした情報システムと言っていい。
これに対し、脳神経系では入力はまず感覚神経の興奮を誘導する。この入力の時点では、感覚細胞内で光子が色素を活性化したり、ニオイ物質が嗅覚受容体に結合することで神経が興奮するため、ここでもインデックス関係が成立していると言える(図5)。しかしインデックス関係が成立するのは感覚細胞内までの話で、感覚が神経膜の興奮に転換され、全く別の神経回路として表象されると、経験と、それに対応する神経回路との間に物理・化学関係は完全に消失している。この意味で、脳神経系の経験(刺激)とその表象と記憶の関係は、パースのシンボル関係と言える。
脳神経回路を基盤とする情報システムは、おそらくDNA情報に続いて地球上に誕生した新たなシンボル情報の誕生と言っていいだろう。このシンボル情報であるということが、ほぼ無限の複雑性を獲得する重要な契機になったが、そのためにはまず意識と、脳神経回路の自己を認識できる「脳神経回路」の誕生が必要だった。
[
西川 伸一 ]
意識と自己
2017年3月15日
ベッリーニのオペラに「夢遊病の女」という不思議なタイトルの作品がある。結婚前夜に夢遊病のために無意識になった主人公が伯爵の部屋に迷い込んで寝込んでしまうが、他の男のベッドで寝ているのを知った婚約者が「不倫だ、破談だ」と大騒ぎになる。無実の主人公は悲嘆にくれるが、今度は村人が集まっているところに、夢遊病発作で再び無意識に陥った主人公が現れ、無実が証明されるという、荒唐無稽な話だ。 音楽は美しいのだが、実際の舞台を見るといつも違和感が残る。ベッリーニがどんな意図でわざわざこのテーマを取り上げたのか不思議に思っていた。
ところがシチリア、カターニャの大聖堂を訪れた時、ベッリーニがこのテーマに並々ならぬ意欲を持っていたことがよくわかった。大聖堂には彼の棺が祀られているが、なんとこの墓のレリーフには、最もよく演奏される「清教徒」や「ノルマ」を差し置いて、夢遊病の女のシーンが、音楽の一節とともに使われていた(図1)。
しかし本当に夢遊病はあるのだろうか?卒後7年ほど医師として過ごしたとは言え、内科だった私には実際の患者さんを見た経験はないし、心の片隅ではまだ信じられない。しかし数多くの論文が毎年発表されおり、総説を読んで見ると、ベッドから起き出して歩き回り、そのことを覚えていないという症状はなんと15%以上の子供に見られるらしい。
眠りとの関係も明らかになっており、年齢を問わず夢遊病で徘徊するときは、ノンレム睡眠と呼ばれる最も深い睡眠時に入っていることがわかっている。すなわちゆっくりした脳波を示す熟睡状態のまま、患者は歩き回っている。驚くことに、服を着替えて車を運転したという報告もある。徘徊中は図1に示したレリーフからわかる様に、目は大きく見開き、背筋を伸ばして歩いており、障害物も的確に避けることができる。しかし、呼びかけても気がつかないし、普通は眠りが覚めたら徘徊中のことはほとんど覚えていない(総説によると(Blake and Logothetis, Visual Competition, Nature Review
Neuroscience, 3:1 (2002))実際には6割程度の患者さんが発作中の経験を一部ではあるが思い出せるらしい)。
その存在を信じる、信じないは別として、夢遊病は、私たちが通常「意識」と呼んでいる機能が喪失しても、外界を感知しそれに合わせた行動を取ることが可能であることを示している。言い換えると、外界の知覚、その表象、記憶を呼び起し、イメージの統合、行動の決定から実行までが、「意識」なしに可能であることを示している。
夢遊病の例を最初に持ち出したのは、もちろん今回から意識の問題を取り上げて、脳神経系の「自己」の問題と一体化して考えていこうと思っているからだ。ただ意識とは何かと大上段に振りかぶって考えるのは、私の任ではない。古来、意識については様々な説明がなされ、現在なおその本態については議論が続いている。
他の脳機能の単純な延長に過ぎず、わざわざ「意識」として抜き出して考える必要はないという意見から、神経系を持つ動物全てに存在するという意見、あるいは人間だけが意識を持つとする説まで様々な考えがある。このため、以後の議論は、意識の定義には深入りしないで、私たちが普通、覚醒時に行動するときには存在して、夢遊病の発作時の行動には存在しないものを意識と、まず漠然と定義しておいて進める。
もちろん熟睡時や、麻酔で眠っている時も意識は存在しない。しかし夢遊病の例は、意識がなくとも私たちは、リアルタイムに入ってくる感覚やこれまでの経験に基づいて行動できることを教えている。しかし意識がないと、新しいことを計画して行動することはない。このように意識の存在はこれまで経験したことのない新しい認識を可能にし、将来に向けた計画的行動には必須の条件になる。
睡眠中や麻酔中に意識は失われるが、意識は覚醒していることではない。覚醒していても、意識せずに行動することはいくらでもある。
私は毎朝ノルディックウォークを日課にしている。ストックを持ってクロスカントリーと同じ要領で歩くウォーキングだ。若い人ならすぐできるのだろうが、私の年になると、最初は自動的に足と腕の動きが揃うことはない。「意識」を集中して、「右、左」とうまく揃うように努力する。しかし100mも歩くと、もう意識しないで腕と足は互い違いに動くようになる。逆に、急に足が止まった後歩き出す時、どの腕を出すのかなどと意識しだすと、逆にうまくいかなくなる。意識を排除して動けるようになると、今度は意識がその動きを邪魔する。
あらゆるスポーツで同じことが見られる。スポーツの練習とは、意識しなくても自然に体が動くようになるまで動作を繰り返すことだ。テニスでも、サーブを打つ相手の微妙な動きを情報としてそれに合わせて走って行く場所を選び、レシーブする一連の動きが意識しないでできるようになると、一人前になる。実際、プロのテニス選手の200km/hを越すサーブがどこに落ちるか見てから行動しても遅い。無意識に動けるからこそ、プロの試合が成立する。どれだけ無意識になれるかが、優秀でクレバーな選手といわれる条件になるのは逆説的だ。
覚醒と意識が全く異なることを一番よく教えてくれるのが盲視と呼ばれる病態だ。何らかの理由でV1と呼ばれる一次視覚野に損傷を受けると、網膜で受けた刺激は知覚できない。しかし、網膜は働いており、そこから直接視床をとおる経路が存在しているおかげで、患者さんは障害物を意識しないまま避けることができる。もちろん患者さんは全く見えないと思っている。当然、景色を眺めて今度はあの道を通ろうなどと新しいことを計画することはない。視覚だけに限れば、夢遊病と同じに見える。しかし、音や臭いについては意識することができているし、明らかに覚醒している。
このように、無意識に個別の運動を支配したり、視覚のみ意識できない盲視の例は、意識が脳内に分散して活動を支配していることを示している。もちろん夢遊病のように意識全体が失われることもあることから、意識を形成する神経ネットワークも階層的なネットワークを持ち、支配する範囲が変えられる様だ。
さてこれまで、意識を夢遊病の発作時に失われる、新しい認識や計画のために必要な何かと定義してきたが、この定義だと意識は人間特有の高次脳機能だという話になりかねない。夢遊病から話を始めたが、私自身、意識は決して高次機能に限るわけではなく、原始的な形は神経回路形成以降かなり初期から存在していたのではないかと思っている。このことを理解してもらうため、意識をもう少し生物学的に調べている研究を見てみよう。
意識の生物学的役割を理解するための面白い例が、両眼視野競争と呼ばれる現象に見られる。両眼視野競争とは、左右の目に異なる像を別々に見せる時、実際にはどちらか片方の像だけが見えて、もう一方が見えない現象を指している。もちろんそれぞれの像は左右の網膜で感知され、反対側の一次視覚野へ投射されている。しかし、実際に私たちが見えていると感じるのはどちらか一方だけで、残りは見えているのに全く認識できない。多くの場合、2つの像が入れ替わり立ち替わり意識に上り、最後はどれか一方の絵が優勢になる。この実験は、私たちは見ていても見えないものがあり、見えるかどうかは意識にかかっていることを示している。すなわち、意識は競合している両眼の像のどちらを認識するかを決めるのに働いているのがわかる。
意識により競合する知覚が選択されるという現象は、なにも両眼競合に限るものではない。図2に示した、見方によって若い女性が見えたり、老婆が見えたりする有名なだまし絵も、意識によりイメージが選ばれていることを示す例だ。
図2 有名なだまし絵:若くて高齢の女性。心理学者エドウィン・ボーリング(Edwin Boring)がこの絵を用いた視覚の研究成果を1930年に発表した。
これらの例から、内外からの様々な刺激により脳内に形成される数多くの表象の中から一つの表象を選ぶことが、意識の機能と考えることができる。脳神経回路に入ってくる情報量の膨大さを考えると、この選択システムがないと、脳はすぐにパンクしてしまう様に思う。
もちろん神経系だけが環境からの膨大な情報に曝されているわけではない。安定的に見えるゲノム情報でも、様々な外界からの情報に曝されており、介入を受け続けている。最近注目されているCRISPR/Casシステムも(http://www.brh.co.jp/communication/shinka/2014/post_000009.html )、本来バクテリアが自分のゲノムへの外来ゲノムの侵入を制限するため進化したもので、ゲノム情報が常に外来の情報に曝されており、その情報を制限する必要があることを示している。
また、免疫系はもともと外来の様々な物質に対応する備えとして進化してきた。しかし、これら2つの系では、外来の刺激の認識自体が、例えばDNA同士の組み替え、あるいは抗原と抗体の結合の様に、物理化学的制限を受けている。従って、抗原受容体のレパートリーに認識できる抗原の数は制限される。
一方脳神経システムでは、入り口の刺激情報こそホストの感知能力による制限(例えば音の波長、光の波長などの制限)を受けてはいるが、この程度で情報量を制限することは不可能だ。例えば視覚で言えば、錐体細胞だけでも片方に800万個も存在する。さらに1次視覚野だけで見ても、この情報は刻々かわる。
さらに厄介なのは、光、音、触覚、匂いなど入り口は違っても、結局脳回路に表象されると、入り口の違いに関わらず表象同士で連結することができる。この様に、連結可能性まで考えると、私の脳が例えば1分で晒される情報の量は途方も無い。
このことを電車の中で席に座っている状況で考えてみよう。前に座っている女性の顔はあまり動かないが(ときには笑ったりあくびをしたりしているが)、窓の外の景色は不断に変わり続けている。これに加えて、様々な音が耳に入ってくる。また、足から、お尻から伝わる振動。頭の後ろに感じる太陽の熱。そして、時によって胃がシクシク痛むといった内臓からのシグナルも入ってくる。これを全部総合すると、何ビットになるだろうか。さらに、最初の刺激が異なっていても、神経回路の興奮に還元されると、あらゆるインプットは連結できる。おそらく電車に座って1分で経験する情報は天文学的量にになっているはずだ。このままだと、どんなに神経細胞が増え、回路が複雑化しても頭の中がパンクすることは間違いない。
幸い、ここに意識が登場すると、状況は一変する。例えば前に座った美しい女性に意識を向けると、窓の外の景色も、電車の揺れも、太陽の熱も、胃の痛みすら消えることがある。
逆にどこから来るかわからないが、お腹がシクシク痛むのが気になり始めると、今度は車外の景色や振動どころか、前の女性すらすっかり見えなくなってしまう。
この例から言えるのは、私たちの脳神経系が刻々と曝されている膨大な情報の中から、意識は特定のセットを選び出す役割を果たしているということだ。神経系での情報が神経細胞ネットワークとして表象されていることを認めると、意識が行っているのは、興奮している様々なネットワークの中から少数のネットワークを選んでいることになる。
この様々な神経回路上に形成された表象を選ぶ役割が意識だと定義すると、少し複雑な神経細胞ネットワークを持つ動物は意識が存在してもおかしくはない。たとえば、動物を訓練する時、こちらが期待する行動を取った時だけ、褒美を与えて覚えさせること広く行われている。この時、褒美を与えることで、特定の行動につながるネットワークが選択される。これは、広い意味で意識されたと言える様に思う。
極端な例で言えば、アメフラシにも意識があって何の不思議もない。アメフラシの水管反応を誘導するエラの刺激を繰り返すと、慣れが起こって水管反応が起こらなくなる。そこに電気ショックを頭に与えると、また水管反応が起こるようになる。これは電気ショックを受けた回路の影響で、エラの刺激が再び水管反応の刺激として選択されたことを意味しており、神経回路の選択を意識として定義するなら、最も原始的な意識と呼んでいいと思う。
ここまで、最初は極めて高次な神経活動として意識を提示しておきながら、一転アメフラシの神経系で見られる神経回路の選択まで意識に含めてしまうと、混乱の極みとお叱りを受けそうだ。しかし、何を基準に膨大な情報から選択が行われるのかを考えていくことで、この混乱は収束できる。その点について、最後に少し触れておこう。
両眼視野競合の際に、縦縞と横縞を別々の目に提示したとしよう。ほとんどの人は縦、横に特に好みはないはずで、実際縦縞と横縞が周期的に現れる。おそらく、サルや猫のような両眼で見ている動物では同じことが起こっている。とすると、この異なるイメージが周期的に選ばれるという選択基準は、私たちの脳回路自体にプリセットされていると考えられる。
同じ模様を使っていても、明るさなどが大きく違っている場合は、最終的にはっきりしている方だけが見える様になる。はっきりしたほうを最終的に選ぶ基準も、生まれた時の脳回路にプリセットされていると考えていい。
ところがもう少し複雑なだまし絵になると、どんなに努力しても片方の絵柄が見えないという人も出てくる。この場合、個人の脳回路の特性による場合もあるが、それに加えて個人が過去に得た経験・学習の結果、特定のイメージにバイアスがかかってしまっている可能性もある。
この様に、表象が選択される基準を探っていくと、進化や発生過程で形成される脳回路自体の特性、あるいは学習や経験により新たに書き換えられた脳回路である場合もあることがわかる。また学習による脳回路の書き換えも勘定に入れ出すと、簡単な書き換えから、極めて複雑な書き換えまで多様性が高いと考えられる。この結果、当然同じ刺激により生まれる表象に対しても、選択基準は一人一人、異なっている。
この様に選択する基準について考えてみると、ゲノムから高次の脳回路書き換えまで、極めて多様な基準が働いていること、そしてこれらの低次から高次にわたる基準は、前回 まで議論してきた、脳回路情報として表現される自己に他ならないことに気がつく。ついに、意識と自己が一つにまとまった。
次回はさらに、意識の選択基準について議論を深める。
[
西川 伸一 ]
意識と無意識
2017年4月3日
最初意識を夢遊病状態と覚醒状態を区別するものとして始めながら、最後はアメフラシにも意識があっていいなどと前回 終わったので、混乱させたのではと反省している。
なぜこのような議論になったかを思い出してもらうと、私たちが普通感じている意識のような高次脳機能が関わる現象を、「脳に入力される情報から、それまでの経験をもとに形作ってきた神経系の自己を基準に、一部を選択する」ことと定義したことに起因する。もし意識が入力の選択過程だけなら、最も単純なアメフラシの神経系でも同過程は存在していい。
ただ忘れてはならないのが、選択の基準となる各動物の神経回路に表現されている自己は、単純な回路から複雑な回路まで、多種多様な点だ。神経回路として同じ原理を共有していても、その違いはアメフラシから人間まで途方もなく異なっている。当然、脳神経系が複雑になればなるほど、神経回路に表現された自己自体も複雑になり、それに基づく選択基準も多様かつ複雑になる。従って、脳内に入ってきた情報を自己を基準に選択するという点では同じでも、選択過程は質的、量的に大きく異なる。最初定義した狭い意味での意識はこの選択過程のほんの一部を代表する最も高次な過程に関わっている。
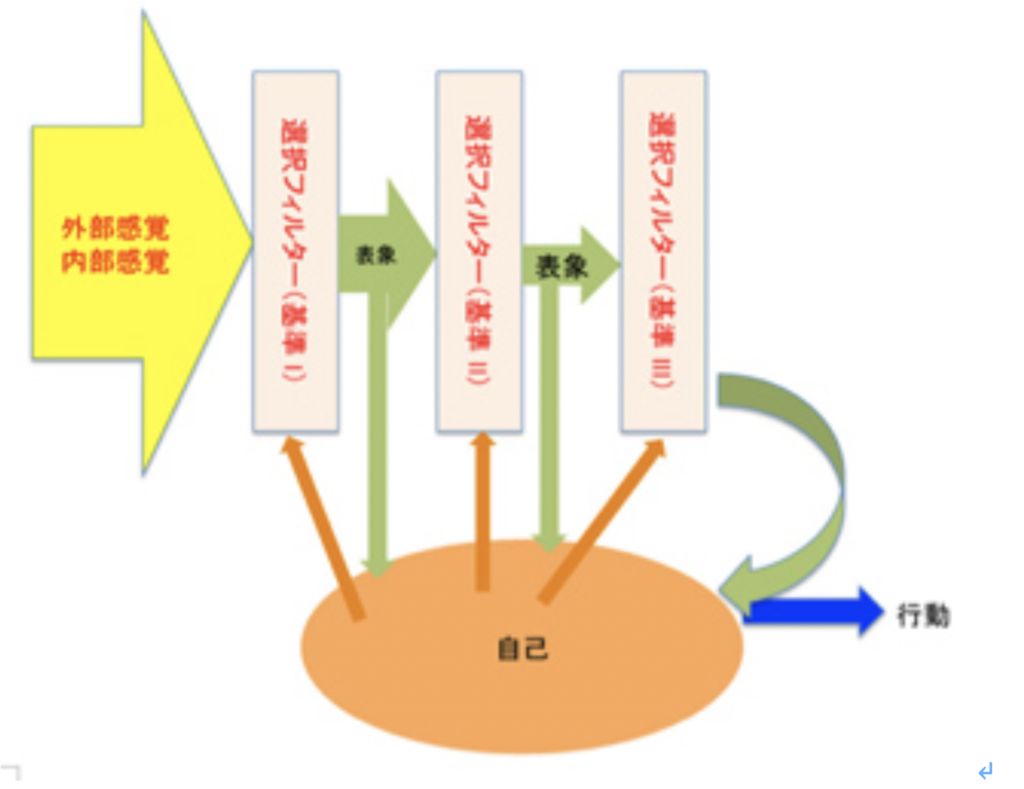
図1:意識を形成する脳内活動。自己の様々な回路に合わせて選択が起こり、選択された表象がまた自己の神経回路に統合される。
図1を使って説明しよう。私たちの脳は多くの情報に曝されているが、基本的には自己の生存に必要な情報だけを選択して他の情報を無視するフィルターを持っている(この傾向がすべての脳回路には備わっており、選択する行為自体を動機付けている)。このフィルタリングを受けた情報が脳内に新しい表象を作る過程が感覚として認識されることが意識だが、神経系の自己全体が反映されたフィルタリングが起こるレベルは多様で、同じ刺激に対しても、様々な表象が選択され、脳の異なる領域に新たな回路が生まれる。こうして選択された様々な表象は、既存のネットワークと統合され、短期的、長期的に脳ネットワークの書き換えが行われるが、最初に定義した意味での意識に上るのはその中のほんの一部になる。すなわち、ほとんどの選択過程は意識されることはない。
もう少し具体的に見てみよう。感覚神経は様々な刺激に反応できる。視細胞は光に、聴覚は有毛細胞への圧力、嗅覚はニオイ物質の嗅覚受容体への結合を神経興奮に転換する。この神経興奮は他の多くの神経興奮とともに統合され表象されるが、この表象は入力とは全く物理的関係を持たず、神経ネットワークの構造変化としてシンボル化されている。まずこの入力に対応する表象を形成する過程でフィルターが存在している。例えばそれぞれの感覚神経細胞レベルで感受できる刺激に限界が存在し、これがフィルターになる。分かりやすく言うと、どんなに頑張っても私たちには紫外線は見えない、また高ヘルツの音波を感じることもない(図2)。
図2:最も原始的なフィルター。それぞれの感覚神経の、刺激に対する閾値は最初のフィルターになる。当然意識されることはない。
次に、アメフラシの水管反射で、エラからの神経回路が、頭からの神経回路の刺激を受けると新たな回路を構成する例からわかるように、他の入力とネットワークが形成されることで、一つの入力だけでは生まれない新しい表象が生まれる。このような表象はしたがって、神経ネットワークの連合の仕方に変化が起こることでもフィルターされる(図3)。
図3:新しい神経回路の連絡路の形成もフィルターになる。
これは単純な回路の例だが、私たちのように複雑な脳になると、連合過程でのフィルターが常に行われていることがもっとはっきり見えてくる。例えば私たちは網膜に入る感覚を、目を動かす動眼神経の運動と統合させることで、空間内の物体を形として背景から区別し、物体の動きを追跡している。すなわち、一つの表象が少なくとも2種類の全く異なる入力を統合することで形成される。すなわちこの統合過程も表象を形成するまでに通過するフィルターと考えることができる。このフィルターの基準となる神経系の自己は遺伝、発生過程で決まるだけでなく、発達途上で経験を通してネットワークが書き換えられることで形成される。
この結果、外来刺激に対する異常な反応は、神経ネットワークの発生異常でも、生後の発達過程の回路形成過程の以上でも起こる。たとえば同じ顔の写真を見たとき、自閉症や統合失調症の患者さんたちが意識に上らせる表象が、普通の人とはずいぶん違っていることはよく知られている。以前私のブログで紹介したことがあるが(http://aasj.jp/news/watch/753 )、てんかん発作の原因を確かめるために脳内に埋め込んだ電極を記録に使った研究から、健常児の扁桃体は通常目に強く反応するが、自閉症児は口に反応することがわかっている。すなわち、同じ像を見ても、フィルターされる表象は全く異なる。
このように脳が高次化するに従って、フィルターの基準となる神経の自己も多様化し、フィルターされた表象が書き換える神経ネットワークも多様化している。前回 述べたように、人間のような複雑な脳を持つ生物の場合、これらの書き換えは狭い意味で意識される場合もあるし、意識されない(無意識)場合もあるが、行われていることはどちらも様々なレベルの神経的自己を基準にした表象の選択だ。したがって、脳の複雑さが一定レベルに達するまでは、すべての選択は、我々の言う「無意識」下に行われる。一方、特定のレベルを超えると、最初定義した狭い意味の意識過程としての選択が誕生することになる。実際、高度に発達した脳を持つ人間も、生まれてすぐは、入力の選択による表象の形成と新たな脳へ書き換えが起こるとはいえ、おそらく意識はまだ存在しない。例えば両眼競合は起こっても、どちらを選択したかを意識することはないだろう。しかし、成長するにつれ選択結果が意識できるようになる。このことからも、入力の選択による表象が、進化過程、発生過程、成長過程で起こる脳構造の変化に応じて起こり、その一部だけが意識されることがわかる。
ようやく問題が狭い意味での意識に戻ってきた。要するに、意識の基盤にある過程は、ほとんどの動物に存在する神経回路の基本的性質だ。そして、脳の発達があるレベルに達すると、意識が生まれる。ただ意識を可能にする脳機能についてはまだ定説はない。神経回路内での選択過程を認識できる意識に特化した新しい回路が出現したと考える研究者が存在する一方、意識は選択時の基準となる神経回路の複雑化の延長上にあり、意識だけのための特定の回路は存在しないと考える研究者もいる。おそらく現時点ではこの議論を脳科学的にこれ以上進めることは難しいと思う。この結果意識の問題は、もう少し現象論的レベルで議論されることになる。
実際、入力の選択についていえば、無意識下の選択、選択した結果の認識、意識による表象の選択などを、脳科学的メカニズムから離れて現象論的に考えることは現在も普通に行われている。このような様々な意識や無意識、あるいは基準としての様々なレベルの自己、表象選択の動機付けの問題を現象論的に考えた巨人がフロイトだ(図4)。
図4:フロイトのポートレート(出典:wikipedia)
フロイトは精神分析学の父としておそらく最も有名な精神医学者と言っていいだろう。科学者や医学だけでなく、彼は20世紀の哲学に大きな影響を与えた。彼の著作を読んだことがなくとも、彼の用語、「エゴとイド」「リビドー」などの言葉を知っている人は多いのではないだろうか。
彼の生涯はほぼカハールと一致しているが、おそらく彼の精神についての現象論を神経回路に当てはめて考えたことはなかっただろうと思う。しかし普通の人間の行動の傾向、あるいは様々な精神疾患の患者さんの異常な行動を、現象学的ではあっても共通の基盤から科学的に説明しようと努力した。そして、この共通基盤の重要な要素として、「イド、エゴ、スーパーエゴ(エゴイデアル)」、「無意識、前意識、意識」、そして「力動、リビドー」などの概念を提唱した。
これらの概念の詳しい説明は次回に回すが、「イド、エゴ、スーパーエゴ」の概念は、これまで議論した入力の選択基準になる神経回路の様々なレベルの自己に対応すると考えられるし、「無意識、前意識、意識」の概念は、入力選択後の表象が、脳回路を書き換える過程で意識の意味を考えるためのヒントを多く与えてくれる。そして、「力動、リビドー」は、これまで議論してこなかった疑問「意識を維持する力とは何か?意識、無意識を問わず選択、表象、統合に関わる神経回路を動かし、新しい神経系の自己を形成し続ける原動力とは何か?」を考えるための重要な示唆を与えてくれる。
次回は、フロイトが進めた私たちの精神についての現象論について解説して、意識と自己についての説明の最後にしたい。
[
西川 伸一 ]
フロイトに見る意識と自己
2017年4月17日
意識と自己についての説明を長く続けすぎたので、そろそろ締めくくらなければならない(本当はこの程度の長さで扱える課題ではないのだが)。
普通、意識や自己はかなり高次な神経活動と思いがちだが、これまでの説明で定義次第で様々なレベルの神経活動に当てはまることがわかっていただいたと思う。とはいえ、意識や自己といえば、やはり哲学をはじめ多くの分野で古くから議論されてきた人間の精神活動を思い浮かべるのが普通だ。したがって、締めくくりとして、人間特有の高次の意識や自己について少し考えてみたい。どのように説明すればいいかいろいろ考え、締めくくりにはフロイトを2回にわたって取り上げてみることにした。
今更フロイトを取り上げる意味は本当にあるのか少し迷った。そんな古い話を持ち出さなくとも、現代では、人間の意識や自己について脳科学的に説明した優れた著作を読むことができる。事実、素人の私がここまで脳科学の知識を整理できたのも、アントニオ・ダマシオさんの「デカルトの誤り」「Self comes to mind」「感じる脳」、やクリトフ・コッホさんの「意識の探求」といった本のお陰だと思っている(図1)。
これらの本には多くの脳研究成果が取り入れられており、しかも一般の人にもわかりやすく書かれている。わざわざ解説するより、人間の意識や自己について知りたいと思われる場合、どれか一冊を手にとって読んでもらうのが一番いい。読めば間違いなく満足できると思う。また、上にリストしたすべての著作では実際の脳神経回路と現象を対応させて説明する努力が行われており、症状や行動の現象論的記述と、独断的(に見える)な説明に終始するフロイトを読むよりよほど分かりやすい。
実際、フロイトを読んでも、脳科学の話はまず出てこない。彼の著作にはダーウィンがなんども登場し、進化論の影響を強く受けていることを感じる。もちろん進化の問題だけでなく、種の起源の最終センテンスでダーウィンが全く手つかずの未来の問題として提示した無生物から生物への過程についても興味を持っていたことはまちがいなく、彼の著書の中で「種の起源」に書かれている内容を彼の著作で繰り返しているほどだ(ちくま学芸文庫「快感原則の彼岸」 p162参照、「過去のある時点において、現在もなお想像できない力の影響によって、生命のない物質の中に生命の特徴が芽生えた」)。ところが、カハールも含めて脳科学の話はフロイトの著作にはほとんど登場しない。おそらく当時の脳科学はまず役に立たないと考えていたのだろう。
しかし、神経科学的視点からの説明が全くされていないことは、神経細胞の進化からスタートしてここまで続けてきた私から見ると、本当は都合がいい。脳科学的に考えるにはまだ早い時代であったとはいえ、フロイトは精神現象を共通の基盤に基づいて科学的に説明しようと常に心がけていた。精神現象を、「エス、自我、超自我」、「意識、前意識、無意識」、「リビドー、タナトス」などの共通の要素から分析しており、個別の現象に対する彼の普遍的説明は理解しやすい。このおかげで、フロイトが記述した様々な精神現象と、それについての彼の説明を、もう一度神経科学の視点から整理し直すことができる。一方、これまで私自身は人間特有の高次な意識や自己について議論を避け、神経ネットワークが複雑化する延長に人間特有の精神活動もあるとして済ませてきた。この認識は間違っていないと思うが、複雑化することで何が可能になったのかは全く手つかずのままだ
一方、フロイトの興味はもっぱら人間の意識だ。従って、自己や意識についての彼の考えを現代の脳科学を知った上で見直すことで、これまでなおざりにしてきた人間特有のレベルの意識や自己の発生に関わる過程についてもヒントが得られることも期待できる。これが、フロイトを選んだ理由だ。
フロイトの考えを紹介するための著作として、今回はフロイトの短い著作「自我とエス」(竹田青嗣編、中山元訳、自我論集、ちくま学芸文庫)を選んだ。これは後期の著作で、一般人に向けた読み物というより、総説論文に近く、短いとはいえ彼の考えが詰まっており、また現代脳科学からも扱いやすい。
例えば意識や自己の発達過程について、フロイトは次のように述べている。
「個人の発展の最初期の原始的な口唇段階においては、対象備給と同一化は互いに区別されていなかったに相違ない。のちの段階で性愛的な傾向を欲求として感じるエスから、対象備給が生まれるようになったと想定される。最初はまだ弱々しかった自我は、対象備給についての知識を獲得し、これに黙従するか、抑圧プロセスによってこれから防衛しようとする。」
「少年の成長について簡略化して記述すると、次のようになる。ごく早い時期に、母に対する対象備給が発展する。これは最初は母の乳房に関わるものであり、委託型対象選択の原型となる。一方で少年は同一化によって父に向かう。この二つの関係はしばらくは並存しているが、母への性的な欲望が強まり、父がこの欲望の障害であることが知覚されると、エディプス・コンプレックスが生まれる。」
この2つの文章には、意識や自己という言葉は使われていないが、フロイトが考えた意識や自己の形成過程に必要な要素が凝縮している。また私がこれまで人間に限定せず見てきた自己や意識について述べてきた重要な要素も含まれている。従って、目標はこの文章を理解することだ。ただフロイトを読んだことがない読者もいるだろうし、彼の文章には一般には使われることのない単語も多く使われているので、まずフロイトの意識や自己に関する考えについて総論的に要約する。とは言っても、ここで述べることは全て私の独断的なフロイト理解であることは断っておく(フロイト解釈で議論する気は毛頭ない)。
まず意識、無意識から始めよう。フロイトというと、「無意識」がすぐに思い出される。しかし彼の著作では無意識については詳しく述べているものの、「意識する」とは何かについて、ほとんど明確にしていないように思う。この論文の中でも「<意識されているとは、まず純粋に記述劇な用語であり、最も直接的で確実な知覚に依拠するものである」と、意識されているものについて簡単に済ませてしまっているが、肝心の「意識とは何か?」についての彼の考えは明確ではない。おそらく彼の理解も、私たちが一般的に意識という言葉で使っているのと同じ内容、あるいは夢遊病を例に定義した意味とあまり変わっていないように思う。
これはフロイトの問題ではなく、意識の厳密な定義が現代でも難しいためで、フロイトの時代にはまだ「両眼競合」のような実験結果も知られていなかった。しかし彼の著作を読むと、彼も私たちと同じように意識を様々な知覚から生まれる脳内の表象を認識して選び取る過程として捉えていたように思う。
私たちはともすれば「意識 vs無意識」と対立的に提示してしまうが、そもそも両者を比べること自体難しい。よく考えてみると意識とは多くの表象の中から特定の表象を知覚する「過程」を意味することが多い。一方、無意識の場合、「無意識する」のようには決して使わず、常に意識過程の外にあるという「状態」を指すことが多い。従って、「意識されるものvs無意識のもの」と対置するのは不自然で、「意識されるものvs意識されないもの」の方が自然だ。すなわち、意識はより過程に関わる言葉として使われることが多く、もう一方は状態を指す言葉として使われる。
フロイトの興味はもちろん人間の心の状態なので、意識されるものについてはあまり重視していない。代わりにフロイトは心の状態の最も大きな部分をしめる、無意識に向かうことになる。
誤解を恐れずフロイトの無意識を「エイヤ!」と意識との関わりから分類してしまうと、無意識とは、
1)意識できなかったもの:例えば両眼競合のように、見ていても気づかない表象のように、いつでも意識される可能性はあったが、選ばれることのなかった状態を指している。 2)忘れて意識できなくなったもの:意識過程で選ばれ知覚されたものの、速やかに意識外に過ぎていく状態を指している。分かりやすく言えば、記憶されなかった表象と言って良いだろう。 3)意識させてもらえないも:意識できないよう抑えられているもの の3種類に分けられる。
最初の2つについては、フロイトは「無意識は潜在的に意識できる状態と一致するもの」と述べて、起きている時にいつでも意識できたのだが,たまたま意識過程で選ばれなかったり、忘れてしまったものとして簡単に済ましている。これを脳科学的に見れば、感覚を通して入ってくる膨大な入力の中からほんの一部の表象を選んで神経ネットワークの書き換えていることに相当する。
ところが、3番目の「意識させてもらえない」無意識は、フロイトの言う「抑圧された」無意識で、私もこれまで全く議論してこなかった。この抑圧された無意識が何を意味するかについては、最初に引用した文章によく書かれている。文章に出てくる備給という言葉はおそらく馴染みがないと思うが、Cathexisの日本語訳で、心的な関心を向けることを意味する。私自身はこの大げさな単語を見た時は、意識する表象を選択する過程に、具体的な方向性と必要なエネルギーを与えることと読み直している。
この文章でフロイトは、父親についての表象が生まれることで、幼児時代に本能的に母親の乳房に向いていた意識過程、すなわち母への性的欲望が抑圧され、無意識(すなわち意識過程から除外された状態)へと追いやられると述べている。すなわち、成長に伴い、本能とは異なる判断基準が自己の中に芽生え、これが母親への性的意識を無意識へと抑圧する。この抑圧された結果としての無意識は、毎日の感覚の中から意識下、あるいは意識外へと選択される無意識とは全く異なり、抑圧を取り除かない限り無意識から意識へと上らせることは難しい。すなわち、抑圧される無意識は、意識過程で選択が行われるという意味では同じだが、両眼競合で見られるような選択とは異なり、高次のレベルで抑制され続けている心的状態と言える。
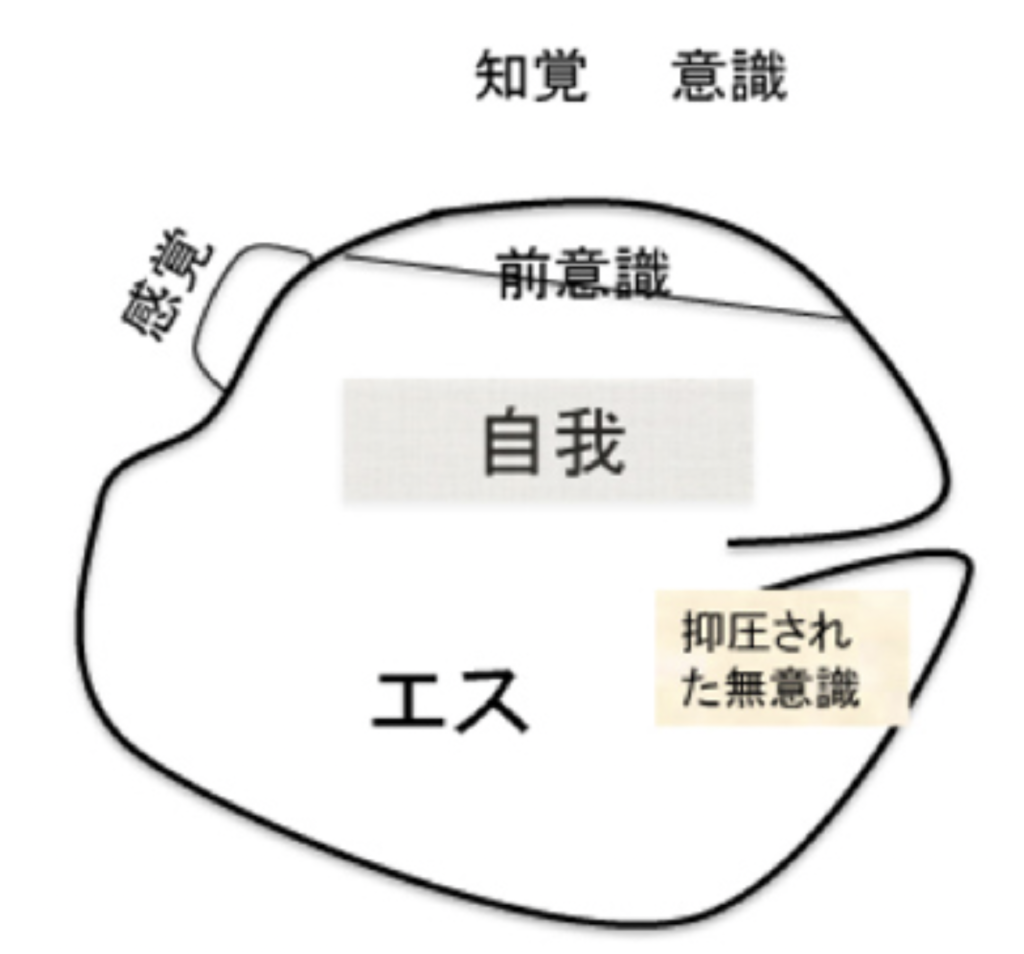
このように、最初の2つの無意識と、3番目の無意識は質的に異なっていることから、フロイトは前者を前意識、後者を無意識と名付けている。このように、無意識に様々な種類があるということは、意識と無意識を分ける時の基準になる自己にも様々なレベルが存在することになる。この基準としての多様な自己を、フロイトは「エス、自我、そして超自我」という言葉で対応させた。
図2は「自我とエス」に掲載されている、自己の精神についてフロイトが描いた図式をほぼそのまま転載したものだが、この図を見ながら彼が自己をどのように考えていたのかもうすこし見ていこう。
線で囲まれた部分が個人の精神的自己全体を表しており、この中に前意識、抑圧された無意識という2つの状態も含まれている。重要なのは、自己の中の表象を選び認識する過程である意識は、自己の枠外に置かれていることで、これにより意識が自己の中に存在するコンテンツではなく、より過程に近い物であることがうまく表現されている。
では、エスや自我とは何か?引用した文章の中でフロイトが、「最初弱々しかった自我」と表現しているように、最初から自我は個人の心に存在するのではなく、生まれてから経験を繰り返すうちに心の中に芽生えてくる物として考えられている。すなわち、経験を通してのみ形成される新しい選択基準と言っていいだろう。
一方、エスは生まれた時から存在し、母への本能的な性的愛情も最初から存在するエスの表れと考えられている。すなわち、フロイトのエスは人間が生まれた時に持っている脳神経ネットワークが生きるために最初から備えている様々な本能と言っても良いだろう。
私自身はこれまで自己についてこれほど詳しく区別せず、脳神経ネットワークが複雑化した結果、選択基準となる自己も多様な表象を持っており、一人の個人に様々なレベルの自己が存在するとして済ませてきた。しかし、生まれてから物心着くまでの一定期間、人間には狭い意味での意識とその記憶は存在していない。従って、記憶や自己の意識は、生後の成長期に形成されると直感できる。この直感は、「自我からその核としての知覚システム(意識)が形成される(図1に表現されている)」というフロイトの考えと同じだ。
誕生時に持ち合わせた脳神経ネットワークの活性を「エス」、この中で成長に応じて高次化する意識過程で選ばれた表象取り込んで脳神経ネットワーク(エス)の中に新たに形成した回路を「自我」考えることはできないだろうか。脳科学的に、純粋に生後の経験だけで生まれる「自我」を完全に分離できるかわからない。フロイト自身も、「エスは、知覚—意識システムの媒介のもとに、外界の直接的な影響を受けて変化する。自我はこのエスの一部である。・・・・」と、本当は両者を完全に分離することはできないと考えている。ただ、経験を通して自伝ともいうべき基準を人間は作ることができるおかげで、新しいレベルの意識が人間には可能になっている。この感情や本能(エス)の上に、自伝を書くメカニズムの解明が、人間とは何かを理解し、次の情報媒体「言語」を考えるための第一歩になる。
期待通りフロイトをたどることで、これまで手がつかなかった人間特異的なレベルの自己や意識の問題について考えることができてきた。まだ、母親へ向かう性的本能を抑圧するのは自我か?フロイトの言うもう一つの自我、「超自我」とは何か?そして意識という過程にエネルギーを与える力は何か?など、フロイトの考えの解説が残っているが、少し長くなりすぎたので、今回はここで止める。次回、最後はフロイトの描いた図1を、現代的な新しい視点で書き直すことで、最初に引用した文章を完全に理解して終わりたいと思っている。
[
西川 伸一 ]
フロイトの意識と自己
2017年5月1日
前回 ・今回とフロイトの考えを紹介しているが、彼の文章を題材に、高次の意識や自己を説明することが目的だ。そこで、前回引用したフロイトの文章をもう一度掲載しておく。
「個人の発展の最初期の原始的な口唇段階においては、対象備給と同一化は互いに区別されていなかったに相違ない。のちの段階で性愛的な傾向を欲求として感じるエスから、対象備給が生まれるようになったと想定される。最初はまだ弱々しかった自我は、対象備給についての知識を獲得し、これに黙従するか、抑圧プロセスによってこれから防衛しようとする。」
「少年の成長について簡略化して記述すると、次のようになる。ごく早い時期に、母に対する対象備給が発展する。これは最初は母の乳房に関わるものであり、委託型対象選択の原型となる。一方で少年は同一化によって父に向かう。この二つの関係はしばらくは並存しているが、母への性的な欲望が強まり、父がこの欲望の障害であることが知覚されると、エディプス・コンプレックスが生まれる。」
前回 、フロイトの意識、前意識、無意識の区別、あるいはエス、自我、対象備給などについて説明したので、この文章もだいぶわかりやすくなったのではないだろうか。
今回は私自身がこの文章をどう読んでいるかもう少し突っ込んで紹介しながら、最後に残っている超自我や、私たちの意識や自己を動かしている力動について説明したいと思う。
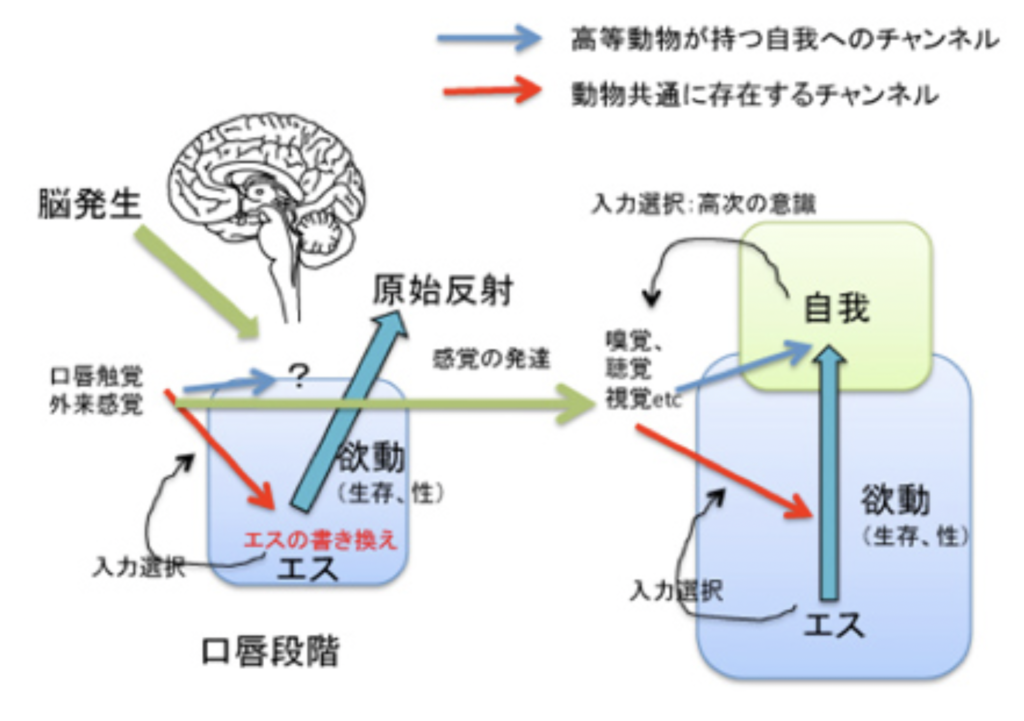
口唇段階の本能で動く脳がエスの始まり
生まれたばかりの私たちは「原始的な口唇段階」、すなわち食べ物を得るため母の乳房を探るという本能により動かされる段階にある。実際、この段階の神経回路の特徴を小児科では原始反射と呼んでおり、口唇に関わる反射が多い。例えば口に物が入ると吸い付く反射、口唇に触れるものを追いかける反射などが有名だ。フロイトが「口唇段階」と名付けたのもこのような古くから知られる赤ちゃんの行動に基づいている。フロイト流にいえば、この段階の精神はほぼエスに等しいと言える。
従ってエスをもう少し実体的に表現すると(対応させること自体は意味がないが、理解のためにこのような対比を今後も行う)、外界からの刺激を経験しない、発生が終わったばかりの脳内神経ネットワークと言える。この脳には自分の生命を守り、外界からのストレスを避けるためのメカニズムが進化の過程でプログラムされている。
幼児の成長に伴う脳の書き換え(同一化)
生まれるとすぐ(実際には生まれる前から)、動物は様々な感覚システムを通して外界から刺激を受け、その一部は高次の意識とは無関係に、できたばかりの脳ネットワークに介入し、ネットワークを書き換えることができる。以前議論したようにこの書き換えは、膨大な入力の中から私たちの脳がその時点で形成している「自己」の基準に従って特定の入力を選択し、神経ネットワークに記憶する(書き換える)ことで進んでいく。これが広い意味での意識だが、この書き換え課程は、フロイトの文章の中の「同一化」とほぼ同じと考えていい。生まれたばかりの「口唇段階」の自己(この場合エス)では、行動のほとんどが母の乳房へと向く様に脳はプログラムされている(対象備給)。しかしこの単純な行動を通して、様々な外界からの感覚を経験する。最初は口唇感覚に限られていたものも、皮膚感覚や匂い、音、そして最後に視覚というように入力装置は複雑化するとともに、入力量は急速に拡大し、新しい経験で私たちの脳のプログラムは徐々に書き換えられていく。この初期段階での入力を選択する自己の基準はエスであり、生まれた時点で備わっている本能的自己だ。もちろん、入力が選択され神経ネットワークの自己が書き換えられるとき、エス=本能的自己も書き換わっていく。このことは、先に述べた新生児の原始反射が発達に伴い消失することからわかる。代わりに、より複雑な外界からの刺激を選択し、本能的自己を書き換える過程で、ハイハイなどの新しい機能が発達する。
自我と高次の意識の誕生
問題は、このような神経ネットワークの書き換えの延長に、高次の意識や自我が発生するかで、この点が意識とは何かをめぐる議論の一番重要な論点だ。おそらくフロイトは自我がエスの単純な延長にあるのか、それともエスとは別の自我を受ける構造が発展するのかあまり気にしていなかったのではないだろうか。前掲の文章で彼はエスから自我が芽生えると述べており連続的に考えていた様に見える。ただ「自我とエスの区別は、原始人だけではなく、はるかに単純な多数の生物にも認めることができる。この区別は、外界の影響の必然的な表現だからである」と、最初の脳ネットワークの自己であるエスと、外界の感覚入力を通して形成され成長するもう一つの自己である自我を分けることの重要性も認識していた。すなわち、エスの中に、エスとは区別された新しい自己、自我を発生させる入力処理機構が必要になる。
しかしこの区別は決して前回 、図1で示したような固定した区別ではない。抑圧された無意識もエスの一部として記憶されると彼が考えた様に、エスはキャパシティーの大きな、自我も無意識も全て包含することができる、変化し続けるフレキシブルな構造だ(本来脳とはそのようなものだ)。このような構造の中にエスとは別の自我が形成されるのは、生後間も無く経験する感覚器を通した様々な入力が、高次の意識や自我を持つ動物の進化で生まれた、それまでとは別のまったく新しいチャンネルを通して処理され、表象されるからと考えられる。
自我を形成する新しい入力チャンネル
実際、口唇期の感覚の中心となる触覚と比べると、最後に発達する視覚認識は、もともと多くのチャンネルを必要としている。私たちは目に入ってきた人間の姿を認識するとき、網膜の視細胞からの入力を、色や単純な形、あるいは物体の動きといった要素として別々に表象する。この過程はほとんど意識されることはない。これらの要素がイメージとして知覚されるためには、この要素を今度は過去の経験も合わせて上から(トップダウン)統合する必要があり、このトップダウン過程は意識される。このように、私たちの脳は本来多数のチャンネルを使って、感覚入力を処理するようにできている。そして、生後経験し続ける感覚入力を統合する際の特別な領野が用意できれば、そこに自我、あるいは新しい自己を形成することが可能になる。これを意識をコードする領域と言っていいのかもしれない(あるかどうかは議論が多いが)。
ではこの新しい領野にどの入力が選択され、記憶され、自我を形成するのだろうか。最初存在する自己の基準はエス、すなわち本能的自己により提供される。生きる本能が乳房を追いかける反応として現れることを思い出してほしい。しかし、エスのレベルで選択されたどの表象が、生まれたときにはまだ白紙状態の自我の書き換えに利用できるのかよくわからない。口唇の触覚を通して経験される感覚はおそらくそれほど複雑でなく、ほとんどの入力が最初の自我の形成に使われるのかもしれない。こうして一度でも自我の形でエスとは別の自己が成長し始めると、この自己を基準に自我回路は書き換えられ続け、自我レベル、すなわち意識される自己が成長する。ただ、入力は意識され、自我の書き換えだけに用いられるわけではない。エスも様々な入力により書き換えられるため、生まれたばかりの状態を代表する様々な原始反射は消失する。
エス・自我・意識のまとめ
これまで議論したことを図にしてみた(図1)。口唇期では外界からの入力はエスとしての自己を基準に選択され、エスの書き換えが行われるとともに、萌芽的自我の形成とその後の書き換えに使われる。こうして自我という新しい自己の基準が形成されると、その後は新しい自己の基準として、高次の意識過程を可能にする。この結果、私たちは「物心がつく」、すなわち感覚器から入ってくる経験を意識し自己の形成に使う。
フロイトは、知覚から生まれる前意識が意識されると、こうして得られた表象は全て自我の形成へと向かうと述べているが、実際私たちの自我が意識的に知覚される入力を選択する唯一の基準になると考えれば当然のことだ。自我が高次の意識の基準であり、それを基準に選択された表象が自我を書き換える。以上が、最初に引用したフロイトの文章の現代風読み替えになる。おそらくみなさんも、引用した文章でフロイトが伝えたかったことは、概ねわかってもらえたのではないだろうか。
しかしまだ、自我により抑制された無意識や、超自我についての説明が残っている。これらの概念は、私たちを自我やエスに基づいて行動へと駆り立てる精神的エネルギーと関わっており、私自身も全く議論してこなかった。
快感を得るための欲動
フロイトは、このエネルギーの源が、「快感」が満たされるまで止むことのない欲動であるとはっきりと述べた。この欲動の起源についてフロイトは、最も重要なのは生存への欲動と、繁殖への欲動で、両者に共通する最も大きなエネルギーの源が性的欲動、リビドーであるとした。このリビドーという用語は、その後ユングにより欲動一般を指すものとして定義し直される。しかし、当時自己とは何かなどと議論していた宗教家や哲学者を尻目に、私たちの脳は快感を追求するようプログラムされているおかげで行動するエネルギーを得ていると、ズバリ指摘したのは、フロイトの最も偉大な業績の一つだろう。
余談になるが、「快感原則の彼岸」とタイトルのついた小論文で、彼はこの欲動の生物学的起源について進化論に即して議論している。単細胞動物の生殖や性、あるいは多細胞動物の始まりと「個体の死」の始まりといった当時の生物学の知識を総動員して、「生きることへの欲動」「生殖のための欲動」そして無限に続く生殖細胞系列を守るための「死への欲動」などが、精神を動かすエネルギーのルーツであると述べている。言葉を変えると、私たちの精神行動エネルギーが、生命として必然的な帰結であることを述べている。
欲動の中で最もわかりやすいのは「生存への欲動」だろう。例えば新生児期を考えると、口唇段階でのこの欲動は空腹を満たすために必須のメカニズムだ。欲望が満たされるまで、子供は母の乳房を求め続ける。男の子になると、この生存への欲求に、男性が本能的に持っている女性への性的欲動が混じる。いずれにせよ、感覚器が発達し、複雑な感覚入力により自我が複雑化するにつれ、欲動の表現も複雑になる。しかし、そのエネルギーのルーツを辿れば、必ずエスの中に組み込まれた生存欲、性欲を生み出す脳構造に帰結する。これを
「個人の発展の最初期の原始的な口唇段階においては、対象備給と同一化は互いに区別されていなかったに相違ない。のちの段階で性愛的な傾向を欲求として感じるエスから、対象備給が生まれるようになったと想定される。」
とフロイトは表現している。
エディプス・コンプレックスの起源
この欲動のエネルギーおかげで幼児は行動し、外界と持続的なコンタクトを維持することができる。最初は原始反射を繰り返しながら、生後徐々に発達する五感を通して経験される母親の表象は常にアップデートされ、幼児期の自我の書き換え(すなわち同一化)の基準を提供する。もちろん人間社会では通常子育てには父親など母親以外の人間の参加があるが、母親以外が表象され自我の書き換えに参加するのは、五感、特に視覚が完成し、母親以外の人間が意識されるようになってからのことだろう。したがって、最初の自我は母親の表象を中心に形成されており、それ以外の表象は常に母親との対比で自我の書き換えに参加する。
これは私の想像で当時のことを覚えているわけではないが、子供を可愛がるのは母親だけではない。父親も子供をあやそうと抱きかかえるとき、子供は母親から一時的にでも引き離されると感じるかもしれない。もちろん父親には母親に期待する乳房はない。当然母とは異なる父親の表象が生まれ、自我を書き換える過程で、母親から引き離す新しい競争相手として父親をイメージしても不思議はない。
フロイトは、このとき形成される母親をめぐる競争相手としての父親と自我との関係を、精神の発達に最も重要な要因であると強調し、
「ごく早い時期に、母に対する対象備給が発展する。これは最初は母の乳房に関わるものであり、委託型対象選択の原型となる。一方で少年は同一化によって父に向かう。この二つの関係はしばらくは並存しているが、母への性的な欲望が強まり、父がこの欲望の障害であることが知覚されると、エディプス・コンプレックスが生まれる。」
と述べている。
「不快」を行動のエネルギーにする超自我
しかしもし子どもの行動を支配するエネルギーが「快感原則」であるとすると、「不快」がなぜ精神を動かすエネルギーになるのかが問題になる。
もちろん動物は「不快」な経験を記憶し、それを回避する脳回路を開発している。当然この書き換えは、自我の書き換えを伴う。だとすると、「不快」の原因である父親を、避けることで母親との「快」の関係を維持する以外に「快感原則」を守る方策はない。おそらく、多くの動物で子育てにオスが関与しないのは、子供への愛情が発達しないのではなく、子供にとって父親が「不快」でしかないことが原因かもしれない。
一方人間を見ると、乳児が父親の「不快」な介入を避けることは難しい。従って、不快を我慢する能力を身につけるか、あるいは積極的なエネルギーへと変換できる自我を開発する必要がある。この「快感原則」と取引できる自我の形成こそが、人間の利他的行動や、道徳の起源だと思う。この「不快」を選ぶという人間の特殊性を、フロイトは無意識と、超自我という概念で説明しようとした。
この問題提起は
「最初はまだ弱々しかった自我は、対象備給についての知識を獲得し、これに黙従するか、抑圧プロセスによってこれから防衛しようとする。」
という文章に見ることができる。
すなわち母親や父親のイメージが明確になってくると、それまで「快感原理」のみに動かされていた行動に矛盾が生じ「不快」を生むようになるが、残念ながら両親に守られている身分では、「不快」を避けるという解決自体が不可能であることが理解される。これが、「父がこの欲望の障害であることが知覚されると、エディプス・コンプレックスが生まれる。」と彼が語る、エディプス・コンプレックスだ。しかし、このコンプレックスは、行動で解決できる代物ではない。このため、不快を避けるのではなく、自分で解決する必要があり、そのために自我を大きく書き換え、自我の領域にこの問題を解決するもう一つの領域、「超自我」が発生する。
この超自我の誕生により、「自我理想(超自我)はそもそもエディプス・コンプレックスの抑圧というこの急激な転換によって成立する」と彼が語るように、「不快」を「快感」へと転換させるエネルギーが生まれる。
すなわち、「快感原理」自体が私たちを動かす本来のエネルギーであっても、この原理を維持するため、不快な経験を快感原理と妥協させる能力、すなわち超自我を人間は獲得した。したがって、フロイトはあらゆる道徳的、宗教的動機は全てこの超自我の仕業であると喝破して見せた。
このように、エス、自我、超自我、前意識、意識、無意識、欲動、リビドーというフロイトの用語は、現代の脳科学から見ても十分説得力があり、さらに人間特有の高次な脳機能を考える時、色褪せることのない道標になってくれる。この中で、超自我として表現される機能は人間特有の機能だろう。従って、彼の超自我の機能の解明は、21世紀脳科学の最大の問題の一つと言っていいだろう。
これでフロイトは終わるが、次回は整理の意味で、私たちの精神のエネルギー、情動について現代の脳科学がどのように考えているのか、幾つかの総説を基礎に述べてみたい。
[
西川 伸一 ]
快感原理
2017年5月15日
「ケセラセラ、なるようになる」と楽しく生きている人もいると思うが、多かれ少なかれ、だれでも自分の行動原理を持っている。例えば宗教や道徳は多くの人にとって行動を決めるときの強い原理として働いている。実際「あなたは行動に当たって何を最も大事に思いますか?」とあらためて聞かれて、「快楽を求めて生きています」と、ドンファンを気どる人はほとんどいないはずだ。私も、「余生は若い人のために」とか「患者さんの助けになれば」とか答えるのが普通だが、答えた途端なんとなく偽善的だなと後ろめたい気持ちに襲われる。
人間には従うべき行動原理があるというドグマに対し、私たちの行動のエネルギーの最も重要な要素は快感原理に他ならないと断定したのがフロイトだ。私たちの快楽を追求するために行動し、嫌なことを避けるために行動しているだけだと建前を切り捨てた。
しかしこのことに気づいたのはフロイトが最初ではない。同じ趣旨のことを17世紀オランダで活躍した偉大なユダヤ人スピノザは彼の著書「エチカ」の中で、人にとっての善悪は結局好きか嫌いかの感情でしかないと述べている。
図1:スピノザの肖像
その幾つか引用すると(全て岩波文庫、畠中尚志訳)、
「我々をしてあることをなさしめる目的なるものを私は衝動と解する。」
「全及び悪の認識は我々に意識された限りにおける喜びあるいは悲しみの感情にほかならない」
「我々は速やかに出現するだろうと表象する未来のものに対しては、その出現の時が現在からより遠く隔たっていると表象する場合よりもより強く刺激される」
「善及び悪の真の認識が感情である限り、それから必然的に欲望が生ずる」
「喜びから生ずる欲望はその他の事情が等しければ、悲しみから生ずる欲望よりも強力である」
などなど、要するに「善は快楽、悪は不快」とまで言ってしまうと、17世紀にかなり自由な国だったオランダとはいえ、キリスト教支配のヨーロッパでは禁断の思想となったのは当然だ。
前置きが長くなったが、これまで長々と述べてきた「意識・自己」についての話の最後は、快楽がどう私たちの行動を支配しているのかについての最近の研究を紹介して終わる。スピノザやフロイトも脳の快楽中枢について研究が行われる日が来るとは想像だにしなかっただろうが、この分野の第一人者Berridge とKringelbachの共著で書かれた2編の総説 (Kringelbach & Berridge, The pleasure circuit found
in the brain. Scientific American , p40, 8月号、2012、 Berridge & Kringelbach, Pleasure system in the
brain, Neuron, 86, 646, 2015)を読むと、面白い研究が進んでおり、これを読めばフロイトも大いに興奮しただろうと思うので、これら総説の内容を私なりに脚色しながら紹介したい。
電極を挿入して局所的に脳を刺激する治療法(脳深部刺激療法)は現在パーキンソン病を中心に様々な疾患に利用されている。しかし脳の病気を電気刺激で治療する可能性追求の歴史は古く、1938年イタリアで統合失調症に対して行われたいわゆる電気ショック療法が最初だ。私が医学生の頃、精神科ではこの治療法は広く行われていた。効果はあると習ったが私自身は現場に立ち会ったことはない。その後、様々な向精神薬の開発が進み、通電時の身体的・精神的苦痛を懸念して、この治療は下火になった。
代わりに外科的に電極を脳に埋め込み、留置した電極を介して微小電流を脳内で流す脳深部刺激治療が開発され、現在パーキンソン病の治療などに広く行われるようになっている。この方法の開発研究の初期に、重いうつ病治療のために視床下部や側坐核周辺の脳幹部に電極を挿入された患者さんが電気刺激を受けている間だけだけうつ症状が改善し、笑うようになることが報告された。驚くことに、この治療を受けた一人は、刺激スイッチを自分で押すことを許可されると、なんと3時間に1500回もボタンを押し、一種の中毒症状を示したことが報告される。この結果は、脳の中に快楽中枢があることを示す証拠として大きな話題になった。
一方実験動物ラットの中脳辺縁ドーパミンシステムを刺激する実験からも、快楽中枢が存在することが示唆され、この実験は快楽電極(Pleasure electrode)実験と呼ばれた。この部位の刺激はラットに快感を与え、ラットを条件付けるための褒美として用いることができることがわかった。例えばラットを大きな飼育箱に入れ、4つのコーナーのうちどこに集まるかを、電気刺激で快感を与えることでコントロールすることができる。さらに驚くのは、ラットが自分でレバーを押して電気刺激をオンにできるようにすると、ラットは中毒に陥ったように自発的にレバーを押し続けるようになることが示された。この刺激中毒に陥ったラットは、食べるのも忘れてレバーを押し続け、なんと1時間に1000回もレバーを押し続けたことが記録されている。
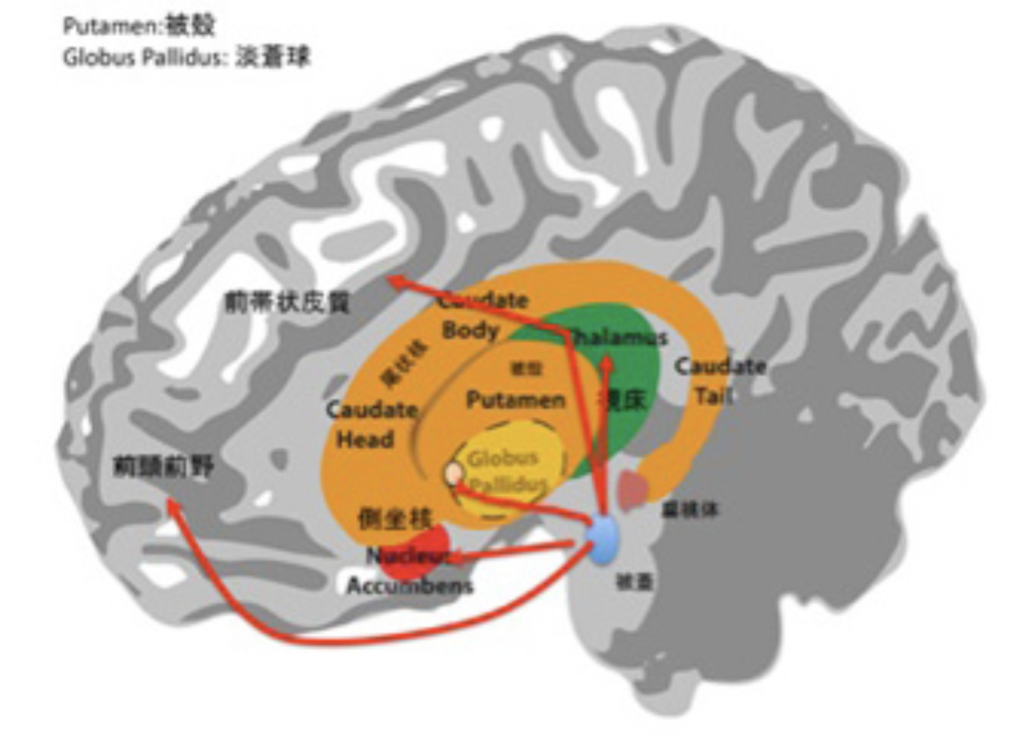
図2:最初に考えられた快楽中枢システムの伝達経路(赤線で示している。)。被蓋からの経路はドーパミンを最も重要な神経伝達分子として使っている。
この結果は他の研究グループによっても追試が行われ、図2の赤線で示した回路が脳の快楽システムを伝達し個体の行動を調節する回路として考えられるようになった。この回路の起点の被蓋にはドーパミン作動性の神経が存在しており、ドーパミンこそが様々な領域の脳細胞に褒美として使われ、行動を支配するニューロトランスミッターであるする「ドーパミン快楽説」が通説になる。実際、中毒になるほどの行動支配力が電極刺激で得られるなら、このシステムが快楽中枢として行動を支配するとするこのドグマは説得力があった。
しかしドグマは常に破られる。このドグマを疑って、快楽による行動支配のメカニズムについて新しいモデルを示したのが、BerridgeとKringelbachのグループだ。研究の歴史はすべて割愛し、快楽による行動支配が現在どう理解されているのかを、彼らの説に従って見ていこう。
彼らは人間や動物の注意深い観察を基礎に、快楽反応が実際には、3種類の過程、Wanting(モチベーション:欲)、Liking(好み、満足)、それにLearning(学習)から構成され、それぞれの過程は別々の神経メカニズムで調節されていることを明らかにした。Learningは一般的な学習のことで、快楽の基準を形成するためには必須だ。例えば、子供の頃には食べられなかった食品も、学習によりうまいと感じる。このように学習は快楽行動の形成に必須だが、今回は説明を省き、WantingとLikingについてのみ説明する。
BerridgeとKringelbachが快楽を感じている指標として最も重視しているのがlikingと彼らが呼ぶ行動で、人間の赤ちゃんからネズミに至るまで、甘いものを与えると、顔の緊張が取れて、口を少し開けて締まりのない表情になるのを観察することができるが、これに相当する。すなわち、満足感が表に出てしまうおかげで、liking反応が起こっているかどうか判断できる。(Neuronに発表された総説はウェッブからフリーアクセスなので是非写真を見て欲しいhttp://www.sciencedirect.com/science/article/pii/S0896627315001336 )。
快楽行動が、WantingとLikingと2種類の神経科学的にも別の過程から構成されていることを確認するため、「快楽反応の主要因」と考えられていたドーパミンの分泌を低下させた動物に砂糖水を与える実験が行われた。
Wantingを砂糖水の消費量、Likingは顔の表情を指標として調べると、ドーパミン産生を低下させたマウスでは砂糖水の消費量は極端に低下するが、甘い砂糖水を飲んだ時はlickingを示すことがわかった。一方ドーパミンの脳内濃度が高いマウスでは、砂糖水を飲もうとする行動が促進されるが、飲んだ後のlikingの表情は示さない。この結果から、これまで快楽回路として考えられてきたドーパミン作動性の回路はWanting、すなわち行動への欲望を高めるのに関わっており、甘い水を快楽と感じることには関わらないことを示している。
このことは、先に述べた深部刺激のレバーを押し続けるうつ病の患者さんでも確認された。すなわち、彼はボタンを押し続けていても、一言も「いい気持ち」とは語っていない。ただ、追い立てられるように行動を起こしているだけだ。おそらくこの快楽が達成できていないことが、ボタンを押すのを止められない理由かもしれない。このように、欲動と、それによる快感は分離することができる。
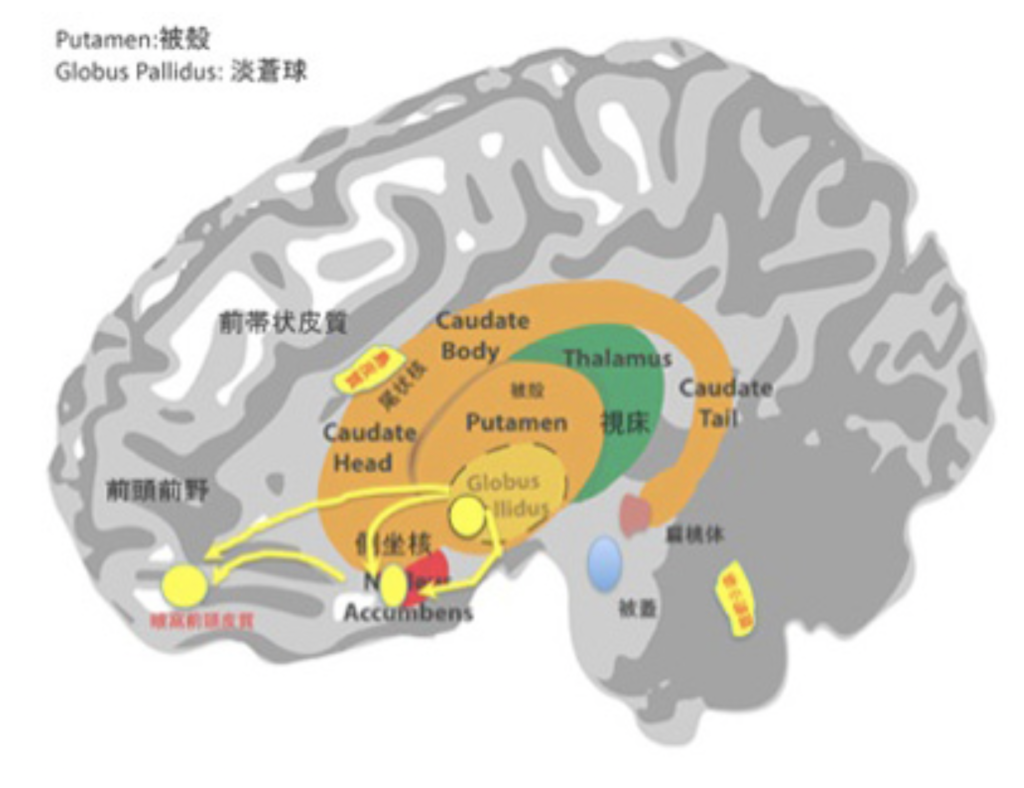
さて快楽行動に関わる2つの過程を分離して調べるための指標が決まると、次にlickingに関わる脳領域を特定するため様々な場所に電極を挿入し、その細胞を刺激(この研究ではエンケファリン(麻薬物質)が注射されている)することでlikingの表情が現れるかどうか調べることができる。脳内の様々な場所に電極を挿入してliking反応が誘導できる部位が特定され、これらの領域をhedonic
spot(快楽スポット)と名付けた。
このhedonic spotという名前からわかるように、例えば快楽を支配する中枢に相当する大きな領域が存在するというものではなく、様々な領域の中にラットの場合1mm立方ぐらいの大きさの小さな独立したスポットが集まる領域が存在することが分かった。また、hedonic hotspotが集まる領域は決して一箇所ではなく、傍小脳脚核、腹側被殻、側坐核、眼窩前頭皮質、島皮質がhedonic spotが集まっている代表的な領域だ(図3で黄色のスポットとして示している)。それぞれの領域は相互に関係しているが、例えば食事の満足で見ると、側坐核内のhedonic spotsと腹側被殻内のhedonic spotsが最も大きな役割を果たしていることが明らかにされている(図3:黄色の矢印)。それぞれは、眼窩前頭前皮質にあるhedonic spotとネットワークを作っている。これらの領域を障害する研究から、3つの領域の中では腹側被殻の障害が最も強い影響が見られることが分かっている。すなわち、hedonic spotsはネットワークで結ばれ、それぞれが異なる機能を持っていることが予想される。
さて、図2に示したように、Wnating(欲動の回路)を支配している最も重要な分子はドーパミンだったが、hedonic spotでは麻薬に反応する受容体が重要な働きをしている。ただ、麻薬に対する反応が常に快楽をもたらすわけではない。例えば、最も研究されている側坐核では、麻薬や大麻などの刺激に対する受容体と体内麻薬分子がホットスポットの興奮に関わり、liking反応を誘導する。しかし同じ側座核でもhot
spotを外れると、同じ刺激がlikingを抑制することが分かっている。要するに、快楽の感情のメカニズムは簡単ではない。
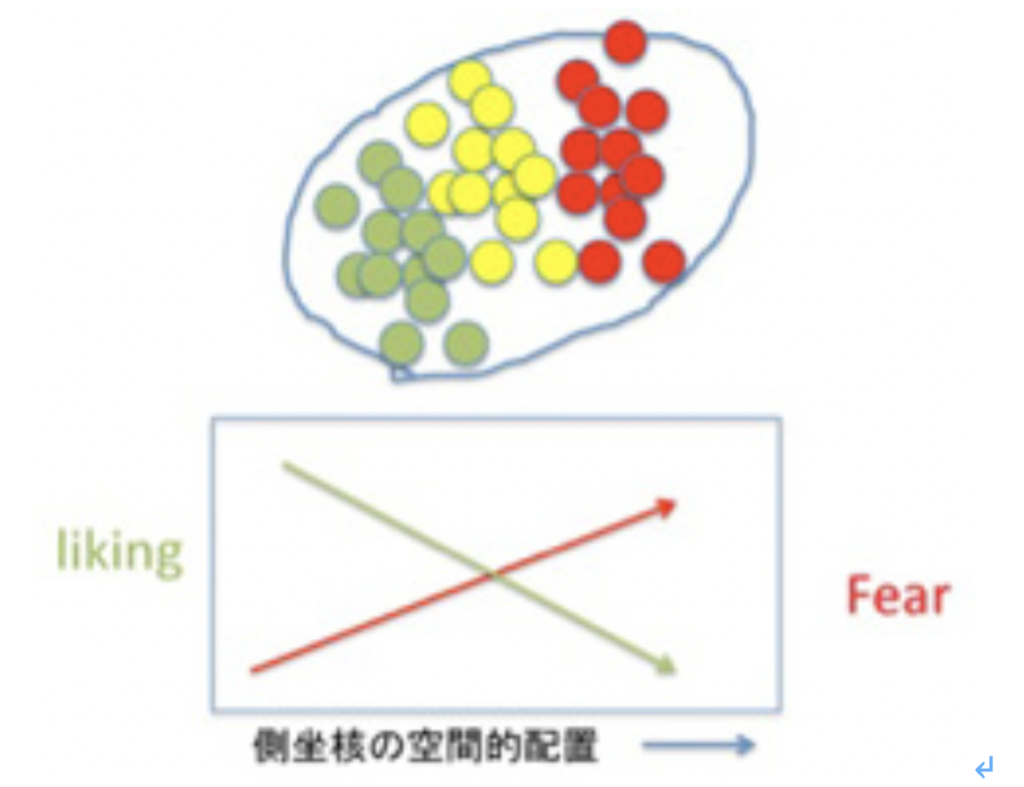
この快楽感情の複雑さを示す最たる例が「感情の鍵盤だ」だ。側坐核内の領域を丹念に刺激し、マウスの行動と対比させるマッピングを行うと、図4に示すようにlikingを高めるhot spotから嫌悪の反応を示すfear spotまでが、空間的に順序だって鍵盤のように並んでいることが明らかになった。この配置を彼らは「感情の鍵盤」と読んでいるが、快楽と恐怖が一つの領域に配置されることで、最終的感情を決めていることに驚嘆せざるを得ない。
図4側坐核の刺激実験により明らかになった「感情の鍵盤」
BerridgeとKringelbachの切り開いた快楽のメカニズム研究分野は現在急速に発展している。この結果、フロイトやスピノザが想像したように、快楽が私たちの行動を強く支配していることは間違いない。しかし、側坐核の複雑さからわかるように、これらの結果を人間の行動理解にどう当てはめていくかは簡単ではないが、hedonic spotとfear spotが常に共存して、私たちの感情を調節し、善か悪かを決めている現代脳科学の最先端に触れれば、スピノザも興奮するだろう。
またこのような感情に関わるスポットが存在する領域が脳内に散らばって、ネットワークされていることも明らかになった。このことは、このネットワークに、感情とは異なる様々な神経ネットワークが連結し、感情の強さや質を変化させ、また感情を行動に統合する。もちろんドーパミンにより作動されるWanting回路はまずこの感情回路と結合しなければならない。そしてこのようにして形成される「エス」は、さらに人間特有の脳回路と結合することで、超自我や抑圧された無意識が可能になる。この人間特有の回路とは何かを考えるときに基盤になるのが、この感情の回路であることは、現代脳科学が発達した今も、フロイトの時代から変わっていない。
次回からは人間特有の回路から生まれた最終的情報、言語について考えていく。
[
西川 伸一 ]