2025年10月16日
Dan Littman は免疫組織の形成を研究していたことから付き合いも深く、今でも当時大学院生だった慶應大学の本田さんは共著で論文や総説を書いたりしている。論文を通してその活躍ぶりを見ているが、長い期間全く休むことなくレベルの高い論文を出し続ける能力にはただただ驚嘆する。
その Littman 研究室から、今度は皮膚の毛細血管維持に関わるメカニズムについて、生きたマウスの皮膚を継続的にモニターする方法を用いて解析した研究が10月15日 Nature にオンライン発表された。タイトルは「 Niche-specific dermal macrophage loss promotes skin capillary ageing(ニッチ特異的皮膚マクロファージの喪失が皮膚毛細血管老化を促進する)」だ。
これまでの Littman 研究室の仕事とは内容が大きく違うが、生きたマウスの皮膚を非侵襲的に長期間追跡する実験システムを開発中に、たまたま気付いた問題を論文にまで仕上げたようだ。その現象とは、真皮の毛細血管に隣接して存在しているマクロファージが時間と共に失われるという現象だ。
元々最も表層にあるランゲルハンス細胞が年齢とともに減ることは知られていたが、これ以上に真皮上部のマクロファージの減り方は著しい。一方、真皮下部のマクロファージはほとんど減らない。さらに重要なことは、マクロファージの数が減ると同時に、毛細血管の数も減っている。これまで、老人の皮膚老化の重要な原因は毛細血管が低下することが一因であるとされてきたが、この背景にマクロファージの減少が存在する可能性がある。
この結果はマウスの皮膚を生きたまま長期間観察する実験システムによりわかったことだが、人間の皮膚の老化による変化を調べると、これまで言われていたように毛細血管の減少とともに、それと接して存在するマクロファージの現象が認められ、決してマウスだけの現象でないことがわかる。
次に毛細血管に接するマクロファージの役割を探るため、毛細血管にレーザーで塞栓を形成させると、マクロファージが血管のダメージを修復し、血栓を除去するのに必須であることを、ミクロの形而的観察から明らかにする。その上で、マクロファージのゴミ処理能力を低下させた遺伝子操作を行い皮膚を調べると、毛細血管の数が低下することを確認している。すなわち、マクロファージが毛細血管の質を維持することで一定の血管密度が維持されている。
次に毛細血管に接するマクロファージのターンオーバーを骨髄細胞移植実験で調べると、真皮下部の毛細血管では新しいマクロファージに置き換わるが、10週間経っても真皮上部のマクロファージは置き換わらず、局所で維持されていることがわかる。このため、自己再生できないと真皮上部のマクロファージは減っていくことがわかる。
では局所のマクロファージの再生はどのように調節されているのか?毛細血管と接するマクロファージをレーザーで取り除いても決してあらたしいマクロファージがリクルートされない。しかし、レーザーを用いて毛細血管を広く障害すると、マクロファージのリクルートが始まること、その結果毛細血管の再構成が誘導されることを発見する。
以上のことから、血管に接するマクロファージを増殖させることができれば、老化による毛細血管減少を防げる可能性が考えられる。そこで、マクロファージ増殖因子にFcを結合させたリガンドを老化マウスに投与すると、見事にマクロファージとそれに隣接する毛細血管が回復することを明らかにしている。
以上、実験から現れる小さな変化を見落とさずに、老化に伴う皮膚最表層の毛細血管減少のメカニズムを明らかにし、それを防ぐ方法まで示した、さすが Littman 研究室と思える論文だった。
2025年10月15日
今年の4月、京大の高橋淳さんたちが Nature に投稿した iPS由来ドーパミン神経移植によるパーキンソン病 (PD) 治療について、私の現役時代の様々な経験とともに紹介した(https://aasj.jp/news/watch/26576 )。また同じ号の Nature に米国スローンケッタリング ガン研究所からES細胞を用いたPDの細胞治療が報告されていた。ともに、無作為化試験でないためそのまま治療枠を広げられるかはわからないが、安全性が確認された上に、自己の幹細胞ではないので、おそらく大規模な治験が行われて治療のための最終段階が進むだろう。
今日紹介するのは、高橋さんたちの治験とほぼ同じ内容の治験が韓国の延世大学で行われたという報告で、まさに日米韓でPDの細胞移植治療の最終段階が揃い始めたことを示す研究だ。タイトルは「Phase 1/2a clinical trial of hESC-derived dopamine progenitors in Parkinson’s disease(パーキンソン病にヒトES細胞由来のドーパミン神経前駆細胞を移植する第1/2相治験)」で、10月15日 Cell に掲載された。
この論文がサブミットされたのは高橋さんの論文が発表されてからで、経過観察期間が日米の研究より短いのに Cell が掲載を決めたのは、それだけPD患者さんたちが細胞治療に期待をかけており、多くの治験が揃うことが重要と考えたからではないだろうか。
さらに個人的感慨を述べると、この研究は韓国にとって大変重要な一歩だと思う。すでにほとんどの人の記憶から消えてしまっているが、山中 iPSが発表される前、多くのグループがクローン胚からのES細胞樹立を目指していた。我が国のミレニアムプロジェクトでも、井村先生からMy ES細胞を実現したいという大きな課題を与えられたのを覚えている。これは山中 iPSで完全に解決したのだが、これは青天の霹靂で、それまではほとんどの研究者がクローン胚を使っていた。そして、これに成功しクローン胚由来ES細胞を樹立したと報告したのがソウル大学の黄禹錫さんだった。物静かでカリスマ性のある研究者で、一躍韓国の星として期待されるが、その後ES細胞が本当にクローン胚由来かについての大スキャンダルが発生し、表舞台から消えた。
この研究では、このトラウマを完全に払拭し、韓国で厳密なガイドラインに従ってES細胞治療の仕組みが完成していることを高らかに打ち出せている。責任著者の Dong-Wook Kim は個人的にも期待していた韓国の研究者で、米国が長く、ビザ申請の推薦書も書いたことがあるが、時間をかけて母国でこれを成し遂げたことは本当に嬉しい。
さて結果だが、高橋さんたちが選んだPDよりは少し重症の患者さんが選ばれ、ほぼ同じ場所に、細胞数では高橋さんたちより少ない細胞(6割ぐらい)を投与している。また、投与箇所についても尾状核は同じだが、それ以上の場所の制限は置かず緩やかな選択を行なっている。今後治療を拡大するためには重要だ。
期間は1年だが、大きな副作用はほとんどなく1例で見られた血小板減少が最も重要なものだった。
さて効果だが、600万個、300万個移植の両群で、パーキンソン症状測定指標の改善が見られ、主観的な改善も全てで見られている。さらに、FDGペットで調べる腫瘍発生の可能性も全く見られないかった。このように、これまでのすべての治験で安全性が確認されたことは今後の治験加速につながる。
高橋さんたちはDOPAの取り込みで機能を調べているが、この研究ではドーパミントランスポーターをPETで調べている。結果、このイメージング検査と症状がほぼ完全に一致することから、今回の結果はプラシーボ効果よりは実際の細胞治療効果と考えられると結論している。
以上、日米韓で同じ結果が揃ったことは、今後様々な工夫も含めた競争で治療が進むことを意味し、患者さんにとっては嬉しい結果だ。一方、iPSを使ったのは我が国だけで、尚且つ高橋さんたちは免疫抑制剤なしに治療ができるMHCを合わせた治療の重要性を訴えてきた。この前高橋さんに会った時、幹細胞移植を統括している委員会が自己 iPSには待ったをかけた結果、iPSの特徴を殺した研究に変更せざるを得なかったようだが、そろそろ iPSの特徴が生かせる治験も進めてほしい。
2025年10月14日
コロナパンデミックの時、ウイルス感染から免疫刺激まで、多くの細胞膜上でのプロセスがメディアを通して一般の人にも共有された。例えばスパイクタンパク質やACE2受容体など、専門的な用語が広く知られることとなった。このように、細胞膜上での様々なプロセスは、それに関わる特異的膜タンパク質の相互作用に基づいて語ることが多いが、実際の細胞膜上のイベントは細胞膜の流動性に大きく依存している。この流動性に関わるのが細胞膜内に含まれるコレステロールで、これが膜タンパク質のシグナルを様々な方法で変化させている。
今日紹介するUCLAからの論文は、この細胞膜 (PM) から小胞体 (ER) へのコレステロール輸送に関わるAster-A分子をノックアウトしたマウスで、腸からの脂肪吸収が低下し体重が減少する原因を探った研究で、10月9日号の Science に掲載された。タイトルは「T cell cholesterol transport links intestinal immune responses to dietary lipid absorption(T細胞のコレステロール移送は腸内免疫とリンクして脂質吸収反応を調節する)」だ。
この研究では、 Aster-A (AA) をノックアウトすると腸からの脂質吸収が低下し痩せるという現象の原因を探ることから始めている。腸上皮や肝臓など脂質吸収に関わる細胞特異的にノックアウトしても異常は起こらないのに、なんとT細胞でノックアウトすると全身でノックアウトしたのと同じ形質が現れる。すなわち、T細胞のコレステロール移送が変化すると、腸での脂質吸収が低下して痩せることがわかった。
T細胞なので、当然腸内での免疫反応が変化し、その結果脂質吸収が低下すると考えられるが、期待通り腸内でのTh17細胞が活性化し、IL-22が強く分泌されることで、腸内での脂肪吸収が抑えられる。また、Th17活性化は細菌叢の働きによることもわかった。
実際、Th17に関わらずT細胞を刺激するとAAがERから細胞膜へと移行する。ERはTMと連結してカルシウムリザバーとして働いているが、T細胞刺激でTMへリクルートされたAAはT細胞とカルシウムチャンネルにコレステロールが蓄積して膜上で刺激が続くのを、コレステロールを取り除くことで抑える働きがあることを生化学的に示している。即ち、AAが欠損すると、コレステロールが活性化されたT細胞受容体やカルシウムチャンネルに蓄積し、刺激が持続してしまう。
この過程が細菌叢から刺激を受ける腸内のTh17で最も著明に現れた結果、腸内の炎症が起こり、そこで分泌されるIL-22により腸内上皮での脂質吸収が抑えられるというシナリオだ。
以上が結果で、T細胞の脂質代謝の変化が全身に及ぶという面白い現象だが、突き詰めていくと炎症による影響に落ち着いた。ただ、膜タンパク質の活性を調節するためには、複雑な脂質代謝が背景にあることがよくわかる論文だ。
2025年10月13日
現在 Single cell テクノロジーは複雑な組織の解析の定番として使われるようになり、特に脳研究での広がりは大きい。
紹介が遅れたが、今日紹介するカナダマクギル大学からの論文は、うつ病患者さんの脳を single cell テクノロジーで解析して、うつ病発症に最も大きな役割を演じる神経細胞を特定し、うつ病の条件を解析した論文で、8月号の Nature Medicine に掲載された。タイトルは「Single-nucleus chromatin accessibility profiling identifies cell types and functional variants contributing to major depression(単一細胞でのクロマチンアクセシビリティープロファイリングはうつ病に寄与する細胞の種類と機能的遺伝子変異を明らかにした)」だ。
この研究の最大の特徴は、うつ病治療中に亡くなった44例の脳の凍結組織を解析できている点だ。しかも、この組織はマイアミ大学のバイオバンクでいつでも申請に応じて利用できるようになっている点だ。最近、論文のリバイスに人間の脳組織を調べるよう言われて、誰かアクセスのある先生を知らないかと聞かれ、一応紹介したが、可能だとしてもとても時間がかかると思う。このように、科学研究に人間の脳組織のバイオバンクは、single cell テクノロジー時代に必須になる。胎児から老人まで、充実したバイオバンクが整備されることを願う。
これまでうつ病のゲノム研究は盛んに行われ、200を超す遺伝子多型が特定されている。そしてそのほとんどがノンコーディング領域なので、これらの多型領域の転写活性がうつ病と正常で異なるかを調べるには、まずクロマチンがどの程度開いているか調べる必要がある。この研究では集めた脳細胞を Atac-seq で解析し、正常と比べて明らかにうつ病でクロマチン構造が変化する領域 (DAR) を探索するとともに、この変化が集まる細胞の特定を試みている。
基本的にうつ病の場合、DARは興奮神経細胞とミクログリア細胞に集まっており、興奮神経細胞ではクロマチンが閉じる方向、ミクログリアでは開く方向の変化が多い。そして、神経細胞ではシナプス活性や細胞分化に関わる遺伝子調節領域が閉じる方向、ミクログリアでは免疫反応に関わる遺伝子調節領域が開く方向の変化になる。
これまで行われている single cell RNAseq と対応させると、閉じる方向では予想通り遺伝子発現が低下し、開く方向では遺伝子発現が上昇している。また、うつ病の遺伝子多型としてリストされてきた領域と、クロマチン構造が変化している領域は強くオーバーラップしている。以上の結果から、これまでの遺伝子多型研究や発現研究をさらに統合することができている。結果、うつ病を形成するのは、ミクログリアの活性化による炎症変化と、興奮神経細胞の機能低下になり、これまで考えられてきたことを概ねサポートする。
Single cell technology はこの変化が起こっている細胞もより正確に特定できる。その結果興奮神経の中でも第6層のNR4A2陽性細胞でうつ病による遺伝子変化が集中しており、またミクログリアでは灰白質に存在するミクログリアに変化が見られることがわかる。
一つ一つの遺伝子の内容については全てスキップしたが、変化する遺伝子や調節領域から、神経細胞ではストレスにより、神経活動依存性の転写因子やシナプス結合に必要な分子の発現が、特に前頭葉の最も深い層に位置する神経細胞で抑えられ、また神経細胞体に近接するミクログリアで炎症に関わる遺伝子の発現が上昇することがうつ病のメカニズムであると結論できる。
あとは、これらの変化が起こる原因を確かめる必要があるが、これまでのように闇雲に調べるという段階から、遺伝子、タンパク質、細胞と統合的にうつ病も考えられるようになったかと感心している。
2025年10月12日
今日紹介するペンシルバニア大学からの論文は16p12.1欠失と呼ばれる16番染色体単腕にある512Kbという小さな領域の欠失により起こる遺伝子疾患の多様性の背景にある、いわゆる遺伝的バックグラウンドと呼ばれる2次背景について検討した研究で、10月7日 Cell オンラインに掲載された。タイトルは「Genetic modifiers and ascertainment drive variable expressivity of complex disorders(表現系が多様な複雑症状をもたらす遺伝的背景と病気の見極め)」だ。
まずこの病気についての説明が必要だろう。複数の遺伝子を含む領域が片方の染色体で欠損する病気は多く、このブログでも何回も紹介したウイリアムズ症候群がそれに当たるが、7つの遺伝子を含む小さな欠損、16p12.1欠失の場合、症状が多様で、はっきりと病気とは診断されないキャリアから、様々な知能や身体の発達障害を伴う重症例まで、極めて幅が広い症候群になる。そのため、病気の多様性は16p12.1に存在する7つの遺伝子の発現が低下する以外に、2次的な遺伝的背景が存在すると考えられてきた。
この研究では発達障害を対象にしたコホートや、病気を限定しない例えばUKバイオバンクやエストニアバイオバンクのようなコホートから、16p12.1欠失の存在する個体を抜き出し、症状を元に詳しく分類して病型を決めるとともに、それぞれの症状に相関する遺伝的背景をデータベース上のゲノム解析を元に追究している。
すると家族発症ケースでも、他の遺伝要因が加わることで症状の強さだけでなく、様々な症状の表れが変化すること(例えば第一世代の母親は不安症を持っていたが、次の世代だと統合失調症やうつ病基質が加わり、孫世代になると発達障害、知能障害、自閉症、顔面形成異常が存在すると言ったケース)が明らかになる。
そこで、ゲノム解析で 16p12.1欠失症状の発症に関わる2次変異の存在を探索し、16p12.1欠失と関わる多くの遺伝子変異が見つかること、そしてそれぞれは異なる症状の発症に関わっていることも明らかになった。すなわち、16p12.1欠失症候群を診断するとき、16p12.1欠失だけで決めるのではなく、他の遺伝的背景も調べないと正確な診断ができないことがわかる。またそれぞれの背景遺伝子変異の、16p12.1に存在する7種類の遺伝子との関係性をネットワーク解析法を用いて調べると、まず16p12.1内の7つの遺伝子はそれぞれ機能的には全く異なっているが、個々に直接関わり合うネットワークを形成しており、これをハブとして他の遺伝子変異が加わったネットワークが形成されることで、それぞれの症状が形成される可能性を示している。
次に、例えば自閉症や統合失調症に関わる様々な変異が統合されたポリジェニックスコアは、16p12.1欠失と明確に相互作用して精神や知能発達症状に関わることがわかる。また多遺伝子だけでなく、一つのレアバリアントが症状発症に関わる例も発見される。
例えば発達障害コホートでは症状から対象がピックアップされるため、16p12.1欠失を持っていても症状の出ないキャリアを除外することで背景の変異のバイアスがかかるため、16p12.1欠失のアウトカムがコホートにより変化する危険性も指摘している。従ってUKバイオバンクのようなバイアスのない対象に関する大規模コホートから16p12.1欠失をピックアップし、症状を追跡することが重要になる。
以上が主な結果で、予想通り微少欠失症を考えるとき、背景のゲノムを詳細に調べる必要性が改めて示されるとともに、発達障害形成に関わる遺伝子間相互作用と病気発症のメカニズムを考えていくうえで、様々な微少欠失の解析の重要性がよくわかる論文だった。
2025年10月11日
我々の腸内では何千種類もの細菌がそれぞれ資源を奪い合ったり協力し合って一定の細菌叢を形成している。この内部の適応に、水平遺伝子伝搬や変異頻度を高めて多様化する仕組みが需要な働きをしていると推察される。その中で注目されているのが DGR (Diversity Generatinv Retroelement) で、アデニンを認識する逆転写酵素を使って、我々が実験で行うアデニン特異的変異誘導を行うユニットだ。ただ、実際の細菌叢でこれらがどのような働きをしているのか、研究は始まったばかりだ。
今日紹介するUCLAからの論文は腸内の Bacterioides に絞ってDGRを調べ上げ、その中で繊毛を形成する pilin 分子を持つDGRが水平遺伝子伝搬により Bacterioides の多様化に関わるプロセスを明らかにした研究で、10月9日 Science に掲載された。タイトルは「Targeted protein evolution in the gut microbiome by diversity-generating retroelements(腸内細菌叢でdiversity generating retroelementによって特定のタンパク質の進化が加速する)」だ。
将来のバクテリアの種特異的な遺伝子改変法の開発も視野に、この研究では腸内でのドミナントな Bacteriodes に絞り、データベースに集まった配列からDGRを探索し、なんと1100種類のDGRを特定している。そして、このユニットは大きく3種類に分けることができ、それぞれのユニットに存在する遺伝子は、繊毛を形成する pilin、細胞質内キナーゼ、そしてウイルス受容体タンパク質に分けることができ、これらの遺伝子の多様化に関わることを示している。
次に pilin をコードしているDGRに絞って、多くがプロファージやICEと呼ばれるバクテリアのモバイルエレメントと一体になっていることを発見する。
まず蛋白質構造学的に多様化の対象になる pilin が繊毛の Variable repeat 領域を逆転写酵素を用いてアデニン特異的突然変異を起こして多様化することを確認したあと、ICEにコードされたDGRが実際に水平遺伝子伝搬されるかを調べている。
通常ではICEはなかなか活性化されてゲノムから離れないのだが、なんと粘液成分に出会うと何百倍にも活性化され、このDGRを含まないバクテリアに水平伝搬される。これは培養系だけでなく、無菌マウス腸内でも同じように遺伝子伝搬と、多様化を誘導できる。そして、ICEの切り出しにはDNAミスマッチ修復酵素が関わることも明らかにしている。
このようにICEとセットでバクテリアからバクテリアへ高い確率で伝搬するだけでなく、内蔵する仕組みでアデニン特異的に変異を誘導して多様化することがわかる。面白いのは、培養上や少ないクローンを移植した腸内ではアミノ酸変化を有する変異が多く誘導されるが、腸内に安定した細菌叢を加えると、変異率が強く抑制され、いくつかの変異に収束する。一方で、アミノ酸変異を伴わない変異は維持されている。即ち、競合の結果特定のアミノ酸変異が選択されることを強く示唆している。
最後に、母親、子供、成長後の子供と腸内細菌叢を調べ、そこに存在する Bacteriodes 内の2700に上るDGRを全てリストし、経膣出産によりDRGが子供に伝わるだけでなく多様化と選択が行われ、独自のレパートリーを形成していることを明らかにしている。
以上の結果は、DGRとその多様化を通して、細菌叢がホストに適応するプロセスが明らかになることを示しており、生物学的、特に細菌叢とホストの共進化を考える上で面白い。また、細菌叢の遺伝子操作は現在でも難しい。その意味で、このような水平伝搬ユニットと遺伝子多様化ユニットを併せ持つDGRの研究は、将来の遺伝子操作に大きな道を開くと思う。
2025年10月10日
両親に遺伝子変異がないのに子供に新しい遺伝子変異が発生する病気は数多く存在し、例えばレット症候群やFOPなどはその典型例だ。これは精子や卵子が形成される過程で起こった突然変異が子供に伝わったことによる。ただこのような変異が頻発しないように、急速な細胞増殖を伴う精子形成では、変異が起こる確率が強く抑えられていることが知られている。一方で、精子形成過程で一部の突然変異、特にガン発生に関わるような変異が選択される可能性が示唆されていた。
今日紹介するサンガーセンターからの論文は、24歳から75歳までのボランティアから精子と血液細胞を採取しDNA配列を解読、精子で特定の遺伝子変異が選択されるか調べた研究で、10月8日 Nature にオンライン掲載された。タイトルは「Sperm sequencing reveals extensive positive selection in the male germline(精子のDNAシークエンスにより男性の生殖系列で起こる強い遺伝子選択が明らかになった)。だ。
これまでの研究と同じで1年間に変異は1.4塩基の頻度で起こるが、血液で見ると1年間に20塩基に跳ね上がる。すなわち、精子形成では元々変異が起こりにくいようできている。変異の種類を調べると、精子では時間とともに蓄積するタイプに限られているが、血液では10%程度DNA障害が維持されているタイプが存在する。即ち、精子では障害がすぐに修復されるか除去されている。
次に、変異が見られる遺伝子について、アミノ酸変異を伴う変異と伴わない変異を調べている。もし変異が精子形成過程で選択されるとすると、アミノ酸変異を伴う変異のみで選択は起こる。とは言え、同じ人で時間をおいて2回調べると、同じ変異が見つかる確率はほとんどない。即ち、精子が多くのクローン由来であることがわかる。
この解析から精子過程で選択される遺伝子変異が30種類ほど特定され、ほとんどがRAS-MAPKの様な増殖シグナルと、発生に関わるシグナルに関わる。そしてその多くは変異に発生異常などの病気の原因になることが知られた遺伝子になる。即ち、病気の原因となる遺伝子変異が精子発生過程で選択されていることになる。逆に言うと、精子形成にアドバンテージをもたらす変異は、発達異常などの遺伝病の原因になることがわかる。
最後に、選択が見られる遺伝子をエクソーム全体で調べると、既に述べたように精子では選択が見られるが、同じような選択は両親と子供のゲノムを比較して子供に伝わったde Novo変異でも見ることができ、選択された変異がde Novo変異につながっていると考えられる。
以上のことから、精子形成での変異は低く抑えられるが、一部の遺伝子は精子形成過程というフィルターを通って選択され、年齢とともに上昇し、中年以上の男性では3−5%の精子がそのような変異を持っている。おそらくこの結果、年齢の高い父親からの子供が様々な疾患リスクを抱える原因になっていると結論できる。
2025年10月9日
ガンの変異遺伝子を狙う標的薬が多く開発され、例えば多くのガンで特定の遺伝子診断に基づいて治療が決められる。最も標的薬が成功したのが慢性骨髄性白血病で、薬だけで完全にコントロール可能になっている。しかし、通常ガンでは様々な遺伝子変異が存在し、それに合わせて薬剤を見つけることは時間がかかり、また専門的知識が必要で、一般医師レベルで遺伝子診断に基づくガン治療が可能かどうか実際には明らかになっていない。また、例えば我が国のオンコパネル検査では、検査に1月半以上かかるが、最初からこれに基づいて治療を始めるには時間的に問題がある。
今日紹介するローマ大学からの論文は、このような問題をある程度解決できるプロトコルを組んで、遺伝子診断に基づくガン治療が有効であることを示した研究で、9月29日 Nature Medicine にオンライン掲載された。タイトルは「Genomically matched therapy in advanced solid tumors: the randomized phase 2 ROME trial(進行固形ガンでのゲノムに合わせた治療:無作為化第二相治験)」だ。
この研究では遺伝子検査によらずに既に様々な治療を受けた後、転移が起こり進行したガンに合わせた治療が必要となった患者さん1794人に絞って324種類のガンで見つかる変異について、オンコパネルで検査している。サンプルは、外科で切除された標本からDNAを抽出したり、あるいは末梢血のリキッドバイオプシーで得られるDNAを調べ、その結果を専門家委員会で議論して、897例は遺伝子から治療方針が立たないと除外、残りの897例を選んでいる。ここまではガンの種類を気にせず議論を進め、そのあとこの827例について専門家委員会でガンの種類も含めて議論を行い、これまでの研究結果などと照合して、やはり対象となる薬剤がないと判断した472例を除外し、最終的に残った400例について、通常の標準医療、あるいは見つかった変異遺伝子に対する薬剤を中心とした治療に振り分け、その後の経過を見ている。
ここまででわかるのは、オンコパネルレベルの遺伝子診断だと、1700例のうち7割近くが遺伝子診断が役に立たなかったことになる。例えば、エクソーム配列決定により多くのネオ抗原が高い確率で見つかるという個人用ワクチン作成等と比べるとあまりにも歩留まりが悪い。おそらくさらに新しい標的治療やその組み合わせが開発されない限り、わざわざ多くの遺伝子を調べる意味がないことになる。例えば Ras や Kit 等のようにそのガンタイプで見られる変異に絞って検査するだけで十分ということになる。
とは言え、400例については変異に合わせた薬剤を見つけることができている。この研究が徹底しているのは、この400例を無作為化して標的薬から始めるグループと、標準治療を続けるグループに分けている点だ。せっかく標的が見つかったのだからと思うが、これが医療統計上の要求になる。できれば、より人道的な統計学がないかといつも思う。ただ、結果は overall response rate で調べており、標準治療の効果がなかった場合は、標的薬に切り替えており、人道的な問題をある程度軽減している。
さて結果だが、ガンの種類にこだわらず治療への反応を見たとき、標的薬グループでは17%が反応、3%が完全寛解に移行した。一方標準治療の場合14.5%が知慮に反応している。3%の完全寛解を除くと、大きな差があると結論できるのか気になる。
それぞれのガンごとに見ていくと、消化器ガンの場合14.8% vs 9.1%、非小細胞性肺ガンの場合 12.5% vs 6.7% と標的薬グループが優れているが、驚くことに乳ガンでは 20% vs 35% と逆の結果になっている。乳ガンの場合、一般治療と言っても標的薬に近い薬剤が使われるのが普通で、例えば CDK4/6阻害剤の場合、変異に関わりなく利用することからこの結果を招いたのだろう。
この治験では、専門家委員会のアドバイスに基づき、修復異常変異のある場合はチェックポイント治療を優先しており、これは大きな効果がある。ただ、修復異常に関しては既にコンパニオン診断として位置づけられており、オンコパネルである必要はない。
ただ、副作用に関しては強い副作用が標準治療では発生する確率が高く、多くの場合白血球減少を伴う。
以上が結果で、結論は遺伝子診断に基づく治療は重要ということになるが、全体で見ると遺伝子診断の重要性を認識していた立場としては残念な結果に思えてしまう。さらに、専門家委員会など一般病院ではなかなか利用できないので、標的治療を目的とした遺伝子診断を普及させるためには、AIや迅速診断など多くのテクノロジーをさらに開発する必要があると思う。
2025年10月8日
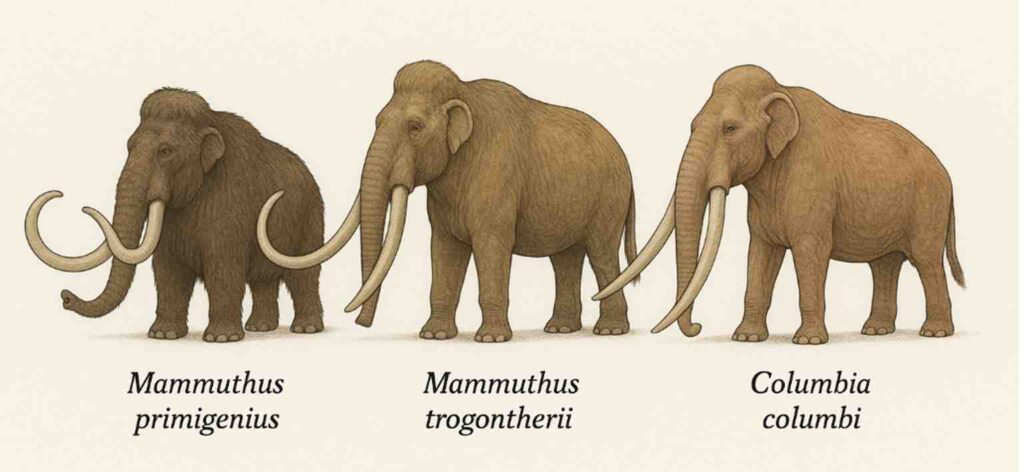
以前紹介したことがあるが(https://aasj.jp/news/watch/15022 )、マンモスには大きく分けて、我々が一般的にマンモスと呼んでいるケナガマンモス(40万年前から1万年)、ユーラシア草原地帯で120万年から20万年まで生息したステップマンモス、そしてケナガマンモスがアメリカ大陸に移動して温暖な草原に適応したコロンビアマンモス(40万年から1万年)に分かれる。GPTに絵を描いて貰うと以下のようになる(左からケナガマンモス、ステップマンモス、そしてコロンビアマンモス)。
Screenshot 以前紹介したのが100万年前のステップマンモスゲノム解析で、このおかげでコロンビアマンモスがケナガマンモスとステップマンモスのハイブリッドであることが明らかになった。
今日紹介するメキシコ国立自治大学からの論文は、2009年から2022年までメキシコ出土したマンモスの大臼歯を集め、ミトコンドリアゲノムを解読し、コロンビアマンモスのアメリカ大陸での進化過程を検討した研究で、10月2日 Science に掲載された。タイトルは「Columbian mammoth mitogenomes from Mexico uncover the species’ complex evolutionary history(メキシコのコロンビアマンモスのミトコンドリアゲノムは種の複雑な形成過程を示している)」だ。
これまでコロンビアマンモスはほとんど北米大陸で出土したゲノムが解読されてきた。すなわち、この研究の目的はメキシコのコロンビアマンモスもこれまで北米で見つかったのとどこまで同じか明らかにすることだ。そのために、同時代に生きていたケナガマンモス、コロンビアマンモスのミトコンドリアゲノムを比較している。
研究はそれだけなのだが、コロンビアマンモスがケナガとステップマンモスのハイブリッドであることは間違いないが、それぞれ大きく異なっており、ケナガマンモスと比べると、北米の種は北米に移動してきたケナガマンモスと近い。一方、メキシコ出土のコロンビアマンモスは、シベリアに生息しているケナガマンモスに近いことがわかった。
即ち、ステップマンモスと交雑する前のケナガマンモスの多様性がそのままコロンビアマンモスに反映している。しかも交雑してコロンビアマンモスが形成されるのはほぼ同時代と考えられ、アメリカ大陸の温暖な気候への適応として、シベリアで形成されたケナガマンモスの多様性が、アメリカ各地の気候に合わせて選択されていったことになる。
ただ、ミトコンドリアだけでは限界があるので、今後は通常のゲノムを調べて適応要因を明らかにする必要がある。幸い、コロンビアマンモスは氷河期の終わり1万年前まで生きており、ゲノム解析も夢ではない。
2025年10月7日
坂口さんのノーベル賞受賞をヨーロッパで聞くことになった。家族ぐるみで付き合ってきたこともあるが、他の人より感慨は深いと自負している。というのも、かなり早くから坂口さんのTregについての研究を見続けて来ただけでなく、評価が定まるまでの様々な苦労も見てきたので、なおさらだ。
もう一つこの機会に是非皆さんに知ってほしいのは、坂口さんが最初に教授になったのは京大の前再生研だったことだ。通常教授は教授会で選ぶのだが、新しい組織の場合は準備委員会でまずコアメンバーを選ぶ。そのとき選んだ3人の一人が坂口さんで、残りは亡くなった笹井さん、そしてヒトES細胞研究の中辻さんだった。この人事が公表されたとき、阪大の岸本先生が「いい人事や」とわざわざ連絡してくれた。そして今、岸本さんの研究所で坂口さんがノーベル賞を貰ったのも面白い因縁だ。そして、このコアメンバーを中心に再生研は自ら新しい人事を重ねて素晴らしい研究所に発展したが、その再生研教授会が選んだのがもう一人のノーベル賞受賞者山中さんだ。即ち、今は改組されてバラバラになったが、京大再生研は小さな組織だったにもかかわらず、なんとノーベル賞受賞者を2人も擁していたことになる。この私も含めて、この研究所設立に関わった委員はもちろん、再生研Goと号令をかけた当時の総長井村先生も本当に喜んでおられると思う。
そこでノーベル賞記念に坂口さんの最近の論文を紹介しようと思って3月にNatureに掲載しているFox3転写調節についての研究を選んだ。というのも、今回のノーベル委員会からの受賞理由を読むとわかるようにFoxP3はTregを考える上での鍵といえる。今回の受賞理由を読むと、若い研究者が免疫学全体の歴史をたどる中で、Tregをその歴史の中に位置づける作業を行っているように思える。歴代のノーベル賞を受けた免疫学者だけでなく、免疫系解明に関わった様々な研究者の業績と歴史的位置が次々に述べられている。これについては、来週13日に恒例のノーベル賞解説で、特異な受賞理由も含めてTregの歴史を振り返ろうと思っているので、参加希望者は連絡してほしい。
論文紹介前にまず正直に告白すると、今回の受賞理由を読んで初めてTregとFoxP3の関係に最初に気づいたのが同時受賞したBrunkowとRamsdellだと知った。今日の今日まで坂口さんの発見かと思っていた。いずれにせよ、FoxP3に関しては2003年ぐらいから坂口さんも多くの論文を発表している。その中の最も最近の論文が今日紹介するFoxP3の転写をRPBJと呼ばれる分子がエピジェネティック機構をリクルートして安定的に抑制していることを示した研究になる。タイトルは「Genome-wide CRISPR screen in human T cells reveals regulators of FOXP3(ゲノムワイドCRISPRスクリーニングによりFoxP3の調節因子が明らかになる)」だ。
この論文を読んで、これまでの細胞生物学をベースにした坂口さんが、おそらく筆頭著者のKelvin Chenさんを触媒として大変身を遂げた事がわかる。即ち、目的は安定したTregを作成して免疫を調節したいという細胞免疫学課題だが、使った方法が CRISPRスクリーニングは言うに及ばず、以前紹介した Perturb-seq と呼ばれる方法(https://aasj.jp/news/watch/1999 )、そして細胞膜を透過する処理をして行う細胞内の Chip-seq や Atac-seq まで、single cell テクノロジーを駆使してこの課題にチャレンジしている。
最初のスクリーニングで、FoxP3の転写に影響する分子が数多くリストされ、それぞれをノックアウトしたときの影響が詳細に示されているが、全部割愛する。要するに FoxP3 は複雑な調節機構下にあると言うことだ。そして結局この中から坂口さんたちが注目したのが BPJ分子で、遺伝子が欠損すると FoxP3 や Treg機能に重要なCD25やCTLA4が上昇する。即ちTregの活性が上がる。予断になるが、私がまだ京大にいた頃、もう一人のノーベル賞受賞者本庶さんが RBPJ 分子を研究していたのを覚えているが、なかなか面白い因縁だ。
この研究の素晴らしいのは、最終的に FoxP3 の転写を RBPJ が抑制すると言うだけでなく、先に挙げた single cell テクノロジーやエピジェネティックス解析手法を駆使して、RPBJが FoxP3上流の CN2 と呼ばれる CpGリッチな領域に結合し、NCOR と呼ばれる核内因子をリクルートし、この NCOR にヒストン脱アセチルか酵素HDAC3 がリクルートされ、H3K27 の脱アセチル化、更には CpG領域のメチル化を誘導することで、安定的に FoxP3 を抑制することを明らかにしている。
このようにエピジェネティックな変化を誘導することで Treg誘導に必要な FoxP3 が安定的に抑制されてしまう。逆に、RPBJ をノックアウトすると、今度は FoxP3 のエンハンサーを安定的にオンにできることが予想できるが、こうなると後は坂口さんお得意の細胞生物学で、RPBJ をあらかじめノックアウトしておくと GvH のような強烈な免疫反応も一定程度抑えられる事を示している。これまで安定性に欠ける(免疫調節に関わる以上当然のことだ)Tregを、安定に維持できる可能性が示された。
以上が結果で、ノーベル賞の話が中心になったので論文の方はかなり雑な紹介になって、坂口さんに怒られそうだがお許し頂くことにして、紹介を終わる。
もう少し詳しい話は13日夜7時からZoomでノーベル賞解説の中で説明しようと思っている。