2025年10月10日
両親に遺伝子変異がないのに子供に新しい遺伝子変異が発生する病気は数多く存在し、例えばレット症候群やFOPなどはその典型例だ。これは精子や卵子が形成される過程で起こった突然変異が子供に伝わったことによる。ただこのような変異が頻発しないように、急速な細胞増殖を伴う精子形成では、変異が起こる確率が強く抑えられていることが知られている。一方で、精子形成過程で一部の突然変異、特にガン発生に関わるような変異が選択される可能性が示唆されていた。
今日紹介するサンガーセンターからの論文は、24歳から75歳までのボランティアから精子と血液細胞を採取しDNA配列を解読、精子で特定の遺伝子変異が選択されるか調べた研究で、10月8日 Nature にオンライン掲載された。タイトルは「Sperm sequencing reveals extensive positive selection in the male germline(精子のDNAシークエンスにより男性の生殖系列で起こる強い遺伝子選択が明らかになった)。だ。
これまでの研究と同じで1年間に変異は1.4塩基の頻度で起こるが、血液で見ると1年間に20塩基に跳ね上がる。すなわち、精子形成では元々変異が起こりにくいようできている。変異の種類を調べると、精子では時間とともに蓄積するタイプに限られているが、血液では10%程度DNA障害が維持されているタイプが存在する。即ち、精子では障害がすぐに修復されるか除去されている。
次に、変異が見られる遺伝子について、アミノ酸変異を伴う変異と伴わない変異を調べている。もし変異が精子形成過程で選択されるとすると、アミノ酸変異を伴う変異のみで選択は起こる。とは言え、同じ人で時間をおいて2回調べると、同じ変異が見つかる確率はほとんどない。即ち、精子が多くのクローン由来であることがわかる。
この解析から精子過程で選択される遺伝子変異が30種類ほど特定され、ほとんどがRAS-MAPKの様な増殖シグナルと、発生に関わるシグナルに関わる。そしてその多くは変異に発生異常などの病気の原因になることが知られた遺伝子になる。即ち、病気の原因となる遺伝子変異が精子発生過程で選択されていることになる。逆に言うと、精子形成にアドバンテージをもたらす変異は、発達異常などの遺伝病の原因になることがわかる。
最後に、選択が見られる遺伝子をエクソーム全体で調べると、既に述べたように精子では選択が見られるが、同じような選択は両親と子供のゲノムを比較して子供に伝わったde Novo変異でも見ることができ、選択された変異がde Novo変異につながっていると考えられる。
以上のことから、精子形成での変異は低く抑えられるが、一部の遺伝子は精子形成過程というフィルターを通って選択され、年齢とともに上昇し、中年以上の男性では3−5%の精子がそのような変異を持っている。おそらくこの結果、年齢の高い父親からの子供が様々な疾患リスクを抱える原因になっていると結論できる。
2025年10月9日
ガンの変異遺伝子を狙う標的薬が多く開発され、例えば多くのガンで特定の遺伝子診断に基づいて治療が決められる。最も標的薬が成功したのが慢性骨髄性白血病で、薬だけで完全にコントロール可能になっている。しかし、通常ガンでは様々な遺伝子変異が存在し、それに合わせて薬剤を見つけることは時間がかかり、また専門的知識が必要で、一般医師レベルで遺伝子診断に基づくガン治療が可能かどうか実際には明らかになっていない。また、例えば我が国のオンコパネル検査では、検査に1月半以上かかるが、最初からこれに基づいて治療を始めるには時間的に問題がある。
今日紹介するローマ大学からの論文は、このような問題をある程度解決できるプロトコルを組んで、遺伝子診断に基づくガン治療が有効であることを示した研究で、9月29日 Nature Medicine にオンライン掲載された。タイトルは「Genomically matched therapy in advanced solid tumors: the randomized phase 2 ROME trial(進行固形ガンでのゲノムに合わせた治療:無作為化第二相治験)」だ。
この研究では遺伝子検査によらずに既に様々な治療を受けた後、転移が起こり進行したガンに合わせた治療が必要となった患者さん1794人に絞って324種類のガンで見つかる変異について、オンコパネルで検査している。サンプルは、外科で切除された標本からDNAを抽出したり、あるいは末梢血のリキッドバイオプシーで得られるDNAを調べ、その結果を専門家委員会で議論して、897例は遺伝子から治療方針が立たないと除外、残りの897例を選んでいる。ここまではガンの種類を気にせず議論を進め、そのあとこの827例について専門家委員会でガンの種類も含めて議論を行い、これまでの研究結果などと照合して、やはり対象となる薬剤がないと判断した472例を除外し、最終的に残った400例について、通常の標準医療、あるいは見つかった変異遺伝子に対する薬剤を中心とした治療に振り分け、その後の経過を見ている。
ここまででわかるのは、オンコパネルレベルの遺伝子診断だと、1700例のうち7割近くが遺伝子診断が役に立たなかったことになる。例えば、エクソーム配列決定により多くのネオ抗原が高い確率で見つかるという個人用ワクチン作成等と比べるとあまりにも歩留まりが悪い。おそらくさらに新しい標的治療やその組み合わせが開発されない限り、わざわざ多くの遺伝子を調べる意味がないことになる。例えば Ras や Kit 等のようにそのガンタイプで見られる変異に絞って検査するだけで十分ということになる。
とは言え、400例については変異に合わせた薬剤を見つけることができている。この研究が徹底しているのは、この400例を無作為化して標的薬から始めるグループと、標準治療を続けるグループに分けている点だ。せっかく標的が見つかったのだからと思うが、これが医療統計上の要求になる。できれば、より人道的な統計学がないかといつも思う。ただ、結果は overall response rate で調べており、標準治療の効果がなかった場合は、標的薬に切り替えており、人道的な問題をある程度軽減している。
さて結果だが、ガンの種類にこだわらず治療への反応を見たとき、標的薬グループでは17%が反応、3%が完全寛解に移行した。一方標準治療の場合14.5%が知慮に反応している。3%の完全寛解を除くと、大きな差があると結論できるのか気になる。
それぞれのガンごとに見ていくと、消化器ガンの場合14.8% vs 9.1%、非小細胞性肺ガンの場合 12.5% vs 6.7% と標的薬グループが優れているが、驚くことに乳ガンでは 20% vs 35% と逆の結果になっている。乳ガンの場合、一般治療と言っても標的薬に近い薬剤が使われるのが普通で、例えば CDK4/6阻害剤の場合、変異に関わりなく利用することからこの結果を招いたのだろう。
この治験では、専門家委員会のアドバイスに基づき、修復異常変異のある場合はチェックポイント治療を優先しており、これは大きな効果がある。ただ、修復異常に関しては既にコンパニオン診断として位置づけられており、オンコパネルである必要はない。
ただ、副作用に関しては強い副作用が標準治療では発生する確率が高く、多くの場合白血球減少を伴う。
以上が結果で、結論は遺伝子診断に基づく治療は重要ということになるが、全体で見ると遺伝子診断の重要性を認識していた立場としては残念な結果に思えてしまう。さらに、専門家委員会など一般病院ではなかなか利用できないので、標的治療を目的とした遺伝子診断を普及させるためには、AIや迅速診断など多くのテクノロジーをさらに開発する必要があると思う。
2025年10月8日
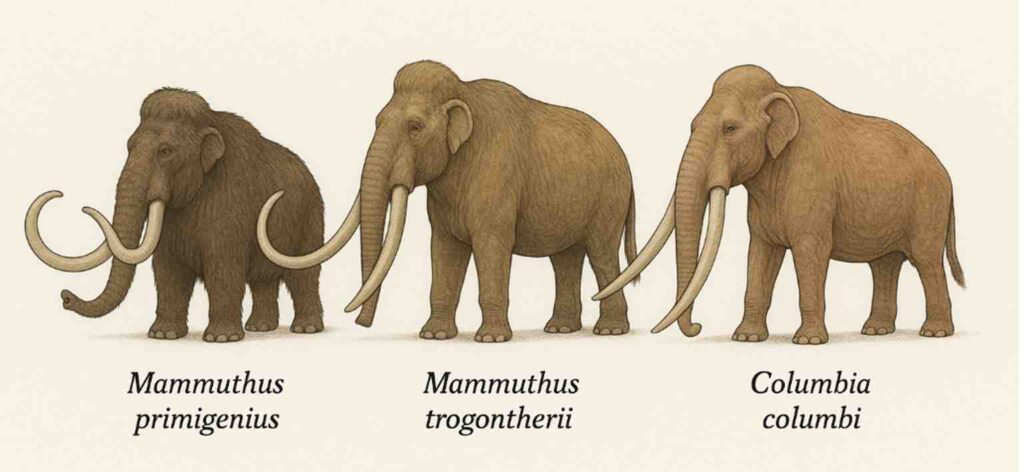
以前紹介したことがあるが(https://aasj.jp/news/watch/15022 )、マンモスには大きく分けて、我々が一般的にマンモスと呼んでいるケナガマンモス(40万年前から1万年)、ユーラシア草原地帯で120万年から20万年まで生息したステップマンモス、そしてケナガマンモスがアメリカ大陸に移動して温暖な草原に適応したコロンビアマンモス(40万年から1万年)に分かれる。GPTに絵を描いて貰うと以下のようになる(左からケナガマンモス、ステップマンモス、そしてコロンビアマンモス)。
Screenshot 以前紹介したのが100万年前のステップマンモスゲノム解析で、このおかげでコロンビアマンモスがケナガマンモスとステップマンモスのハイブリッドであることが明らかになった。
今日紹介するメキシコ国立自治大学からの論文は、2009年から2022年までメキシコ出土したマンモスの大臼歯を集め、ミトコンドリアゲノムを解読し、コロンビアマンモスのアメリカ大陸での進化過程を検討した研究で、10月2日 Science に掲載された。タイトルは「Columbian mammoth mitogenomes from Mexico uncover the species’ complex evolutionary history(メキシコのコロンビアマンモスのミトコンドリアゲノムは種の複雑な形成過程を示している)」だ。
これまでコロンビアマンモスはほとんど北米大陸で出土したゲノムが解読されてきた。すなわち、この研究の目的はメキシコのコロンビアマンモスもこれまで北米で見つかったのとどこまで同じか明らかにすることだ。そのために、同時代に生きていたケナガマンモス、コロンビアマンモスのミトコンドリアゲノムを比較している。
研究はそれだけなのだが、コロンビアマンモスがケナガとステップマンモスのハイブリッドであることは間違いないが、それぞれ大きく異なっており、ケナガマンモスと比べると、北米の種は北米に移動してきたケナガマンモスと近い。一方、メキシコ出土のコロンビアマンモスは、シベリアに生息しているケナガマンモスに近いことがわかった。
即ち、ステップマンモスと交雑する前のケナガマンモスの多様性がそのままコロンビアマンモスに反映している。しかも交雑してコロンビアマンモスが形成されるのはほぼ同時代と考えられ、アメリカ大陸の温暖な気候への適応として、シベリアで形成されたケナガマンモスの多様性が、アメリカ各地の気候に合わせて選択されていったことになる。
ただ、ミトコンドリアだけでは限界があるので、今後は通常のゲノムを調べて適応要因を明らかにする必要がある。幸い、コロンビアマンモスは氷河期の終わり1万年前まで生きており、ゲノム解析も夢ではない。
2025年10月7日
坂口さんのノーベル賞受賞をヨーロッパで聞くことになった。家族ぐるみで付き合ってきたこともあるが、他の人より感慨は深いと自負している。というのも、かなり早くから坂口さんのTregについての研究を見続けて来ただけでなく、評価が定まるまでの様々な苦労も見てきたので、なおさらだ。
もう一つこの機会に是非皆さんに知ってほしいのは、坂口さんが最初に教授になったのは京大の前再生研だったことだ。通常教授は教授会で選ぶのだが、新しい組織の場合は準備委員会でまずコアメンバーを選ぶ。そのとき選んだ3人の一人が坂口さんで、残りは亡くなった笹井さん、そしてヒトES細胞研究の中辻さんだった。この人事が公表されたとき、阪大の岸本先生が「いい人事や」とわざわざ連絡してくれた。そして今、岸本さんの研究所で坂口さんがノーベル賞を貰ったのも面白い因縁だ。そして、このコアメンバーを中心に再生研は自ら新しい人事を重ねて素晴らしい研究所に発展したが、その再生研教授会が選んだのがもう一人のノーベル賞受賞者山中さんだ。即ち、今は改組されてバラバラになったが、京大再生研は小さな組織だったにもかかわらず、なんとノーベル賞受賞者を2人も擁していたことになる。この私も含めて、この研究所設立に関わった委員はもちろん、再生研Goと号令をかけた当時の総長井村先生も本当に喜んでおられると思う。
そこでノーベル賞記念に坂口さんの最近の論文を紹介しようと思って3月にNatureに掲載しているFox3転写調節についての研究を選んだ。というのも、今回のノーベル委員会からの受賞理由を読むとわかるようにFoxP3はTregを考える上での鍵といえる。今回の受賞理由を読むと、若い研究者が免疫学全体の歴史をたどる中で、Tregをその歴史の中に位置づける作業を行っているように思える。歴代のノーベル賞を受けた免疫学者だけでなく、免疫系解明に関わった様々な研究者の業績と歴史的位置が次々に述べられている。これについては、来週13日に恒例のノーベル賞解説で、特異な受賞理由も含めてTregの歴史を振り返ろうと思っているので、参加希望者は連絡してほしい。
論文紹介前にまず正直に告白すると、今回の受賞理由を読んで初めてTregとFoxP3の関係に最初に気づいたのが同時受賞したBrunkowとRamsdellだと知った。今日の今日まで坂口さんの発見かと思っていた。いずれにせよ、FoxP3に関しては2003年ぐらいから坂口さんも多くの論文を発表している。その中の最も最近の論文が今日紹介するFoxP3の転写をRPBJと呼ばれる分子がエピジェネティック機構をリクルートして安定的に抑制していることを示した研究になる。タイトルは「Genome-wide CRISPR screen in human T cells reveals regulators of FOXP3(ゲノムワイドCRISPRスクリーニングによりFoxP3の調節因子が明らかになる)」だ。
この論文を読んで、これまでの細胞生物学をベースにした坂口さんが、おそらく筆頭著者のKelvin Chenさんを触媒として大変身を遂げた事がわかる。即ち、目的は安定したTregを作成して免疫を調節したいという細胞免疫学課題だが、使った方法が CRISPRスクリーニングは言うに及ばず、以前紹介した Perturb-seq と呼ばれる方法(https://aasj.jp/news/watch/1999 )、そして細胞膜を透過する処理をして行う細胞内の Chip-seq や Atac-seq まで、single cell テクノロジーを駆使してこの課題にチャレンジしている。
最初のスクリーニングで、FoxP3の転写に影響する分子が数多くリストされ、それぞれをノックアウトしたときの影響が詳細に示されているが、全部割愛する。要するに FoxP3 は複雑な調節機構下にあると言うことだ。そして結局この中から坂口さんたちが注目したのが BPJ分子で、遺伝子が欠損すると FoxP3 や Treg機能に重要なCD25やCTLA4が上昇する。即ちTregの活性が上がる。予断になるが、私がまだ京大にいた頃、もう一人のノーベル賞受賞者本庶さんが RBPJ 分子を研究していたのを覚えているが、なかなか面白い因縁だ。
この研究の素晴らしいのは、最終的に FoxP3 の転写を RBPJ が抑制すると言うだけでなく、先に挙げた single cell テクノロジーやエピジェネティックス解析手法を駆使して、RPBJが FoxP3上流の CN2 と呼ばれる CpGリッチな領域に結合し、NCOR と呼ばれる核内因子をリクルートし、この NCOR にヒストン脱アセチルか酵素HDAC3 がリクルートされ、H3K27 の脱アセチル化、更には CpG領域のメチル化を誘導することで、安定的に FoxP3 を抑制することを明らかにしている。
このようにエピジェネティックな変化を誘導することで Treg誘導に必要な FoxP3 が安定的に抑制されてしまう。逆に、RPBJ をノックアウトすると、今度は FoxP3 のエンハンサーを安定的にオンにできることが予想できるが、こうなると後は坂口さんお得意の細胞生物学で、RPBJ をあらかじめノックアウトしておくと GvH のような強烈な免疫反応も一定程度抑えられる事を示している。これまで安定性に欠ける(免疫調節に関わる以上当然のことだ)Tregを、安定に維持できる可能性が示された。
以上が結果で、ノーベル賞の話が中心になったので論文の方はかなり雑な紹介になって、坂口さんに怒られそうだがお許し頂くことにして、紹介を終わる。
もう少し詳しい話は13日夜7時からZoomでノーベル賞解説の中で説明しようと思っている。
2025年10月6日
これまで最も長生きしたことが知られているのはフランス人の女性で122歳だ。おそらく120歳を超えたのはこの人だけだと思うが、100歳を超える人の数が7万人を超える今でも110歳を超えることは簡単ではなく、我が国でも110歳を超えた supercentenarian の数は114に満たない。
今日紹介するスペインのホセカレーラス白血病研究所からの論文は、117歳まで生存して2024年になくなったスペイン女性について老化に関わる様々な指標を徹底的に調べた研究だ。一例報告なので軽々に結論するのは戒めるとして、しかし様々なヒントを教えてくれる研究で、10月21日 Cell Reports Medicineに掲載された。タイトルは「The multiomics blueprint of the individual with the most extreme lifespan(極端に長生きした一人の女性のマルチオミックス青写真)」だ。
最近では生物学的老化を調べる様々な指標が開発されているが、この研究ではそれらの全てを117歳のスペイン女性について調べている。多くのデータが示されているが、面白いと思われるポイントだけを箇条書きにしてみた。
老化と言えば時間とともに短くなるテロメアが出てくるが、驚くことにこの女性は長生きしているにもかかわらず血液細胞のテロメアが短い。おそらくこれまで調べられた中では最も短いテロメアで、コントロールと比べて40%短い。この方は検査の後少しして亡くなっているので、テロメアが短いためとも言えるが、逆になくなるまでガンや心臓病などの病気らしい病気にかかっていないことを考えると、テロメアが短いからといって必ずしも病気になるわけではないこともわかる。
この方に特異的なゲノム変異を探索した結果、16種類のコーディング遺伝子、3種類のノンコーディング遺伝子のホモ接合性変異が特定されている。バリアントがホモ接合したケースはコントロールで全く認められないレアバリアントなので、超長寿に関わる可能性がある。これらの遺伝子は免疫系、認知、さらに動物の寿命に関わることが知られている遺伝子で、納得できる。即ち、いくつかの寿命に関わる遺伝子がいくつか合わさった結果が超長寿につながっていると言える。
一方、多くの研究で寿命を縮める事がわかっている様々な遺伝子変異を調べると、ほとんど存在しないことも明らかになり、超長寿には遺伝的背景が重要であることがわかった。
以前115歳の超長寿者の血液がたった2個の造血幹細胞でまかなわれているという論文を紹介したことがあるが (https://aasj.jp/news/watch/1464 ) 、ここまで極端ではないが、老化に伴うクローン性増殖ははっきりと見られ、しかもTET2等の変異も特定される。この方ではMycの活性化を伴うB細胞のクローン増殖が際立っているが、他の超長寿者を調べると、B細胞の増殖が一般的でないこともわかる。いずれにせよ、変異も認められるクローン増殖状態が腫瘍にまで至っていない点で、この理由がわかると長寿への介入法が一つ明らかになるかもしれない。
オートファジーも老化とともに大きく変化することが知られているが、この方では様々な分子マーカーで調べたオートファジー機能は若い人と同じレベルを保っていた。
うらやましいのは脂肪代謝を調べると、VLDLレステロールがおそらく何もしていなくても極めて低値を維持しており、逆にHDLコレステロールは高い。即ち生活習慣も含め、若い血管を保つ要因を備えている。タンパク質解析からも、脂質のトランスポートや、リポプロテイン除去機能が若々しく保たれているのが確認される。
老化の指標である自然炎症のマーカーも低いレベルを保っているが、獲得免疫に関わる細胞やタンパク質は若いレベルを保っている。
現在老化指標として広く用いられる血液細胞のDNAメチル化も調べて、生物学時計の進み方が通常よりかなり遅いことを確認している。
最後に腸内細菌叢についても検討し、Bifidobacterium が群を抜いて高いことを発見している。この方はずっと多くのヨーグルトを摂取されており、これを反映しているのかもしれない。
最初に述べたようにこれは一例のケースレポートで一般化は難しいが、希な遺伝的背景に恵まれて、生活習慣病とは無縁の生活を送ることが超長寿の秘訣になる。いずれにせよ、我々凡人は超長寿とは無関係なことがよくわかる研究だった。
2025年10月5日
ALSは進行性の神経変性疾患で、現在のところ神経細胞やグリア細胞の内因的原因で起こると考え研究や治療開発が行われている。例えば昨年認可された変異SOD1の発現を抑える核酸薬はその代表的な例と言えるだろう。我が国でもCiRAの井上さんたちは iPS由来神経オルガノイドを用いた創薬研究を行っているが、この実験系では基本的に自己免疫疾患のような免疫メカニズムは想定していない。
一方で、これまでこのブログでも紹介したが、免疫系の関与を示唆する研究も存在する。一つは3例の患者さんに制御性T細胞を末梢血から純化し戻すと、細胞が作用している間は進行が止まるという研究だ(https://aasj.jp/news/watch/8483 )。さらに、マウスでT細胞が媒介する自己免疫ALSモデルを作成し他研究も紹介した(https://aasj.jp/news/watch/19988 )。
今日紹介する La Jolla 免疫研究所からの論文は、ASLの患者さんの末梢血のリンパ球を取り出し、ALS に関わるTD-43、SOD-1、C9orf72由来ペプチドに対する反応を詳しく調べ、ALS患者さんでは C9orf72 由来の様々なペプチドに反応してIL-5分泌など主に2型免疫反応を示すCD4T細胞の活性が上昇していることを示し、ALSも自己免疫として治療開発を行う価値があるのではと提案する研究で、10月1日 Nature にオンライン掲載された。タイトルは「Autoimmune response to C9orf72 protein in amyotrophic lateral sclerosis(ALSではC9orf72mタンパク質に対する自己免疫反応が見られる)」だ。
研究ではともかくALSの患者さんでALS関連分子に対する免疫反応を検出できるかに絞って調べている。 La Jolla 免疫研究所はコロナパンデミックでいち早く患者さんのT細胞免疫を調べた論文を発表した研究所で、ヒトの免疫反応検出では定評がある。
まず末梢血T細胞タイプの変化を調べると、増加しているポピュレーションは全く見られず、逆にMAITと呼ばれる粘膜免疫に関わるT細胞やTh1型のT細胞の減少が見られている。
次に、それぞれの抗原に対応するオーバーラップする15アミノ酸からなるペプチドプールを抗原として患者さんの末梢血の反応を見ている。ただ、反応するT細胞の数が少ないので、まず2週間抗原反応性細胞を増加させたあとで、同じ抗原で二次刺激を行い、様々なサイトカインの分泌反応を見ている。
結果だが、ALSとコントロールの反応を比べた時、ALS特異的反応が見られたのは C9orf72 に対してのみで、しかもインターフェロン分泌のTh1反応ではなく、IL-5やIL-10を分泌するTh2反応優性であるという不思議な結果が出ている。一方、パーキンソン病やアルツハイマー病の患者さんの末梢血も C9orf72 に反応するが、ほとんどがインターフェロン分泌するTh1がたであることも確認している。
以上から、ALSでは C9orf72 に対するTh1反応が上昇していると結論できるが、実際反応している細胞を調べると、DD4陽性のTh2型細胞であることが確認された。
この研究の圧巻は、ALS患者さんのT細胞が反応する個々のペプチドを特定している点だ。これまでの様にまず全てのペプチドをプールして刺激の後、次に10種類のペプチドで刺激を続け、最後に個々のペプチドに対する反応でサイトカイン分泌を調べると、それぞれのペプチドに対する反応が測定できる。なかなか凝った実験系だ。驚くのは、何人もの患者さんが反応する C9orf72 由来のペプチドがいくつも存在することで、例えば C9orf72 の57番目から70番目までのペプチドにはなんと3割の人が反応し、反応レベルも群を抜いて高い。要するに、なぜかALSの患者さんでは C9orf72 由来の様々なペプチドに対してTh2型の反応が起こっているということだ。また、それぞれのペプチドのHLAとの結合についても調べており、多くの人に反応するペプチドは確かに多くのHLAと結合できる。
しかし、これだけのデータでALSが自己免疫疾患だというのは早いと思う。これを証明するには免疫系を対象にした治療の結果病気を抑えられることを示す必要がある。これにはまだまだ時間がかかるだろう。さらに不思議なことに、ALSの患者さんでは C9orf72 のマクロファージでの発現が低下することが知られており、抗原が過剰に作られるという単純な話ではない。
実際、進行の遅い患者さんではペプチド刺激によるIL-10分泌反応が5倍以上高いこともわかっており、免疫反応の一部は病気の進行を抑えていることも示唆されている。逆に言うと、C9orf72 に対するIL-10反応を高めることで病気の進行を抑えられることすら考えられる。
以上のように、ALSの患者さんで C9orf72 に対する免疫反応が見られることは間違いないが、これらの免疫反応の病気に対する効果はまだまだわかっていないと結論するのが正しいだろう。面白いのは、ALSリスクの高い C9orf72 突然変異を持っている患者さんでは C9orf72 に対する免疫反応が何倍も高い。従って、神経変性と免疫反応が複雑に絡み合っていることは間違いなさそうだが、どちらが原因かについてはわからない。もし免疫が原因なら治療可能性が出てくるのだが。
2025年10月4日
腸上皮幹細胞がγδT細胞、上皮内T細胞、あるいは自然免疫に関わるILC等から分泌されるIL-22等のサイトカインによって調節を受けていることはよく知られた事実で、このメカニズムを強めることは腸管の再生力を高め、ひいては抗老化にもつながると考えられる。
今日紹介するMITからの論文は、システインの豊富な食事、あるいはシステインを摂取するだけで、特に上皮内CD8T細胞と上皮幹細胞 (ISC) の相互作用を通してISCの再生能力を高めることを示した研究で、10月1日 Nature にオンライン掲載された。タイトルは「Dietary cysteine enhances intestinal stemness via CD8 + T cell-derived IL-22(食事中のシステインはCD8T細胞由来IL-22を介して腸幹細胞の幹細胞能力を高める)」だ。
おそらくこのグループは腸管幹細胞のケトン合成酵素が食事により変化する現象に焦点を当てて研究していたように思う。ケトン体は当然幹細胞性活性を高めるので、ISCのケトン体合成に関わるHMGC2発現に影響するアミノ酸を一つづつ摂取させて調べた結果、システインが最も高いHMGC2誘導効果を示すことを発見した。種明かしをしてしまうと、最終的にシステインはHMGC2とは別の経路でISCを活性することがわかるのだが、システインを多く摂取させると幹細胞の増殖が高まり、放射線障害に対しても回復が早いことを発見する。
なぜシステイン摂取でISCの増殖力が上がるのか探索するうちに、システインを摂取したマウスでは腸管上皮のCD8T細胞の数が増加していることに気づく。とすると、ISCの増殖はCD8T細胞から分泌されるIL-22によって誘導されている可能性が浮上した。そこでT細胞の存在しないRAGノックアウトマウスにシステイン食を摂取させISC増殖を調べると、全く増殖が起こっていないことがわかり、CD8T細胞を介してISCが増殖していることを確認している。
次に、IL-22がシステイン食によるISC増殖のメインの要因かどうかIL-22ノックアウトマウスを用いて調べ、ノックアウトマウスではシステイン食のISCへの効果は全くないが、CD8T細胞の増加は見られることを発見する。即ち、システインによりCD8T細胞は増殖するが、IL-22ができないとCD8T細胞が増えても、ISCには何も起こらないことが明らかになった。
ではシステイン摂取によるCD8T細胞の増殖はどのようなメカニズムで誘導されるのか?アミノ酸は細胞内にトランスポーターを通じて吸収されるが、システインのトランスポーターは小腸の上皮に強く発現しているが大腸上皮や他の細胞では発現が低い。システイン摂取後の代謝物の動向を調べると小腸で代謝物が生成していることがわかり、システインはまず小腸の上皮に吸収されると考えられる。中でもCoenzymeA (CoA) はシステイン摂取に依存しており、これが上皮内で増殖することが最初の引き金になっている可能性が高い。そこで、CoAを直接摂取させると、システイン摂取とほぼ同じT細胞増加IL-22分泌、そしてISC増殖が見られることが予想通り確認された。
以上が結果で、なぜCoAが上皮で上昇するとT細胞が増加するのかについてははっきりしないが、CoAが直接CD8T細胞に作用するという話もあり、このようなメカニズムでT細胞が増殖し、IL-22を分泌することで、ISCの再生力を高めていることになる。とすると、システインは腸の幹細胞システム維持の重要なサプリメントになる可能性もあり、アンチエージング効果も期待できるかもしれない。もちろんガンの増殖を促す心配はあるが、直腸にはほとんど作用しないので、システインの抗酸化作用も合わせてサプリとして使われるような気がする。
2025年10月3日
組織レベルで細胞ごとに多くの遺伝子の発現を調べる方法が急速に進んでおり、AASJでも新しい組織学としてYouTube配信を2年前に行った(https://www.youtube.com/watch?v=KtjY4JEEjaA )。これまで開発された方法は、バーコード配列を組織上で読み取って mRNAをsingle molecule レベルで特定する方法と、識別のための読み取り配列を持つプローブを標的にハイブリダイズさせたあと、読み取り配列を検出する蛍光ラベルしたプローブを組織上で何度も繰り返す方法に分かれる。特に後者の方は必要なリエージェントやRNAの数を細胞ごとにカウントするソフトも提供され、また外注でサービスを受けることもできることから、普及が進んできた。
とは言え、MERFISHは一つの遺伝子に何個ものプローブが必要で、コストも含めて気軽に使えるというレベルにはなっていない。今日紹介するイェール大学からの論文は、MERFISHを利用するが、新しく開発したRNAを組織内で増幅する方法を組み合わせることで、MERFISHを一つのプローブだけでできるようにし、感度を上げた上にコストを下げることに成功した方法開発研究で10月1日 Cell にオンライン掲載された。タイトルは「Sequencing-free whole-genome spatial transcriptomics at single-molecule resolution(配列決定が必要でない単一分子解像度での全ゲノム空間トランスクリプトミックス)」だ。
これまでも組織上でRNAを増幅することは行われていたが、この研究では標的のRNAに接して結合する2種類のプローブに、片方には増幅のためのプライマー、もう片方には増幅される配列を結合させて、ハイブリダイゼーションしたRNA上でプライマーから標的配列まで何度も増幅できるようにしている。トリックとして、増幅される共通配列には最初切断を入れておいて、増幅が標的配列まで進まないようにしておく。まずこれを連結させる操作を行ったあと、プライマーから増幅させると、今度は標的のRNAも配列まで到達して増幅させることができる。この増幅したDNA配列を標的にMERFISHを行うと、一つのプローブで十分検出が可能になる。
この増幅セットを転写される全ての遺伝子に対して用意しておいて、増幅後にMERFISHで増幅された遺伝子を検出すると、一つのRNAは一個の明確なドットとして検出できる。人間で転写される16501個のコーディングRNAと、6811個のノンコーディングRNA全ての発現解析を肺ガン細胞株で行うと、一個の細胞あたり平均3749個のRNA を検出できる。
これまでin situ hybridizationというと、見たい遺伝子を決めて調べる方法だったが、一つの組織で全遺伝子について発現を調べられるということは、細胞が発現している遺伝子について予断を完全に排して解析ができることを意味する。即ち現在定番になった single cell RNA sequencing と同じレベルの解析に、組織上の局在まで加えて解析が可能になった。
このパワーを示すためいくつかの例を選んで解析を行っている。まず培養細胞を用いて全ゲノムレベルの発現解析を行うと、多くの遺伝子発現を見事に細胞周期ごとに振り分けることができる。中でもこれまで解析が進んでいないノンコーディングRNAのうち99種類は明確に細胞周期に割り当てられることを示している。
次に構築と全ゲノム発現解析を合体させるパワーを示すため、肝臓組織について同じように全ゲノムレベルの発現解析を行い、single cell RNA seq 以上の解像度で細胞を分類できること、さらにそれぞれの細胞が組織のどこに存在するのかについて明らかにすることに成功している。このおかげで、それぞれのゾーンに分布する細胞間の相互作用についても発現遺伝子から推定することができる。
他にも胎児の胎盤、あるいは免疫反応が起こっているリンパ節についても解析を行い、例えば胎盤では血管内皮、赤芽球、栄養膜細胞、マクロファージなどの局所での相互作用の様態を示したり、リンパ節では様々なゾーニングとともに胚中心がはっきりと他のゾーンから区別できることも美しい写真で示している。
他にもクリスパーノックアウトとの組み合わせられることなどを示しているが割愛する。結局論文を読んで貰わないと、どれだけパワフルな方法かを文章だけで伝えることはむずかしい。要するに、組織上で全ゲノムレベルの遺伝子発現を解析できる、これまでより高い信頼性を持った方法が開発されたことがこの研究の全てだ。あとは個々の生物学的問題をこの方法で解析していくことで評価が定まると思う。
この研究では、全ゲノム分のプローブを作る(あるいは買う)と、あとは増幅していくらでも新しい実験に使えることから、コストもMERFISHより遙かに安上がりだとしている。組織上での増幅に必要な全プローブのコストは、5100ドルで、2000回の実験が可能でとしているので、本当なら是非試してみる価値はある。ひょっとしたら、組織全ゲノム解析の定番になるかもしれない。
2025年10月2日
最近 Nature Medicine に発表された論文の中に、変わった切り口の臨床研究を見つけたので紹介する。
最初は糖尿病予備軍の糖尿病への移行を防ぐため、食事の改善や運動を取り入れたプログラムを参加者に1年間行って貰い、その後の9年にわたる経過観察で、実際に糖尿病への移行をかなりの程度防ぐことができたコホート研究の中から、体重が低下しない、あるいは増えたにも関わらず糖尿病予防が達成できたグループを抜き出して調べた研究で、タイトルは「Prevention of type 2 diabetes through prediabetes remission without weight loss(2型糖尿病を体重の減少なしに予防できるケース)」だ。
このような介入試験の常だが、1100人あまりの参加者のうち、230人は体重減少を達成できなかった。しかしながら、このうち50人は糖尿病予防が達成できており、体重減少と糖代謝の改善が乖離した。そこで、介入によって体重減少が達成できず、糖尿病の予防が達成できないグループ(non-responder)と、予防が達成できたが体重は減少しなかったグループ (responder) について、その差を探索している。結果をまとめると、
50人の responder では、介入によりインシュリン感受性が改善している。
Responder ではインシュリン分泌能やβ細胞機能が改善していた。
Responder では皮下脂肪優位の肥満で、体重にかかわらず介入成功者の多くは内臓脂肪の減少が見られた。
肝臓の脂肪は両者で変化なかった。
慢性炎症を示す指標は responder、non-responder で差はなかったが、responder ではアディポネクチンのレベルが non-responder より高かった。
GLP-1、GIP分泌は両者で変化はなかったが、グルカゴンのレベルが responder で低下していることから、インクレチンに対する感受性が responder では改善している。
遺伝的肥満リスクスコアに差はなかった。
以上が結果で、これまで考えられているように、皮下脂肪がついても、内臓脂肪の蓄積を防げれば糖代謝を正常に維持できる良い肥満と考えて良いという話だが、生活改善介入臨床研究から明らかになった点が面白い。
もう一つのフロリダ大学からの論文は、芸術の力を借りて病気を防げることをうたった研究論文を集めて調べ直したメタゲノム研究だが、記述的すぎてよくわからない点も多い。ただ、芸術の力を簡単に持ち出す話は多いので、その意味で面白い研究だ。タイトルは「The arts for disease prevention and health promotion: a systematic review(病気の予防と健康増進のための芸術:システミックレビュー)」だ。
この研究では芸術を健康増進や予防のために利用した結果を報告している論文を網羅的に集め、研究が科学的に行われたかどうかでフィルターをかけ残った6831編の論文を精査している。1992年から2024年までのほぼ30年に6800もの論文が健康と芸術の関わりについて発表されているのにまず驚く。
最終的には条件をクリアした95報に絞っているが、それでも解析は散漫で終わっており、結論らしい結論は出ずに、著者らの感想が書かれているといった具合だ。実際、芸術といっても、ビジュアルアート、音楽、ダンス、劇、文学まで含んでおり、それぞれ人間に対する影響は異なるはずで、アートと一言で片付けるのは乱暴に思える。
また、介入した対象集団も多様だが、どうしても貧困などの問題を抱えている集団が対象になりやすい。また多くの論文では最初からアートの効果を考えるわけではなく、貧困層の健康を守るためのリテラシーを上げるためのシンボルとして使われているケースが多い。例えばみんなで合唱しようといった運動のイメージだ。
結局明確な結論はなく、最後は著者の印象として、ほとんどの研究で芸術は文化活動に参加することで対象となった人々の身体的活動を高め、また人と人とが混じり合える機会を作るために用いられており、芸術自体の力というわけではないと結論している。わかりにくい研究でよく採択されたと思うが、ともすると芸術自体の力を信じてしまうが、それに対する批判的な取り組みとして見ると面白い。
2025年10月1日
オステオポンチンはbone biologyではよく知られた分泌分子で、石灰化を抑え、破骨細胞活性化による骨吸収を高めるなど、骨のリモデリングに関わる分子として知られてきた。ノックアウトマウスでは骨の発生に異常は認められず、骨吸収が抑えられ骨量増加が見られる程度だが、骨折時の修復の遅延等が報告されている。ただ、ノックアウトマウスの解析から、オステオポンチンが骨以外の様々な細胞で機能していることが明らかになった。
今日紹介する英国ガン研究所からの論文は、オステオポンチンが膵臓ガンの上皮間質転換を誘導し転移を促進することを示した論文で、膵臓ガンでは骨のリモデリングと使われている同じ分子セットが働いていることがわかる研究。9月24日 Nature にオンライン掲載された。タイトルは「SPP1 is required for maintaining mesenchymal cell fate in pancreatic cancer(膵臓ガンの間質細胞形質の維持に必要)」だ。
SPP1はオステオポンチンのことで、このような全く記号化された名前をわざわざタイトルに使うことで読んでみようとする人の数が減るのではないかと心配する。私も「SPP1とは何ぞや」と調べた結果、オステオポンチンと知って急に興味がわいた。
全く知らなかったが、膵臓ガンが進行すると血中のオステオポンチンが上昇するすることが知られていたらしい。この上昇が膵臓ガンの悪性度と関係があるのか調べるために、single cell レベルで遺伝子発現を調べ、オステオポンチンの発現と上皮が間質細胞のように変化するEMTが強く相関していることがわかる。ただ、間葉系に変化した細胞がオステオポンチンを分泌するのではなく、上皮タイプの細胞から分泌される。
ガン細胞からオステオポンチン遺伝子をノックアウトすると、間質系の形態をとる細胞が消失することから、上皮からのオステオポンチン分泌が間葉系へ転換したガンを維持していることがわかる。また発ガン後オステオポンチン遺伝子をノックアウトすると、転移が強く抑制される。異常のことから、膵臓ガンは様々な刺激で間質系細胞への転換が起こり転移しやすくなるが、間葉系細胞は上皮からのオステオポンチンに依存して増殖維持されていることが明らかになった。
そこで、上皮から分泌されたオステオポンチンが間質系細胞に作用するメカニズムを、上流から下流まで詳しく調べ、
膵臓ガンの場合オステオポンチンはインテグリンβ3を受容体としてシグナルを伝える。
膵臓ガンのオルガノイド培養で、オステオポンチン刺激によりBMP2とその阻害分子Grem1が誘導される。BMP2はインテグリンの直接の下流で誘導されるが、Grem1は誘導されたBMP2により誘導される。
インテグリンの刺激はNFκBシグナル経路を介してBMP2を誘導する。
以上が結果で、BMP2は snail、slug、twist 等を誘導してガンの上皮間質転換を誘導することは知られていたが、膵臓ガンではその上流にオステオポンチンが存在したことになる。そして、骨の細胞と同じように、BMP2は同時に自らの阻害剤であるGrem1の誘導を刺激することで、間質系転換への絶妙バランスを誘導することになる。
この3者によるバランスは、例えばGrem1をノックアウトしておくと、オステオポンチンをノックアウトしても間質系転換した細胞はそのまま維持される。逆にオステオポンチンを過剰発現させて誘導される強い間質系細胞への転換は、Grem1を過剰発現させると抑えられる。このようにBMP2を真ん中に3者がバランスを形成することで、膵臓ガンの上皮間質系転換が調節されていることがわかる。
研究としては特に驚くほどではないと思うが、膵臓ガンがオステオポンチン、BMP2、そしてGrem1という骨のリモデリングの三種の神器をそのまま使って、より悪性の転移しやすい細胞を作っているという類似性には驚いた。