2016年3月23日
我が国でもDTCサービス(個人用遺伝子診断サービス)が始まって、主に一塩基多型を元に様々な病気のリスク診断が行われるようになった。このサービスは、ほとんどの場合リスク診断という意味で受け取られており、また提供する方も、遺伝子検査からリスクを算定して、生活習慣を変えて病気が予防できると宣伝している。しかし、自分でお金を払ってDTCサービスを受けた顧客が、その後さらに健康意識を高めて生活するようになるかどうか、各社もあの手この手で調べようと努力しているが、簡単ではない。
今日紹介するケンブリッジ大学からの論文は遺伝子検査によるリスク判定では生活改善を促すほどのインパクトにならないことを示す調査研究で、英国医学雑誌に掲載された。タイトルは「The impact of communicating genetic risk of disease on risk reducing health behaviour: systematic view with metananalysis (遺伝子検査によるリスクを教えることがリスクを減らすための生活改善に与える影響:メタ解析を用いた総合的再調査)」だ。
研究ではこれまで遺伝子リスクを伝えることが生活改善努力につながったかどうかを調べた18編の論文を選び出し、ここで記載されたデータを詳しく調べなおしている。この中には、遺伝子リスクと禁煙行動を調べた我が国の研究も含まれている。この18の論文を見てみると、ほとんどは特定の病気に関する遺伝子リスクで、一般に行われている様々な疾患リスクを同時に予測するDTCサービスではない。例えば我が国の研究では、L-mycという直接肺ガンに関する遺伝子の多型を調べ、そのリスクが禁煙につながるかの調査を行っている。それぞれの論文で対象にしている疾患は異なっており、調べられた行動変化も、1)禁煙、2)アルツハイマー病のリスクに基づくビタミン剤の服薬、3)アルコール摂取、4)紫外線防御行動、5)ダイエット、6)運動、7)サポートプログラムへの参加、と多岐にわたっている。
結論は簡単で、すべての項目で、遺伝子検査だけでは人は動かないことを示した残念な結果だ。一方、ApoEが上昇していることを具体的に示された患者さんは、かなりの人が健康薬を常用するようになり、健康に気をつけるようになるようだ。
この結果の背景にある人間の心理については今後よく検討することが必要だろう。DTCは現在2−3万円前後で販売されているが、提供企業にすれば受けてくれた顧客と長い付き合いをして、様々な有料サービスを受けてもらって初めて投資に見合うだけの利益が上がるようになっていると思う。ところが、多くの人が遺伝子検査の結果にほとんど影響されないとすると、このビジネスモデルは成り立たなくなる。また、全ゲノム検査が安価に提供される日が1日1日と迫っている。最初に設定したものとは異なる新しい出口を示す必要が出てくるだろう。
私は全ゲノム解読が現在の価格の半分になれば、ぜひ多くの人が検査を受けて欲しいと思っている。この時、リスク判定など役にたつという考えで検査を受けてもらうようでは、普及しないだろう。ゲノム解読を21世紀を象徴する文化として推進する新しいアイデアが必要だ。
2016年3月22日
プロゲステロン(黄体ホルモン)というと、排卵後の卵胞が変化した黄体から分泌され、子宮を着床可能な状態に誘導するホルモンで、典型的女性ホルモンの一つだ。しかしこのホルモンは細胞に働きかける2種類のルートを持っていることをこの論文を読んで初めて知った。
今日紹介するカリフォルニア大学バークレイ校からの論文は、プロゲステロンが、遺伝子の転写を直接調節する核内受容体以外にもう一つの受容体を通して反応の早いシグナルを誘導することを精子の活性化をモデルとして示した研究で、8月18日Scienceオンライン版に掲載された。タイトルは「Unconventional endocannabinoid signaling governs sperm activation via sex hormone progesterone (性ホルモンであるプロゲステロンを介した通常とは違う内因性カンナビノイドシグナルが精子の活性化を調節している)」だ。
精子に限らず、核内受容体以外のプロゲステロン受容体が広く組織に分布していることは知られていたようだ。ただ、通常の細胞では核内受容体を介する活性が強いため、もう一つのシグナルを分離するのはなかなか難しい。そこでこの研究では転写活性のない成熟精子にプロゲステロンを作用させた時に何が起こるか調べ、秒単位でカルシウムチャンネルが開くことを発見した。次に、チャンネルが開くメカニズムを調べ、プロゲステロンが直接結合するのではなく、内因性のカンナビノイドによる抑制が外れてチャンネルが開くことを突き止める。すなわち、細胞膜に存在してカルシウムチャンネルを阻害していた内因性カンナビノイドがプロゲステロンの刺激により分解され、カルシウムチャンネルへの抑制が外れて、チャンネルが開くというプロセスが明らかになった。最後に、プロスタグランジンに結合して内因性カンナビノイドの分解を促進する分子を探索し、ついに加水分解酵素alpha/beta hydrolase domain containing protein 2 (ABHD2)を突き止める。
この結果、精子が精巣上体へと移動していく過程で、1)プロスタグランジン刺激を受け、2)ABHD2酵素が活性化され、3)内因性カンナビノイドの分解を通して膜脂肪酸の再編成が起こり、4)この結果カルシウムチャンネルへの抑制が外れて、5)精子が活性化し人間の場合運動が高まる、というシナリオが示されている。他の細胞では何が起こるのか興味がある点だが、実際生理や妊娠でおこる説明のつかない変化の一部は、ひょっとしたらこのシグナルが関わっているかもしれない。
驚きはないが、一つづつ物知りになれることを実感する研究だった。
2016年3月21日
まだ臨床医をしていた時、人工透析のシャントを外して自殺未遂を図った患者さんからB型肝炎をもらった。今でもこの時の思い出は鮮明だ。ナースから呼ばれて病室に駆けつけると布団が血の海で、カルテを詳しく見る間もなく止血、輸液、そして最後に輸血をはじめ、処置が済んでほっとしてからカルテを見るとHB陽性だった。当時は手術処置以外手袋をする習慣がなく、やばいなと思っていたら、2ヶ月半後急性肝炎になった。幸い慢性化せず今もアルコールを楽しめるが、医療が危険と隣り合わせだということを思い知った。
B型肝炎ウイルス(HBV)は極めて複雑な生活サイクルを持つ。原則的に1本鎖DNA で、これが核内で安定な環状の2本鎖DNAを形成し細胞内に長く維持され、そこから新しいウイルスを作るためのRNAを転写し続ける。この時HBVは、染色体外に独立して存在するウイルスの転写を優先するようホストの転写システムを変化させる。ウイルスゲノムがホストゲノムに組み込まれるとこの転写促進は消失することから、ホストゲノム外にあるエピゾームの転写だけが促進される。この現象にウイルスの持つHBx分子が関わることはわかっていたがメカニズムの詳細はわかっていなかった。今日紹介するジュネーブ大学からの論文はHBxの作用メカニズムを明らかにした研究で3月17日発行のNatureに掲載された。タイトルは「Hepatitis B virus X protein identifyies the Smc5/6 complex as a host restriction factor (B型肝炎ウイルスのXタンパクはSmc5/6分子を宿主のウイルスに対する防御因子として特定し処理する)」だ。
これまでの研究でHBx分子はホストのDBB1と結合しタンパク分解システムを利用することで、ホスト内の邪魔な分子を処理することがわかっていた。この研究は、この処理される分子とは何かを検討している。方法としては、DDB1とHBxが結合しているキメラタンパク質を作り、これに結合する分子を生化学的に調べ、Smc5とSmc6を中心に複合体を形成している分子が、このキメラタンパクと結合していることを発見した。即ち、肝炎ウイルスにとって邪魔な分子がSmc5/6複合体で、HBxはこれと結合してホストのタンパク分解システムを使って分解していることがわかった。
Smc5/6はもともとDNA切断による修復システムとして働いており、また核小体でのリボゾームDNAをRAD52分子から守っていることが知られている。B型肝炎ウイルスにとってどの機能が邪魔なのかはっきりしないが、Smc5/6を欠損させた細胞では、やはりエピゾーム型のウイルスゲノムの転写が上昇するので、この複合体をHBxが標的としていることは間違いないようだ。おそらく、Smc5/6複合体昨日の研究に取っても面白い系が出来たと思う。
RNAウイルスであるC型肝炎では完治のための薬剤が開発されたが、B型肝炎を完全に除去する治療薬はない。この研究は新しい治療標的を示せた点で重要だ。しかし、またウイルスのスマートな戦略を思い知った。
2016年3月20日
以前このホームページで紹介したが、マイケル・クライトンが小説ジュラシックパークで描いた琥珀の中の生物からDNAを採取して解読する話は、科学的にありえないことが示されている(
http://aasj.jp/news/watch/480)。しかし、この小説が出版されたあと、このアイデアに影響された研究者から、琥珀の中の生物のDNA解読の論文がトップジャーナルに相次いだのは、研究者の強い思い込みが科学を簡単に間違った結論に導くことを教えてくれた(
http://bylines.news.yahoo.co.jp/nishikawashinichi/20151102-00051047/)。 現在、時間によってDNAが被る物理化学的変化については理解が進み、一定の割合でDNA情報が時間とともに失われることがわかっている。従って、どの年代の遺物まで解析を拡大できるのか、慎重な研究が続いている。今日紹介するライプチヒ・マックスプランク人類進化学研究所からの論文はスペイン・カスティーヤ地方のアタプエルカで発見された中期更新世の人類の骨のDNAを解読できるかどうかの挑戦についての論文で3月14日号のNatureに掲載された。タイトルは「Nuclear DNA sequences from the middle Pleistocene Sima de los Huesos hominins (Sima de los Huesosで発見された中期更新世時代の人類の核DNAの配列)」だ。
Sima de los Huesosではこれまで中期更新世時代の人類の骨が40本以上発見されている。私たちホモサピエンス(HS)の祖先がアフリカからユーラシアに移動した7−10万年前よりはるかに古い40万年前の原人と推定されている。すなわち、もう一つの人類デニソーバ人とネアンデルタール人が別れた40万年前後に一致する。事実ここで出土した骨の特徴は、ネアンデルタール人に似ていると示唆されていた。ところが最初に解読されたミトコンドリアDNAは、スペインを含む西ヨーロッパに居住していたという証拠の全く見つからないデニソーバ人により近縁で、ネアンデルタール人とデニソーバ人の関係についての大きな謎が残った。そこでこの分野のパイオニア、ペーボさんたちは核DNAの復元に挑戦していた。論文のほとんどは実験上の困難の記載にさかれている。要するに、どれが骨の持ち主のDNAかを慎重に検証する作業の繰り返しだ。ようやく4万—200万bpの原人由来DNA配列を特定し、このうち100万bp以上の解読ができた配列を用いてネアンデルタール人、デニソーバ人、現代人のゲノムと比較、結局この場所から出土する原人はネアンデルタール人に近いと結論している。一方、新しく解析された原人もミトコンドリアはデニソーバ人に近かった。このミトコンドリアDNAと核DNAの矛盾については、ヨーロッパのネアンデルタール人が、アフリカから移住してきた母のミトコンドリアに由来しているからではないかと説明している。このように50万年前まで解析が拡大すると、さらに人類の相関図が詳しくなると期待できる。ペーボさんたちの頭には何万年前が標的になっているのだろう?
折しも3月17日Scienceオンライン版に掲載された同じ研究所からの論文では、現代人ゲノムの中のネアンデルタール人、デニソーバ人由来の遺伝子を拾い出して再構成する研究が行われている。すでに、現代人に散らばるネアンデルタールの遺伝子は、1300Mb、デニソーバ人の遺伝子は300Mb拾い出されてマッピングされている。その結果、ネアンデルタール人と我々の祖先が何回かにわたって交雑を行っていること、またメラネシアの人たちにはネアンデルタール人とデニソーバ人両方の遺伝子が残っていることが確認されている。他にも、知能に関わるネアンデルタール人遺伝子は現代人から完全に消えているようだ。我々とネアンデルタール人との戦いは、頭脳勝負だったのか、体力勝負だったのか興味は尽きない。
この研究所の発展を見ると、つくづく羨ましい。
2016年3月19日

明日14時よりAASJチャンネル(ニコニコ動画)では、大阪医大の学生さんが中心となった、「高い意識を持った生命科学の学生」のための放送を行う。この放送はあくまでも学生が中心で、私はいわばコメンテーターの役割だが、彼らはこの番組を続けていこうと「えぐる」という名前まで考えている。第一回は今話題の「CRISPR/Cas9をえぐる」(図1)だ。
山中iPSと同じで、一般報道はCRISPR/Casを臨床応用との関わりでしか扱わないが、この技術の「びっくり道具箱」としての可能性は計り知れない。おそらく提案した学生たちも、一般報道と同じレベルからスタートしているのだろう。コメンテーターとしては彼らにこの大きな可能性を伝えることができればと思っている。生命科学を目指す学生さんには是非見て欲しいと思う。この第一回の放送にふさわしいCRISPR論文がないかと探していたら、カリフォルニア大学サンディエゴ校から最適の論文が4月7日発行予定のCellに掲載された。タイトルは「Programmable RNA tracking in live cells with CRISPR/Cas9(CRISPR/Cas9を用いて生きた細胞の中でRNAの動きの追跡をプログラムする)」だ。
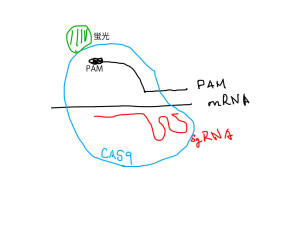
普通CRISPR/Casシステムの標的は2重鎖DNAで、Cas9が標的に結合するためには標的内のPAMと呼ばれる短いストレッチと、標的DNAに結合するガイドRNAが必要になる。この研究では、PAMの機能を果たすDNAを外部から提供して、ガイドを1本鎖RNAと結合させることで(図2)Cas9をmRNAに結合させられないか検討している。結果は期待通りで、外から標的RNAと相補的に結合するガイドRNAとやはり標的RNAに結合するPAM—DNAを細胞に導入し、蛍光標識したCas9を発現させると、Cas9は標的mRNAと核内で結合し、核から細胞質、そして必要なくなったRNAが処理されるストレス顆粒に移行する様子を追跡できることを示している。詳しい写真などは明日の放送で紹介するが、特定のRNAの動きを映画で取ることができるようになった。
この論文はおそらく始まりにすぎない。同じテクノロジーは、肝炎やインフルエンザなどRNAウイルスの細胞内での胴体の追跡に大きな力を発揮するだろう。要するにCas9を介して、好きな分子を特定のRNAに結合させることが可能になった。このことは、ゲノム編集どころか、CRISPR/Cas9が生きた細胞の中であらゆる形の核酸や核酸に結合する分子の編集を可能にすることを物語っている。この興奮が明日学生さんにも伝わるのか、楽しみだ。
2016年3月18日
一般の人は再生医学というと、試験管内で組織や細胞を調整して、変性した組織に移植することを想像すると思うが、一番優れた再生医学は、自分の組織がもともと持っている再生能力を発揮させて、変性組織を生き返らせる方法だ。ただこのような方法の開発にはおそらく優れた臨床医の感性が必要だと思う。今日紹介する孫文の名前にちなんだ広州・中山大学からの論文はレンズ全体を体内で再生させるという内容にも驚くが、優れた臨床医の感性を感じさせる研究で、3月17日号のNatureに掲載された。タイトルは「Lens regeneration using endogenous stem cells with gain of visual function(組織に存在する幹細胞を利用したレンズ再生により視力を得る)」だ。
レンズを作る細胞をリクルートする幹細胞が存在し、少しは再生に寄与することは知られていたようだが、重症の白内障になるとレンズを完全に抜き取り、人工レンズに置き換えるのが普通だった。この研究では、人工レンズを使わず再生ができないか、基礎研究から、前臨床研究、そして臨床研究へと絵に描いたような道を辿って調べている。まず、幹細胞がレンズ前面を覆う上皮であることを示すため、心臓死の方のレンズを提供してもらい、その全培養を行って、増殖細胞をラベルする実験を行っている。また、細胞培養でもこの細胞の幹細胞性を示している。次に、様々な遺伝子改変マウスを用いて、Pax6/Sox2陽性細胞が幹細胞として体内で働き、レンズを再生していることを明らかにする。また、この自己再生に血液幹細胞でも働いているBMI1分子が重要な役割を演じており、この分子が欠損すると再生が低下し、白内障が起こることを示している。これでも十分面白い研究だが、次に幹細胞をできるだけ障害せずにレンズを抜き取り、元のレンズを再生する治療法を開発できるかどうか、まずウサギ、そしてアカゲザルで手術術式を確立し、最後に同じ術式を用いて12例の新生児白内障を治療している。上皮を極力残してレンズをぬきとる手術で、完全なレンズが再生するのは驚きだが、8ヶ月時点でこれまでの治療法と遜色ない回復が全例で得られている。重要なのは、この方法だと時間はかかるが、ほとんど副作用がないことだ。コントロールとして選んだ25例の人工レンズの患者さんの92%では何らかの不具合が発生している。これに対して、新しい手術方法では17%しか不具合は発生していない。今後改良を重ねて、一般の医療として確立する可能性が高いと思う。
繰り返すが、基礎から臨床まですべての過程が一編の論文にまとめられているのは圧巻だが、眼科医としてのセンスが前面に押し出され、結果としてこれまでよりずっと安価な治療法を開発できている。まさに臨床医冥利につきるだろう。臨床医でないとわからないことがあることを実感する論文だった。
2016年3月17日
物質代謝はよく渦に例えられる。渦を作っている水分子は刻々と変化するが、渦という巨視的形態は内部の分子が変わっても維持される。細胞も同じで、それを構成する分子は代謝により刻々と変化するが、細胞のアイデンティティーは生きている限り維持される。などとほざいていても、実際細胞内で起こっている物質代謝についてどこまで知っているのか本当は心もとない。
今日紹介するマサチューセッツ工科大学からの論文は培養細胞内の炭素がどの栄養成分に由来するか丹念に調べた研究で3月7日号のDevelopmental Cellに掲載された。タイトルは「Amino acids rather than glucose account for the majority of cell mass in proliferating mammalian cells (ブドウ糖よりアミノ酸が分裂中のほとんどの細胞の質量に貢献している)」だ。
研究では培養中の有機物(糖、脂肪、アミノ酸、核酸)の収支を正確にはかるとともに、C14アイソトープで標識した様々な栄養成分で細胞を培養し、その成分から細胞の質量の何パーセントができるのか調べている。結果は詳細にわたり、詳しく述べても仕方ないだろう。まとめてしまうと、タイトルにある通り増殖中の細胞の質量のほとんどは外部からのアミノ酸の摂取に頼っており、核酸は別として、ブドウ糖から新たにアミノ酸や脂肪を作ることはほとんどないという結果だ。これは、外部からできるだけ完成した栄養分を摂取して、細胞内で新たに合成することを避けることにより、合成したATPを節約し、多くの有機成分を細胞の分裂・増殖に回していることを示唆している。研究では、ブドウ糖やアミノ酸の細胞質量への取り込みの割合を、増殖中と静止期の細胞で比べたり、脂肪を外部から供給しない条件、すなわち細胞自ら脂肪を合成する必要がある条件で培養するなど、様々な条件で同じ実験を繰り返し、外部からの栄養成分の使われ方を調べている。細胞は必要なら有機分子を自分で合成するが、環境に栄養分があればそれを有効に使って、なるべく自己努力を減らして生きるようにできているようだ。
この結果は全て培養中の細胞での話で、細胞同士が複雑な相互作用を行う個体全体の代謝バランスを反映しているわけではない。ただ、これからの医学では細胞培養技術の革新が必要になる。私が卒業してから引退するまで、培地の栄養組成についてはほとんど変わっていないのではないだろうか。これは、培地開発が特定の細胞の増殖だけを指標に行われ、細胞内での代謝を詳細に調べたデータを利用してこなかったからだろう。今日紹介したような研究を基礎に、細胞にストレスのない培養法が開発されるのだろうと思う。
2016年3月16日
様々な組織の細胞が障害されている程度を図ることは、臨床検査の重要な項目になっている。血中に漏れ出た酵素を用いて肝臓細胞障害や心筋梗塞の程度を測定するGOTやLDH検査は一般の人にも馴染みが深い。ただ、このような検査のためには組織特異的な酵素を見つけてくることが重要になる。これに対し、今日紹介するイスラエル、ヘブライ大学からの論文は、血中に漏れ出たDNAを酵素の代わりに用いる可能性を調べた研究で、米国アカデミー紀要オンライン版に掲載された。タイトルは「Identification of tissue-specific cell death using methylation patterns of circulating DNA(血中DNAのメチル化パターンを使って組織特異的細胞死を検出する)」だ。
血中に漏れ出たDNAと言ってももちろんあらゆる細胞は同じ DNAを持っており、そのままでは診断にならない。この研究ではDNAに加えられる組織特異的メチル化パターンを組織細胞の指標にしている。例えばインシュリンをつくる膵臓β細胞のプロモーター付近の6カ所のCpG配列はβ細胞だけでメチル化を受けている。逆に神経細胞発生時に必要な転写因子Brain1は脳以外のほぼ全組織でメチル化されているが、脳のほぼすべての細胞ではメチル化が外れている。さらに、脱髄性疾患で問題になるMBP分子は髄鞘をつくるオリゴデンドロサイトだけでメチル化が外れているという具合だ。このように組織特異的メチル化パターンを特定して、そのパターンを血中に漏れ出たDNAで調べることで、1)1型糖尿病で膵島移植を受けた患者さんでの移植膵島の状態や、1型糖尿病の患者さんの状態、2)多発性硬化症の再発、3)外傷性の脳障害の程度、4)膵臓癌と膵炎の経過、鑑別などが可能であることを、少人数のパイロット試験ではあるが、示している。
メチル化パターンを利用して直腸癌を診断する検査がすでにPhase IIIを終わっていることを考えると、当然の試みだと思う。様々な組織のメチル化パターンの比較から、検査に適したDNA断片を見つけてくるのもオーソドックスで、確かに新しい検査法が開発できることがわかる。しかし、読んでから、この検査が普及するかどうかを考えると、ビスルフィド処理とPCRが必要であることなど、普及を妨げる幾つかの問題があるようだ。少なくとも一般検査にはまだ適さないだろう。ただ、MiniOnなどの一分子シークエンサーで直接メチル化パターンを簡便に解読できるようになると(時間の問題だろう)、ブレークするかもしれない。それまでは、やはり論文のための論文という印象だった。
2016年3月15日
抗原で刺激されると、B細胞はリンパ組織の胚中心と呼ばれる領域で選択され、抗原とより高い親和性で反応できる抗体を進化させる。この過程は免疫反応の中でも最もよく研究されていると言っていいだろう。元々臨床をやめて基礎研究を始めた時、抗体遺伝子の再構成と突然変異と選択による抗体親和性の進化について研究しているRajewskyの研究室に留学したので、今は完全に免疫学から離れていても、この分野は興味を持って見てきた。それでも、この胚中心でのリンパ球の選択過程を目で見ることができるとは考えたことがなかった。今日紹介するマサチューセッツ工科大学の論文は、胚中心で起こるB細胞の選択過程を可視化する方法を示した面白い研究で、3月4日号のScienceに掲載された。タイトルはズバリ「Visualizing antibody affinity maturation in germinal centers(胚中心での親和性の成熟を可視化する)」だ。
この研究ではB細胞が活性化され胚中心に入る前後から誘導されるAIDという遺伝子にタモキシフェンを投与時にCreリコンビナーゼが活性化される遺伝子を導入している。これにより、胚中心に入ってきたB細胞を選択的に標識できる。普通標識には一種類の蛍光標識遺伝子を用いるが、この研究ではそれぞれの染色体に4種類の蛍光遺伝子を導入し、そのうちの一つがCreによって活性化されるように設計している。これにより、それぞれの染色体でどれか一つの色が選ばれる。染色体は2本あるので、これにより10種類の異なるカラーでB細胞クローンを標識することができる。この方法を着想し、実際に使えるようにしたのがこの研究の全てだ。
この方法で、抗原刺激後5日目、胚中心で選択が始まる少し前にタモキシフェンを注射してB細胞を標識し、その後の過程を見ると、標識後3日目では様々な色の蛍光を発するB細胞からできていた胚中心が、時間とともにクローン選択され、特定の蛍光で標識されたB細胞によって占められる過程がわかる。
とは言っても、すべての胚中心が一種類のクローンによって占有されるというわけではなく、反応が終わった時点でも何種類かの蛍光を発するB細胞クローンが混じり合っている胚中心も存在している。細胞を取り出して抗体遺伝子の配列を調べ、作っている抗体の抗原への親和性を調べると、親和性は間違いなく上昇して進化が進んでいる。また、同じ胚中心に存在するB細胞は、異なるカラーで標識されていても近い関係にあることも分かった。
以上の結果から、AIDが誘導されタモキシフェンが効果を発揮するタイミングや、T細胞との相互作用のタイミングなど、様々な要因で、B細胞クローンは胚中心内でも、親和性上昇とは別に多様化してしまうようだ。要するに、胚中心は抗原への親和性を上昇させる場所であることは間違いない。一方、B細胞の細胞内過程への影響は、同じ胚中心でも多様性があるため、蛍光カラーが必ず一種類になるわけではないが、たまに、一つのクローンが普通より早い速度で拡大すると、胚中心が一つのクローンだけで占有されることになるようだ。これらの結果は、少し予想とは違ったが、おおむねこれまで何十年かの研究で蓄積された考えに沿った結果が出ていると言えるだろう。しかし、この動きを全部見ることができるとは感激だ
私事になるが、ドイツ留学中に使っていた懐かしいNP抗原やB1-8というイディオタイプの名前が出て当時を思い起こすことができた楽しい論文だった。
2016年3月14日
2014年のノーベル賞を受賞した脳内の場所記憶に関する研究は、詳細はともかくとして、専門外の人間にも問題がわかりやすく、「なるほど」と結果を楽しむことができる。また手法も、同時に何百もの神経細胞を行動と共に記録してコンピューター解析で相関を調べる、ビッグデータ解析の走りが使われており、21世紀的雰囲気がある。
いずれにせよ、頭の中に地図があることで行動の安心が得られるのがよくわかる。この記憶は寝ている時にも維持されないと、夜中にトイレに行くのに困ることになる。この記憶維持には、休息中、あるいは睡眠中に定期的に興奮を繰り返すことで場所記憶が維持されるとされてきた。今日紹介するカリフォルニア州立大学サンフランシスコ校からの論文は、これまで知られていた場所記憶細胞やネットワークとは全く違った反応を示す細胞を海馬のC2領域に発見したという論文で3月10日号のNatureに掲載された。タイトルは「A hippocampal network for spatiall coding during immobility and sleep (静止中や睡眠中に場所をコードする海馬ネットワーク)」だ。
研究では新しい手法が用いられているわけではなく、これまでの場所神経細胞の研究と同じように迷路を移動中、休息中、そして睡眠中に、海馬のCA1,CA2,CA3領域に存在する細胞の神経興奮を同時記録し、あとで詳しく分析している。これまで報告されているように、すべての領域で、迷路課題に取り組んでいる時、場所に応じた神経興奮が記録され、また同じ細胞が休息中、あるいは睡眠中に短く興奮しておそらく記憶を維持しているのが確認される。
ただ、この研究ではこのネットワークに加えて、このネットワークが興奮する時に逆に興奮が低下している神経細胞集団をCA2領域に発見し、この細胞の機能に注目して研究を行っている。CA2Nと名付けたこの集団は、動いている時にはあまり興奮せず、動きが遅くなったり休んだりしている時に興奮し、興奮の頻度にも特徴がある。また、それぞれのCA2N型神経細胞は、迷路で褒美にありついた時の場所の記憶と相関している。ただこれはCA2領域特異的ではなく、他の領域にもCA2Nと相関して興奮する神経が見つかることから、特定の場所に応じて興奮するネットワークに対して、休息中にのみ場所情報を提供するネットワークが存在することを示唆している。言って見れば、動と静に応じたネットワークのセットで場所記憶を維持していることになる。面白いのは睡眠中で、記憶維持のために場所細胞が興奮する時、CA2Nネットワークが興奮して、睡眠中の場所細胞興奮を抑えることを発見している。
結果はこれだけで、実際このネットワークが何をしているのかはまだ推論に過ぎない。将来、このネットワークだけを抑制する方法を開発して何が起こるのかなどが研究されるだろう。しかし、陰と陽、動と静がセットになって記憶が維持されるのはなんとなく理解できる。
旅行中のホテルで目が覚めて、今どこにいるのか混乱することがあるが、迷路のパターンをマウスの睡眠中に変えてしまうとどうなるのか、想像が尽きない面白い領域だ。





