2023年11月13日
「食べ物の分解によりできたコレステロールは十二指腸で胆汁の作用でミセル化した後、小腸上皮のコレステロール結合分子NPC1L1 により補足され、その後おそらくエンドゾームを経て小胞体(ER)に移送され、そこで ACAT2分子によりエステル化され、そこで他の死亡とともにカイロミクロン形成がおこり、細胞外へ分泌される」と思っていた。
ところが細胞膜から ER までの輸送経路については全くわかっていなかったようで、今日紹介する UCLA からの論文は、肝臓での膜から ER へのコレステロール輸送に関わる Asterファミリー分子が小腸上皮でも働いていることを示した研究で、11月10日号の Science に掲載された。タイトルは「Aster-dependent nonvesicular transport facilitates dietary cholesterol uptake(Aster分子による小胞体を介さない輸送システムが腸管でのコレステロール吸収を促進する)」だ。
Aster はコレステロール細胞輸送の担い手として肝臓で研究が進んでおり、当然小腸でも働いていて良い。そこで、Aster分子が遺伝的に標識されているマウスを用いて調べると、主に Aster-B と Aster-C が発現しており、両方をノックアウトするとコレステロールの吸収が低下することを発見する。さらにコレステロールの吸収されるプロセスを追跡して、Aster が細胞膜から ER への輸送に関わることを明らかにしている。重要なのは、Aster 阻害だけでは完全に抑えられないので、これまで考えられてきた他の経路も存在するが、Aster 経路が本筋になっている。
コレステロールは合成できるので、Aster B/C をノックアウトしてもマウスは生まれてくるが、ノックアウトマウスでは高コレステロール食でもコレステロールは上昇しない。ただ、当然体内での合成は上昇している。
コレステロール吸収を阻害する薬剤としてNPC1L1に結合するエゼチミブが使われているが、面白いことにエゼチミブは Aster にも結合して、分子を安定化させる。
次に Aster の細胞内での動態を調べ、コレステロールが細胞膜にロードされると細胞膜へと移行し、ここで NPC1L1 からコレステロールを受け取って ER へと移動し、最終的にエステル化のために ACAT2 に受け渡されることを明らかにしている。
さらに、Aster を阻害する AI-3d でこの過程を抑制し、エゼチミブと同じようにコレステロール吸収を抑えることを明らかにしている。
結果は以上で、小腸での吸収経路が明らかになり、標的分子が増えることで、食事からのコレステロール吸収を抑える様々な薬剤の開発が加速すると思う。現在もスタチンと併用してエゼチミブが使われているが、他の可能性が生まれることは製薬会社だけでなく、食品企業にとっても重要だろう。
2023年11月12日
両生類や魚類は言うに及ばず、人間やマウスのような哺乳動物でも成熟した卵子は大きく、肉眼でもなんとか確認できる。これは卵発生過程で母親からRNAや蛋白質が注入され、受精後の急速な活動に備えるためだ。ある意味で、卵は高分子でパンパンに膨れた細胞とも言えるが、母親からの多くの高分子は受精後まで保存しておかないと、いざというときに使えない。ただ、卵子と言っても生きており、細胞内での蛋白質の代謝機構が働いており、貯蔵する蛋白質はこの代謝経路から隔離する必要がある。
今日紹介するドイツ・ゲッチンゲンにある最も新しいマックスプランク研究所( Multidisciplinary Science )からの論文は、マウス卵子での蛋白質貯蔵の仕組みを、最近の顕微鏡テクノロジーを駆使して明らかにした研究で、11月2日 Cell にオンライン掲載された。タイトルは「Mammalian oocytes store proteins for the early embryo on cytoplasmic lattices(哺乳動物の卵子は初期胚に必要な蛋白質を細胞質格子に貯蔵する)」だ。
この論文を読むまで知らなかったが、哺乳動物の卵子には電子顕微鏡レベルで検出可能な格子構造が存在し、この構成には PADI6 と Subcortical maternal complex (SCMC) と呼ばれるいくつかの分子の複合体が必要であることがノックアウト実験からわかっていた。ただ、この格子構造が何をしているのか、ほとんどわかっていなかった。
まずこの研究では現在使える画像技術が独自に工夫された上で利用されている。ただ高額器械があれば研究が出来る物ではなく、それを使いこなす努力の必要性がよくわかる。使われた画像技術をリストしておくと、高解像度顕微鏡、組織を膨らませて拡大する技術(Expansion microscopy)、3D 高解像度解析、クライオ電顕、Scanning Transmission Electron Microscopy, Cryo-electron tomography などだ。しかし通常の細胞と異なり、卵子は大きいためこれらの技術を使いこなすには様々な工夫が必要で、それがこの研究の売りになるが割愛させていただく。
結果は以下に箇条書きにする。
細胞質格子は PADI6 と SCMC を核に形成される。ただ、これまで細胞膜に近いところで形成されていたというのは、蛍光体法のアーティファクトで、実際には細胞質全体に拡がっている。
細胞格子は構造的にコアになる蛋白質が形成するらせん状の700nmサイズのフィラメントが5-40本集まって出来ており、PADI6、及び SCMC が核になっている。
この構造がなくなると、卵子細胞質の多くの蛋白質の量が低下する。そして低下する多くの蛋白質は母親から卵子に注入された蛋白質で、初期発生での分裂、転写、翻訳という重要な機能に必要な分子になる。
これは PADI6 などのコアになる蛋白質が低い親和性で様々な蛋白質と結合する能力があるからで、これにより胚発生まで残しておきたい蛋白質を、細胞格子に閉じ込めて、細胞の代謝から隔離することが出来る。
実際この格子が出来ない変異では、正常な胚発生が出来ず、流産したり、構造のない胞状奇胎形成が起こる。また、格子の量的な変化でも、DNAメチル化再構成に必要な分子が先に使われてしまい、インプリント異常が起こる。
以上が結果で、小胞体のような細胞内器官、相分離などに加えて、新しい蛋白質の隔離貯蔵法の存在が示された。しかしなんと言ってもこの研究の売りは、形態学で、イメージに圧倒される。是非写真だけでも眺めて欲しい論文だ、
2023年11月11日
CAR-T による白血病のめざましい治療報告が発表されたとき、CAR-T の力を思い知らせてくれたのは、白血病細胞だけでなく正常のB細胞も身体から消失するという驚きの事実だった。使った抗原は正常B細胞に発現していることから当然なのだが、この事実を見て免疫治療はガン治療の中心になると実感した。
この性質を生かして、B細胞抗原に対する CAR-T を使ってB細胞を除去し、自己抗体を抑えるという自己免疫治療さえ行われるようになってきたが、自己抗体産生細胞を除去したいなら、抗原を細胞外に発現するT細胞キメラ受容体を用いれば、自己抗体を作っているB細胞だけ除去することが出来るのではと着想した研究がマウスモデルで進んでいる。
最初の研究は世界のCAR-Tセンターになったと言っても過言でないペンシルバニア大学からで、2016年デスモグラインに対する自己抗体により皮膚に水疱が出来る天疱瘡モデルマウスをデスモグラインを細胞外に発現するCAR-T細胞で治療可能であることが Science に発表され、さらに今年に入って同じグループによって重症筋無力症のキナーゼ抗原を用いた CAR-T を用いた治療の可能性が Nature Biotechnology に発表された。
今日紹介するドイツベルリンにあるドイツ神経変性疾患センターからの論文は、最も重要な神経伝達分子の一つ NMDA 受容体に対する自己抗体による重篤な脳炎治療のための CAR-T の開発研究で11月9日号の Cell に掲載された。タイトルは「Chimeric autoantibody receptor T cells deplete NMDA receptor-specific B cells(自己抗体に対する受容体を発現する自己T細胞はNMDA特異的B細胞を除去する)」だ。
アイデアについては既にペンシルバニア大学からの論文が2報あるのによく掲載にこぎ着けたなと言うのが正直な感想だが、しかし重篤な脳疾患であることを考えると、実際の患者さんの自己抗体遺伝子を14種類もクローニングし、ほぼ全てに反応する NMDA受容体の構成を決め、最適の NMDAR分子構成を持つキメラ遺伝子を作成し、これをマウスT細胞に導入して、自己抗体を分泌するB細胞を除去できるか確かめており、勿論評価は出来る。
結果は予想通りで、基本的にはどんな自己抗体でも NMDAR に反応すれば必ず in vitro でも in vivo でも除去できることが示されている。また、in vivo の実験ではほとんど副作用を認めることもないし、また標的細胞が少ないためサイトカインストームも起きにくい。
従って、結果の詳細は省くが、一つだけ驚いたのは、自己抗体による免疫病の場合、血中に自己抗体が大量に存在するのに、それに対する抗原をT細胞受容体にしているT細胞が働ける点だ。実際、マウス体内の実験だけでなく、試験管内でも自己抗体存在化に、キラー細胞活性が発揮できている。
これを結果オーライと済ますのは簡単だが、今後人間に応用するためには、是非 CAR-T がどのように自己抗体を産生するT細胞に近づいて除去するのかについて、もう少し詳しく調べて欲しいと思う。
いずれにせよ、抗原をT細胞受容体とキメラにする CAR-T が可能であるという事実は、CAR-T の可能性をさらに一段と広げるように思う。
2023年11月10日
基本的に論文ウォッチでは図書を推薦することはしないことにしているが、あまり馴染みのない科学領域をわかりやすく解説している本は例外で、例えば識字障害については「プルーストとイカ」(https://aasj.jp/news/watch/509 )を推薦した。今日紹介するのはフランス・ソルボンヌ大学からの睡眠中の意識状態についての研究だ。睡眠中の意識というと、夢が頭に浮かぶが、実際には単純な話ではない。夢は誰もが経験し、フロイト以前から夢についての研究は行われていた。というのも、人間の意識を考える時、意識と無意識の境に位置する夢は最も重要な研究対象だと古くから考えられてきたからだ。しかし、睡眠研究と比べると夢自体の研究論文は少なく、研究状況となると知らないことが多い。その意味で、今日はモントリオール大学教授アントニオ・ザドラとハーバード大学教授ロバート・スティックゴールドによる「夢を見るとき脳はー睡眠と夢の謎に迫る科学 」はおすすめだ。
さて今日紹介する論文に戻ろう。Nature Neuroscience 11月号に掲載された論文のタイトルは「Behavioral and brain responses to verbal stimuli reveal transient periods of cognitive integration of the external world during sleep(睡眠中の言葉に対する行動及び脳の反応は外部世界を統合的に認知する短い期間が存在することを明らかにした)」で、睡眠中に言葉を聞かせて、意味を理解して寝る前に指示された行動がとれるか調べた、面白い研究だ。
ともかく凝った研究だ。まず夜間の眠りではなく、昼にうとうととする時を狙っている。ただ、覚醒時と区別するため、脳波で睡眠を確認しながら(例えば REM、N1、N2、N3 睡眠)、その時に意味のある単語、あるいは意味のない単語を聞かせて、反応を調べている。そして、昼間に寝込んでしまうナルコレプシーの患者さんを集め、正常人の昼寝と比べている。最後にナルコレプシーの患者さんがREM睡眠に入ったあと、自分が寝ており夢を見ていることも完全に意識している Lucid Sleep 状態だったかについて申告してもらい、それ以外の睡眠自意識状態と比べている。Lucid Sleep は最も覚醒時に近い意識状態として知られているので、これがコントロールになる。
実験で用いた課題は簡単で、覚醒中でも睡眠中でも、耳に入ってきた単語の意味がわかったら表情に表すように前もって指示しておく。すなわち睡眠中に単語を聞いたとき、このインストラクションと結びつけることが出来れば、睡眠中でも表情を変えようとするはずで、筋電図でそれを検出できる。
この実験により、まず睡眠中でも正常人、ナルコレプシーともに単語を聞いて理解し、それに従って顔の表情を変える行動が一定の割合で現れることがわかった。当然1やREM睡眠の様に浅い睡眠時に確率は上がるが、深い睡眠時でも観察できる。なんとナルコレプシーでは、N1 睡眠中で7割の確率で意味があるかどうかを判断し、それを表情に出すことができる。
これだけでも面白いのだが、この時の脳波を詳しく調べ、正解したときの脳波状態と間違ったときの脳波状態を比べると、α、β 波が上昇し、脳波パターンが複雑化し、δ 波が低下するパターンが、正解前に現れる確率が高いことを発見する。
この同じ脳波パターンは Lucid Sleepと呼ばれる完全に意識出来ている夢でも現れる。
以上が結果で、詳細は省いてわかりやすくまとめたことを断っておくが、要するに睡眠中に Lucid Sleep に代表される意識状態が存在し、これに近い状態では外界からの刺激を、それまでの記憶や指示と統合して判断する能力が働いているという結果だ。
これは昼寝だけの現象かどうかを明らかにする必要はあるが、N1 や REM睡眠中だけでなく、低い頻度でも N3 のような深い睡眠中でも外界に反応出来る意識状態が現れることを考えると、おそらく夜でも同じだと思う。このことから、睡眠と意識状態は別の仕組みの脳活動であることがわかる。とすると脳波から意識状態を判断して、寝ている内にしっかり学習することも可能になる、等と考えるのは貧乏暇なしの悪い癖だが。
夢や睡眠の研究はいつも面白い。
2023年11月9日
現役時代は徹夜することもあったが、覚えている限り次の日はあまり調子よくなかった。ましてや、活動的になって仕事がうまくいった覚えは全くない。ところが今日紹介する米国ノースウェスタン大学からの論文は、働くための徹夜は、ドーパミン神経を活性化する結果、活動性が上昇し、ストレスによるうつ症状も改善する、という意外な研究で、11月2日 Neuron にオンライン掲載された。タイトルは「Dopamine pathways mediating affective state transitions after sleep loss(寝られないとドーパミンを介して感情状態の変化が起こる)」だ。
この研究のポイントの一つは、マウスにあまりストレスを与えることなく睡眠を妨げる方法を開発したことだ。通常眠りを妨げるためには、音や光で睡眠を妨げるか、ケージの床が動かせて眠りを妨げる。後の方法は徹夜で働く状況に近いが、しかし動く床で動きながら飲んだり食べたりするため、環境が悪化し感覚的ストレスになる。この研究では動く床とともに、少し高いところに小さなプラットフォームを作成し、ここからしか飲み食いが出来ないようにすることで、環境を清潔に保ったまま、しかし動き続ける状況を作っている。
これにより睡眠を完全に阻害したあと、すぐに様々な行動テストを行うと、まず活動性が高まり、さらに性的活動性も高まる。また、知らないマウスに対する攻撃性はほぼ2倍に上昇する。これだけでなく、電気刺激を続けて誘導したうつ状態も、一回完全に睡眠を妨げることで大きく改善することがわかった。
これらの行動の背景にはドーパミン神経の活動があることがわかっているので、視床腹部のドーパミン神経を阻害できる遺伝子改変マウスを用いて、睡眠を妨げている間中ドーパミン神経が働かないようにすると、睡眠を阻止することで現れる症状のほとんどが消えることがわかった。ただ、性的活動の上昇は変化がなかった。
ドーパミン神経は様々な領域に投射している。そこで、側座核、内側前頭前皮質、視床下部、そして線条体にそれぞれ投射するドーパミン神経を逆行性アデノウイルスベクターを用いて阻害すると、側座核へのドーパミン神経阻害では他動だけが抑制され、視床下部へのドーパミン神経抑制では性的活動性上昇が抑えられ、ストレスによるうつ症状の改善効果は前頭前皮質へのドーパミン神経により調節されていることがわかった。一方、攻撃性などの社会性については、様々な領域が関与していることもわかった。以上の結果は、ドーパミン神経は投射場所に応じて異なる行動を支配しているが、睡眠が妨げられると、ほぼ全ての経路が活性化していることがわかった。
最後に、このドーパミン刺激が、それぞれの領域でのシナプス形態を変化させる可塑性を誘導していることも、スパインの形状変化に必要なシグナルを抑える方法で確認している。
以上が結果で、そのまま徹夜をうつ病の治療に使うわけにはいかないと思うが、一つの可能性として慎重に人間でも効果を確かめるのは重要だと思う。
2023年11月8日
Treg は免疫システムを制御して自己抗原に対する反応を抑える重要な細胞で、現在大阪大学の坂口さんにより発見された。これは抗原特異的細胞を標的にする反応が念頭にあるが、損傷を受けた組織で炎症を抑える保護作用も最近注目されている。
今日紹介する論文は、以前「胸腺びっくり動物園」として紹介し、YouTube 配信も行った胸腺トレランスに関する重要な発見を行った Dian Mathis 研からの論文で、運動による筋肉の炎症を抑え、運動機能を高めるのに抑制性T細胞(Treg)が重要な働きをしていることを示した論文。11月3日 Science Immunology に掲載された。タイトルは「Regulatory T cells shield muscle mitochondria from interferon-γ–mediated damage to promote the beneficial effects of exercise(抑制性T細胞は筋肉のミトコンドリアをインターフェロンγ から守り運動機能向上に寄与する)」だ。
この研究では、マウスに乳酸は高まるがクレアチンキナーゼは高まらない程度の運動を課すと、運動後24時間をピークに筋肉に免疫細胞やマクロファージが集まり、インターフェロンγ が分泌されることで、筋肉疲労が起こることを、組織学的、RNA解析などから確認している。また、運動を自由に続けさせる慢性運動では、2週間目がピークの細胞浸潤、ミトコンドリアの酸化リン酸化の上昇が起こること明らかにする。
この実験系で、Treg だけジフテリアトキシンで除去する実験系を用い、運動による筋肉組織の変化を調べると、リンパ球の浸潤が抑えられず、インターフェロンγがさらに上昇し、炎症反応が高まるとともに、筋肉障害も起こることを発見する。
この結果、Treg 存在化では認められる運動後に見られる筋肉の酸素消費量上昇を介する運動機能の上昇が認められず、 Treg が筋肉負荷後の運動能増強に必須であることを示している。すなわち、運動負荷は筋肉自体に様々な変化を誘導するが、同時に炎症を誘導してしまう。この炎症の効果を Treg が抑えることで、運動負荷による筋肉増強を守っていることがわかる。
実際、Treg が存在しないと、筋肉のミトコンドリアは膨らんでしまい、回復増強過程での酸化的リン酸化が維持できないことがわかる。
最後に、Treg がこのような機能を発揮できる原因を探り、他の組織障害に続く炎症時と同じで、インターフェロンγ の産生を抑制することで、筋肉を炎症から守っていることがわかる。実際、インターフェロンγ に対する抗体を注射すると、Treg が存在しなくても、炎症を抑え筋肉増強が可能になる。また、インターフェロンγ 受容体が筋肉で欠損したマウスでは、運動付加による運動機能の上昇が著しい。
以上が結果で、運動することは身体に良いが、局所の炎症を誘導してしまうので、これに対応できないと、運動の良い効果が発生しない。これを担っているのが Tregで、主にインターフェロンγ 抑制を介して機能を発揮していることになる。
日常の運動は、カロリー制限とともに、長生きの秘訣とされているが、この一端を Treg による炎症抑制が担っているとすると、Treg を高める長寿法も可能かも知れない。
2023年11月7日
今日は膵臓ガン制圧に向けた新しい経路についての研究を2編紹介する。
まず紹介したいのはテキサス大学からの論文で、膵臓ガン細胞特異的にフェロプトーシスを誘導して免疫を高める治療法の開発で、11月1日 Science Translational Medicine に掲載された。タイトルは「Tumor-specific GPX4 degradation enhances ferroptosis initiated antitumor immune response in mouse models of pancreatic cancer(マウス膵臓ガンモデルで、腫瘍特異的に GPX4 を分解することでフェロプトーシスに誘導されるガン免疫を誘導できる)」だ。
細胞死では様々な炎症物質が周りにまき散らされる危険性があるため、アポトーシス過程はできる限り周りを巻き込まないよう細胞死を誘導してこっそり死ぬように出来ている。これはガンに対する免疫を誘導する観点からはマイナスに働く。一方、場合によっては周りを巻き込みながら大騒ぎして起こる細胞死もある。この一つがフェロプトーシスで、ガンの周りに集まってきた白血球もフェロプトーシス型で死ぬことで、さらに白血球を呼び集めることが行われる。このように、ガン免疫という観点ではガン細胞のフェロプトーシスを誘導する治療法は理想的だが、現在得られるフェロプトーシス抑制因子 GPX4 を標的とする化合物は、ガンだけでなく白血球や腎臓など様々な細胞のフェロプトーシスを誘導するため利用が難しい。
この研究では膵臓ガン細胞特異的に GPX4 を抑制しフェロプトーシスを誘導する化合物を探索した。GPX4 が多くの細胞に発現していることを考えると、この不可能に挑戦したこと自体が立派だ。しかもうまい具合に N6F11 と名付けた化合物が見つかった。
この化合物は GPX4 に直接働くのではなく、ユビキチンリガーゼの一つ TRIM25 に働くことで GPX4 のユビキチン化、続く分解が誘導されることでフェロプトーシスが起こることを明らかにした。TRIM25 は低いレベルで多くの細胞に発現しているが、ガンでは発現が高く膵臓ガンでは発現は悪性度と相関している。
実際腫瘍を移植したマウスで投与実験を行うと、ガンの増殖を抑えることが出来、ガンではフェロプトーシスが起こっていることを確認できるが、浸潤している白血球を含め他の細胞ではフェロプトーシスを誘導できない。
重要なのは、ガンの抑制が完全にT細胞と死んだガン細胞から分泌された炎症分子に依存していることで、この治療をガン免疫を誘導するために利用できる可能性を示唆している。
このようにガン細胞特異的なユビキチンリガーゼを利用してGPX4を分解することが可能だとわかると、今後多くの製薬会社でより効率の高いリガンドが開発できる可能性がある。個人的には極めて有望な方法で、これまで免疫治療の対象になりにくかった膵臓ガンも対象に出来る。是非多くの会社で競争して追求して欲しい。
もう一つのイタリア・ミラノ、サンラファエロ研究所からの論文は IL1β とプロスタグランジンE2が膵臓ガンの治療標的になる可能性を示した研究で、11月1日 Nature にオンライン掲載された。タイトルは「IL-1β + macrophages fuel pathogenic inflammation in pancreatic cancer( IL1β陽性マクロファージが膵臓ガンの病的炎症をたきつける)」だ。
元々膵臓ガン周囲には炎症像が見られるので、この論文ではマクロファージに絞って調べ、膵臓ガン周囲のマクロファージが IL1β を発現していることに気づく。IL1β は自然炎症の主役だし、膵臓ガン周囲には炎症が見られるので特に意外性はないが、膵臓ガン周囲マクロファージで IL1β が誘導される仕組みを探った結果、以下のシナリオが明らかになっている。
膵臓ガンとマクロファージは、膵臓ガンが強く発現しているプロスタグランジン E2(PGE2) と TNF により刺激され、IL1β を発現、またこの IL1β は膵臓ガンの周りに炎症を強めるだけでなく、腫瘍にも直接働きかけて炎症細胞のリクルートメントに関わり、このサイクルが回ることで膵臓ガンがより悪性化する。
以上の結果は、PGE2 と IL1β 経路をブロックすることで、膵臓ガンとマクロファージの相互増強回路を止める可能性があることを示しており、実際 COX2 がノックアウトされたガン細胞を移植すると増殖は低下するし、IL1β に対する抗体でガンの増殖が抑えられることも示している。また、Cox2 阻害剤でもある程度腫瘍の増殖が抑えられることも示している。
以上が主な結果で、最初の論文と比べると驚くほどではないが、しかしすぐに治験を行う可能性がある発見なので是非可能性を確かめて欲しいと思う。
2023年11月6日
脳内に電極を留置して深部を刺激する方法がパーキンソン病などいくつかの疾患で広く使われるようになり、一定の周波数で脳を刺激することで、神経の興奮を同調させたり、可塑性を高める機能的な治療が、健常人も含めた広い対象に使える可能性が示されている。しかし、手術して電極を挿入するという方法は、健常人に使うことは、将来は別として、当分は許されない。
このため、特定の領域を頭蓋の外から刺激する方法の開発が続けられており、その一つが TMS と呼ばれる磁場を使う方法だ。ただ、この方法は装置も大がかりで、手軽な治療になるには時間がかかる。
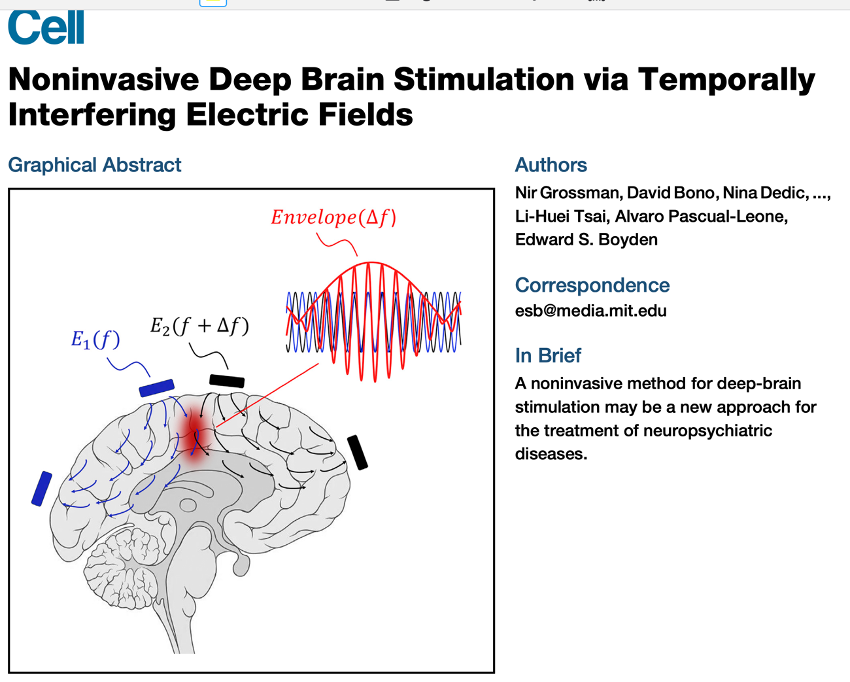
これに対し2017年 MIT のグループは、脳神経に影響のない高い周波数の電場を脳内に形成させる時、少しだけ周波数を変えておくと、両方の電場が重なるところで干渉が起きて、Envelope と呼ぶ低い周波数で大きい振幅(TMSのθバースト刺激に相当する)の刺激を局所的に発生させらることを明らかにした。
それからすでに6年が経過したが、ようやくこの方法を海馬及び線条体に対する深部刺激として使えることを示した論文が11月号の Nature Neuroscience に2報掲載された。
最初の論文は2017年の筆頭著者の研究室、英国サリー大学からで、この方法を海馬刺激に用いると、記憶の呼び起こしの正確度が増すことを示した。タイトルは「Non-invasive temporal interference electrical stimulation of the human hippocampus(非侵襲的時間干渉電気刺激を用いた人海馬の刺激)」だ。
この研究では死体脳を用いて、時間干渉電気刺激(TIS)で海馬だけにθ波を発生させられるか調べている。その上で、電場の量を調整することで、海馬全体、及び主に前方にθ波を局在させられることを確認している。
その上で、覚えた人の顔を思い出す課題を刺激下で行わせ、海馬前方を刺激すると、大きくはないが正確度が高まることが示された。この時、同時に機能的MRI (fMRI) を行うと、意外なことに刺激した方が脳血流が低下することが明らかになった。メカニズムは完全にわかっているわけではないが、θ刺激で同じようの結果が見られるので、おそらく思い出す時の反応が落ち着くことで、記憶の正確度が上がるのだろうと考えている。
もう一つはスイス・ローザンヌ EPFL からの論文で、運動学習の際に線条体を TIS で刺激する効果を調べており、タイトルは「Noninvasive theta-burst stimulation of the human striatum enhances striatal activity and motor skill learning(人間の線条体の非侵襲的θバースト刺激は線条体の活動と運動スキル学習を高める)」だ。
この研究では刺激の効果をまず線条体の脳血流量を fMRI で調べて確かめている。海馬と異なり、刺激により線条体の血流量は高まる。重要なのは、学習に使っている場所だけでこの現象が見られることで、利き手とは逆の指でボタンを押す操作に関わる右の線条体のみ、TIS の効果が現れる。そして、学習によるボタンを押す正確度は改善する。
すなわち、学習に使う領域の同調性を高めることで、シナプスの可塑性が高められていることがわかる。
この研究のハイライトは、同じ実験を高齢者と若者で行って、高齢者ほど TIS の効果が高いことを示している点で、おそらく神経結合性を高める効果が高齢者ではよりはっきり見えるのだろう。
以上、詳細は全て省いているが、簡単な非侵襲的刺激法の開発は、深部刺激研究の裾野を大きく拡げると考えられる。勿論個々の脳の形態から刺激法を計算する安全な方法の開発が必須だが、おそらく規制が必要になるぐらい様々な目的で利用されるようになるのではと思っている。それがいいのか悪いのか、今のところ予想できない。
2023年11月5日
行動時の脳活動を記録するエンコーダーと活動から行動を予測するデコーダーが開発されて、脳科学に回路学とは異なる研究領域が生まれた。その典型がオキーフとモザー夫妻のノーベル賞で、動物が認識している場所に対応する場所細胞や場所の空間的位置に対応する格子細胞の発見で、特に格子細胞は記録した活動をもう一度デコードしたとき脳内に格子が現れることでわかる。
ただこれまでのエンコード/デコード実験は行動と全く切り離した状況、すなわちイマジネーションの世界で行われたわけではない。というのも、実験動物が何をイマジネーションしているか問いただすわけにはいかず、結局行動から判断するしかなかった。一方我々人間は、昨日通った道を頭の中で再現することが出来るのは明らかで、動物でも同じようなイマジネーションの世界があるはずだ。
そんな中で、夢の研究から覚醒中に経験した神経刺激パターンが睡眠中に再現されていることが実験動物でも明らかにされた。これは行動と切り離されているのだが、意志に従って想像しているわけではない。面白いのは、以前紹介したように(https://aasj.jp/news/watch/20414 )、マウスが覚醒時の経験をもう一度夢で再現しているときは、目の動きとして行動にも表れることだ。この行動から、マウスが何を夢見ているのか読み解けることがわかった。
今日紹介するハーバード大学からの論文は、エンコード/デコード実験をさらに進めて、ラットの覚醒時に、イマジネーションの中だけで自分が移動したり、物を目的の場所に移動させたり出来るかを調べた研究で、11月3日 Science に掲載された。タイトルは「Volitional activation of remote place representations with a hippocampal brain–machine interface(離れた場所に対応する神経表象を海馬とコンピュータの間のbrain-machineインターフェースを用いて活性化する)」だ。研究の内容をGPT-4にインプットして出来た漫画も掲載しておくが、残念ながら理解の足しにはならないので文章を読んで欲しい。
研究は海馬を128チャンネルの電極でカバーし、その活動を25ヘルツの頻度で記録し、また刺激できる様にしている。このラットを、ボール型のトレッドミルで走らせ、トレッドミルに連動したプレーグラウンドという外界イメージに基づいて、海馬に場所細胞を形成させる。次に目的を定めて同じ外界を走らせると、海馬の場所細胞が対応する場所に応じて興奮しながらゴールにたどり着くパターンをデコードすることが出来る。
これを確かめた後、今度はプレーグラウンドからの情報が全く入らない、すなわち周囲は白紙のトレッドミルにラットを置いて、これまでのデータからデコーダーが特定した場所情報(ゴール)を海馬に刺激としてラットにインプットしたとき、ラットが頭の中で示されたゴールに到達するかを調べている。勿論イメージの中でのゴールに到達するとご褒美がもらえる。
結果は期待通りで、頭の中で示されたゴールに、そこに至る場所細胞を順番に活動させながら到達する。面白いことに、最初はイメージに合わせて足も動いていたが、慣れてくると全く動かないで頭の中だけでゴールに到達して褒美をもらえるようになる。すなわち楽をして完全にイメージの中だけで遊んでいる。
ラットもイメージの中で行動できることが確認された瞬間だ。さらに実験を進めて、今度はラットの場所を固定して、特定の場所細胞を刺激することで、イメージ上でラットのいる場所から少し離れた場所に対象物、そして他の場所をゴールとして示し、対象をゴールに運ぶ道筋をイメージさせている。自分が動くことをイメージするのと比べると、精度は少し落ちるが、それでも離れた場所から離れた場所への移動をイメージしていることが、順々にゴールに向けて場所細胞が活動することからわかる。言ってみれば、ラットも完全に頭の中だけでゲームで遊ぶことが出来る。
これらの実験は、夢実験と異なり、ご褒美を当てにして、意志を持って脳の活動を自分で調整出来たことを示している。これが、場所細胞を一定のベクトルに従って順々に活動させることで行われることも確認している。
結果は以上で、脳全体の道具化を目指す人工知能研究が、今やbrain-machineインターフェース研究として実際の脳を巻き込んで研究を加速させていることがわかる。恐ろしいと思う人もいるかも知れないが、私のような老人は毎日新しい世界を経験できる今を楽しんでいる。
2023年11月4日
胸腺トレランスは1950年代から、自己と非自己を区別する免疫学の重要なドグマとして多くの研究者を魅了し続けてきたが、昨年6月(https://aasj.jp/news/watch/19920 )及び今年9月(https://aasj.jp/news/watch/22849 )に紹介したように、自己抗原を胸腺内で提示する仕組みについては全く新しい進展を見た。ただ、この新しい進展も自己反応性のT細胞は胸腺内で細胞死が誘導され除去されるというドグマはそのまま継承している。というのもこのドグマについてはトランスジェニックマウスを駆使して行われた von Boehmer 達の見事な論文があるからだ。
ただ、ドグマもよく調べてみると例外が見つかることが多い。今日紹介する米国国立衛生研究所からの論文は、CD8T細胞の少なくとも一部は胸腺内で細胞死せず、未熟な内に末梢へ移行し、そこで一部は疲弊し、一部は抑制性T細胞へと分化することを示した研究で、11月3日号の Science に掲載された。タイトルは「CD8 T cell tolerance results from eviction of immature autoreactive cells from the thymus(CD8T細胞のトレランスは未熟自己反応性T細胞を胸腺から排出することで達成される)」だ。
以前から自己反応性CD4T細胞は胸腺内で完全に除去されることが確認されているが、自己反応性のCD8T細胞は末梢に一部流れているという指摘があった。すなわち、胸腺内での除去が完全でない可能性が高い。そこで、Y染色体上に存在するオスだけで発現する自己抗原に対するT細胞の反応を調べると、胸腺で確かにY抗原に対して反応する細胞は存在するが、PD-1を強く発現して刺激を緩和しており、その結果細胞死に必要なカスパーゼの活性化がほとんど見られないことを発見する。逆にクラスII 抗原に対するT細胞はPD-1をほとんど発現していない。
以上の結果からクラス1+自己抗原に対する細胞のかなりの部分が胸腺内で除去されていないと確信をもち、反応性のT細胞の抗原受容体もY抗原特異的なモデルマウスを駆使し、胸腺内で細胞除去が出来ないとしたら、どのようにトレランスが維持されているのかを調べている。膨大な結果なので、詳細を省いて結論だけを箇条書きにする。
クラス1+Y抗原で刺激された未熟T細胞(CD4/CD8陽性)は胸腺内で自己抗原の刺激を受けるが、除去される前に胸腺外に排出される。
この排出には通常成熟した細胞が胸腺から末梢に移行するときに利用するスフィンゴシン受容体S1P1 が関わっており、T細胞で SIP1 がノックアウトされると、未熟CD4/8T細胞は胸腺にとどまり、そのままCD8細胞へ分化する。残った細胞はしかし完全に除去されることなく、胸腺内でインターフェロンを発現し炎症を起こす。すなわち、CD8T細胞は早く胸腺から排出されるから細胞死へと向かわないのではなく、PD-1の発現などからみてもともと除去されにくいと考えられる。そう考えると、除去ではなく胸腺から排出することが、CD8T細胞トレランスには重要な経路であることがわかる。
さらに、CD4とCD8の胸腺を離れる時期の違いについて、S1P1発現調節に関わる転写因子FOXO1の発現が成熟CD4T細胞では抗原刺激が低下してから誘導されるのに対し、未熟T細胞では強い抗原刺激を受けたときに誘導されると説明している。
では、末梢に排出された自己反応性未熟CD8T細胞の運命はどうなるのか。まず胸腺を離れたばかりのT細胞をラベルし、CD4/CD8陽性細胞はCD8細胞へと分化するが、末梢CD8T細胞ではほとんど自己反応性が認められないことから、トレランスが成立していることを明らかにする。
そして、このトレランスは、末梢で出会った自己抗原により一部は細胞死で除去される可能性は残るが、多くはCD8特異的抑制性T細胞、すなわちCD8Tregへと分化することで、トレランスを維持することを示している。
結果は以上で、CD8T細胞では最初から末梢でのTregを誘導する仕組みが組み込まれたトレランス維持が行われていることが見事に証明された。これは、CD8T細胞によるガン免疫や自己免疫を考える上でも重要な発見だと思う。