2023年5月12日
ガンの末期になると悪液質と呼ばれる状態に陥り、ただ痩せるというだけではなく、特徴的な容貌や外見を示すようになることは一般の人にもよく知られている。中でも筋肉の萎縮は特徴的で、単純に使わないから萎縮する以上のことが起こっている。
この悪液質にはIL1、IL6などのサイトカインが関わることが知られており、悪液質を止めて生活の質を高めるため、これらのサイトカインに対する抗体を用いた治療治験が行われているが、筋肉萎縮についてはそのメカニズムはわかっていない。
今日紹介するトルコKoc大学(トルコからの論文を紹介するのははじめてだ)からの論文は、ガン末期に筋肉萎縮が進行するメカニズムをマウスモデルと培養細胞で明らかにした研究で、5月10日 Nature オンライン版に掲載された。タイトルは「EDA2R–NIK signalling promotes muscle atrophy linked to cancer cachexia(EDA2R-NIKシグナルがガン悪液質による筋肉萎縮を促進する)」だ。
この研究は極めてオーソドックスだ。まず、マウスモデルで悪液質が誘導されると、筋肉にこれまで機能がはっきりしていないTNFファミリー分子のEdaa2とその受容体Eda2rの発現が上昇することを特定する。
そこで、筋肉培養系でEdaa2を添加すると、筋肉内で蛋白分解システムが高まり、ミオシンなどの分子量が低下するとともに、筋管の形成が強く抑えられる。また、Edaa2遺伝子を筋肉で発現するトランスジェニックマウスでは、悪液質がなくても筋肉移植が起こるし、Edaa2に対する受容体Eda2Rを筋肉でノックアウトすると悪液質を誘導しても筋肉移植は起こらない。
このように、予想外のEdaa2/Eda2rシグナルが悪液質の筋肉萎縮特異的に働いていることを発見したのがこの研究のハイライトになる。
後は、悪液質でEdaar2が上昇する上流のシグナルと、Eda2R下流のシグナルについて、ノックアウトマウスや培養細胞について検討し、
IL6ファミリー分子の一つオンコスタチンMがEda2rの発現を上昇させ、筋肉のEdaa2に対する感受性を上げること、またオンコスタチンM受容体を筋肉からノックアウトすると、悪液質による筋肉萎縮を抑えられること、
Eda2rの下流ではNFκシグナル経路の中のNIKリン酸化を介する経路が働いて、筋肉を萎縮させること、またNIKを筋肉でノックアウトすると悪液質による筋萎縮を防げること、
を明らかにしている。
以上の結果から、ガンの悪液質が誘導されると、IL1. IL6などの炎症因子とともに、オンコスタチンMが誘導され、これにより筋肉でのEda2rの発現が上昇し、Edaa2への刺激感受性が上がることで、NFκB経路のうちNIKを介するシグナルが誘導され、これが筋管形成を抑制、また蛋白分解系を活性化させミオシン量を減らすことで筋肉が萎縮するというシナリオが示された。
おそらく、この経路は抑制できるので、悪液質の筋萎縮を抑えて、生活の質を高める可能性はあると思う。
2023年5月11日
今世界中でChat GPTなど、foundation modelと称される大量のラベルなしデータで学習させ、そのデータの相関を拾って、様々なタスクに対応できるようトランスフォームするAI手法が大きな話題になっている。これは、これまで一つ一つのデータに専門的なタグ付けという膨大な作業が必要だったAI概念を一変させた。
医学領域も例外なくfoundation modelによる変革が起こりつつある。例えばこれまで専門家の正確なタグ付け(例:右下葉に限界がはっきりした陰影があり、大葉性肺炎が疑われるなど、)を必要としたレントゲンフィルムの学習を、極端に言えば異常有り無しだけのタグ付けデータがあれば正確な診断が可能になるというスタンフォード大学からの論文が発表され、レントゲン読影をfoundation modelが自然にこなしていけることが示された。すなわち、私たちが医師に成り立ての頃に学習したのと同じように診断能力をつけていく。
専門家ではない私でも、最近の大きなトレンドを感じることが出来る。そこでいくつかの理由から、foundation modelについて自分の理解を一度まとめようと思ってきた。
まず最も大きな理由は、5年前、患者さんの質問にわかりやすく答えてくれるAIが可能か、何人かの若手情報研究者に聞いてまわったことがある。その時、簡単ではないという答えが圧倒的だったが、Chat GPTは今やそれを実現した。
例えば最近JAMA Internal Medicineに掲載された論文では、専門的ではないが一般の人が聞きそうな問題を、医師とChat GPTに投げかけて、患者さんがどちらの答えに好感を持ったか調べた論文が発表された。言うまでもなく、ChatGPTのほうが丁寧で、しかも患者の気持ちに寄り添っているという結果だった。
おそらく難病患者さんについても十分対応できるようになるだろう。この可能性を聞いて回った若手は限られていたが、現状を見るにつけ、5年前この日が来るのを予測できない若手研究者には少し失望した。
もう一つの理由は、現在行われている議論の多くが、GPTには創造性があるか、倫理性があるかなど、哲学的な話にまで発展していることだが、この議論がカントがヒュームに対して行った反論にとても似ていて、人間の理性とは何かという問題に直結しているからだ。これについては、今、「生命科学の目で読む哲学書」としてまとめている。
いずれにせよ、GPT-4などは、task agnosticと呼ばれ、特定の専門領域へと学習を方向付けることは着手されていない。しかし、私が医学に興味を持ち、医学部で学習し、その後も学習を続けて一定の専門家になるように、foundation modelも医学専門家へと育てる試みが行われるのは、医療や健康に関する消費額を考えると当然のことだ。
今日紹介するスタンフォード大学からの総説は、総合的医学AIを育てるfoundation modelの条件や、それが可能にする世界、さらにその問題についてまで論考した優れた総説で、さすがfoundation modelを最初に提案したスタンフォード大学と感心した。
順を追って紹介して行くと、ガチガチにタグ付けられたデータを必要とするこれまでの医学AIとは全く違う、例えば患者さんの経過とともに検査や画像など異なるモダリティーのデータを学習するとともに、医学を基礎づける文献、知識やグラフなどを、それぞれに表象させたトークンとして学習し、それぞれの関係性の確率をベースに、医師の必要に応じたデータをわかりやすく提示するGMAIと呼ばれるプラットフォームで、おそらく現在建設過程にあるのだと思う。先に述べたようにタグ付けが必要のない自己学習なので、極端に言えば患者さんの様々なレコードを学習するだけで、一般的医師のレベルを十分超える、能力を獲得すると考えられる。しかも、ChatGPTに見られるように、わかりやすい文章で提示したり記録したりしてくれる。
ではGAMIを医療でどう使えるのかについていくつかの例を挙げて説明している。
新しい画像について、レポートできる。例えば「この患者さんの経過で新しい病巣が発生しているか」と聞くと、画像上で新しい病巣を指しながらせつめいしてくれる。またこれに関する医療データも同時にレポートできる。
手術時に、経過のビデオをモニターしながら、言葉で手術の問題について指摘してくれる。また手術中に論文から引き出したアプローチについても教えてくれる。
手術場で役に立つと言うことは、ベッドサイドではもっと助かる。急速な悪化をモニターで検出すると、アラームだけでなく、理由も含めて警告を出し、場合によっては治療法を示唆できる。
今病院で働いている医師にとって何よりもうれしいのは、患者さんとの会話、検査データなどから、わかりやすい記録を書いてくれることだ。この結果、外来で医師がコンピュータにインプットする時間は完全削減される。例えば退院レポートなどは、勿論医師が後でチェックすることは重要だが、同じ形式で病院でレコード出来る。
医師だけでなく、患者さんの質問に対してChatGPTよりさらに詳しい、しかしわかりやすい対話が可能だ。特に、難病や希少疾患の場合はわかりやすく説明してもらえるのは重要だ。
勿論様々な文献にアクセスして引き出してくるので、ガンの遺伝子変異がわかると、蛋白構造まで示され、場合によっては新しい薬剤を使える可能性まで指示できる。
などなど、是非医師の方は自分で読んで未来を確認して欲しい。
ただ問題は、AIをビッグブラザーや神にしないためにも、しっかりと医師コミュニティーでバリデーションを行い、決して鵜呑みにしないことだ。
現在GPT-3だけで、300種類のアプリとリンクしている。おそらく、GMAIはそれぞれの医療現場での利用にあった、もっと多くのアプリとつながっていくだろう。勿論、エネルギーなど様々な問題はあるが、私はポジティブな評価をしている。
折しも、ソフトバンクが、勝ち負けではなくfondation model を日本でも始めることが重要だと述べたことが報道されていた。おそらくこの分野で我が国は大きく後れをとったのだと思う。それでも、始めることが大事だと思う。
2023年5月10日
昨年6月、single cellレベルでCRISPRを利用した遺伝子改変を行い、その効果をsingle cell RNA sequencingを用いて調べるPerturb-seqという技術について述べたカリフォルニア大学サンフランシスコ校からの論文を紹介し(https://aasj.jp/news/watch/19994)、またその重要性からYoutubeでの解説も行った(https://www.youtube.com/watch?v=-Yddv5xuPC8 )。
今日紹介するハーバード大学からの論文は、この技術を血液臨床にどう生かすかを様々な例で示した研究で5月2日Cellにオンライン掲載された。タイトルは「Massively parallel base editing to map variant effects in human hematopoiesis(徹底的なベース編集をもちいてヒトの造血をマップする)」だ。
以前紹介したPerturb-seqはCRISPRガイドRNAを用いて遺伝子をノックアウトし、その結果をsingle cell RNA seq(scRNAseq)で測る方法だったが、今日紹介するハーバード大学からの論文はタイトルにあるようにベース編集法を用いている。
ベース編集というのは遺伝子に切れ目を入れるのではなく、特定の核酸をAからTに変える方法で、現在ではCをGに、AをTに変える技術も進んでおり、ほぼ全てのゲノム領域を一塩基単位で変化させることが出来る。これは、血液発生に関わる多くの変異が一塩基置換であることを考えると、血液臨床に必須の技術になる。また血液は様々な系列に分化するので、scRNAseqにより一つの変異の効果を様々な系列で調べることが大事になる。実際には、突然変異の解析等、これまで個別の症例を詳しく解析する以外に方法がなかった課題が、一網打尽に明らかに出来る。
研究では、ベース編集を行う場所を決めるガイドRNAをレンチウイルスベクターでゲノムにインテグレートさせ、転写されたガイドRNAをscRNAseqで検出して、どのベース編集が起こったのかわかるようにしている。
ベース編集蛋白質は、遺伝子導入により行う代わりに、電気的穿孔による蛋白質の導入で行っている。これにより、編集効率は低下するが。一過性で安全な編集が可能になる。また、scRNAseqを用いることで、編集が行われていない血液が混じっていても、正確に効果が判定できる。
以上の技術を最も効果的に生かす課題として、将来の治療も視野にいくつかの課題を検討している。
CD33発現を低下させる編集法の開発:CD33は白血病の標的抗原だが、正常細胞にも発現している。このため、移植骨髄細胞のCD33遺伝子をノックアウトする方法が試みられている。この目的で、スプライシングに関わる塩基を編集して、正常CD33を効率よくノックアウトするためのガイドRNAのスクリーニングを行い、8割以上の編集成功率が達成できる編集箇所を特定している。
遺伝子編集が期待される病気の一つがサラセミアや鎌状赤血球症のようなヘモグロビン合成のアンバランスの病気だが、発現を抑制する分子のプロモーター領域を網羅的に編集して、この発現を低下させ、幼児型ヘモグロビンの発現を低下させるために最も有効な遺伝子編集部位を特定している。
GATA1は赤血球発生のマスター遺伝子で、これまでも様々な変異が知られている。この研究ではGATA1エクソンを網羅的に編集し、赤血球分化のステージごとにGATA1の機能に影響する一塩基変異を特定している。これらは既に人間の変異として知られている者を含むが、様々な形質を誘導する可能性のある遺伝子変異を網羅的にリストできたことは大きい。
強い赤血球性貧血が起こることで知られる変異を再現し、これが赤血球分化のみ影響する変異であることを正常細胞を用いて確認した。
以上は基本的にはCからTエディターを用いているが、他の塩基編集酵素でも同じ実験が可能。
以上、Perturb-seqでこれまで人間ではほとんど不可能で、マウスでようやく時間をかけて行ってきた実験が、やる気になれば一定の期間で行える時代が来たと、年寄りは目を見張るばかりだ。
2023年5月9日
ヒトの組織には当然様々な細菌が存在しており、解析された古代ゲノムの中には細菌叢由来ゲノムも混在している。これを利用して、たとえば5000年前のペスト菌のゲノムを調べ、中世のペスト菌と毒性を比べる研究をこのHPでも紹介した(https://aasj.jp/news/watch/4277 )。面白いところでは、現在のチューインガムのように噛んでいた白樺の皮に付着していた5700年前の口内細菌を特定し、虫歯菌は存在しないが、歯周病菌は現在と同じように存在することを示した研究も紹介した(https://aasj.jp/news/watch/14280 )。虫歯菌がいないことから、甘いものをほとんど食べなかったことは推察できるが、このように細菌叢の再構成は当時の生活状態を知るための欠かせないデータになる。
今日紹介するドイツ・イエナにあるライプニッツ研究所からの論文は、なんとネアンデルタール人の歯石から細菌ゲノムに存在する分子合成経路を再構成し、当時の細菌の合成していた分子を特定しようとしたチャレンジングな研究で、5月4日 Science にオンライン掲載された。タイトルは「Natural products from reconstructed bacterial genomes of the Middle and Upper Paleolithic(旧石器時代から中石器時代のゲノムから再構成したバテリア自然合成分子」 だ。
おそらくこの研究の本当の目的は、旧石器時代や中石器時代といった10万年以上まえの人間や動物と一緒に存在していた細菌ゲノムをどこまで詳しく特定できるかについて明らかにすることだったと思う。おそらく、口内細菌でも、腸内細菌でもどちらでも良かったのだと思うが、確実に古代の人間と存在している事が確実な点から、dental calculus=歯石を選んでいる。
問題は、この歯石から得られるDNAの中から古代人とともに生息していたバクテリアゲノムをどれだけ再構成出来るかだ。実際は、10万年も経っている顎骨から取り出した歯石のDNAは、変性の仕方から人間と同じ時期のゲノムである事が確実なものを選び出すと、30bp程度にズタズタに切断されており、ここから配列の重なりを見つけ出して、コードしている機能的遺伝子を特定するのは、大変な仕事だ。この時、現存細菌のゲノムをレファレンスに使ってしまうと、間違った方に誘導される心配があるので、レファレンスなしで配列を繋いでいく必要がある。私にはその難しさは想像できるが、使われたアプリケーションなど情報処理方法については全くフォローできていないので、本当の苦労はわからない。
いずれにせよ、大変な作業の末に、1kb以上の配列ストレッチを30-50万種類も再構成し、その中で10KBのストレッチが再構成できたのは8千から2万種類にも達している。また、再構成できたゲノムの7割は、現在の口内細菌のものと相同性があることから、歯石細菌は、死後に歯石に付着したのではないことも確認している。とはいえ、細菌叢研究という観点からは、あまりにも読めたゲノムが少ないので、一般的な口内細菌叢の研究を行うところまでには到底いかない。
そこでこの中からかなり完全なゲノム再構成が可能だった緑色硫黄細菌に絞って、得られたゲノムからその物質代謝経路を特定できるかに課題を切り替えて研究を進めている。緑色硫黄細菌は、現在ではまず口内常在菌ではない。したがって、本当にこの菌が10万年前のネアンデルタール人の口内に存在したかどうか難しい問題だが、すでに述べたように、歯石由来の場合口内細菌である確率が高いことから、10万年前のネアンデルタール人では、この細菌が口内に存在していたと考えられる。
次に。古代の緑色硫黄細菌と現在のところ同じ系統最近との比較を行い、決める事ができた配列から10万年前の緑色硫黄菌と、現在の緑色硫黄細菌は同じ系統に属するが、古代菌として多様性の低い、独自のグループを形成しており、当然これまで全く発見されてはいない細菌種であることを確認している。
次に再構成した古代細菌ゲノムの遺伝子の機能を実験的に確かめられるか、ブチルアセトン合成経路について検討し、現存の菌で見られるのと同じ3種類の核となる分子を挟んで全体で7つの遺伝子セットからなる合成経路の存在が古代菌にも存在することを確認している。これらの遺伝子は、地理的にも全く離れた古代人から分離されていても、遺伝子配列はほぼかんぜんに保存されており、機能的重要性を示している。
最後に、この3つの遺伝子を緑膿菌に導入し、これによりブチルアセトン合成が起こる事を確認している。
以上が結果で、現在の口内細菌の中には存在しないとはいえ、一種類の緑色硫黄細菌のゲノムを50%以上再構成し、またその中の一つの分子合成経路を現代細菌の中で再現できた事が素晴らしい。この研究が行われたイエナはライプチヒからも近く、最近はゲノム考古学によく顔を出すようになってきた。このようにライプチヒだけでなく旧東独地区が新しい科学の中心として進展していることは、ドイツに留学し、東西統合という歴史的事業を目にした私には感慨が深い。
2023年5月8日
これまで、脳の活動から、脳に浮かんだ文章を解読するAIの開発については紹介してきた(https://aasj.jp/news/watch/15671 )。私たちが文字や単語を思い浮かべたり、書こうとする時に働く脳領域の活動をできるだけ細かく拾って、あとは機械学習で脳活動と文字や単語を対応させるAI技術が背景にある。しかし、ここれを可能にするためには、これまで手術により脳の皮質に直接クラスター電極を設置する必要があり、また電極自体も長期に設置は難しく、誰もが被験者になれるというものではなかった。
しかし、今日紹介するテキサス大学オースティン校からの論文は、なんと時間解像度から考えてまず文章の再構成には不向きと考えられていた機能的MRI(fMRI)を用いて記録した脳の活動から、脳に浮かんだ文章を再現することに成功し、この分野を大きく進展させるだけでなく、人間の脳の言語処理の理解にも迫る画期的な研究で、5月1日 Nature Neuroscience にオンライン掲載された。タイトルは「Semantic reconstruction of continuous language from non-invasive brain recordings(連続的言語の意味の再構成を非侵襲的脳記録だけで可能にした)」だ。
あらかじめ断っておくが、AIなどの情報処理手法については全く疎いが、それでも何が行われたかは概ね理解できる。従って、この理解の範囲でだが、今日は大変興奮している。最近のFoundation ModelやGenerative pretraining transformer(GPT)などに詳しい人は、ぜひ自分で読んでほしいし、間違いがあれば指摘してほしいと思う。
ご存知のようにfMRIは日本の小川誠二博士によりその原理が明らかにされた脳活動記録法で、活動が始まった脳領域への血流が増加することをMRIで捉えるものだ。従って、刺激に対しリアルタイムに反応することは難しく、どうしても数秒間のラグをおいて反応が起こる。従って、言葉を聞いたり見たりした瞬間に脳記録をすることは不可能になる。
そこで、このグループは一つの文章のまとまりが表象された時の脳の活動を記録し、単語ではなく、単語が集まった意味をとらえて、それを文章に作り直すという戦略をとっている。そのために、今流行りのGPTを用いて、脳の活動でキャッチされる意味をベースに、そのまま文章に再現し、その文章を単語レベルと意味のレベルで評価してトレーニングすることを繰り返し、一人ひとりの脳についての解読モデルを作り上げている。そのために、数分の文章を聞かせるトレーニングを、一人16時間も行っている。
また、解読についても、いくつかの左右言語野を別々に取り上げ、それぞれの解読結果をGPTにより文章にして評価することを行い、最後に全体を統合して最終解読結果が出るようトレーニングしている。
こうしてトレーニングした解読システムの最終テストとして、1分間頭の中でスピーチを考えてもらいながら、その時のfMRIを記録、後でそのスピーチと、fMRI記録から解読したスピーチを比較し、満足いくレベルで意味を解読できていることを示している。また短い音のない動画を見ている間にfMRIを記録すると、脳の反応から解読された動画の内容が実際の動画と完全ではないにせよ、十分なレベルで合致していることも確認している。すなわち、その人が何を見ているかも、脳のfMRIの記録から推察できる事がわかった。
以上、単語と脳活動の対応ではなく、ひとまとまりの意味と脳活動の対応を学習させることで、私たち人間が考えていることを読むことを可能にした画期的な進歩だと思う。また、GPTによる文章生成を、人間の脳の解読のためのフィードバックに利用したアイデアにも驚く。おそらく脳で考えている内容の解読を超えて、なぜホモサピエンスが言語を獲得できたのか、また人間の脳の言語処理を理解する上でも、大きな貢献をしたと思う。
2023年5月7日
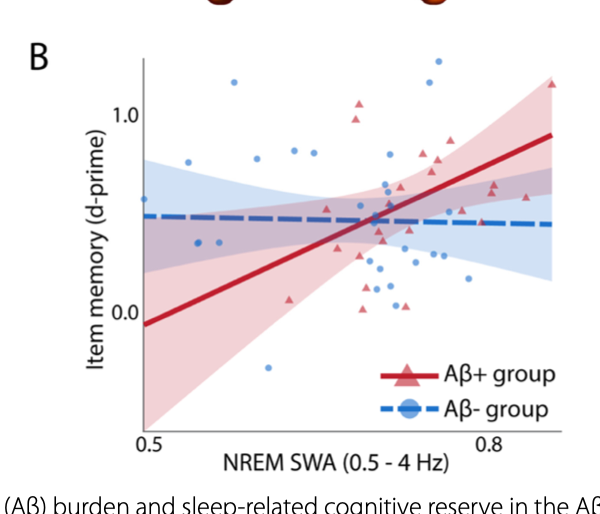
不眠がアルツハイマー病(AD)を悪化させることは現象的によく知られている。逆に5月3日オンライン掲載されたオープンアクセスのBMC Medicineの論文では、アミロイドが溜まり始めた患者さんでは、睡眠時の除波睡眠量が多い人ほど認知機能が高い、すなわちAD進行が遅れることを示している(以下の図B)
ただ、なぜ睡眠不足がAD進行に関係するかのメカニズムについては不明の点が多い。広く認められているメカニズムの一つは、睡眠が髄液の循環を促し、アミロイドが洗い流されるという考えだが、今日紹介するワシントン大学からの論文は、このメカニズムに加えて睡眠障害により脳の炎症がミクログリアの機能を変化させ、アミロイドの処理機能が低下しAD進行を促進することを示した研究で4月26日号 Science Translational Medicine に掲載された。タイトルは「Sleep deprivation exacerbates microglial reactivity and Aβ deposition in a TREM2-dependent manner in mice(睡眠障害によりTREM2依存的にミクログリアのアミロイドβに対する反応性が亢進する)」だ。
この論文では、最初から睡眠障害を炎症とミクログリアに関連させ実験を行っている。ミクログリアの活性化を調節するTREM2の機能を変化させた遺伝子に変えたヒト化マウスを、アミロイドの蓄積が亢進しているトランスジェニックマウスと掛け合わせ、慢性的に睡眠を障害する実験を行い、まずアミロイドプラークの形成度合いを調べている。結果は期待通りで、TREM2の活性が低いと、アミロイド沈着が少ない。もちろん睡眠を妨げないと、6週間程度では沈着は起こらないので、睡眠障害はTREM2シグナルを介してアミロイド沈着を誘導することになる。
また、分子マーカーや機能的検討から、この異常の細胞学的背景に、ミクログリアの機能異常、すなわちアミロイド処理能力低下がある事も明らかにしている。組織学的に調べると、ミクログリアがアミロイドを貪食するのだが、リソゾームでの処理が停滞している像がみられる。また、リソゾー無活性に必要な分子の発現もTREM2の活性が高いと低下している。これらの変化は、TREM2が完全欠損したマウスや、活性の低い遺伝子に置き換えたマウスではみられないことから、TREM2による刺激の結果と結論できる。
もちろんミクログリアはアミロイドでも活性化される可能性があり、リソゾームの異常はアミロイドの蓄積が亢進しているトランスジェニックマウスでミクログリア機能異常はさらに増強されるが、アミロイドなしでも睡眠障害のみでTREM2を介して異常が誘導できることも示している。
以上の結果は、睡眠障害が、髄液の流れに影響するだけでなく、TREM2を介してミクログリアのリソゾーム機能低下を通してADの進行させることを明らかにし、睡眠が様々な経路でわれわれの脳を守っている事がよくわかる。
この論文はTREM2をADという観点から見て悪者にしたが、TREM2は正常ミクログリアで働いている。従って、何らかの生理的機能があるはずで、睡眠とリンクするシグナルとして睡眠不足を脳に教えてくれるのが正常のミクログリアのTREM2機能と言えるかも知れない。
2023年5月6日
古代DNAの解析には人骨の発見がまず必要という時代は終わり、今や土壌に吸着したDNAから洞窟の住人のDNAを抽出して解析する時代が来ていることはすでに紹介した(https://aasj.jp/news/watch/16022 )。これらの技術は、昨年ノーベル賞に輝いたペーボさんが設立したドイツ・ライプチヒにあるマックスプランク進化人類学研究所の業績で、ペーボさんが開いたDNAから歴史を紐解く研究(これについては是非日本構想フォーラムでの講演まとめを読んでください:https://nihonkosoforum.org/report/20221121/ )を着実に発展させている。
今日紹介するのは、マックスプランク進化人類学研究所とオランダライデン大学からの論文で、今度は身につけていた動物の骨で作ったペンダントから、それを身につけていた人のDNAを抽出し解析できることを示した研究で、5月3日 Nature にオンライン掲載された。タイトルは「Ancient human DNA recovered from a Palaeolithic pendant(旧石器時代のペンダントから回収した古代人のDNA)」だ。
博物館に行くと石器時代には多くの骨で作った道具や装飾品が展示されているが、骨や歯の成分になっているハイドロオキシアパタイトはDNAを吸着する性質を持ち、分子生物学でも使われてきた。従って、この骨が由来する動物のDNAだけでなく、これを身につけていた人の汗に浸み出したDNAなどが吸着されている事が期待できる。とはいえ、発掘時から現在まで、実際には様々な人とのコンタクトがあることから、当然本来の持ち主とは全く別のDNAのコンタミも予想される。
この研究では、持ち主のDNAは長く触れていたため、骨の奥まで染み込んでいるため、おそらくコンタミと区別して抽出する方法があるはずだと考え、抽出を骨を壊さず、表面から内部まで段階的に行うことで、持ち主のDNAにたどり着けるとかんがえ、様々な抽出法を試している。
最初、すでに発掘されて長く経過したペンダントについて検討を加え、EDTAなどが加えられていない、ただのリン酸ナトリウム緩衝液を用いて、温度を順番にあげていく方法で、DNAの変性が起こった古代DNAを濃縮できることを見出す。
実際には単純な方法だが、これは遺物を保存して、DNAだけを抽出できるという点では理想的な方法と言える。とはいえ、最終の抽出物の中にも、コンタミが存在していることはいかに古代DNA解析が難しいかがわかる。
そこで、現在出土が進行中の遺物に焦点を当て、土の中から遺物が顔を見せると、フェースガードと手袋でコンタミを極力防ぐ方策をとってブルガリアの発掘現場から発掘されたペンダントからミトコンドリアDNAを抽出している。これほど注意しても、まだ新しいDNAがコンタミしていることは恐ろしい話だが、高い割合で古代人のゲノムを回収することに成功している。
このゲノムを解析すると、シベリアから北米に渡った人類と類似性が高い。また、DNAによる時代測定から1万9千年前(実際には5千年から3万年前のいつか)と計算される。人間のDNAとともに、この骨が由来する大型の鹿ワピチのDNAも回収されこの時代測定で2万5千年前のDNAとわかった。
結果は以上で、骨を用いた遺物、特に装飾品は多いこと、さらに動物と人間のDNAの両方で年代測定が可能な点などから、また新しい手法が考古学にもたらされたのではと期待する。
2023年5月5日
脳に腫瘍ができると、頭痛のような症状に加えてさまざまな脳機能障害が引き起こされる。例えば失語症などはよく知られた例だが、感覚や運動麻痺から生命維持システムの障害など、場所により数限りない症状が発生する。ただ、このような障害が発生する理由は、腫瘍による圧迫、腫瘍周辺の浮腫や炎症による神経障害、そして血管の遮断による細胞障害など、受身的なものと考えてきた。
今日紹介するカリフォルニア大学サンフランシスコ校からの論文は、グリオーマ自体が、神経ネットワークの結合性を変化させて神経異常を誘導するだけでなく、自分自身が神経ネットワークと一体化することで増殖性を高めることを明らかにした研究で、5月3日 Nature にオンライン掲載された。タイトルは「Glioblastoma remodelling of human neural circuits decreases survival(グリオブラストーマによる神経回路のリモデリングにより生存期間が低下する)」だ。
グリオーマは様々な神経を変化させる分子を発現することから、おそらくグリオーマが神経回路に何らかの影響を及ぼすことは多くの人が考えていたと思う。ただ、神経回路が変化して機能が変わることを示すのは簡単ではない。
この研究では、グリオーマの手術中に皮質に設置するクラスター電極を腫瘍を覆うように設置、切除前に様々なテストを行い、その時の神経活動を記録するという離れ技でこの問題を解決している。おそらく、脳外科とガン研究者、神経研究者の連携がないと難しい研究だ。
視覚や聴覚から入ったインプットが何かを言わせる課題を手術中に行い、その時に起こる皮質の興奮から回路の結合性を調べると、腫瘍が存在する領域では高い結合性が確立している事がまず明らかになった。すなわち、ガンが浸入してきた領域ではシナプス結合が高まる。高まったからいいわけではなく、刺激性が高まった結果、腫瘍領域での言語処理力が低下していることを明らかにしている。
記録の後手術に進むが、切除された腫瘍組織で、シナプス結合性が高い領域と低い領域に分けて、遺伝子発現や single cell RNA sequencing を行い、シナプス結合性が高まるメカニズムについて解析している。この結果、通常アストロサイトが分泌してシナプス結合を高めるTSP1分子をグリオーマが強く発現する結果、浸潤領域での神経結合性が高まっていることを発見する。一方、結合性の低い領域では、TSP1分子はホスト側のアストロサイトが発現している。
実際、TSP1による神経ネットワークの再構成は、試験管内でも再現でき、神経細胞によるオルガノイド形成時に、結合性の高い領域のグリオーマを加えると、シナプス結合が高まり、オルガノイドの自然神経興奮が高まる。
最後に、結合性の高い領域のグリオーマと、低い領域のグリオーマを動物に移植する実験を行い、結合性が高い領域のグリオーマ、すなわちTSP1を高発現するグリオーマがホストの神経回路を変化させるだけでなく、再編されたホスト神経回路により自らの増殖を促進させる結果、ホストの生存は短くなる。
同じ事が人間でも起こっているかについて、脳磁図計により腫瘍組織の結合性を調べ、高い結合性を示す領域を持つ患者さんでは予後が悪く、また認知機能の低下が見られることを明らかにしている。すなわち、グリオーマで認知機能の低下がある場合は、予後が悪い可能性が高くなる。
以上が結果で、グリオーマはTSP1発現を通して脳回路に寄生し、脳回路の活性を使って自らの増殖を高めるという恐ろしい話だ。あとは、TSP1を標的にして、この悪循環を止められるか、それが次の問題になる。
2023年5月4日
臨死体験といっても、実際には蘇生できた人が語る体験だが、将来脳科学が進んで、脳活動から意識下の脳活動を解読できるようになれば、実際に人は死ぬ前に何を意識しているのかがわかるようになるかも知れない。おそらく、その前に脳活動から夢の内容がわかるようになる必要があるが、以前紹介したようにdeep learningを使うと、少しづつそんなことが出来るようになってきたと感じる。
臨死体験が語られているということは、脳の活動が完全に停止する脳死になる前に、さまざまな脳活動が起こっていることを意味する。今日紹介するミシガン大学からの論文は、心臓発作などで意識を失い集中治療を行った結果、回復の見込みがないと人工呼吸やエクモ装着を中止した4人の患者さんが、脳活動を完全に失うまで脳波を取り続け、脳波が完全に停止する前に、一時的に意が識が回復したような脳波が現れることを明らかにした論文で、5月1日米国アカデミー紀要にオンライン掲載された。タイトルは「Surge of neurophysiological coupling and connectivity of gamma oscillations in the dying human brain(死につつある人間の脳ではγ波の神経生理学的カプリングと結合性がが一時的に急上昇する)」だ。
紹介する前に、少し用語を解説する必要がある。まず脳波検査でわかるγ波のカプリング及び結合性だが、γ波というのは脳波の成分で、30Hz以上の早い周期を持つ成分で、注意や感覚の認知などに関わることが知られており、言ってみれば意識の必須要素になる。また、カプリングというのは、ゆっくりした周期の波、たとえばθ波の振幅にγ波の振幅が完全に重なることで、誤解を恐れずザクっと言ってしまうと、複雑な認知機能が働いていることを示している。結合性とは、同じ脳波成分が異なる領域で同期して検出されることで、脳の異なる領域が動員されていることを示している。
このように脳波の解析は、コンピュータの助けなしには行えないほど複雑なので、この研究からわかったことを、ざっとまとめると次のようになる。
人工呼吸器を外して低酸素状態に陥ると、副交感神経刺激が起こり、この自律反応が次に体性感覚を刺激し、その後脳のγ波活動が一時的に上昇する。
このγ波上昇には、波長の低い要素とのカプリングが起こっている。
意識の中枢と考えられている、皮質ホットゾーン(TPO)のγ波活動が上昇し、脳のさまざまな領域と同期的に活動する。
このような意識活動を示唆するような変化は、てんかん発作の既往がある人で選択的に認められ、決して誰でもに起こるわけではない。すなわち刺激閾値が下がっている人で、このような反応が起こりやすい。
もちろん今回の被験者からの自己申告を得るのは不可能なので、いくら視覚野とホットゾーンの同期した活動があるからといって、これまで臨死体験として語られてきた例えば強い光をこの患者さんたちが見ていたかどうかはわからない。おそらく、夢と同じで、ここで幸運にも覚醒して自ら語ってもらうしか、現在可能な方法は無い。しかし、将来意識や、脳活動の解読などが可能になると、さらに正確な推察が可能になるかも知れない。
研究としては一見ゲテモノに見えるが、感覚と認知を理解するためには面白い方向だと思う。
2023年5月3日
島田雅彦さんのファンなら、優しいサヨクというタイトルを見て、彼が学生時代に発表した「優しいサヨクのための嬉遊曲」を思い出すだろう。島田さんとはひとまわりも年が違うし、私たちの学生時代はもっと政治的な運動が活発だったが、それでも島田さんのノンポリサヨクの複雑な心境の表現は私も共感できた。
今日紹介するイタリアのベニス大学と、ルッカIMT高等研究大学からの論文は、69カ国、46000人の調査で、チャリティーへの積極参加という点ではサヨクがウヨクより優しい事を示した研究で、4月5日 米国アカデミー紀要 にオンライン掲載された。タイトルは「Political ideology and generosity around the globe(政治的イデオロギーと寛大さの世界的傾向)」だ。
このグループは、世界中の研究施設を組織化して、Covid-19パンデミックが社会や政治に及ぼしたさまざまなインパクトについて調べており、その時に世界中から集めたデータの中から今回利用したデータを抽出している。
さて今回利用したデータだが、政治的にleft-leaning=サヨク傾向がある、あるいはウヨク傾向があると思うかを自己申告させ(実際には10段階に分けて自分を位置付けてもらっている)、また寄付をしたかどうかについて、母国のチャリティーを対象とした寄付と、国際的チャリティー活動に対する寄付に分けて、寄付回数や額を調べている。研究はCovid-19の社会的インパクト研究の一環として行われているので、パンデミックによる困窮者に対する寄付についても詳しく聞いている。
もちろん個人的チャリティーが必要かどうかは、国の福祉レベルを抜きにしては評価できないので、各国の福祉状態を数値化して、個人寄付行動との関係をプロットしている。
さて結果だが、調べたほとんどの国でサヨク傾向があると感じている人の方が、ウヨク傾向があると感じている人より全般的に寛大であることが示された。すなわちサヨクは優しい。
もちろんウヨクだから寄付をしないというわけではない。ただ、寄付行動の傾向を調べると、ウヨクは母国の活動に対して寄付を行い、インターナショナル(例えばユネスコなど)なチャリティーに対しての寄付は少ない。逆に、サヨクの方は、インターナショナルな寄付を重視する傾向がある。
面白いのは、各国の福祉行政状況を数値化してプロットした時、サヨクもウヨクも、各国の福祉状況が上昇するのとともに、母国のチャリテーへの寄付行動の割合が低下している点だ。すなわち、国の福祉が行き届くと、母国への寄付活動は全般的に低下する。
一方、国際的チャリティーに対する寄付を見ると、サヨクは福祉状況が高まるのと比例して、寄付を増やす。すなわち自分の国に回さない代わりに、国際的なチャリティーを支援する。一方、ウヨクは福祉状況が良くなる程、その国のチャリティーへの寄付が減るだけでなく、国際的チャリティーへの貢献も低下し続けている。
以上が結果で、自己申告されたウヨク度とサヨク度をどこまで信頼するのかは問題だが、島田さんの表現した「サヨクは優しい」という感覚と合致するような結果だ。個人的にはこの結論に異論はないが、私の感覚としては、現代のウヨクは一種の新自由主義の支持者で、サヨクはより福祉国家論の支持者のように感じた。