2022年8月11日
現在のネオアジュバント治療と手術療法を組み合わせた徹底的な治療法により、乳ガン治療の成績は格段に上昇しているが、それでも、ネオアジュバント治療以前の治療法を受けた患者さんを中心に、脳転移を含む再発例は多い。中でも脳転移では、HER2を発現しているケースでも、抗体薬のような大きな分子の透過性は悪いと考えられることから、従来のシステミックな治療は難しいと考えられていた。
最近乳ガンに関しては新しい薬剤の開発が続き、患者さんの励ましになっているが、その中でも第一三共が開発した、HER2に対する抗体にトポイソメラーゼ阻害剤(deruxtecan)を結合させ、乳ガン細胞に抗体が結合して取り込まれると、細胞内でリンカーが外れてトポイソメラーゼが細胞の増殖を阻害する抗体―薬剤結合薬(ADC)は、転移性の乳ガンに対する強い効果を示すとして世界中で利用が始まっている。ただ、効果を高めるため1分子の抗体に8分子の deruxtecan が結合している大きな構造を持つため、脳転移には効果がないのではと言われていた。
今日紹介するウィーン医科大学からの論文は、それまで HER2 抗体を含む様々な治療の効果が見られ亡くなった15人の脳転移の患者さんに、DS8201 を3週間に1回、通常治療に使われるのと同じ量(5.4mg/Kg)の治療が脳転移にも高い効果を示すことを示した第二相治験で8月8日 Nature Medicine に掲載された。タイトルは「Trastuzumab deruxtecan in HER2-positive breast cancer with brain metastases: a single-arm, phase 2 trial(Trastuzumab deruxtecanの脳転移を起こした HER2 陽性乳ガンへの効果:単一群第二相治験)」だ。
基本的には、このような大きな分子が脳血管関門を超えて脳組織に移行するとは考えにくいのだが、結果はこの予想を覆し、DS8201 が病気の進行を止める高い効果を示すという結果だ。
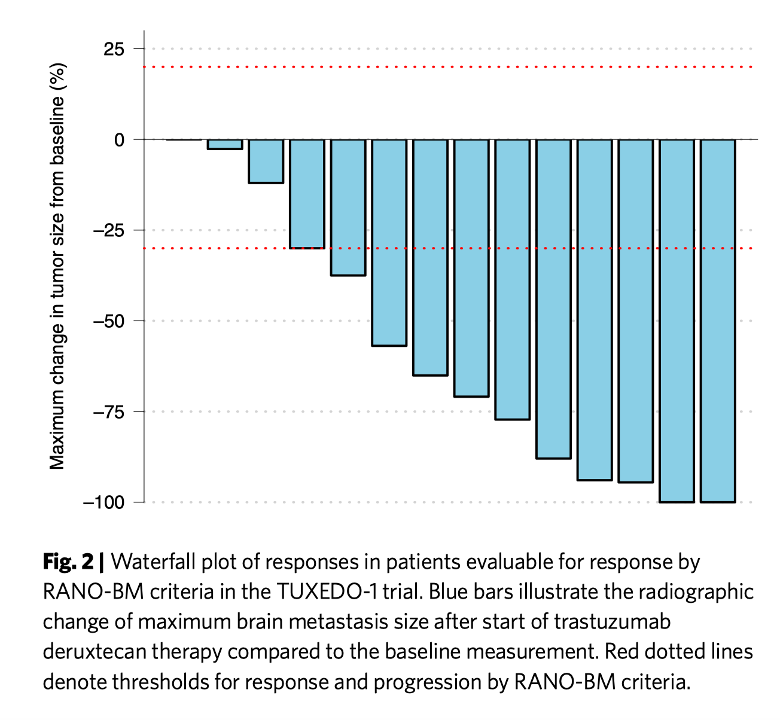
評価基準はシンプルで、ガンが進行したかどうかだけを評価している。従って、脳転移巣が大きくならなければ、progression free であると判断される。論文がオープンアクセスなので許されると思うので、結果をカットアンドペーストしておく。
この図は、治療によりガンがどの程度縮小したかをしらべた図で、右端の2例は完全に縮小したことを示す。また、左端の患者さんでも縮小はしていないが、ガンは大きくなっていないことを示している。
結果から予想できる、病気の進行を抑える期間は14ヶ月と計算されている。もちろん副作用も100%の患者さんで見られるが、これまでの DS8201 治療と大体同じと考えてよい。
以上が結果で、15例程度の少数例の、非無作為化試験という問題を踏まえた上でも、これまで脳血管関門を通るとして使われてきた薬剤より効果が高いのではと結論している。
おそらく乳ガン転移領域の脳血管関門が高分子を通過しやすくなっていると想像されるが、我が国で開発された薬でもあり、早期に治験を終えて、脳転移の患者さんにも利用できることを期待している。あるいは、すでに転移性乳ガンに対して認可されているので、そのまま適用を増やせばいいだけかもしれない。
2022年8月10日
ネアンデルタール人と現生人類がきびすを接して生活していた頃、他種間ではあるが交雑が行われ、その痕跡が私たちのゲノムの中にレガシーとして残っていることは今世紀最大の発見の一つだ。流入したネアンデルタール人の遺伝子は、通常なら組み換えを通して、一人一人のゲノムの中では薄まるが、集団としては広く分布していく。実際には様々な選択圧に加えて、組み換え時のホモロジーが低いことから、現生人類ゲノムから除去されやすい。これらを勘案して、我々の先祖の歴史をゲノムから想像するのだが、実際にグループ間の交雑がどのように行われるのかなど、短い期間の交雑データーがほしいところだが、全く不可能だ。
今日紹介するデューク大学からの論文は、ケニア・アンボセリ国立公園に生息する黄色ヒヒの群れを9世代50年にわたって記録し続け、そこで行われたアヌビスヒヒとの交雑で流入したゲノムの動態を調べた本当に頭が下がる研究で、8月5日号の Science に掲載された。タイトルは「Selection against admixture and gene regulatory divergence in a long-term primate field study(長期にわたる霊長類の野外研究により、他種間交雑と遺伝子発現の多様性が選択圧にさらされていることがわかった)」だ。
この研究の素晴らしいのは、50年前に将来の科学解析の可能性をよく考え、黄色ヒヒとアヌビスヒヒの生息域の境界に住むグループを選び、黄色ヒヒの集団の家族歴を全て記録するとともに、血液サンプルからゲノムを調べ、流入したアヌビスヒヒのゲノムが選択される動態を調べたことだ。観察当初は、黄色ヒヒだけのグループに、1980年ぐらいから後で、ゲノムからアヌビスヒヒと交雑したことがわかったはぐれザルが合流する歴史などが記録され、そこからアヌビスヒヒのゲノムを持つ現集団が出来ていく過程が追えている。我が国でも長期的視野に立つ研究の重要性が強調されるが、私が務めた京大で霊長類研究所のリストラを平気で行う様子を見ると、我が国の長期的視野などお題目に過ぎないこともよくわかる。
データを見ると、さらにこのグループの長期的計画のすごさを実感する。元々アンボセリの西と東に完全に分離されているアヌビスヒヒと黄色ヒヒのゲノムは、期待通り古代の交雑の痕跡はあるが、近年の交雑の痕跡は全くなく、いわば5万年前のネアンデルタール人と現生人類のような関係にある。ところが元々黄色ヒヒのアンボセリのグループには多量のアヌビスヒヒのゲノム流入を観察できる。即ち、他種間の交雑が境界では頻繁に行われていることを示している。
重要なのは、この研究では野外観察により詳細な家族歴が記録されており、ケースによっては他種間交雑による子供のゲノムも完全に把握できている。この結果、流入したアヌビスヒヒのゲノムを追うことで、相同性が低下することで、外来ゲノムが組み換え過程で自然選択される部位やレートが正確に計算でき、黄色ヒヒでは、アヌビスヒヒのゲノムは6%ほど相同性が低下しており、これがゲノムを排除する自然選択圧として働いている。まさに、ネアンデルタール人ゲノムについて想像されていることに一致する。
また、コーディング領域や、プロモーター領域は、種としての同一性を守る方向で選択されている。これを確かめるため、血液で発現している MRPL2 遺伝子の発現レベルを調べ、この領域にアヌビスヒヒのゲノムが入ると遺伝子発現が低下することまで確定している。即ち、両者が分離した後、それぞれが生息域に適応して獲得してきた形質を維持する方向に選択圧が働き、アヌビスヒヒのゲノムが排除されていることが、はっきりわかる。
以上、これまで我々の中にあるネアンデルタール人やデニソーワ人ゲノムについて想定されていたことと同じだが、家族歴が加わることで、想定が証明レベルに高まっている。しかし、このような研究を支える大学や国が存在することが、科学力だと思う。
2022年8月9日
以前、顧問先の企業の研究員に、バクテリオファージで細菌叢を操作することは可能か聞かれたことがある。細菌叢は複雑で一つの属でも複雑な構成をしているため、例えば大腸菌だけを相手にする実験的なファージ研究とは全く異なる難しさがあること、さらに運良く細菌を特異的に溶菌させても、耐性がすぐに現れるのではと答えたことがある。
しかし、こんな常識を全く気にせず、炎症性腸炎をプロモートする細菌をバクテリオファージで除去する課題にチャレンジしたのが、今日紹介するイスラエル・ワイズマン研究所からの論文で、8月4日号 Cell に掲載された。タイトルは「Targeted suppression of human IBD-associated gut microbiota commensals by phage consortia for treatment of intestinal inflammation(ヒト炎症性腸炎と連関する腸内細菌叢をファージを組み合わせて標的にすることで腸炎の治療が可能)」だ。
これまで、多くの研究により、クローン病や潰瘍性大腸炎などの炎症性腸炎(IBD)に、腸内細菌叢が関わっていることが明らかになっている。即ち、細菌感染症ではないが、細菌により免疫系が炎症型へと傾くと考えられ、実際正常人の便を移植することで、症状が軽快する例が示されてきた。とすると、IBD で腸の炎症を後押しする特定のバクテリアがいるかもしれないと、これまで探索されている。
この研究の前半は、IBD で特に増加しており、無菌マウスに移植したとき、腸内免疫システムを炎症型へと変化させている細菌の探索を行い、最終的に腸内常在菌の Klebsiela pneumonie(Kp)を特定する。事実、Kp はこれまで公開されている IBDコホートの腸内細菌叢で増加しており、マウスに移植するとインターフェロンγ を分泌する炎症型CD4T細胞が増加、炎症を抑える IL10 をノックアウトしたマウスに Kp を移植すると、大腸に強い炎症が起こることを確認している。
標的細菌が見つかると、細菌を溶菌するファージの特定に移る。基本的には、他のバクテリアに対する作用は全て気にせず、Kpの分岐群を溶菌させられるかどうかに絞り、ファージを探している。ファージの標的になったバクテリアの方も当然耐性を獲得してくるが、この変異体にも作用のあるファージをさらに探して、最終的に試験管内だけでなく、マウスに経口投与してKpを減少させ、しかも腸管内で一定期間維持されるファージの組み合わせを突き止める。
あとは、マウスに抗生物質を投与した後、Kpを移植して IBD を起こす実験系で治療効果を確かめている。結果はドラマチックなものではなく、治療群で一定の効果が見られている。
最後に、人間への応用を考え、消化管での環境に耐えられることを確認した後、胃酸分泌を抑える条件で人間に投与し、腸管内でファージが10日以上維持されることを確認している。
結果は以上で、あとは SPFマウスに Kp を投与するというマウスのモデル実験ではなく、実際 Kp が増えて、かつ IBD が発生している患者さんを選んで治療できるか、臨床研究が出来るだけとなった。個人的には、そう簡単ではないと思うが、結果をまとう。
2022年8月8日
腫瘍組織に浸潤する白血球は、同じ場所へのリンパ球の浸潤を阻害するため、ガン免疫を抑えるため、チェックポイント治療をはじめとするガンの免疫療法の最大の問題と考えられている。このブログでも何回か紹介したが、白血球の浸潤を防ぐ様々な方法がこれまで開発されているが、ガン周囲組織のサイトカインや、ケモカインを標的にした治療が中心となっている。私がこれまで読んだ中では、骨髄造血レベルで白血球の浸潤を抑える方法は、c-Kitに対する抗体を用いて造血全体を抑える方法で、1-2相の臨床研究としてテキサス大学から発表されていた(Science Translational Medicine 14, eabm6420, 2022)。
今日紹介する中国科学技術大学からの論文は、ガン細胞は視床下部から松果体のホルモンシステムに働いて、そこから分泌されるメラノサイト刺激ホルモン(MSH)が、白血球の前駆細胞に直接働き、白血球を増加させて免疫を抑えるという、意表を突く研究で、この意外さがなければ到底 Science には掲載されないのではと思うが、臨床応用が可能なら重要な論文だと思う。タイトルは「Pituitary hormone α-MSH promotes tumor-induced myelopoiesis and immunosuppression(松果体ホルモン α-MSH は腫瘍による白血球増多を促進し免疫を抑える)」だ。
実に古典的かつ、シンプルな研究だ。まず腫瘍を移植したマウスでは MSH のレベルが上昇していることを発見する。次に、MSH の松果体での発現を shRNA を用いてノックダウンすると、腫瘍組織の白血球が減少し、代わりにリンパ球が増えて、PD1抗体によるチェックポイント治療の効果が高まる。すなわち、ガン組織の白血球浸潤の重要な原因は松果体の刺激による MSH であることを明らかにしている。
では、MSH は白血球浸潤をどのように誘導するのか。MSH受容体の発現を調べ、驚くことに造血幹細胞だけで MSH受容体の一つ Mc5r が強く発現し、Mc5r をノックアウトされたマウスでは、ガン組織への白血球浸潤が低下し、リンパ球の数が上昇し、結果ガンの増殖が抑えられることを明らかにする。
そして、Mc5r阻害剤が腫瘍の増殖を抑制し、さらにPD1抗体によるチェックポイント治療と組み合わせると、ガンの強い抑制効果があることを示している。
最後に、人間のガンでも同じことが言えることを示す目的で、非小細胞性肺ガンの患者さんを調べ、MSH の血中濃度が高いこと、血液幹細胞で Mc5r の発現レベルが高いこと、そして MSH濃度に比例して白血球数が上昇していることを示している。
結果は以上で、極めた単純な実験だが、もし本当なら、ガン患者さんで白血球数の高い人を選び、その中から MSH も上昇している人について、Mc5r阻害剤をチェックポイント治療と組み合わせる治験をやってみることは重要だ。意外な結果だが、臨床まで持ってきてほしいと思う。
2022年8月7日
心室細動がきて循環が止まると、10分以内にAEDで心臓の動きを回復させないと、細胞や臓器では虚血で不可逆的死のプロセスが始まるとされている。しかし、私たちの身体は心臓が止まった後、何時間は蘇生可能なのかの限界については、心臓が停止してしまった個体で調べることは出来ない。
この問題に、イェール大学のグループはチャレンジを続け、2019年 Nature に、脳であれば虚血後4時間までなら、細胞保存液の人工循環によって、回復させられることを明らかにした。今日紹介する同じグループからの論文は、2019年に脳回復のために開発したシステムを改良して、今度は循環完全停止1時間後に、大動脈、大静脈に全身の人工循環器を装着することで、細胞死のプロセスが始まった細胞や臓器の活性を回復させられるか調べた研究で、8月3日 Nature にオンライン掲載された。タイトルは「Cellular recovery after prolonged warm ischaemia of the whole body(全身の温虚血の後の細胞の回復)」だ。
研究では、ブタで人為的に心室細動を誘導して、1時間放置する。当然これまでの常識では、回復は不可能だが、実験では1時間後に通常のエクモ、あるいはこのグループが開発している対岸循環装置OrganEXを装着、その後7時間までの臓器や細胞の機能を、様々な方法を動員して評価している。
重要なポイントは、末梢の血管から循環を維持するエクモと違い、開腹して大同静脈から体外循環へと誘導し、全身の循環量が維持できるようにしている点と、透析液をベースに、抗凝固剤だけでなく、様々な細胞保護剤を加えた対外循環液を開発した点で、これがこの研究のハイライトになる。最終的には、酸化された対外循環液で置き換わり、7時間循環が維持される。
さて結果だが、まず末梢までの循環の維持という面では、ほぼ完全に維持が出来ている。すなわち、循環停止後1時間であれば、血管系はほぼ完全に機能を回復する。
後は、組織学的、代謝学的、神経科学的、細胞学的に徹底的に変化を検索している。結論的には、細胞レベルでは、虚血がなかったレベルまでほぼ回復が可能になっている。一方、エクモは全く役に立たない。ただ機能で見ると、7時間では様々な異常が残っている。例えば心筋の収縮力で言うと、全体の拍動は回復し、代謝も正常化するが、細胞レベルの収縮は浅い。また、組織的には完全に戻っていても、尿は7時間では生成されていない。
Single cell RNA解析でみると、虚血がなかった場合と比べると、様々な細胞死プログラムが7時間たっても発現している。細胞死の進行で見ると、アポトーシス、ピロトーシス、ネクローシスなどを阻害できているが、スイッチはオンのままなのかもしれない。
以上が結果で、まとめると細胞レベルではほとんどの細胞で、いったん入りかけた細胞死を止めることに成功している。すなわち、虚血1時間では確実に細胞死のスイッチは入るのだが、幸いそれ以上の進行を止められる可能性があると言うことだ。
ただ、体外循環液を正常の血液に置き換え、最終的に個体として蘇生できるかは全く別の話だ。もちろんこの研究は臨床的様々な問題を解決するために行われているのだが、個体というシステムを全く違った側面から研究するのにも面白い方法かもしれない。
2022年8月6日
昨日に続いて、染色体を引っ張ったり押したりする力についての研究を紹介する。と言っても、昨日のように人為的に染色体を引っ張るのではなく、この引っ張られる過程が自然に起こっている過程、即ち細胞分裂過程で、引っ張ったり押したりする力にどのように染色体が自己の構造を守るのかについて調べた研究だ。しかし、昨日の論文と同じで、一個一個の細胞についてここまでいろんな操作ができるのかと、細胞生物学のプロの世界に感心してしまった。
オーストリア分子細胞テクノロジー研究所からの論文で、8月3日 Nature にオンライン掲載された。タイトルは「A mitotic chromatin phase transition prevents perforation by microtubules(分裂時の染色体の相転換により微小管が染色体に侵入するのが防がれる)」だ。
繰り返すが細胞生物学のプロの世界だ。細胞生物学を習った人は知っているはずだが、分裂時、染色体は凝縮し、セントロメアにあるキネトコアと結合した微小管に引っ張られることで、両方の細胞に平等に染色体が分配される。とはいっても、この引張り力にDNAが耐えるためには、染色体は凝縮した構造をとる必要がある。このために、DNAをループ状にまとめて凝縮させるコンデンシンという分子と、ヒストンの脱アセチル化によるクロマチンの凝縮が重要であることがわかっている。
この研究では、まずコンデンシンを分裂時に除去する実験系で、コンデンシンがないと染色体全体が分裂糸の形成されている領域から完全に排除されてしまうことを示している。実際、分裂糸は見事に形成されているにもかかわらず、染色体がその外側にかたまっているのがわかる。しかし、クロマチンの凝縮は維持されている。
一方、ヒストン脱アセチル化を抑制すると、やはり染色体は分裂糸からはじかれるが、この場合染色体の凝縮は完全に崩壊してしまって、染色体が細胞全体に広がっている。実際の細胞の写真を見せられると、素人の私も、この2つのメカニズムが異なる役割を演じることで、染色体が壊れることなく、分裂糸により分配されるのだとよくわかる。
以上を確認した後、この研究では、コンデンシンが除去されたとき、クロマチンの凝縮は維持されたまま、微小管を避けるかのように、分裂糸の形成面から染色体が排除されていること、そしてこの凝縮をヒストンの脱アセチル化が調節していることに注目し、凝集したクロマチンが微小管を受け付けないメカニズムをさらに探っている。
繰り返すがプロの仕事で、クロマチンの凝集維持にDNAの連続性が必要ないことを証明するため、なんと細胞内にDNAを切る制限酵素を注入し、細胞が死ぬ前に細胞の様子を観察するといった離れ業を行って、DNAが断片化しても、染色体凝縮は維持されることを示している。
後は、特に微小管と凝集した染色体の関係を調べ、ヒストン脱アセチル化により凝集した染色体が微小管を排除するのは、脱アセチル化したヒストンにより染色体全体が大きな相分離体へと転換し、可溶性のチュブリンだけでなく、重合した微小管の侵入を拒絶する構造へと変化することを突き止めている。
圧巻の実験は、ノコダゾールで分裂糸の形成を抑え、さらに染色体凝集を維持したままDNAを断片化した分裂期の細胞を作成し、急にノコダゾールを洗い流して分裂糸のを誘導すると、見事に凝集した染色体がセントロメアから伸びる微小管によってはじかれる像を示し、相分離により凝集した染色体こそが、チュブリンによる排除の原因であることを示している。
私の文章力では、到底伝えることが出来ない驚くべき細胞の像が次から次に示されている論文で、自由自在に細胞操作を行い、計画通りの結果を画像とし示す美しい研究だ。
2日間、細胞生物学の真髄とも言える仕事を紹介したが、おそらく一般の人には超難しいと思う。自分だけ興奮して、結局うまく伝えられずにごめんなさい。
2022年8月5日
昨日紹介したJacob Hannaの研究もそうだが、普通考えない目標を設定してマニアックなチャレンジを繰り返す人たちがいる。現役の頃、いわゆる1分子の挙動を追いかけていた研究者の話を聞いたときも同じような印象を持った。
今日紹介するフランス・キュリー研究所からの論文を読んで、1分子の研究もこんなところまで来ているのかと驚いた。タイトルは「Live-cell micromanipulation of a genomic locus reveals interphase chromatin mechanics(生きた細胞のゲノム上の一つの場所を操作することで間期の染色体の力学がわかる)」で、7月29日号 Science に掲載された。
テトラサイクリン(tet)により遺伝子発現をon/offする仕組みがあるが、この研究では細胞のゲノムに、tetによる調節遺伝子配列が約2万個並んだトランスジーンを導入し(従って決して1分子の研究ではない)、この領域に結合するTetR分子とGFPに対するナノボディー(ラクダなどのH鎖抗体で、細胞内で働く)を結合させた分子を、やはりトランスジーンとして発現させる。この結果、tetO領域にaGFPナノボディーが結合した細胞が出来るが、この細胞に鉄を結合するフェリチンにGFPを結合させた分子をマイクロインジェクションすると、tetOの並んだ領域がGFPで可視化されるとともに、鉄が結合した状態が出来る。
ここに磁場をかけて鉄を引っ張ると、核内でこの領域が一方向に引っ張られる。その後で、磁場を止めると、今度はストレスにより核内に生じた力で、この領域が動くと予想される。
はっきり言って、研究は引っ張ったら何が起こるかということだけに集中しており、DNAが切れるか?とか、転写が変わるか?などは全く気にしていない。しかし、核内の中央部にある領域が、核膜直下まで引っ張り上げられ、その後少し戻るのだが、完全には戻らないことを写真で見せられると、今後様々な実験に使えるなという実感を持つ。
研究では、引っ張った後磁場を止めて自由に運動させるときの動きから、核内の染色体はポリマーが液体の中を動くのと同じような法則(Rouse法則と言うらしい)に従い、これまで予想された居たようなガチガチのポリマーゲルの中にいるわけではないことを示している。すなわち、クロマチン全体は弱いゲル状構造を持っており、それ自体が一つの領域の移動を弱く制限しているが、この構造のおかげで染色体の離れた領域が会合し、そこで比較的安定な構造を維持することが出来る基盤があることがわかる。
結果は以上だが、今後遺伝子発現との関係や、染色体上での相分離などとの関わりを考えていくためには、面白いテクノロジーになるような気がする。直接の関係があるわけではないが、明日はクロマチンの相転換の研究を紹介することにする。
2022年8月4日
動物の個体発生で、原腸形成期は細胞の塊が個体へを変化する重要な段階で、高等動物の細胞がオーガナイズされ、Organism へと発生する過程と考えられている。従って、この段階を超える前後で個体性が発生したかどうかの境にしようとする宗教倫理もあるぐらいだ。科学的にもこの境は明瞭で、ウニですらこのステージを超えると、個体をバラバラにして細胞塊にしてしまうと、そこから個体を再構成することは難しい。
実際マウスES細胞を培養して、embryoid body を形成させて、その中で様々な細胞を分化させることは出来るが、現在行われている培養では、無秩序な細胞の塊という段階を超えることはない。これに対し、今日紹介するイスラエル・ワイズマン研究所、Jacob Hanna 研究室からの論文は、ES 細胞からほぼ完全な8.5日胚ができたという実感を持つ研究ではないだろうか。タイトルは「Post-Gastrulation Synthetic Embryos Generated Ex Utero from Mouse Naïve ESCs(マウスナイーブ ES 細胞から誘導した原腸形成期を超えた合成胚)」で、7月28日 Cell にオンライン掲載された。
Hanna は個人的にも知っており、Jaenisch の研究室でも常に異色の存在だったが、出来ることは間違いないが、誰もが実現できなかったことをやり遂げるというスタイルの研究者だ。その Hanna がついに ES 細胞からほぼ完全な個体を作ることに成功したというのがこの論文だ。
このような実現のための努力は、ドラマにはなっても、解説は難しい。「ついに実現した、すばらしい」という以外にない。どうして Hanna のグループが成功したかと見てみると、
未分化な ES 細胞に加えて、Cdx2 の発現による栄養外胚葉細胞、そして Gata4 の発現による原始内胚葉細胞を別々に誘導し、それを混ぜた細胞塊を培養したこと、 そして、注入するガスの量などを厳密にコントロールできる回転培養器を開発したこと、 そして慣れた目で正常に発生した5日胚を選び、選択したこと、 などが挙げられるが、書くのがむなしいぐらいで本当は大変だろう。
その結果、神経形成、体節形成、Yolk sac や allantois まで備えたほぼ完全な8.5日胚が形成されている。Single cell RNAsequencingで調べて、栄養膜細胞由来の細胞以外完全に存在している。この方法では、一般の胚培養と異なり、どうしても8.5日胚で発生が止まるのは、おそらくこの欠損による可能性が高い。もう一つの課題は成功率で、5日目で1回選んだ後も、完全な胚まで進むのは2%に満たないようだ。
結果は以上で、これまでほとんど不可能と思っていたことが可能になるとともに、この方法の限界も正確に述べたさすがの仕事だと思う。オープンアクセスなので、是非論文にアクセスして、示された写真を見て欲しい。
2022年8月3日
最近は、代謝や免疫に対する運動の効果についての研究を目にする機会が増えたが、今日紹介するニューヨーク大学、グロスマン医科大学からの論文は、膵臓ガンに対する免疫を有酸素運動が高めるという話で、何でも思いついたら実験してみるのが良いという典型研究に思う。タイトルは「Exercise-induced engagement of the IL-15/IL-15Ra axis promotes anti-tumor immunity in pancreatic cancer(運動が IL-15/IL-15Rα シグナルを介して膵臓ガンに対する免疫を高める)」で、7月11日号 Cancer Cell に掲載された。
この研究の全てはマウスを用いて持続的な運動が膵臓ガンの増殖を抑えないか思いついたことだ。このようなアイデアは思いついてもなかなかやる気にならないのだが、このグループはマウスのトレッドミルをつくって、週5日、1日30分、15cm/秒の速度で走らせ、ガン遺伝子を発現させたマウスで膵臓ガンの発生や、移植した膵臓ガンの増殖を調べた。
結果は期待通りで、運動により膵臓ガンの自然発生は抑制され、また間質反応は抑えられ、膵臓ガンの病理型も腺房型を保つ。さらに、膵臓にガンを注射してから運動させてもガンの増殖を抑えることが出来る。勿論治すというより、抑制するだけだが正直ここまでの効果があるとは驚きだ。この差があれば、後はメカニズムを探索し、以下のシナリオに到達している。
腫瘍局所では、運動によりキラー CD8T 細胞が増加し、逆に免疫を抑える白血球の浸潤を抑えることが出来る。この変化の一部は、運動による交感神経興奮がノルアドレナリンを分泌を介して CD8T 細胞の循環と、局所への浸潤を促須子とで誘導される。
またシグナル経路は不明だが、運動により膵臓局所で IL-15 の分泌が高まり、CD8T 細胞の増殖や、機能維持を誘導し、キラー活性を高める。また、こうして誘導されるキラー活性はチェックポイント治療にも感受性で、PD1 に対する抗体と運動を合わせると、腫瘍局所の T 細胞は増加し、腫瘍抑制効果も高まる。
運動についての結果は以上で、全てが交感神経を介しているのかどうかはよくわからないが、ともかくガンの免疫に関して言えば、IL-15 を介して免疫を高める効果がある。
後は、運動でなくとも IL-15 と可溶性 IL-15 受容体を結合させ、γ 受容体刺激活性を強めたスーパーアゴニストと、PD1 抗体、そしてさらにジェムシタビンとパクリタクセルを組みあわせることで、根治ではないが生存期間を高められることを示している。
以上は全てマウスの話で、人間でも同じ効果があるのか気になる。実際に同じような実験が人間でも行われており、膵臓ガンの手術前に運動を続けさせ、切除後ガン組織を調べるコホート研究を利用して、運動により腫瘍組織の CD8T 細胞が上昇すること、またCD8の数が増えた患者さんでは予後が良いことを示している。
結局、現在治験が進行中の IL-15 スーパーアゴニストを組みあわせた免疫療法を膵臓ガンに使える可能性があることと同じ話になるのだが、運動に限らず少しでも、薬剤とは別のアプローチも真面目に考慮していくことの重要性を示す研究だと思う。
2022年8月2日
久しぶりにネアンデルタール人のゲノムを解読し、またそれまで明らかでなかった新しい古代人デニソーワ人の存在を証明したペーボさん論文を紹介する。ペーボさんは現在沖縄科学技術大学院大学にも所属されているので、OISTも研究場所に入っている。
前回紹介したペーボさんの論文はネアンデルタール人由来の遺伝子が新型コロナウイルスの重症化や、場合によっては抵抗力に関わることを示した論文だったが、今日の論文はペーボさんのライフワークになっている、現生人類と古代人類の脳の違い、特に言語の発生をゲノムから探る研究方向で、7月29日 Science Advances にオンライン掲載された。タイトルは「Longer metaphase and fewer chromosome segregation errors in modern human than Neanderthal brain development(現生人類の脳発生では、ネアンデルタール人より中期が延長してエラーが減少している)」だ。
これまでと同じく、私たちホモサピエンス(HS)とネアンデルタール人のゲノムを比較して、HSが出始めて現れた変化を特定し、その機能の変化をもう一度ヒト細胞やマウス細胞を用いて検証する研究手法だ。
今回ペーボさん達が注目したのは、細胞分裂時のチェックポイントに関わる遺伝子で見られる、現生人類特異的変異だ。というのも、類人猿と人間のiPS由来脳オルガノイド培養での細胞分裂を比べると、細胞が二つに分かれる分裂期の中期で、人間の神経細胞の方が時間がかかることを発見していたからだ。時間がかかる方が効率が悪いと思ってしまうかもしれないが、中期は紡錘体微小管と染色体が正確に結合するまで分裂を待たせるチェックポイントの役割があり(spindle assembly checkpoint:SAC)、このチェックポイントがうまく働かないと分裂時のエラーが増え、染色体レベルの大きな変異が入りやすい。従って、この過程に関わる遺伝子の変化は、分裂時の大きなエラーにつながる可能性が高い。
この過程に関わる分子を HS とネアンデルタール人で比べると、KIF18a と KNL1 、そして SPAG5 で、類人猿とネアンデルタール人の間には変化がないが、HS だけで起こったアミノ酸変化が全部で6種類のアミノ酸置換を特定している。
面白いことに、マウスも類人猿、ネアンデルタール型なので、実験ではマウスのアミノ酸を人間型に置き換え、新皮質の神経細胞増殖を調べると、KIF1a、 KNL1 それぞれの置換により少しではあるが、中期の延長が見られる。そして、KIF1a,、KNL の変異が合わさると、はっきりと中期の延長が見られることが分かった。
逆に、ヒト iPS の KIF1a、KNL1 をネアンデルタール型に変化させ、脳のオルガノイドを形成させた後、神経細胞の分裂を観察すると、今度は中期が短縮している。すなわち、現生人類の脳神経細胞は、ネアンデルタール人より中期のチェックポイントに時間がかかることがはっきりした。
最後に、この差の細胞学的基盤を調べ、HS 型の分子が合わさると、キネトコアでの SAC の数が増え、染色体の分離時のエラーが起こりにくい、すなわちチェックポイントがより厳しくなることで安全性が高まっていることが明らかになった。
以上が結果で、せっかくマウスが出来ているので、マウスの脳機能を是非知りたいところだが何も言及がない。ひょっとしたら、賢いマウス生まれたという論文が近々発表されるのだろうか。期待したい。