2025年8月21日
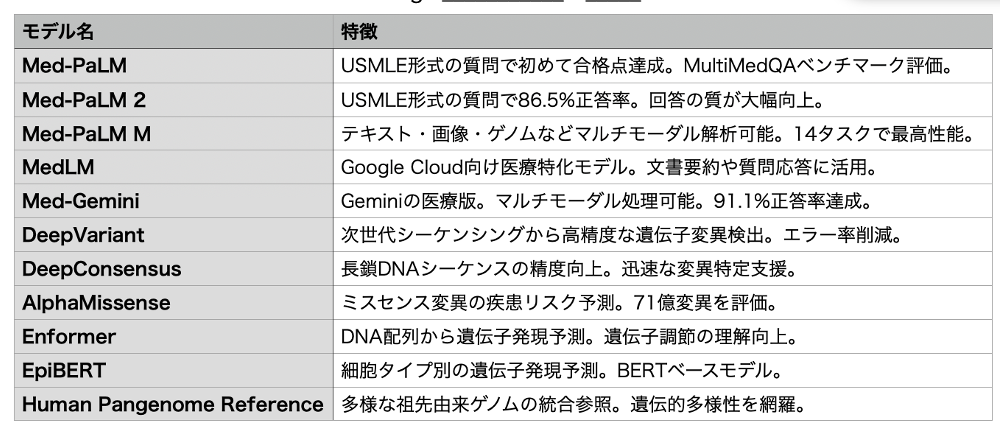
Google の2人の科学者が昨年のノーベル化学賞を受賞したことから分かるように、大規模言語モデルを進化させるためには医学生物学への進出が欠かせないと、生命科学では Alfafold2、3 だけでなくさまざまなモデルを開発している。私が目にしたモデルだけを表にしてみたが、自然言語からDNAまでまさに統合的に扱うのは医学生命科学分野だと焦点を当てているのがわかる。これにアルファフォールドや、最近紹介した鑑別診断モデルAMIEも加わり、多くがトップジャーナルへに掲載されている。
ただ Google 一人勝ちではもちろんない。それぞれのテックが生命科学に新しい可能性を求めている。例えばメタはアルファフォールドに匹敵する構造予測モデルを作成すべくスタートして、自然言語による機能記述、DNA配列、そして構造を一つの多次元空間にまとめ、言語記述から欲しいタンパク質のDNA配列を作成できる EMS3 を発表し、新しい領域を切り開き(https://aasj.jp/news/watch/26196 )、なんと生命情報の研究所まで設立している。
これに対し今日紹介するのはマイクロソフトの AI 研究所からの論文で、一つのタンパク質がとりうる様々な構造を予測できるモデルの開発で、8月21日号 Science に掲載された。タイトルは「Scalable emulation of protein equilibrium ensembles with generative deep learning(タンパク質のさまざまな平衡分布を生成深層学習を用いて大規模にシミュレーションする)」だ。
アルファフォールドでタンパク質の構造予測を行うとき、最も可能性が高い一つの構造が提案されるが、実際のタンパク質はさまざまな構造変化を短時間で繰り返しており、また条件に応じて大きな構造変化をしている。これを捉えるために、スーパーコンピュータを使って自由エネルギーの計算を行いタンパク質動態を解析することが行われるが、気楽に行えるものではない。スパコンによる天気予測のように大変な計算量を伴う。
最近天気予報も普通の計算量で行えるよう大規模言語モデルが使われるが、この研究でもスパコン並の計算量が必要なシミュレーションで得られる構造変化に対応する様々な構造を予測できるモデルの開発を試みている。
これまで行われた計算シミュレーションの結果をそのままインプットしたモデルも作成できるが、データが少なすぎる。そこで、AlphaFold2 に目をつけた。以前紹介したように構造予測という点では AlphaFold2 は AlphaFold3 に道を譲った感がある。これは、AlphaFold2 がその中核の Evoformer と呼ばれる一つのタンパク質の構造を制限する進化的変化を数多くのタンパク質を比較してコンテクストとして取り出し構造予測をするためで、どうしてもタンパク質のみに構造予測が限られる。この縛りを緩めて配列自体にある構造的制約を計算することで、進化に関わらない分子との関係も自由に予測できる利点が AlphaFold3 にはある。
一方で、Evoformer は一つのアミノ酸配列を他の少しづつ違う相同分子と比べることで、どのような構造がありうるかを反復的にアップデートしながら構造を決めている。この AlphaFold2 から計算される反復的アップデートされる表象を、今度は AlphaFold3 で、進化的コンテキスト非依存的に構造化すると、一つのアミノ酸配列に対する数十種類の構造が得られる。このような Evoformer と diffusion を組み合わせた膨大なタンパク質構造データを学習させる。
これとともに、実際のタンパク質構造計算による200ms時間内の構造変化のシミュレーション結果も学習させるが、データの数は数千種類にとどまっている。一つの配列に何十種類もの異なる構造をインプットするという点では同じだが、これは物理的計算が行われた結果なので信頼でいるデータとして扱える。
最後に、たんぱく質の構造的安定性について計算した50万種類のデータをファインチューニングに使っている。(注:たんぱく質の安定性と AlphaFold2 を組み合わせる方法は、突然変異の効果を調べるGoogle Missense でも用いられている。アルゴリズムに物理法則を反映させる一つの方法のようだ)。
これら2種類のプレトレーニングと1種類のファインチューニングの結果できたモデルでは、
RAS の GTP と GDP 結合型の構造や、CAM-KinaseII の autoinhibition による構造変化などを例に、大きく変化した構造を予測できることを示している。
また、通常は数ヶ月もかかわる分子動態の計算シミュレーションを、小規模の GPU だけで再現できる。
そして、たんぱく質の安定性を自由エネルギーの数値として推定できる。これは Google Missense と同じような遺伝子変異の機能解析にも使える。
以上が結果で、過去のデータを学習することで、計算に時間とコストのかかるタンパク質の動態シミュレーションを手軽に行えるようになったという話になる。
同じようにEvoformer+Diffusionを用いたタンパク質動態解析法が、中国のマイクロソフト研究所からちょうど一年前に発表されている。今回のモデルの方がスケールアップし使いやすいと思うが、異なるマイクロソフトのグループが独立によく似た方向の研究をしていることに驚いた。
このように世界を席巻しているテックは生命科学をそれぞれ独自の方法で取り込むことで、AI を進化させているのがよくわかる論文だった。現在渋谷に行くと AI センターが林立しているが、我が国でDNAを情報媒体として新しい AI モデルを目指すグループがどの程度存在しているのか気になる。少なくともトップジャーナルの論文で見る限り、テック、アカデミアを問わず日本からDNA やアミノ酸配列を媒体とした新しいモデル開発論文をまだ目にすることはない。しかし、DNAから脳、そして言語から AI と繋がってきた以上、言語以降の AI だけを扱っていては、人の後を追いかけるだけになる。我が国の若手研究者がこの分野で活躍することを願っている。
2025年8月20日
遺伝子の解析が可能になったホモ属(ネアンデルタール、デニソーワ、そして我々サピエンス)は全て、サルから分かれた様々なヒト属のアフリカでの進化の結果形成されたもので、アフリカでのヒト属の進化研究が熱を帯びてきた。
一般的には、最初のヒト属が400万年前に2足歩行を確立したアウストラロピテクスで、200万年前まで少しづつ分化したサブグループ( anamnennsis, frarensis など)を生み出しながら200万年前まで続いたと考えられている。
この中から分かれたHomo属(H.abilis)が260万年ぐらい前に別れたと考えられているが、アフリカにはこれ以外に同じくアウストラロピテクスから分かれたパラントトロプスが東アフリカで生息していた。すなわち300万年前から2200万年前の間には、アフリカには3種類のヒト属が同時に存在していた可能性が高く、研究の焦点になっている。
今日紹介するアリゾナ州立大学からの論文は、エチオピアの Ledi-Geraru で始まった発掘研究から発見された歯の化石についての分析で、同じ場所からほとんど同時期にアウストラロピテクスとホモ属の歯が出土したことの報告され、8月13日 Nature にオンライン掲載された。タイトルは「New discoveries of Australopithecus and Homo from Ledi-Geraru, Ethiopia(エチオピア Ledi-Geraru でのアウストラロピテクスとホモ属の新しい発見)」だ。
Ledi-Geraru は焦点になっている250万年から300万年前の地層が存在していることから、実際にはかなり広い範囲にわたっているが、アリゾナ州立大学を中心に2002年から発掘が続けられている。その中から見つかってきたのが13コの歯の化石で、ほぼ1kmも離れた3カ所から発見されている。登呂遺跡でも十分広いが、これほど広い範囲の発掘プロジェクトから、このような小さな歯をしっかり見つけ出せているのに驚く。
まだ研究途上で、年代測定はほぼ完全に地層学に依拠して行っている。そして、今回見つかった LD302 及び AS100 は地層学的に278万年から259万年前の化石で、形態学的にホモ属のものと特定している。一方、そこから1kmほど離れた地層から出土した LD750 と LD760 は265万年前の地層で、形態の検討からアウストラピテクスのものと結論している。
と、簡単に紹介してしまったが、歯の計測と評価の過程がともかくすごい。素人目にはほとんど区別できない多様性の中から、最も確率の高い結論を導くための議論が行われている。特に問題なのは、最終的にアウストラロピテクスのものと結論した LD750、LD760 が、アウストラロピテクスの代表 afarensis や最も最後まで生きていた garhi とも一致しないこと、しかしホモ属だけで無く、同じ時期に東アフリカに生息していたパラントトロプスの歯とも一致しない点で、考察の結果アウストラピテクス afarensis が独自に進化してきた新しいサブグループではないかと結論している。
いずれにせよ、アウストラロピテクスとホモ属が1kmしか離れていない場所で10万年程度オーバーラップして存在していた可能性がある。もちろん化石は出ていないが、パラントトロプスも東アフリカに生息しており、それぞれの能力についての研究が重要になる。
アウストラロピテクスはオルドワン型石器で有名だが、その後ホモ属を特徴付けるアシュール型石器へと変化していくのだが、エチオピアはこの進化の中心地と言えるので、石器との対応がこれからの課題になると思う。
2025年8月19日
歳をとってボケてきたのか、寝入りと目覚めはすこぶる快調だ。ただ、時差のある地域に旅行すると調節力が低下していることを感じる。誰にとっても睡眠は健康にとって最も重要で、その理由も次々と明らかになっているが、20人の人間の様々な目覚めを256チャンネルの脳波計で記録した論文をたまたま目にしたので紹介することにした。オランダ神経研究所からの論文で、20人1073回の様々な目覚めを、脳波と行動上の覚醒時期との関わりで調べた研究で、8月18日 Current Biology にオンライン掲載された。タイトルは「Cortical activity upon awakening from sleep reveals consistent spatio-temporal gradients across sleep stages in human EEG(睡眠から覚醒する皮質活動記録は様々な睡眠ステージで見られる人間の脳波での空間的時間的勾配を明らかにする)」だ。
この研究では頭蓋の外に設置した電極による脳波記録だけを用いて覚醒を解析しているため、内部領域の活動は皮質活動から推察するほかない。そのための精緻な解析と知識の結果結論が出されているので、今回は最終的に著者らが出した結論から紹介する方が内容がわかりやすいのではと思う。
まず覚醒を支配する2つのシステムが存在し、両方が一致したときに快適な目覚めが生じる。一つは、視床から皮質に伝わる回路で、元々睡眠時に見られるゆっくりとした波長成分(δやθ)を特徴としている。この睡眠時の遅い波は覚醒の前に急速に高まり、完全に覚醒すると消失する。この覚醒シグナルは、感覚野や運動野と言った皮質中央へと伝搬していく。ただ、このシグナルだけでは覚醒に至らず、実際睡眠時の K-complex として知られる脳波はこのシグナルが重要な役割をしている。即ち、視床では一定の間隔で、覚醒へのシグナルが発生していることになる。
実際に覚醒するときは、この遅い波が一過性に高まったのをきっかけに、早い波(β波)が高まるが、もう少し遅い波の α、σ 波を含めて、これらは脳幹の青班核を中心とした領域から発生し、前頭葉を通って皮質を前から後ろへと覚醒させる。例えば、REM 睡眠から急に覚醒する場合は、遅い波の上昇なしに、直接この覚醒経路が活性化される。
重要なのは遅い波が上昇したあと、早い波の覚醒にシフトする場合は寝覚めがよく、これがノンレム睡眠から自然に覚醒したとき、レム睡眠からの覚醒よりすっきり覚醒できる理由になる。また、音で覚醒させるとき、遅い波が高まるときに起こすと、寝覚めがいい。
以上が結果で、それぞれの波がどのように生成され、また脳を覚醒させていくのかについては何も示されない現象論的研究になる。この研究の前に、覚醒に関してどれだけわかっていたのか把握していないのでなんとも言えないが、今後は視床や青班核でそれぞれの波がどう発生するのか、そしてこれらの波が脳を覚醒させるメカニズムについて調べることが重要だと思う。
ただ、現象論でもこれを利用して、視床由来の波が高まるときを狙って起こしてくれる目覚ましができればヒットすること間違いない。
2025年8月18日
末梢血には血液細胞を中心に、様々な細胞から吐き出されたDNAが流れている。この中にはガン細胞から吐き出されるDNAもあるし、妊婦さんの場合は胎児に由来するDNAも流れている。これを利用して、ガンの経過を追跡したり、胎児の出生前診断が行われている。このように末梢に流れるDNAは臨床に利用できる便利な材料だが、例えば感染や敗血症で量が増えると、腎臓での濾過障害や炎症を起こすこともある。従って、一定の量を超えないようにDNAを処理できるようになっている。最も重要なのは血中のDNaseによる分解、マクロファージなどによる除去、そして断片化されたDNAは腎臓から濾過される。
今日紹介するオックスフォード大学からの論文は、血小板も末梢のDNAを取り込んでDNA濃度を抑える働きがあり、末梢血の cell free DNA (cfDNA) と同じように利用できることを示した研究で、8月14日 Science に掲載された。タイトルは「Platelets sequester extracellular DNA, capturing tumor-derived and free fetal DNA(血小板は細胞外のDNAを隔離する機能を保ち、腫瘍や胎児由来のDNAを捕捉できる)」だ。
血小板や赤血球がDNAを取り込む可能性があることは以前から指摘されていたが、これが血中からDNAを除去する一つのメカニズムではないかと着想したのがこの研究の全てといえる。
まず血小板にDNAが取り込まれていること、そして通常は全体の8%ぐらいが多くのDNAを取り込んでおり、取り込まれたDNAには胎児のY染色体由来の遺伝子も含まれることから、血小板ができるときに取り込まれたDNAではなく、末梢に流れる間に取り込んでいることを確認している。
次に血小板が血中DNAのクリアランスを行っていることを示すため、人為的に血小板減少症を誘導して血中のDNA量を調べると、血小板の低下に伴い、血中DNA濃度は4倍近くも高まることを示している。即ち、DNA分解酵素だけではなく、血小板も血中 cfDNA濃度の調節に重要な働きをしている。
次は血小板にDNAが取り込まれる様式を細胞学的に調べ、一つは血小板がエネルギー依存的に膜が落ち込むエンドゾーム形成による cfDNA取り込みと、細胞から吐き出されたDNAが詰まったエクソゾームを取り込むことが主な様式で、DNAは膜で守られているため、外部のDNaseの影響を受けないことを示している。血小板の寿命は1週間から10日ぐらいなので、血小板とともに貪食細胞に処理されることになる。この過程は、細胞骨格の変化を伴う過程なので、様々な化合物を使って抑えたり、高めたりすることもできる。
では血小板に取り込まれたDNAをガンの診断に用いることができるか?結論的には、cfDNAと同じぐらいの感度でガンや胎児診断に使うことができる。ただ、マウスを使った大腸ガンモデルを使って cfDNAと検出感度を比べ、少し血小板のDNAの方が感度良くガン特異的DNAを検出できることを示しているが、手間も考えると cfDNAアッセイに変わるところまでは行かないだろう。
結果は以上で、着想の面白さと血小板減少と血中 cfDNAを比較した実験以外は、驚くほどの結果ではなかったが、例えばSLEで血小板減少が見られるときには腎障害の頻度が高まると言った現象も新しい見方ができるかもしれない。
2025年8月17日
毛根は独立した組織として上皮や間葉系の細胞を一つの構造にまとめている。例えばヘアサイクルを誘導する間葉系細胞 dermal papilla (DP) は、回りの線維芽細胞とは全く別の細胞としてヘアサイクルだけに関わっている。逆に、毛根の周りの線維芽細胞は、組織を支える土台であってもヘアサイクルに影響を及ぼすことはないと考えてきた。特に老化や男性ホルモン型ハゲの場合は、DP と毛母細胞がアンドロゲンに応答して毛根の縮小を起こすと考えられてきた。
ところが今日紹介する中国北京の生物学研究所からの論文は、本来のヘアサイクルには全く関与しないカリウムチャンネルの機能から、ヘアサイクル維持に関してこれまで考えもしなかったメカニズムを明らかにし、新しいヘアサイクル操作の可能性を示した画期的研究で、8月15日 Cell にオンライン掲載された。タイトルは「Fibroblast bioelectric signaling drives hair growth(線維芽細胞の生体電気的シグナルが毛髪増殖を誘導する)」だ。
この研究は17番染色体に見られる小さな欠損や重複の結果、先天性の多毛症の遺伝的メカニズムの解析から始めている。欠損箇所や重複が異なる5例の患者を対象に研究しているが、特定の遺伝子が欠損すしているわけではないので、以前詳しく説明した染色体3次元構造化の異常(https://aasj.jp/news/watch/3533 )が遺伝子欠損で誘導された結果ではないかと考え、患者さんから iPS細胞を作成したり、また同じ欠損を誘導した iPS細胞を作成し、染色体トポロジーを調べた結果、通常は皮膚に発現がないカリウムチャンネル (KCNJ2) 遺伝子が、1Mbも離れたエンハンサーの支配下に入ってしまって、皮膚の線維芽細胞で発現していることを発見した。即ち、この変異により本来発現のない KCNJ2 が発現することが多毛症の原因であることがわかった。
これを確かめるため患者さんの皮膚細胞の single cell RNA sequencing を行い、皮膚の線維芽細胞だけで KCNJ2 の異所性発現が見られることを明らかにしている。次は、KCNJ2 を異所性に発現させて同じ症状が発生するかが問題になる。そこで、DP や脂肪細胞を含む様々な皮膚細胞特異的に KCNJ2 を発現させヘアサイクルを調べると、毛根の周りにある線維芽細胞特異的に KCNJ2 を発現させたときだけ、ヘアサイクルが半分に短くなり、また強い毛根の増殖を誘導する結果できてくる毛も太く長くなることを明らかにした。この結果は驚きで、これまで毛根は独立していると思っていたが、実際には周りの線維芽細胞により影響されていることがわかった。
ではなぜカリウムチャンネルの異所性発現がこのような効果を発揮するのか。まず KCNJ2 を発現した線維芽細胞の膜電位を調べると、通常より強く脱分極していることがわかった。この脱分極がヘアサイクルを変化させていることを明らかにするため、KCNJ2 を皮膚に直接遺伝子導入する実験を行い、これだけで毛根を活性化できること、逆にカリウムチャンネル機能を失った変異 KCNJ2 を導入しても毛根に変化ないことを明らかにし、カリウムチャンネル機能の結果として毛根が活性化されることを明らかにしている。
そして、カリウムチャンネルが発現することで細胞内カルシウム濃度が低下することが線維芽細胞の Wnt シグナルへの感受性を高め、Wnt シグナルが高まることで毛根再生に関わる様々な遺伝子が活性化し、これが毛根の活性化を高めていることを示している。とはいえ、決して毛根周囲の線維芽細胞が DP 化したわけではなく、あくまでも Wnt 刺激感受性が上がり様々な分子を発現した結果である事を示している。
簡単に紹介しているが、実際にはカリウムチャンネル阻害や細胞内カルシウム濃度を変化させる実験を通して、このシナリオが正しいことを示している。多毛症の原因特定から細胞内カルシウム変化まで、高い実力を感じさせる実験で中国の躍進が感じられる。いずれにせよ、KCNJ2 遺伝子導入でこの状態が局所的にできて、毛根が活性化されることがわかった。
この方法は決して新しい毛根を作成するわけではない。実際新しい毛根再生を必要とするのは火傷のあとの皮膚再生で、ハゲの場合は毛根が残っている。従って、この方法はハゲの治療に使えると想定できる。事実、ディヒドロテストステロンを塗布してハゲを誘発する実験系で局所に KCNJ2 を遺伝子導入すると、毛を再活性化してハゲを治せる。
また、我々の線維芽細胞は正常でも老化に伴ってカルシウム濃度が上昇し、膜電位が低下することも示しており、ハゲだけでなくこの状態を変化させることで、老化によるヘアサイクル変化も若返らせるかもしれない。
以上が結果で、毛根を臓器として対象にすると難しかった介入が、周囲の線維芽細胞を変化させるだけで可能になるという結果は、この分野の大きな転換点になる気がする。
2025年8月16日
けんかが強いというのは才能で、はっきり言って怖じ気づかない事が最も重要な気がする。自分を振り返ると、この恐れる気持ちを振り切るのが苦手で、けんかには弱かった。高校時代ラグビー部に所属していたが、半分けんかに近いところがあり、タックルは下手だった。
今日紹介するハーバード大学からの論文は、4匹のマウスを互いに競わせて力の階層ができたときに、各階層のマウスの脳を比較してランキングを固定する脳回路を調べた研究で、8月11日 Cell にオンライン掲載された。タイトルは「Molecular and neural control of social hierarchy by a forebrain-thalamocortical circuit(社会的階層は前脳-視床皮質回路の分子的神経学的調節により決められる)だ」。
こういう研究は脳を調べるまでの実験設定が面白い。4匹の別々に育ったオスマウスを、一つの部屋で競わせたり、またチューブの中を動いているとき鉢合わせしたとき進むか退くかを何度も繰り返させ、最終的に4匹のランクが形成するのを待つ。ある時期にトップとボトムは決まるが、2位と3位のランクはなかなか固定しないが、最終的には固定する。
面白いことに、こうして発生したランクは精子の数と、唾液腺の大きさと一致している。要するに身体的強さに応じたランキングができる。
このようにランキングが固定すると、様々な脳を調べる方法が存在する。まずチューブテストではランクに応じて進む退くが決まるが、このときの脳の活動を比較すると、前頭前野と連携して意志決定などに関わる背内側視床核 (MDT) と行動調節に関わる前帯状皮質 (ACC) でトップランクのマウスで活動が高いことがわかった。
この結果を機能的に確かめるため、まず MDT 神経を破壊すると、社会性とは無関係にランキングを固定化する機能があることがわかる。そこで、光遺伝学などを用いて MDT を刺激あるいは抑制する実験を行い、刺激によりランクの低いマウスがけんかに強くなる。一方、トップランクのマウスにはほとんど影響はない。一方、阻害実験ではトップランクも低いランクもほとんど変化がないことから、刺激程度がランクの意識を維持していることがわかる。
次にトップランクマウスで刺激が高まる分子基盤を遺伝子発現を比べることで探索し最終的に電位依存性のイオンチャンネル TRPM3 の発現が TMD で高まることが、トップランクのマウスで TMD の活動を高めていることを明らかにしている。
もちろんランキングは相手の匂いなど様々な認識インプットが統合されて形成されるので、TMD へ投射しているメインな回路を探索し、最終的に眼窩前頭皮質 (OFC) → MDT の活動がトップランクマウスで上がり、逆にランクの低いマウスでは前脳基底部→ TMD の抑制により刺激が上がらないようにできていることがわかった。
最後に TMD から投射を受ける前頭皮質と ACC の回路特性を調べ、トップランクのマウスでは、MDT が興奮すると ACC の抑制神経が興奮し、同じ ACC の興奮神経を抑える。一方、前頭皮質では MDT は直接前頭皮質の興奮を高めて社会的な勝利感を高めていることを示している。
ちょっと回路が複雑になったので整理すると、ACC 興奮は怖じ気づかせる作用があり、一方前頭皮質興奮は社会的勝利感を誘導する。けんかに強くなるためには、ACC の興奮を抑え、前頭皮質の興奮を上げる必要があるが、これを調節しているのが MDT の興奮で、ランキングが固定化する過程で OFC→MDT 回路の活性が TRPM3 発現上昇により高まり、一方で前脳基底部の抑制が低下することで、MDT 活性が高く維持されてけんかに強いマウスが誕生するということになる。
このような研究はやっている方も楽しいが、研究でもけんかが強いことは重要かもしれない。
2025年8月15日
腸管上皮内の L細胞、及び K細胞からグルコース依存的に分泌されるそれぞれ GLP-1、 GIP の2種類のインクレチンは、G共役型の受容体を介してβ細胞のインシュリン分泌を誘導する。この性質を利用して、2型糖尿病患者さんのインシュリン分泌を助ける目的で利用され始めた GLP-1 受容体作動薬は、予想を超えた効果を示し、心血管障害や腎障害を抑制し、今やアルツハイマー病の進行を遅らせる目的でも治験が行われている。そしてこれ以上に世間の注目を浴びたのが、その体重減少効果で、代謝調節だけでなく視床下部の食欲調節神経細胞に作用して食欲を抑えることが効果の主要な原因であることがわかっている。この GLP-1 受容体作動薬ブームにさらに促進したのが、GLP-1 受容体と GIP 受容体の両方に作用する dual agonist で、GLP-1 単独を遙かに超える体重減少効果が見られることから、今やマンジャーロとググると、多くのオンラインクリニックの宣伝がトップに来る有様で、製薬会社も心配するぐらいの隠れたブームになってしまっている。
末梢組織では GLP-1 と GIP 受容体の発現は異なり、dual agonist の作用を完全に把握するのは簡単ではない。さらに、脳への作用となるとよくわかっていないのが現状で、脳幹の GABA 神経特異的に GIP 受容体をノックアウトする実験から、GLP-1 受容体刺激による食欲抑制効果を、この回路を介して促進すると考えられている。
これに対し今日紹介するウェルカム・MRC 代謝研究所からの論文は、GIP がオリゴデンドロサイトの分化を促進し、これが結果的に GLP-1 が脳へ拡散する窓を開けることで GLP-1 作動薬の効果を高めるという、普通では思いつかない可能性を示した研究で、8月13日 Cell Metabolism にオンライン掲載された。タイトルは「Glucose-dependent insulinotropic polypeptide receptor signaling in oligodendrocytes increases the weight-loss action of GLP-1R agonism(オリゴデンドロサイトの GIP 受容体シグナルは GLP-1 受容体作動薬の体重減少作用を高める)」だ。
Single cell レベルの転写解析で GIP 受容体 (GIPR) が分化したオリゴデンドロサイト (OL) に強く発現しているという発見がこの研究の動機で、まず視床下部と脳下垂体をつないでいる正中隆起の OL が強く GIPR を発現しており、過食による肥満でこの領域の OL の数が増えることを確認する。
その上で、OL 特異的に GIPR をノックアウトしたマウスを作成、正中隆起での OL の増加は GIPR 依存的であることを明らかにする。一方、OL の前駆細胞では GIPR は発現しておらず、GIP による作用は全く受けない。
驚くことに、OL 特異的に GIPR をノックアウトすると、OL 数が減るだけではなく、全身のエネルギー消費が減りインシュリン抵抗性が上昇、さらに脂肪細胞が肥大する。即ち、正中隆起と言った小さな領域での GIP による OL 分化促進が、全身の代謝に影響している。
これは GIP 単独の影響とは考えにくいため、この研究では GLP-1 の作用との関わりに焦点を当てて調べ、OL で GIPR がノックアウトされると、GLP-1R 作動薬と比べたとき、dual agonist の効果が特異的に減少することを発見する。即ち、GIP と GLP-1 が協調する条件で OL での GIPR ノックアウト効果が出ることを明らかにする。
この理由について、GIPR 作動薬の結果正中隆起で OL が増加し、またミエリン量も増えることで、この経路を介して GLP-1R 作動薬が脳内に侵入しやすくなるのではと考え、蛍光ラベルした GLP-1 を GIPR 刺激で静脈注射する実験を行い、予想通り GIPR 刺激により正中隆起経路を通して GLP-1 が脳内に侵入すること、この侵入は OL の GIPR ノックアウトで阻害できることを示している。
最後に、神経機能を抑える実験から、これまで食欲に関わることが知られている傍室神経のバソプレッシン神経がこのルートで侵入する GLP-1 の標的であることを示している。
GABA 神経の関与などこれまでの研究とすりあわせも必要だとは思うが、GIP が直接食欲を調節するのではなく、OL の分化やターンオーバーを促進し、その結果神経ルートが開いて GLP-1 が脳内に入る道を作るという、全く意外なメカニズムの提案で、この分野について我々がまだまだ知らないことが多いことを示している。
最近の論文を見ていると、薬をやめるとリバウンドは必死で、またこれまで考えられていたほどではないが、それでも筋肉量の減少や筋力の低下を誘導するので、医者の管理の下で使うことが重要だと思う。
2025年8月14日
人間の歴史は感染症と切り離すことはできない。医学が急速に発展した現代でも、コロナパンデミックが我々の社会に及ぼした影響は計り知れない。トランプ政権やケネディ衛生長官もコロナパンデミックから生まれたとすら考えられる。このような感染症と人間の歴史の関係を読み解く手段として古代ゲノム研究の重要性が高まっている。即ち、人間の進化と病原体の進化を同時に調べることができる。例えば人口の半分近くが死亡したヨーロッパのペスト大流行の結果、人間集団の遺伝子が4年という短い間にも変化したことを捉えることができた論文を以前紹介した(https://aasj.jp/news/watch/20803 )。この原因となったペストはノミを通して人間とネズミを媒介することで大流行を果たしているが、このような大流行とは別にペスト菌が家畜に維持され、ヒト感染症のリザバーになっていることもチベットでの感染研究を通して知られている( https://aasj.jp/news/watch/8847 )。
今日紹介するベルリンのマックスプランク感染症研究所からの論文は、チベットで見られたのと同じような家畜と人間の間でのペスト感染症維持が先史時代にも存在した証拠を探し求めた結果、ロシア大草原地帯のシンタシュタ文化の遺跡から出土したヒツジの骨からペスト菌を分離し、このゲノムから人間とペスト菌の付き合いを調べた研究で、8月11日 Cell にオンライン掲載された。タイトルは「Bronze Age Yersinia pestis genome from sheep sheds light on hosts and evolution of a prehistoric plague lineage(ヒツジから分離した青銅器時代のペスト菌ゲノムは先史時代のペスト系統と人間の進化を教えてくれる)」だ。
ノミの体内で生存できる進化を遂げたのが現代のペスト菌の進化のエポックで、これによりネズミが媒介するペストの大流行が起きるのだが、先史時代のヒトゲノムから見つかるペスト菌にはこのような変化は存在しない。しかし、新石器時代や青銅器時代のヒトの骨から多くのペスト菌が発見されるが、ほとんどが普通に埋葬された骨から見つかり、大流行で見られる集団墳墓ではないことから、おそらく以前紹介したチベットで見られたような感染様式が維持されているのではと考えられてきた。
この研究の基本は、馬を家畜化しユーラシアに広く拡大した牧畜分化遺跡から出土する動物の骨を探索して、一本のヒツジの骨からほぼ完全なペスト菌ゲノムを分離したことにつきる。などと簡単に言ったが、きちっと埋葬されている人間の骨と異なり、食用として使われた家畜の骨からDNAを抽出することは簡単でない。そのため、本当にこれがヒツジの骨か、古代ゲノムかなど徹底的な検証を行い、青銅器時代の家畜に感染が維持されていることを明らかにした。
分離されたゲノムと他のペスト菌ゲノムを比べると、新石器・青銅器時代の人の骨から分離されたペスト菌の系統樹に完全に収まることから、決してヒツジ独自に進化したのではなく、人間とともに進化してきたペスト菌であること示され、ヒツジなどの家畜と人間の間で行き来して維持されてきたと考えられる。また、ヒツジと人間で異なる選択圧が存在した痕跡があるため、家畜内での感染、人間での感染を繰り返して進化しているが、相互に感染することで一定のゲノムに落ち着いて維持されることがわかる。即ちチベットで見られたように、先史時代のペスト菌は家畜の利用をベースに維持されてきたことがわかる。
ペスト菌は偽結核菌として知られる Y.pseudotuberculosis (Y.pse) から7000年前に分岐してきたことがわかっているが、現在のペスト菌と異なり Y.pse の多くの遺伝子がまだ残っており、分岐直後から独立に進化してきた菌で、Y.pse の様々な遺伝子を独立に不活化することで、人や家畜に感染できる菌へと進化している。
面白いのは、この系統のペスト菌がユーラシア全体に広がっており、地域ごとの異なる進化が見られないことで、人間の移動がペスト菌を広げたとも考えられるが、渡り鳥によって広がった可能性も否定できない。
今後新石器・青銅器時代のペスト菌系統を再現して実験的に研究するとともに、さらに多くの遺跡からペスト菌を分離する努力が必要となる。以上、ヒツジから見つかった一つのペスト菌ゲノムから様々な可能性が広がる。
2025年8月13日
例によって気になった臨床研究をいくつか紹介するが、今日最も紹介したい論文は変異RASペプチドを抗原として膵臓ガンや大腸ガンの患者さんの抗ガン免疫を誘導する第一相治験のフォローアップ論文で、Nature Medicine にオンライン掲載された。
このワクチンについてはかなり期待できるとして昨年1月に紹介している(https://aasj.jp/news/watch/23781)。よく考えられたワクチンで、抗原としては変異RASペプチドを用いており、RASをドライバーとするガンはほとんどが標的になる。このペプチドを脂肪酸を介してアルブミンと結合させ、皮下注射するとすぐにリンパ節に行くように設計している。さらに同じアルブミンにアジュバントとして Tol9 を刺激する一本鎖DNAをつないで免疫を高めている。25例中21例でガンの増殖を抑えられたという結果だったが、今回の論文は同じ患者さんをさらに平均19.7ヶ月まで追跡した結果を報告している。
最初はワクチンだけの治療だったが、その後ガンマーカーが上昇する場合他の治療を組み合わせており、その中には PD-1 に対する抗体もあるが、このような治療上の違いは全くカウントせず、再発、生存期間でフォローしている。コントロールはないが、膵臓ガンで半数が2年以上生存していることから効果は大きい。特に、免疫後のT細胞反応が10倍近く上昇したグループを抜き出してみると2年で生存率が75%で、最初の論文の予想が確認された。他のガン抗原に対する免疫も誘導される spreading も認められており、今後チェックポイント治療や、あるいは粒子線治療などの組み合わせを工夫すれば大きな成果を上げられるように思う。特に、手術前にネオアジュバント治療として採用する治験も是非進めてほしい。すでにコントロールを置いた次にフェーズに入っているということで、かなり期待している。
次の上海交通大学からの論文は漢方薬で下痢止めや肥満防止に使われている黄柏由来のアルカロイドベルベリンが大腸ポリープ切除後の再発を抑えるという治験研究だ。
前臨床研究でベルベリンが大腸のポリープの再発を抑えることがわかったので、無作為化して450人づつの規模でベルベリン接種有り無しに分け、まず2年追跡して再発を抑えることを確認したあと、さらに6年までフォローアップを伸ばして調べたのがこの研究だ。6年追跡すると、ポリープの再発だけでなく、ガンの発生についてもある程度追跡できる。
結論としては、ポリープの再発は強く抑制でき hazard ratio で0.58と大きく低下する。ガンの発生についても、ポリープほどではないが一定の効果が見られると結論している。
ベルベリンはサプリとして利用されおり、アスピリンなどと同じく直腸ポリープ、即ちアデノーマを予防的に抑える薬として使えそうだ。最後に、上海交通大学の研究はこれまでも紹介しているが、いつも漢方への気配りが感じられる研究で面白い。
3番目の論文は新しい乳ガンの経口薬に関する治験で、乳ガンは新しい薬とそれに対する耐性のいたちごっこにはなっているが、着々と理論に基づいて新しい薬剤が開発され、再発後の長い戦いを支えていることがよくわかる論文で、8月7日号の The New England Journal of Medicine に掲載された。
乳ガンの7割を占めるエストロゲン受容体 (ESR) 陽性、HER2 陰性の患者さんの再発例は、ESR 阻害、あるいはエストロゲンの枯渇を誘導するアロマターゼ阻害剤と、CDK4/6 阻害剤の組み合わせが用いられ、このブログで何回も紹介した。ただ、この治療を続けると半分ぐらいの患者さんで ESR の変異が起こり、エストロゲン治療が効かなくなる。
これに対し ESR にタンパク分解システムをリクルートして ESR を分解してしまうプロタック型、あるいは分子糊型の薬剤が開発され、現在はアストラゼネカの Fulvestrant が使われている。ただ、溶解性が悪く筋肉注射が必要で、経口薬が待たれていた。この目的でアストラゼネカは同じ分子糊型 Camizestrant を開発し、同じ号の The New England Journal of Medicine にアロマターゼ阻害剤の代わりに使えることを示している。
これに対し今日紹介する論文は、Arvinas/Pfizer が提供するプロタック型経口薬 Vepdegestrant の第三相治験で、同じように ESR を分解するアストラゼネカの Fulvestrant 筋肉注射と比較している点が面白い。
筋肉注射が必要という問題はあっても ESR 分解なので同じ程度に効果があるのかと思いきや、ESR 変異を持つ患者さんで見たとき、Fulvestrant より明らかに効果が高く、18ヶ月で全くガンが進行しないケースが3割近く存在する。すなわち、同じメカニズムでも、薬により効果は大きく違うことがわかった。
今後アストラゼネカの分子糊型経口剤 Camizestrant との比較が行われるのではと思うが、患者さんの治療可能性が広がる過程は、創薬企業の熾烈な競争過程であることがよくわかる治験だ。いずれにせよ、ESR の変異が発生したときの次の手の効果が高まることは喜ばしい。
ガラッと趣を変えて、次の論文は認知症の発生に対する教育程度の効果を調べた研究で、7月28日 Nature Medicine にオンライン掲載されている。
これまで、高い教育を受けているほど認知障害の発生が抑えられることを示す研究は多く存在する。この研究では、ヨーロッパとアメリカの17万人のデータ、その中の1万5千人の MRI データを分析し、これまでのドグマを再検討している。
結果だが、確かに記憶力を測ると教育程度が高いほど高いスコアが出るが、年齢とともに記憶力が低下する速度は全く同じで、結局は脳の老化や認知症の発生を教育では根本的に予防できないという結論になる。
この結果は MRI による脳の萎縮程度でも確認され、教育によって脳機能に下駄を履かせることはできるが、年齢による機能低下速度を変えることはできないようだ。いずれにせよ、若いときに脳を鍛えてスタートラインをずらせておけば、劣化が始まっても余力を残すことができるので、やはり教育は大事だ。
2025年8月12日
CRISPR システムを用いた遺伝子編集は、遺伝子切断による変異誘導や一塩基変換に関しては定着してきたが、遺伝子を組み換えたり、一定の領域を置き換える方法はまだまだ研究途上と言っていい。そんな一つが2019年に Liu らが開発したプライム遺伝子編集で、Cas9 に逆転写酵素を融合させ、標的をカットしたあと逆転写酵素で新しいDNA配列を合成させて、希望の配列に置き換える方法を指す。すでにヒト血液幹細胞を用いた遺伝子編集にも使われるなど期待は大きいが、新しく合成した DNA 鎖と元の配列に当然起こるミスマッチ修復メカニズムが働いてしまって、この遺伝子編集効率を大きく低下させるという問題があった。
今日紹介する韓国国立ソウル医科大学からの論文は、昨年ノーベル化学賞を受賞した Baker さんらが開発した RFdiffusion を用いてミスマッチ修復酵素複合体をブロックできるペプチドを設計し、それをプライム編集に組み込んで編集効率を8倍近く高められることを示した研究で、8月5日 Cell にオンライン掲載された。タイトルは「AI-generated MLH1 small binder improves prime editing efficiency(AI により設計した MLH1 結合ペプチドはプライム編集効率を高める)」だ。
プライム編集はこれまでも様々な改良が加えられ、特にミスマッチ修復システムに関わる酵素の機能抑制酵素を組み込んだ方法などが開発されたり、現在までに7バージョンの編集システムが開発されている。この研究では一歩進んで、ミスマッチ修復に必要な MLH1 と PMS2 の結合をブロックする全く新しいペプチドを、RFdiffusion を用いて設計し、プライム編集に組み込んでミスマッチ修復を抑えようと考えた。
Baker さんの方法が本当に多くの研究をインスパイアしているのがわかるが、MLH1 と PMS2 の結合サイトの4つのアミノ酸残基と相互作用できる80残基のペプチドを RFdiffusion を用いて設計し、最初にリストされたペプチドを、独自に開発した AlphaFold3 ベースの拮抗阻害ポテンシャル測定方法を用いてフィルターをかけ、最終的に得られた60種類のペプチドについてはプライム編集時に導入して効率を調べた。効率が3倍以上高まるペプチドが9種類得られており、比較的成功率は高いと言える。
この中から効率が6倍程度上昇した配列の一つをその後の研究に用いている。まずプライム編集システムと別々に細胞に導入してこれまでの方法と比較し、全ての細胞でこの方法が最も高い効率を示すことを確認している。また、この阻害効果が設計通り MLH1 への結合の結果である事も確認している。
その後、プライム編集コンストラクトにこのペプチドを組み込んだコンストラクトを作成、ヒトiPS細胞を含む様々な細胞でその効果を確認したあと、このコンストラクトを直接動物に注射して、肝臓細胞での igf2 遺伝子編集の効率について調べている。プラスミドを直接導入するという効率が高くないと思われる方法をなぜか用いているが、それでも1%近くの細胞で遺伝子の編集に成功している。
結果は以上で、今後デリバリーの方法を改善すれば、プライム編集が目指していた生体内での遺伝子配列の書き換えもぐっと近づいたと思う。また、RFdiffusion などで可能になる全く新しいペプチドデザインを細胞内の分子過程の制御に使うアイデアは、遺伝子編集にとどまらず、ポテンシャルは大きい。RFdiffusion をマスターして新しい利用法を開いたソウル医科大学のグループの今後に期待したい。