2015年6月4日
常識は不思議だ。誰も疑わないから常識なのだが、なぜ疑わないのかよくわからないことが多い。とはいえ、覆って見るとその影響の大きさに驚くことも多い。このため、常識を考える時一番面白いのは、なぜそれが疑われるようになったかだ。例えばインプリンティングやX染色体不活性化のある哺乳動物で体細胞クローンはできないという常識は、常識を最初から気にしないウィルムートさんや、若山さんが覆した。今日紹介するバージニア大学からの論文も、もし正しければ常識が覆った例として長く語り継がれるだろう。タイトルは「Structural and functional features of central nervous system lymphatic vessels (中枢神経系に存在するリンパ管の構造的機能的特徴)」だ。タイトルにある中枢神経系に存在するリンパ管だが、少なくとも私が卒業した時から存在しないと考えられてきた。脳脊髄液の循環経路が最終的にリンパ管とつながっているのではないかと考えられてはいたが、わざわざ脳内にリンパ管が別に必要だとは誰も思わなかった。ただ昨年10月19日このホームページで紹介したように(http://aasj.jp/news/watch/608)、グリア細胞がglymphatic systemを作って、眠っている時に脳に溜まった老廃物を除去しているという論文がサイエンスに出て、脳にある新しい循環系に注目が集まった。ただそれでもリンパ管があるとは誰も考えなかったようだ。このグループは、T細胞が中枢神経内を循環する経路を探索しているうちに硬膜静脈洞に接して、さらに濃縮して循環している脈管系の存在があることに気がついた。リンパ球が濃縮していることから、ひょっとしたらリンパ管ではないかと思いつき、細胞マーカー、電顕、機能的循環アッセイなど様々な方法を駆使して、この管が血管やglymphaticsとは異なるシステムで、あらゆる面でリンパ管と言っていいことを確認した。残念ながらこの研究でも、このリンパ管へT細胞が入ってくる入り口はよくわからない。ただ、脳内の反応が深部の頸部リンパ節とつながっていることは明確に示している。いずれにせよ、多発性硬化症など脳内での免疫反応をこの構造の存在を前提とする新しい目で見ることが必要になるだろう。しかし、リンパ管研究のあらゆるマーカーが揃っていても全く疑われず現在に至るとは、本当に常識は恐ろしい。一方、水生動物のリンパ管は静脈と多くの吻合を示すし、両生類の研究者はリンパ液を循環させる心臓があることを知っている。要するに融通無碍の脈管系だ。そう考えると、これを知りながら常識にとらわれていた自分が一番常識的な人間だと反省する。
2015年6月3日
今日は一般の方には理解が難しい話題を取り上げるが、私の誕生日ということで許していただく。発生やガンを考えるためには大事な話題だが、限られた字数で説明しきれるとは思えない。情報としてのゲノムを考えるためには重要な問題なので、JT生命誌研究館ホームページに連載している「進化研究を覗く」というサイトにもう少し詳しく書こうと思っている。
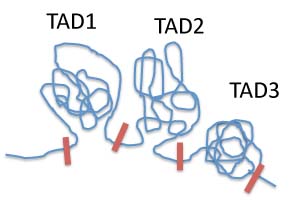
さてゲノム情報というとA,T,C,Gの4塩基の配列でコードされる情報と考えがちだが、これ以外にもゲノムが構造化されることで、配列とは違う情報が発生していることについて今日は考えてみたい。論文紹介に進む前に、まずtopology associating domain (TAD)について普通は使わない図を使って紹介しておこう。私たちのゲノムは図に示すTADと呼ばれる構造化された区域が約2000集まってできている。図1に示すようにTADとTADの間には特殊な境界領域が存在し(赤の線で示している)、隣接するゲノム領域が影響し合わないよう3次元的に隔離していると考えられている。一つのTADの中には1〜複数の遺伝子とともに、その遺伝子発現を調節するエンハンサーが存在している。特殊な境界と構造化のおかげで原則として一つのTAD内エンハンサーは隣接するTADに影響できないように隔離されており、このおかげで重要な遺伝子が間違った時期や場所で発現できないようになっていると考えられている。といってもこの概念はゲノム各領域のトポロジカルな関係を調べるchromosome conformation capture法と呼ばれる方法から得られる結果から想定されている可能性に過ぎない。またTAD区域は固定的でなく、発生とともに変化するし、またTADを超える相互作用も存在することから、TAD構造とその境界領域が具体的に働いていることを機能的に示す研究が待たれていた。今日紹介するベルリン・マックスプランク分子遺伝学研究所からの論文はTAD間の境界が変異により壊れると隣接するTADに存在するエンハンサーの影響が及んできて発生異常が起こることを示した力作で5月21日号のCellに掲載された。タイトルは「Disruptions of topological chromatin domains cause pathogenic rewiring of gene-enhancer interactions (クロマチンのトポロジーが壊れると遺伝子とエンハンサーの相互作用が異常に再構成される)」だ。この研究ではまず、複雑な手指の発生異常(多指、融合指、短指など)を起こすゲノム変異が集中するEPH4遺伝子が存在する領域に焦点を絞り、遺伝子変異の性質とそれに起因する手指奇形の種類を相関させるところから始めている。(余談になるが、多指症は18世紀ベルリン科学アカデミーの会長になったMaupertuisが最も興味を持って研究した家族性発生異常で、何か因縁めいたものを感じる。) EPH4遺伝子の存在するTAD(TAD2とする)は3Mbの大きな領域で、Wnt6,Ihh両遺伝子を含む1MbほどのTAD(TAD1)とPax3遺伝子を含む0.5Mb程度のTAD(TAD3)に挟まれている。ヒトの異常を調べると短指症はTAD2,TAD3境界の欠失、指の融合はTAD1,TAD2境界での逆位、多指症がTAD1,TAD2境界の欠失で起こるという法則性を突き止めた。次に同じ欠失を遺伝子操作でマウスに再現するとヒトの異常とほぼ同じ奇形が発生しメカニズムを追求するためのモデルとして使えることが分かった(このモデル動物を作るだけでも大変だ)。このモデルを使って、手指発生時の遺伝子発現や、各領域内のトポロジカルな関係や相互作用を調べると、予想どおり境界が破壊されるとTAD2に存在するエンハンサーの影響が隣接するTAD内の遺伝子発現に影響する結果、普通は手指発生では発現の見られないWnt6, Ihh,Pax6が異所的に発現することを突き止めた。そして、Wnt6の異所的発現では指の融合、Ihhの異所的発現では多指が、そしてPax6が発現すると短指が発生することを見事に明らかにした。さらに研究では、TAD2内のどのエンハンサーがそれぞれの遺伝子発現に影響するか、それぞれ違う変異でどのようにTADが再構成されるかなど詳しく示されているが、詳しく説明する必要はないだろう。この研究で示された全ての結果は、TADが3次元的に複雑に絡み合ったゲノム内で、エンハンサーの働く区域を限定し、遺伝子発現の安定性を確保するための必須の構造であることを明確に示した。ゲノムは構造化され、構造自体が重要な塩基配列とは別の情報として発生や進化に関わっていることがはっきり理解できるエキサイティングな結果で、これまでのもやもやが吹っ飛んで、頭がすっきり整理できた気になる。正直言ってこのような理解の仕方ができるようになってきたのはほんの数年前からだ。TADを単位として考える重要性を本当に認識したのは、2013年に引退後、同時に同じ細胞で進む前腕及び手指を形成するための2種類のプログラムに、なぜ同じHoxDクラスターが使えるのかを示したスイスのDubouleたちの見事な研究に驚いた時で、たかだか2年前だ。ゲノム解析が進み、ゲノムワイドな手法が開発されることで、急速にこの分野の理解が進んでいることを実感している。構造も塩基配列と同じようにゲノムが表現する情報の一つなら、発生学は言うに及ばず、iPSやその応用でさえこのレベルの理解なしに可能なはずはない。このホームページは多くの若手の学徒にも読んでもらっているようだが、もしTADなど考えたことがないという人たちがいるなら、今からでも遅くない。是非ゲノムが構造化されていることを頭に入れて、発生や進化を考えていって欲しいと思う。
2015年6月2日
プロビオティックスというと、私たちの体を助けてくれる微生物のことだが、一般的には発酵食品やヨーグルトなどに含まれる微生物を思い浮かべる。例えば「プロビオで腸内細菌のバランスを整え健康な生活を送ろう」といった具合だ。事実トクホや機能性食品の認可のハードルを低くして健康産業を育てるのがアベノミクスの一つの柱のようだ。税金が必要な健康保険や介護保険の費用を、健康寿命を伸ばして減らすというアイデアは当然だが、今の政府のやり方を見ていると、トクホや機能性食品が乱立し、健康食品の売り上げだけが伸びただけで、肝心の健康寿命が全く伸びないという事態になる心配がある。トクホや機能性食品が本当に健康寿命を伸ばし、医療費削減につながるのか検証することが先決だと思う。ぼやきはこのぐらいにして、プロビオティックスに戻ると、世の中にはずっと先を考えて微生物を使おうとしている人たちがいる。今日紹介するマサチューセッツ工科大学からの論文はなんと微生物をガン転移の早期発見に使う研究で5月28日号のScience Translational Medicineに掲載された。タイトルは「Programmable probiotics for detection of cancer in urine (ガン患者さんの尿でガンの早期発見のためのプログラムを組み込んだプロビオティックス)」だ。普通体内の臓器は無菌的だと思っているが、様々なルートで細菌は各臓器に広がる力を持っている。この研究は経口投与後肝臓に侵入する細菌を用いて、肝臓内に存在するガン細胞を検出するのが目的だ。まず経口摂取して肝臓に広がっても無毒な細菌を確立し、それが確かに肝臓に到達し増殖することを確認している。次に、この細菌にガンが分泌する器質を切断する酵素を組み込む。この酵素により、ガンが分泌する特定の分子を切断し、その断片の中で尿中に出てきた成分を標識としてガンの存在を検出するというアイデアだ。この酵素を一定量発現したときだけ生きるように細工を加えた細菌を作成し、これを肝臓にガン転移が起こったマウスに摂取させ、まず組織学的に調べている。詳しいメカニズムはまだわからないと思うが、この細菌の増殖は転移巣でより亢進しており、うってつけの運び屋になっている。そして最後に、基質を発現するガン転移を起こしたマウスと、正常マウスの尿に分泌される標識分子を調べ、期待通り転移巣がある場合にのみ尿に特定のマーカーが検出されることを示している。もちろんこの論文はまだ微生物を転移ガンの早期発見に使えるというアイデアが実現可能であることを示したモデル実験でしかない。また、早期発見だけで言えば他の方法が結局優れているという結果に終わることは十分あり得る。しかし、健康診断の2−3日前にこの微生物の入ったヨーグルトを食べておいて、検診の時に尿だけでガンが診断できるなら、十分他の方法と競合できるだろう。何よりもこの先に、転移巣選択的な治療につながる可能性もある。このようにプロビオティックスが本当に健康な人を増やすことを示すためには、優れたアイデアと、長期的視野、そして科学的検証が必要だ。繰り返すが、我が国がトクホが栄えて、病気の高齢者も増える国になることだけは避けなければならない。
2015年6月1日
研修医の頃、胸水で見つかった進行性の卵巣癌の患者さんを受け持ったことがある。心嚢炎まで併発して、次々と起こる症状への対応に精一杯で何もできないうちに亡くなった。もちろん当時はガン発生のプロセスも、遺伝子のことも何もわからなかった時代だ。このガンに対しては早期発見と外科手術以外に医学はなすすべもなかった。しかし今日紹介するオーストラリア・クイーンズランド大学を中心にしたコンソーシアムからの論文は、あれから40年たってガンのことが理解できても、進行性の卵巣癌の治療が簡単ではないことを示す研究で、Natureオンライン版に紹介された。タイトルは「Whole-genome characterization of chemoresistant ovarian cancer(化学療法抵抗性の卵巣癌の全ゲノム解析)」だ。この研究の対象は卵巣癌のうち悪性漿液性癌と呼ばれるタイプの癌で、化学療法に抵抗性を示した癌114サンプルの全ゲノムを解析し、正常組織と比べた研究だ。これまで、翻訳される部分を調べたエクソームに関する研究は論文があるが、全ゲノムを徹底的に解析したのはこの論文が最初のようだ。いつものことだがゲノム研究の論文のデータは膨大で、詳細を紹介するのは難しい。従って幾つかの点について要約する。まず、他の癌と比べた時、この癌では細胞の増殖を促進する遺伝子を特定しにくいことが知られていたが、全ゲノムレベルの解析をしてもこの状況はからわらず、ほとんどのサンプルで検出可能なのはp53の変異だけと言える。ただ、全ゲノムを調べることで遺伝子発現調節領域の異常が特定できるおかげで、NF1やRB1といった癌抑制遺伝子の発現異常は2割ぐらいの患者さんに見られ、この癌では様々な癌抑制機構が無力化されていることもわかる。重要なことは、他の癌と比べると遺伝子変異の量は圧倒的に多く、この変異の種類を調べると、BRCAを中心にした相同組み替えに関わる遺伝子異常が原因で起こってくるタイプの変異であることがわかる。すなわち、BRCAをはじめ様々な相同組み替え分子異常が最初に起こり、その結果多くの変異が癌でランダムに起こっていくことが発がんの最初の引き金になっている可能性が高い。実際、ほとんどの癌ではp53と共に、BRCA遺伝子か他の相同組み替え機構に関わる遺伝子に変異が認められる。次に、ゲノム解析結果から癌の予後をどの程度予測できるか調べ、サイクリンE遺伝子が増幅しているケースでは化学療法がほとんど効かないこと、逆にBRCA変異がある場合は化学療法への反応性が高いことがわかる。ゲノムの不安定性を増して発がんの原因になるBRCA遺伝子の変異が、予後にとっては良いサインであることは重要だ。修復機構は癌の生存にも必要なため、化学療法の効果が大きいのだろう。一般抗がん剤だけでなく、最近BRCA変異があるとPARPと呼ばれるDNA修復酵素依存性が高く、この分子を阻害剤する薬剤が使われるようになった。このように、BRCAは発がんの誘引だが、癌の弱点として治療選択肢を増やしてくれることがこの研究でも確認された。ただ転移したガンを調べると、BRCA変異が元に戻って、薬剤に反応しなくなる細胞が発生する。他にも薬剤を細胞外へ汲み出す分子の発現亢進など、がん細胞が生きるための様々な機構を短い期間に獲得する、融通無碍の癌がこのタイプの癌であることがよくわかった。まとめると、相同性組み替えを使う修復機構の異常から始まり、ゲノム全体で変異を急速に積み重ねることがこの癌の特徴で、最初から極めて多様で、ガンとしての共通の特徴が見つけにくい。この結果、適合する標的薬を見つけることは現在のところ難しい。ただ救いもある。変異が多いということは、ガン特異的抗原を発見するチャンスが多いということだ。また、BRCA変異を持つガンでは、腫瘍部位へのリンパ球浸潤が見られる。このガンの最初の引き金がゲノム修復異常なら、免疫療法は効くチャンスが高い。実際、このタイプのガンに抗PD1抗体が著効を示したケースも報告されている。ガンのエクソームとチェックポイント阻害を組み合わせた治療法をぜひ開発して欲しいと願う。
2015年5月31日
過去の経験に固執せず様々な分野の研究論文を読もうと心がけているが、自然と苦手分野が出来てくる。その中の一つが、連続的な神経活動記録と行動の相関を調べる研究だ。もともと現役の頃ほとんど読むことがなかったのと、多くの神経細胞を同時に記録してその活動を行動に投影するという膨大な処理がされており、示された実際のデータも理解しずらい図が多いため、どうしても想像を交えながらメッセージを切り取るしかない。今日紹介するのはこの典型で、昨年ノーベル賞を受賞したモザー夫妻の研究室からだが、間違った理解をしているかもしれないと最初から断ったほうがよさそうだ。筆頭著者はItoさんとあるので日系の人だろう。どうでもいいことだが、つい目がいく。タイトルは「A prefrontal-thalamo-hippocampal circuit for goal-directed spatial navigation (ゴールをめざす移動をナビゲートするための前頭前部—視床—海馬回路)」で、Natureオンライン版に掲載されている。年をとると、何か行動を起こした後、何のために起こしたのか忘れてしまって途方にくれることがある(私だけかもしれないが)。逆に言うと、行動とは何か目的や意図があるのが普通で、意図と現在の行動の相関が外れるとどうしても不安にかられる。言うまでもなくモザー夫妻は脳の中の位置や経路をマップする神経回路を研究してノーベル賞に輝いた。この研究では、迷路を走るラットが分かれ道で右か左か決める時、これから選ぶ経路が脳内にどのように表現されているのかを調べている。前向きにしか進めない経路の途中に分かれ道があり、例えば右に行けば褒美が得られ、その後またスタートラインに戻るような設計の迷路を作り繰り返させる。次の選択の経路が脳内に前もって表現されているなら、分かれ道に差し掛かる前から、次に選ぶ経路を想像して活性化する脳神経が存在するはずで、それを調べている。実際には、記憶を始め様々な情報が統合される海馬のここの神経細胞を50−100個同時、連続的に記録し、次の経路を反映する神経が海馬のCA1と呼ばれる場所にあることを突き止める。面白いのは、これらの神経が最も興奮するのは、どちらに行くかを決めなければならない分かれ道のすぐ手前だ。次にCA1に結合している視床の結合核細胞を同じように記録すると、やはり選んだ経路と反応が相関する細胞を記録できる。この時の興奮は割と早めから始まり、経路を選んだ後褒美をもらうところまで続く。視床は前頭前部と神経結合があるので、今度は300以上の神経細胞を同時記録すると、期待通り選んだ経路に相関する神経細胞が記録できる。この神経細胞は視床と同じで分かれ道のかなり手前から興奮し始め、選んだ後も興奮が続く。回路の支配関係を調べるため、視床結合核を取り除いたり、興奮を抑えると分かれ道手前で起こる海馬の興奮は抑えられ、海馬がCA1の反応を変化させていることがわかる。この実験では繰り返し同じ経路をグルグル回ることになるので、前のトライアルの記憶をこれらの神経が表現している可能性がある。これを否定するため、次のトライアルに入る前にスタートラインに戻ってきたところで時間をおいてすぐ前の記憶を消すと、それぞれの経路表象に関わる神経は分かれ道に近づくにつれ興奮が上昇することを確認し、この可能性を否定している。結論的には、前頭前部、視床、海馬と行くべき経路の予想図が受け渡され、海馬で他の地図情報と統合されるというシナリオのようだ。多くの神経の同時連続記録、光遺伝学による神経興奮操作などを駆使した研究が動物行動学を変化させていることを実感する研究だ。まだまだ理解しずらいところも多いが、生命とは何か、生命の情報とは何かを考えるためには脳研究から目が離せないことを実感している。今後も苦手を厭わず手にとって読む、これが重要だろう。
2015年5月30日
今日5月30日は日本IDDMネットワークが創立20周年のサイエンスフォーラムを開催される日だ(http://japan-iddm.net/sympo_aichi_2015/)。なんども紹介したが、日本IDDMネットワークは認定NPO法人で、寄付に対する税制優遇措置を受けることができる数少ない患者さんの団体の一つだ。活動を見ていると、間違いなく今後も発展が続くと確信する。アメリカのJDRFと比べて、おそらく次の一手として考えられるのは、ネットワーク自体が自前の科学諮問会議をもって、運動方向などに利用することではないかと思う。大いに期待している。論文ウォッチでもエールを送る意味で、この分野の面白い論文がないか目を光らせていたところ、イタリア・ミラノ大学から抑制性T細胞を用いて1型糖尿病を治療する可能性についての論文がScience Translational Medicineに掲載された。まだまだモデル研究段階で、患者さんを混乱させる懸念もあるのだが紹介することにした。タイトルは「Insulin B chain 9-23 gene transfer to hepatocytes protects from type 1 diabetes by inducing Ag-specific FoxP3+Treg.(肝細胞へ直接インシュリンB鎖の9−23ペプチド遺伝子を導入することでFoxP3+Tregを誘導し1型糖尿病を防げる)」だ。1型糖尿病のほとんどは自己免疫疾患で、自己β細胞に対する免疫反応が誘導されるために起こる。ただ、β細胞に対するキラーT細胞が誘導されていても、多くの患者さんは発症までに時間がかかる。これは、キラーT細胞の反応を抑える抑制性T細胞が誘導されているからと考えられている。ただ、何かの原因でこのバランスがキラーに傾くと、β細胞が殺され病気が発症する。従って、免疫システムのコントロールはこの疾患研究の重要なテーマで、この研究ももちろんJDRFのイノベーション助成を受けている。言ってみれば、患者さんに選ばれた研究の一つだ。多くの方はご存じないと思うが、イタリアは遺伝子治療研究が進んでいる国の一つだ。この研究では、1型糖尿病モデルマウスの自己抗原として特定されているインシュリンB鎖ペプチド遺伝子をビールスベクターにつないで肝細胞だけに発現させることで、抑制性T細胞を選択的に誘導して、免疫反応のバランスを変えることができるのではないかというアイデアを検証している。詳細を省いて結果だけを述べると、1)肝臓特異的ベクターを用いて遺伝子を導入した時だけ糖尿病の発症を止めることができる、2)この発症抑制は抗原特異的抑制性T細胞が誘導されたからで、この細胞を糖尿病マウスに移植すると発症を遅らせることができる、3)発症が始まったマウスも、低い濃度の抗CD3抗体と同じ遺伝子の導入で病気を直すことができる、ことが示されている。3番目の結果は、発症が始まってもβ細胞があるうちは治療できる可能性を示した重要な結果だ。肝臓細胞に提示される抗原は抑制性T細胞が誘導されやすいことから着想した概念が証明された研究だと言える。もちろん患者さんにしてみれば、まずレトロビールスで肝臓に遺伝子を導入することが安全か、なんらかのきっかけでキラー側にバランスが傾かないかなど、まだまだハードルの高い治療法だと思う。しかし、予防と発症防止が1型糖尿病の患者さんのまず第一の目標であることを考えると、学ぶところの多い研究だと思う。幸い、この抑制性T細胞は現在阪大にいる坂口志文さんが発見し、今も世界をリードする研究を続け、最近ガードナー賞に輝いている。この日本の研究伝統を少し借りればもっとハードルの低い治療法開発も可能かもしれない。是非一度坂口さんにそのへんを聞いてみたいと思った。
日本IDDMネットワーク20周年おめでとう。今後もできる限りの協力をしたいと思います。
2015年5月29日
片方の腎臓を手術で除去すると、もう片方が代償的に肥大することは私も習ったし、実際には100年以上前から知られていたようだ。実験的研究も盛んに行われたようで、腎切除した動物を2匹用意し、それぞれ腎切除により片方の腎臓を肥大させた後、肥大した腎臓をもう一匹に移植するといった凝った実験まで行われ、ドナーの腎臓も、ホストの腎臓も共に小さくなるという結果が報告されている。すなわち、左右の腎臓は直接つながっていなくても、互いのコミュニケーションをとっており、互いの大きさを一定に保っている。残念ながら、この不思議な現象のメカニズム、特に何が両方の腎臓のコミュニケーションの媒体になっているのかなどは、謎のまま現在に至っている。今日紹介するジョージア医大からの論文はこの1世紀にわたる謎が解けたと主張する論文で、Journal of Clinical Investigation5月27日号に掲載された。タイトルは「Phosphatidylinositol 3 kinase signaling determines kidney size(フォスファチジルイノシトール3キナーゼ(PI3K)シグナルが腎臓のサイズを決める)」だ。この研究の発端はPTENと呼ばれるシグナル分子を腎臓の尿細管で欠損させたマウスの腎臓が肥大しているという結果から始まっている。この結果は、細胞のシグナル伝達に詳しい人なら、「なるほどな」と納得するはずだ。PTENは様々なシグナル伝達経路と関わる重要な分子で、細胞増殖を抑制してガンを抑える働きがあり、研究も進んでいる。実際、マウスの尿細管細胞特異的に緩やかな増殖亢進が起こる結果腎肥大が起こるが、ガンにはならない。このシグナルをたどっていくと、PTENが抑制的に働く最もオーソドックスな経路、チロシンキナーゼ受容体からフォスフォイノシトールのリン酸化を経てAKT分子の活性化する経路を抑制している。なぜこの抑制が腎肥大を誘導するかについては、mTOR分子を介したタンパク合成など代謝を上昇させるためと考えている。次に、PTENを欠損したマウスで、腎切除後残った腎臓肥大にどのような影響が出るか調べたところ、肥大はさらに進むが、このシグナル自体にはPTENが直接関わらないという結果を得ている。事実PTENだけを欠損させた場合と異なり、腎切除による肥大では糸球体の肥大も誘導される。もともと調べたいPTENとは関係なかったものの、細胞を増殖させる最終のエフェクター分子がわかっていることから、腎切除がどのような信号をもう一方の腎臓に送るのかを追求し、腎血流が上昇することで残った腎臓に多くのアミノ酸が提供され、これがPI3Kの異なるシグナル経路を通して最終エフェクターmTOR活性化を誘導することを示している。実際、腎切除により残った腎臓には2倍以上のアミノ酸が入っており、シグナルの活性化も示され現象的には一応納得できる。気になるのはPTENとは無関係なら、このシナリオで普通のマウスで起こる腎肥大を止められるか調べられていない点だ。というのも、これまで100年も放置された課題だ。一旦解決したと皆が思うと、次の100年誰も手をつけなくなる恐れがある。とはいえ、私自身は半分以上納得した。
2015年5月28日
言うまでもなく、膵臓癌の予後を決めているのはその転移性だ。膵臓癌で亡くなった私の友人たちも、発見されたときにはリンパ節は言うに及ばず、多くが肝臓転移を伴っていた。原発巣が小さいときから転移が早い癌の転移メカニズム研究には、できるだけヒトに近い動物モデルが必要だ。膵臓癌については、膵臓だけにヒトと同じ様々な発がんに関わる変異を導入したマウスが存在する。今日紹介するフレッド・ハッチンソン癌研究センターからの論文は、このモデルを使って転移しやすい膵臓癌のバイオマーカーを探索した研究で、6月4日号のCellに掲載された。タイトルは「Runx3 controls a metastatic switch in pancreastic ductal adenocarcinoma (Runx3は膵管腺癌の転移性スイッチをコントロールする)」だ。研究自体は地道な積み重ね型研究で、驚くようなアイデアがあるわけではない。ただ、実際の膵臓癌を常に念頭に置いて研究を進めていることがよくわかる研究だ。研究ではヒトの膵臓癌に見られる様々な遺伝子変異を導入し、転移を早める遺伝子変化を探索し、Dpc/smad4遺伝子が片方の染色体で欠損したとき転移性が上昇することを突き止める。この変化がヒトのガンでも見られることを確認し、次にDpc変異の影響がどの分子を介して転移性の変化につながるのか調べ、Runx3と呼ばれるruntドメインを持った転写因子が転移性を調節していることを突き止める。マウスモデル、ヒトの膵臓癌のRunx3の発現を変化させこの分子発現の影響を調べると、転移性が上昇るす一方、発現自体は細胞増殖を抑える方向に働くことがわかる。この結果から、膵臓癌発がん過程でp53遺伝子に変異が入るとRunx3が上昇し細胞の増殖を抑える方向に働くが、これが同時に転移性を上昇させる細胞変化を誘導し、原発巣が小さくても転移性が高くなるという結論を導いている。最後にこの仮説に立って人間の膵臓癌を調べたところ、Runx3が高いガンでは50%生存率で約1年の差があることを示している。この研究ではさらに進んで、化学療法と、局所放射線照射の併用療法の効果を調べ、Runx3の低いガンは、併用により高い効果が得られることを示したうえで、Runx3,DPC4をバイオマーカーとして用いることで、手術、放射線、化学療法の組み合わせを選択できる可能性を示している。これまでプレシジョンメディシンについては個人用の治療ばかりを紹介してきたが、このようにモデル研究と臨床例を丹念に対応させることで、それぞれのガンに合わせた治療を設計することが可能であることがよくわかる。その意味で、目的のはっきりした好感の持てる研究だ。もちろん、次はこの仮説を実際に治療に生かしたとき、もっと多くの膵臓癌の患者さんが助かるかどうか、臨床側で調べる番だ。期待したい。
2015年5月27日
このホームページでなんども紹介したように、ガンはゲノムに蓄積する様々な変異の結果発生する。ガンのゲノムを正常と比べられるようになった今、このことはますます明確になってきた。喫煙者に肺ガンが多いのは、喫煙がゲノム変異の蓄積を促進するためで、肺ガンのゲノムを喫煙者、非喫煙者で比べると、変異の数は喫煙者のガンの方が何倍も多い。従ってガンになる前、正常と思っている細胞にも既に多くの変異が積み重なっているだろうと予想されている。ただ、生きている人からそれを調べるためにバイオプシーをすることは簡単ではない。今日紹介する英国・サンガー研究所からの論文はこれを調べるための格好の機会を見つけ正常組織のゲノム変異を調べた研究で5月22日Scienceに掲載された。タイトルは「High burden and pervasive positive selection of somatic mutation in normal human skin(ヒトの正常皮膚細胞では既に多くの体細胞突然変異が存在し、それにより増殖性細胞の選択が蔓延している)」だ。この研究では生きたヒトのまぶたの皮膚を調べている。瞼のバイオプシーとはなんと残酷なと思われるかもしれないが、まさにこれが格好の機会だ。私もその傾向があるが、歳をとると瞼の張りがなくなり目にかぶさる眼瞼下垂が起こりやすい。この治療として瞼を切除するblepharoplasty(眼瞼形成術)が行われる。この切除した瞼の皮膚の様々な場所から細胞を取り出し、ゲノムを調べたのがこの研究だ。234箇所からバイオプシーを行い、全体で3760箇所の体細胞突然変異を発見している。詳しくは述べないが、こうして特定された多くの突然変異の原因が紫外線であること、加えて皮膚の修復による活発な転写を原因になっていることが、突然変異を解析することでわかる。しかし何よりも驚くのは、調べた4人の皮膚で、発ガンに関わるとして知られている6種類の突然変異が高い頻度で見られている。原理的には紫外線による突然変異は全ての遺伝子にランダムに起こるはずで、特定の遺伝子に起こった変異が高い頻度で見られるというの結果は正常皮膚で突然変異を起こした細胞が既に異常増殖を始めていることを示している。中でもNOTCHと呼ばれる遺伝子の変異は全ての人で観察されている。また、見つかった変異を実際のガンと比べると、これまでガンの原因として考えられてきた突然変異がほとんど揃っている。ただ、PITCと呼ばれる遺伝子のようにガンでだけ変異が見つかる遺伝子もあるので、発ガン過程を完全に理解するためには重要な情報になる。最後に今回正常組織に特定できた突然変異の頻度から、眼瞼という小さな領域で起こっているイベントを次のように描いている。まず順番はわからないが、FGF3,p53,ARID1Aに変異が起こった細胞が他の細胞より少し早い増殖を繰り返し、5ミリ平米ぐらいの大きさになった時点で、Notchを含む次の変異の蓄積が始まり、クローンの多様性が生まれるというシナリオだ。要するに、正常時から細胞の一種の異常増殖が進んでいるという恐ろしい結果だ。しかしそれでもそう簡単にガンが起こっていないことが面白い。これほどの変異が蓄積しても、さらなる決定打がガンになるために必要なことがわかる。これが何か?PTCH遺伝子なのか?その先にガンの予防や早期発見が期待できる。
2015年5月26日
1990年ドイツ再統一直後、統合された地域が東独時代の雰囲気を残す間に見ておこうと旧東独を旅行した。その時訪れたシューマンの生まれた町ツヴィッカウで、ドイツでは人気があるとはいえほとんど聴くチャンスのないイエッセルのオペレッタ「Die Schwarzwaldmädel(黒い森の乙女)」を聴くことができた。統一後とはいえ、まだまだ東側の生活が残っており、小さな町の劇場を使って、なんと旅回りのオペラ一座がこの演目を上演していた。演奏のレベルから考えても、いつかはこのような一座は消えていくのだろうなと感慨深く聴いた思い出がある。今日紹介するデンマーク国立博物館が5月21日号のScientific Reportsに発表した論文も黒い森の少女の話で、今から3500年ほど前、ドイツ黒い森とデンマークの間にすでに活発な人的交流があったという研究だ。もちろんオペレッタの個人的思い出とは無関係だが、私も黒い森の少女というだけでここまで連想するようになると、かなり耄碌してきたかもしれない。論文のタイトルは「Tracing the dynamic life story of a bronze age femail(青銅器時代の女性のダイナミックな生活を追跡する)」だ。私は知らなかったのだが、1920年、デンマークユトランド半島のEgtvedで極めて良い保存状態で少女のミイラが発見された。樫のお棺に埋葬された今から3000−3500年前の少女のミイラはEgtved girlとしてデンマークでは有名らしい。埋葬品や方法から、当時の有力者の家族と考えられていたが、この研究ではこの少女の身体、及び着衣などのストロンチウム87と86の比を調べ、この少女の出身地を調べている。ストロンチウム同位元素比は、地域の地質を反映しており、またそのまま体内に植物を通して摂取されるので、この少女がヨーロッパのどこで育ったかなどがわかる。また、爪や髪の毛のように常に成長している組織では、いつ頃どこにいたのかを推定することができる。結果をまとめると、1)この少女自身の組織、及び埋葬時に着せられていた着衣はEgtvedで作られたものではなく、南ドイツ黒い森近くの地質に似ている、2)着衣の飾りとして使われている牛の尾はEgtved産と考えられる、3)髪の毛や爪を成長時期で分けて調べると、この少女は黒い森で生まれ、Egtvedにおそらく嫁いできて、埋葬される1年半までには一度南ドイツに帰っている。DNAも調べているが、埋葬されていた酸性の土壌のせいで、ルーツを確かめるまでには至らなかったという結果だ。Egtvedと黒い森は1000kmほど離れているが、この結果は、3000年以上前の青銅器時代にはすでに、有力者同士の結婚が行われるほど両地域の密接な交流があり、またこのような少女でも1000km離れた実家に帰郷できるほど道が確保できていたことがわかる。気になってネットでドイツのメディアを調べてみたが、案の定各紙が大きく取り上げていた。論文を詳しく読むと、この同位元素比から黒い森が特定できるわけではなく、南ドイツの広い範囲が候補として考えられる。わざわざ黒い森の少女と名付けたのは、イエッセルのオペレッタが著者の頭にもあって受けを狙ったのかもしれない。




