2019年8月25日
今日選んだカナダ血液センターからの論文は、かなり個人的感慨によるもので、論文としてはそれほどではないことを断っておく。
ドイツ留学前後から、基礎研究を目指して当時胸部疾患研究所の細菌血清学部門の桂先生の研究室で研究を始めた。自由に研究ができる雰囲気で、この時からリンパ球の発生を研究することができた。当時桂研ではモノクローナル抗体の作成を重要な手段としていたが、その中で助手の喜納さんが樹立したモノクローナル抗体がTer119で、現在も世界中でマウスの赤血球分化決定マーカーとして広く使われている。
このTer119を注射するだけで自己免疫性の炎症を抑制できるというのが今日紹介する論文で、8月21日号のScience Translational Medicineに掲載された。タイトルは「Treating murine inflammatory diseases with an anti-erythrocyte antibody (マウスの炎症性疾患を抗赤血球抗体で治療する)」だ。
私は全く知らなかったが、突発性の血小板減少症に赤血球のD抗原に対する抗体を投与する治療法があるそうだ。他にも、大量の免疫グロブリンを投与してFcをブロックすることも行われている。この研究では、このモデルとして、喜納さんが作ったTer119を試してみたようだ。
赤血球の前駆細胞から全ての持つglycophorinA随伴タンパク質を認識しているので、この抗体を注射すると当然赤血球に結合して貧血が起こる。実際、抗体投与後3日目には赤血球が半分になる。従って、実際の治療に用いるとした時問題になることは間違いない。しかし、この副作用とともに、マウスの自己免疫性血小板減少の血小板をほぼ3倍近くに回復させられる。
これだけではなく、T細胞受容体を操作した自己免疫性リュウマチモデル、コラーゲンに対する抗体を用いたリュウマチモデルなどいくつかの自己免疫性炎症モデルを、急性効果ではあるが見事に改善する。
ここまでがこの研究のハイライトで、副作用はあるかもしれないが、一回投与でなんとか症状を改善させるときに免疫抑制剤と併用することができるという点では大事なモデルといえる。
しかし、そのメカニズムについて探索しているが、Fc受容体を介しているらしいこと(Ter119のFc部分の糖鎖が必須)、輸血による致死的なTRALIにも効果があることから、抗体が関与する自己免疫性炎症に効果があること、ケモカインの分泌を高めて炎症細胞の浸潤を低下させること、など現象論に終始し、最終的になぜ効果があるかについて決定的な結果は示されていなかった。
その意味ではフラストレーションの残る研究だが、ドイツから帰ってきた頃を懐かしく思い出すことができ論文だった。折しも、昨日難病連関西支部の集会に呼ばれたとき、一緒に桂研の最後の頃のスタッフ河本さんと一緒に話をした。桂研の話で盛り上がったが、この出会いを覚えておく意味で、この論文を紹介することにした。皆さんごめんなさい。
2019年8月25日
自閉症スペクトラム(ASD)は、極めて複雑で人間ならではの状態で、だからこそ神経多様性として捉えられようとしている。しかし、ASD研究、特に薬剤の開発や脳機能の解析研究には動物モデルが欠かせない。もちろんこの様な複雑な神経多様性を動物で再現するのはむずかしいため、遺伝的原因で発症するASDと同じ遺伝子を改変した動物を用い、人と動物モデルで共通に見られる症状を探し出して、研究を行なっているのが現状だ。
動物モデルを作る時重要なのは、神経機能に直接関わる分子、例えばシナプスの神経伝達に関わる分子の変異を利用することだ。これにより、比較的単純な(それでも超複雑なのだが)経路に絞ってASDの症状との関係を研究することができる。この様なタイプの変異で比較的頻度が高いのがグルタミン酸受容体が形成される時の基質となるSHANK3遺伝子が片方の染色体で機能を失う変異で、Phelan-McDermid症候群と呼ばれている。自閉症様症状だけでなく、筋力低下、睡眠障害、様々な程度の知能発達障害を示すが、同じ様な症状は多くの遺伝性発達障害でもみられる。
自閉症スペクトラム(ASD)全体から見ると、遺伝的な発達障害は一部に過ぎないが、原因となる機能分子がわかっているという意味で、遺伝的ASDは疾患メカニズムの研究に欠かせない。しかしほとんどのモデル動物は遺伝子改変がしやすいネズミでとどまっていた。たしかにSHANK3欠損マウスは社会性や学習異常を示すが、しかし人間と異なりヘテロではほとんど症状がないため、もっとヒトに近いモデル動物が求められていた。
昨年、クリスパー遺伝子操作を行ったクリスパー遺伝子操作受精卵を移植、出産させたとして中国の研究が一躍注目を浴びたが、これからもわかる様に中国はこの技術の利用の幅広さでは世界一といってもいい。
そしてついに、深セン市先端科学研究所の研究グループはSHANK3遺伝子変異サルを作成し、よりヒトに近い自閉症モデルとして使えることを示して先月Natureに発表した(Zhou et al, Atypical behaviour
and connectivity in SHANK3-mutant macaques(SHANK3変異を持つカニクイザルは非典型的行動と神経結合の異常を示す)Nature 570, 326,2019)。
この研究では受精卵のSHANK3遺伝子のエクソン21にCRISPR/Cas9を用いて機能欠損変異を導入し、最終的に5匹のSHANK3変異サルを得ている。それぞれゲノムレベルで起こっている変異は多様で、2匹は異なる変異をもつ2本の染色体が集まる複合ホモ接合体になっていた(あまり言葉を気にする必要はなくようするに遺伝子機能が完全に欠損したサルと考えればいい)。さらに、2匹のサルから精子を採取し、同じ様にSHANK3変異のヘテロ個体を繰り返して作れることも示している。すなわち、金はかかるが、ASHNK3モデルサルを欲しいだけ作れる体制が整った。
さて、症状だが、個体ごとにみられる多様な症状と、全ての個体で共通に存在する症状がある。例えば活動性は全ての個体で低下しており、睡眠障害、特に寝るまでに時間がかかる点は共通している。
社会性を様々な指標で調べると、サルになると正常でもかなり多様な行動を示す。しかし変異サルになると、全ての検査項目で一様に社会性が低下することがわかった。
また筋肉の低緊張もヒトと同じで一様にみられることから、ヒトのPhelan-McDermid症候群にかなり近いと結論できる。
サルでのモデルを用いると、マウスではほとんど不可能な視線を追いかける実験も行える。この結果、視線が落ち着かないという特徴が一様に存在することがわかった。同じ様な症状はASDでは一般的に指摘されているが、SHANK3変異によるASDでは調べられていないので、ヒトでも調べる必要があるだろう。
最後にテンソルMRIで各領域間の結合性を調べ、感情やモチベーションに関わる領域と前頭葉や運動野との結合が低下していることを示している。一方、やはりヒトで指摘されている様に、各領域の内部での神経結合性は高まっている。
以上が結果で、まだ始まったばかりだが、ヒトの症例をかなり反映したモデルができたと言えるだろう。また、サルで初めて見つかる症状も存在することから、今後詳しい解析が進めばそのままヒトの症例へフィードバックできる可能性がある。
なかでも最も期待されるのが、発達過程の解析、そして薬剤などによる介入実験だ。例えば以前紹介した様に 、マウスSHANK3変異を用いた研究でロイテリ菌が社会性を改善させる効果を持つことが示されている。ぜひ、サルを用いて組織レベルの変化まで詳しく調べ、新しい介入法の開発につなげて欲しい。
2019年8月25日
脆弱性X症候群
脆弱X症候群(Fragile X症候群:FXS)とは舌をかみそうな名前で、名前を見ただけでは何のことかわからないと思うが、我が国の難病情報センターのサイトによると少なくとも5000人(遺伝子検査を行えばおそらくもっと多くの)患者さんがおられる。様々な身体症状が認められるが、最も重要なのが知能障害と自閉症で、まだ完全に機能がわからないFMR1遺伝子の機能が低下することにより発送する遺伝病だ。
遺伝子変異の分子生物学的解析は進んでおり、遺伝子内に存在するCGGと塩基が繰り返す配列の数が増加することで、遺伝子の機能が失われることで起こる。このような3塩基リピート病の多くは、沈殿しやすいタンパク質ができて細胞が変性することが多いが、FXSの場合は、遺伝子内のCGGリピート配列がメチル化されて遺伝子の転写が抑えられることが原因であることがわかっている。
私のブログで紹介したように 、一旦できたメチル化を遺伝子治療ではずすことでFXSを治すことができる。すなわち、遺伝子治療による根本治療の可能性が示されている。
一般治療薬による脳神経ネットワークへの介入
このような遺伝子治療は将来の切り札にはなっても、まだまだ開発に時間がかかる。そこで、FMR1遺伝子欠損で症状が出るプロセスを解析して、FMR1欠損の影響を受けて変化している様々な治療標的を探す試みも行われ、現在多くの薬剤が治験段階にある。その中の一つが、高脂血症に用いられるロバスタチンで、マウスモデルでシナプスの変化を正常化できることがわかり、現在8歳から55歳までのFXSの治験が進んでいる。
しかしFXSが3歳ぐらいから発症することを考えると、できるだけ早い時点で治療を行ってみたいと思うのは当然だ。とはいえ、発達期の子供の薬物治療はハードルが高く、治験を始めるには動物を用いたしっかりした前臨床研究が必要になる。
今日紹介するエジンバラ大学からの論文は高脂血症の治療に使われるロバスタチンを、脳の発達が進む早い時期に投与すれば、根本的な治療が可能になる可能性を示したラットを用いた前臨床研究でScience Translational Medicineに掲載された(Asiminas
et al, Sustained correction of associative learning deficits after brief, early
treatment in a rat model of Fragile X Syndrome (ラットFXSモデルを早い時期に短期に治療することで連合学習を長期にわたって正常化できる), Science Translational Medicine 11:eaao0498, 2019)。
FXSは通常3歳ぐらいで知能異常や自閉症が発見される。したがって動物モデルで実験するとき(この研究ではラット)、生後4週ぐらいで完成する行動を特定し、その機能に対する薬剤の効果を調べる必要がある。この研究ではラットで生後4-6週から発達してくる連合記憶機能(複数の感覚入力を連合させて初めて成立する、場所と対象認識機能(例えばどこでその獲物に出会った)や、場所と文脈を組み合わせた対象の認識機能(どこでどんな時に出会った)などの学習機能を指す)が、FXSモデルラットでは選択的に抑えられることを確認する。
つぎに、ロバスタチンを生後5週目から餌に混ぜて投与し連合学習能を調べると、ほぼ完全に回復していることを確認する。しかも、こうして正常化した機能は、ロバスタチンをやめた後も長く維持される。
さらにロバスタチン投与したラットの脳の生理機能についても調べ、ロバスタチンがFXSで認められる海馬のタンパク質合成の上昇をおさえ、前頭前皮質の興奮の長期増強の異常を正常化できることも示している。
結果はこれだけだが、ロバスタチンという既存薬を発達期に投与することで、遺伝的欠損があっても神経ネットワークを長期間回復させられる可能性を示した重要な貢献だと思う。
同じように、FXSではロバスタチン以外にも、メトフォルミン、アルバコルフェンなど異なるメカニズムの薬剤の治験が進んでいる。すなわち遺伝子変異があっても、既存薬で治療できる可能性がある。
個人的意見だが、安全性が確認された薬剤については、発達期の子供で慎重に治験を進めてもいい時期に来たように思う。治験を進めるための条件について早期に議論されることを期待する。というのも、FXSでの経験は、他の原因による自閉症や知能障害の既存薬剤による早期介入治療の開発に直接つながる可能性は大きく、期待は大きい。
2019年8月25日
自閉症スペクトラム(ASD)治療薬の可能性が示された
このブログでも、ASDの症状を軽減する薬剤、例えばオキシトシンについて紹介してきた。他にも、自閉症様症状を示す遺伝病では、さまざまな薬剤の臨床治験が進んでいる。しかし、米国のFDAが認可したASD治療薬はまだ存在しない。ところが先週、ASDの幾つかの症状が改善することを示した科学的な手法に基づく臨床治験論文がScience
Translational Medicineに相次いで発表された。FDAもこの結果に注目して、特別に審査することを決めたほどの重要な展開だと思うので、緊急に紹介することを決めた。ただ、論文を読んでみると、背景にあるメカニズムについてはかなり高度の知識が要求される。そのため、少し努力してもらうことを前提としてブログを書くが、エッセンスだけを知りたい人のために、最後に簡単なまとめを残すので、ほとんど読み飛ばしてもらっていい。
バソプレシンとオキシトシン
ASDに対する薬剤というとオキシトシンと思い浮かべる人も多いと思うが、実際にはバソプレシンとセットにして理解しておく必要がある。バソプレシンは抗利尿ホルモンとしての作用がよく知られるが、実際にはオキシトシンと同じで、脳内で分泌され、社会性などの調節に関わることが知られている。ともに、9個のアミノ酸からできるペプチドで、何と2個のアミノ酸以外は全て同じで(図を参照)、分子の構造も極めてよく似ている。
バソプレシンには3種類、オキシトシンには1種類の受容体が神経細胞への作用の入り口になっている。しかし、バソプレシンは弱くではあってもオキシトシン受容体に結合できるし、また逆も起こる。このため、オキシトシンが実際にどの細胞を刺激しているかを完全に特定することが出来ない。すなわち、オキシトシンを投与した時オキシトシン受容体細胞だけが活性化するわけではなく、両者が複雑な相互作用を行うため、それぞれの影響は複雑な相互作用の総和として現れる。すなわち、因果性をはっきりさせることが大変難しい。
バソプレシンはASDの社会性を回復させる
さて今日最初に紹介するスタンフォード大学からの論文は、6歳から12歳のASD児童に鼻粘膜からバソプレシンを4週間続けて投与することで、ASDの様々な社会症状が軽減することを示した臨床治験研究だ(Parker et al, A randomized placebo-controlled pilot trial shows that
intranasal vasopressin improves social deficits in children with autism(バソプレシンの無作為化盲検法による小規模治験は自閉症の児童に対して効果を示した)Science Translational Medicine 11: eaau7356, 201)。
30人の6-12歳のASD児童を無作為化して、バソプレシンを含む経鼻薬あるいは偽薬を含む経鼻薬を毎日投与、4週間目に様々な指標での症状改善を調べている。詳細は全て省くが、社会性、反復行動、過度の不安など全てではっきりとした改善が認められ、また心配される血管や腎臓の副作用もないという素晴らしい結果だ。示されたデータを見ると、素人の私でも改善がはっきりしているのがわかる。
この治験では利尿や血圧への影響を考えて、中程度の用量を用いているが、不思議なことに血中のバソプレシンがもともと高い子供ほど改善の程度が強い。この結果は、ASDの児童ではもともとバソプレシンの分泌量が低く、その結果血中濃度の低い子供では投与した量では足りないのかも知れない。
なぜバソプレシンの治験がこれまで進んでいなかったか考えてみると、正常人にバソプレシンを投与すると、特にバソプレシン受容体の一つV1aRを介して、不安や恐怖が高まることが知られていたためで、もし同じことがASDの子供に起こると、逆効果になる。しかしこの論文は、ASDの子供についていえば、これは全く杞憂であったことを意味しており、実際不安に対する自己防衛とも言える反復行動や、不安症状もバソプレシン投与で軽減している。是非大規模治験を早く進めてほしい。
バソプレシン受容体V1aRの阻害剤も自閉症症状を改善させる
今日紹介したいもう一つの論文は製薬会社ホフマン・ラ・ロッシュの研究所からの論文で、今度はV1aR受容体の機能を抑制すると、大人のASDの症状を改善できる可能性を示した臨床治験だ(Bologani et al, A phase 2 clinical trial of a vasopressin V1a
receptor antagonist shows improved adaptive behaviors in men with autism
spectrum disorder(バソプレシン受容体V1aの阻害剤はASDの大人の適応行動を改善した)Science Translational
Medicine11: eaat7838, 2019)。
先の論文ではバソプレシン自体がASDに効果があるといい、この論文ではバソプレシン受容体の抑制がASDに効果があるというのは、矛盾するように思えるが、最初述べたように反応する受容体が複雑なため、このような結果自体はある程度理解することができることを最初に断って、治験の結果だけを紹介する。
このVa1R阻害剤は、内服できるという最大のメリットがある。先に述べたように、正常人でバソプレシン投与が不安症状を高めるという結果に基づき、V1aR受容体を抑えると不安を抑えられるのではと期待して開発が進められた。
この治験も無作為化し偽薬も用い、患者さんには何が処方されているかわからなくなっている。対象は大人のASDに限っており、A1aR1は当然抗利尿作用などもあるので、確かに最初から児童について調べるのは難しいと思う。実際には偽薬あるいは3種類の異なる用量を服用させ、12週目に様々な指標で効果を確かめている。
結果だが、付き添いの人の印象に基づく改善度(最も厳しい指標)で見ると4mgまで全く効果がないが10mgでは効果が少しみられている。この結果に基づき、計画通りの効果が見られなかったと結論しているが、しかし社会性やコミュニケーション能力の検査では、服用量に応じて改善がはっきり見られている。副作用では不思議なことに、最も多い10mgを投与した群より、偽薬群のほうが頻度が高いという結果で、おそらく長期の使用も問題ないだろうと結論している。
まとめ
科学的な手法に基づく臨床治験(第2相)で効果がはっきりしたASDの治療法が初めて報告された。現在オキシトシンの治験がどのような状況か把握していないが、バソプレシンや受容体阻害剤が有望な薬剤として登場したのは、私にとっても意外だった。しかし、ASDの人たちにとっては、科学的な効果が確認された薬剤があることが重要で、その意味では大きな前進だと思う。今後大規模治験、対象を変えた治験など、多くの臨床治験が進むことが期待され、実際FDAなども本腰を入れて支援する構えだ。時間はかかると思うが、進展については逐一紹介するつもりなので、乞うご期待。
2019年8月25日
ウイリアムズ症候群とは?
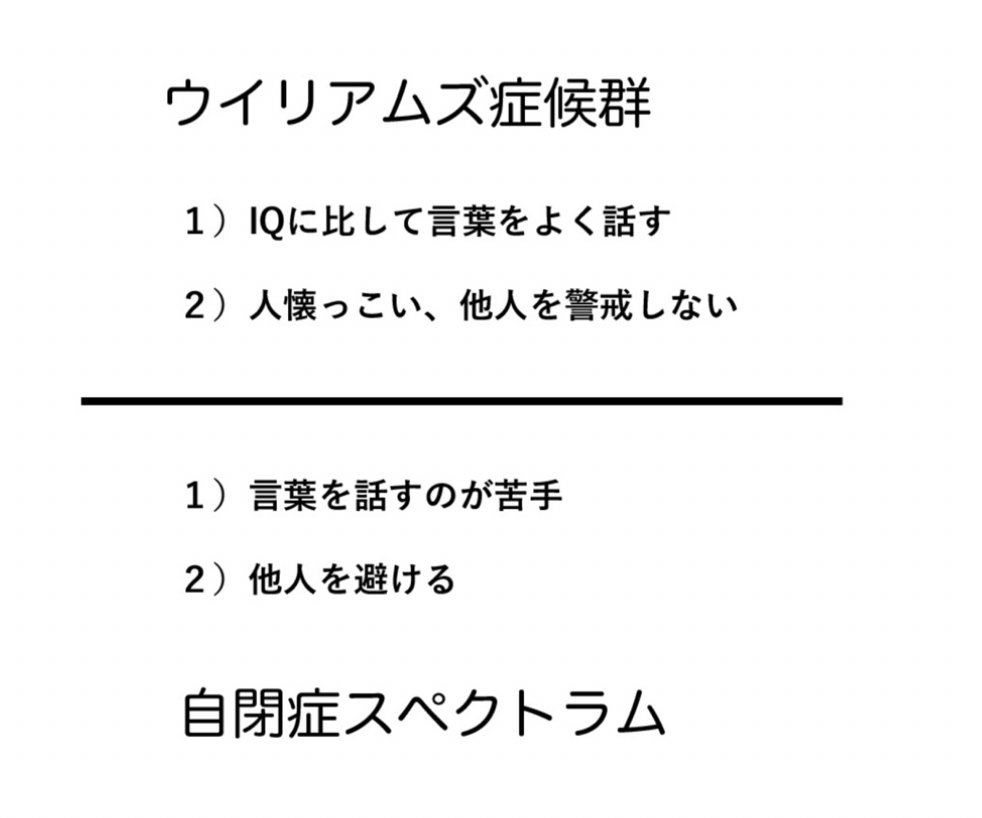
まずほとんどの読者は、ウイリアムズ症候群について聞いたこともないと思う。しかし発症メカニズムも全く異なっているのに、なぜかウイリアムズ症候群は自閉症スペクトラム(ASD)と対比して語られることが多い。この理由は、両者が社会性という点で全く逆の症状を示すからだ。
ウイリアムズ症候群(WS)の原因はよくわかっており、7番染色体の一部が大きく欠損することで起こる遺伝病だ。欠損する領域には、26種類の遺伝子が存在しており、知能だけでなく、実際には様々な身体の発達障害をがおこる。ただWSが注目される最大の理由は、知能発達の遅れにも関わらず(IQの低下がある)、言葉を話す能力が極めて高い。そして「天使のように愛くるしい」と形容される人懐っこさを示し、初めての人でも不安を持つことなく近づく社交性を同時に持っている。
これに対し、ASDは知能発達は正常でも、言葉を話すのが苦手で、他の人と接するのを極度に嫌う。すなわち、WSとは真逆の症状を示す。
この結果から、話し言葉の能力には、他の人と交流したいというモチベーション、すなわち社会性が重要な要因であることが想像される。このため、ASDとWSから言語と社会性の関係が理解できるのではと研究が続けられている。
犬はウイリアムズ症候群?
一部の遺伝的ケースを除いて、多くの遺伝子が複雑に絡み合うASDと違って、WSでははっきりと同じ領域の遺伝子欠損が認められる遺伝病だ。ただWSでは最大26種類もの遺伝子が欠損するため、どの遺伝子が社会性に関わるのか絞り込む作業が必要だ。最近の多くの症例の解析から、社会性にはGtf2遺伝子が重要な働きをしていることがわかってきた。すなわち、大きな欠損があってもGtf2i遺伝子が残る場合は、社交性の変化は見られない、あるいは欠損でもGtf2i遺伝子が欠損した場合だけ、社交性が高まることがわかってきた。
更に驚いたのは、2017年プリンストン大学のグループが、オオカミとペットとして飼われるようになった犬の遺伝子を比べ、なんと犬ではGtf2iを含むWS領域に構造的な変異が起こっていることを発見した(von Holt et al, Science Advances 3:e1700398, 2017)。すなわち、オオカミを飼いならして、人になつく様に犬をペット化する過程で、このWSに関わる遺伝子の発現が意図せず変化させたという、嘘のようなしかし納得の話だ。
Gtf2i遺伝子の機能をマウスで調べる
このように、高い社交性に関わる遺伝子が特定されてくると、その遺伝子を操作する動物実験が可能になる。神経細胞だけでGtf2i遺伝子を欠損させたマウスを用いて、マサチューセッツ工科大学のグループは、WSのメカニズムを調べNature Neuroscience4月号に掲載した(Barak et al,
Neuronal deletion of Gtf2i, associated with Williams syndrome, causes
behavioral and myelin alterations rescuable by a remyelinating drug (ウイリアムズ症候群に関わるGtf2iの神経細胞特異的ノックアウトは再ミエリン化薬剤で治療可能な行動とミエリンの変化の原因)Nature Neuroscience 22: 700, 2019)。
この研究では前頭葉の興奮ニューロン特異的にGtf2i遺伝子をノックアウトしたマウス(cKOs)を作成し、WSと比べながら調べ、以下のような結果を得ている(少し説明が専門的になるので読み飛ばしてもらえればいい)。
WSでは大脳皮質の縮小が見られるが、Gtf2iを神経で欠損させても同じような皮質の現象が見られる。 WSは高い社交性と、不安の欠如が見られるが、cKOsの行動解析でも、同じように、他のマウスに対する高い社交性と不安行動の低下が見られる。 cKOsの遺伝子発現を調べると、なんと低下する遺伝子の7割がミエリン合成に関わる分子で、実際脳のミエリンの厚さが低下して、神経伝達速度が低下していることがわかった。そこで、WSの脳の遺伝子発現とミエリンを調べると、cKOsと似たミエリン厚の低下と、ミエリン関連遺伝子の発現低下が見られた。 カリウムチャンネルをブロックして神経伝達機能を高めるアミノピリディンを投与すると、運動機能が正常化し、さらに社会性が高いという変化も正常化する。 オリゴデンドロサイトの分化を誘導しミエリン形成を高めることが知られており、現在はアレルギー症状改善に用いられるクレマスチンを投与すると、ミエリンの厚みが増し、社会性も元に戻る。 Gtf2iを片方の染色体のみ欠損させた、よりWSに近いモデルマウスでもWSと同じような症状とミエリン形成異常が起こる。 要するに、WSの精神発達障害のかなりの部分はGft2i遺伝子の欠損で説明でき、しかも薬剤による治療可能性があることを示した画期的研究だと思う。特に運動障害も正常化することから、社交性や不安感状の欠如のみならず、多くの症状を改善できるかもしれない。
また、WSを調べることで、分子、神経ネットワーク、社会性などの行動を結ぶメカニズムを理解することが可能になる。こうして得られた知識は、間違いなく裏返しの症状を示すASDの理解と治療にも役立つと期待している。
2019年8月25日
ASDの消化管症状
2017年Autism Speaksから発表された「自閉症の健康」と題されたレポートを紹介した。その中でASDでは高頻度に慢性の消化管症状が(便秘、下痢)みられ、生活の質が著しく低下することが書かれていたが、「本当に困っており、この記事を読んで納得した」と多くのメールをいただいた。
このとき、消化管症状の原因が腸内細菌叢の異常で、治療のために健康人の便を移植する治療が始まっていることも紹介した。もちろんこの治療の主要目的は消化管症状の改善だが、消化管刺激によりASD自体の症状が悪化している可能性も高く、消化管以外の症状を改善できる可能性が期待できる。
この期待を裏付ける2編の論文が今年に入って相次いで発表されたので、自閉症の科学27として簡単に紹介しておくことにした。
ロイテリ菌の力
わが国では、多くの企業が乳酸菌やビフィズス菌についてその効能を謳った宣伝を毎日繰り広げている。あまりに多すぎて、乳酸菌という言葉が効能のシンボルとして使われ、消費者も乳酸菌やビフィズス菌と枕詞がついておれば、実際の効能はほとんど気にしないで食べていると思う。かく言う私も、特定のヨーグルトを毎朝食べているが、そこに書かれている効用など気にしたことはない。
当然企業側も効能については臨床試験を行い、科学雑誌に結果が掲載されたことを強調して宣伝に勤めてはいるが、私の知る限りほとんどの菌株についての研究は、トップ科学ジャーナルに掲載されるまでには至っていない(小児の壊死性腸炎抑制効果を調べた大規模治験で某会社の菌株が効果がなかったというThe Lancetの論文はある)。
しかし一つだけ、Nature(http://aasj.jp/news/watch/7695 )やCell(http://aasj.jp/news/watch/5406 )といったトップジャーナルにも掲載されている例外の菌株がある。それはロイテリ菌で、私のブログでも紹介した。また国際的治験登録機関であるClinical Trial Governmentに登録された治験がなんと154にも及んでおり、科学的な効果の検証が続いていることをうかがわせる。
岡山の乳業会社がロイテリ菌をライセンスして市場に提供していることをアナウンスした新聞広告を見たことがあるが、「この菌の効能に関しては数多くの論文がすでに存在しています。」とだけ書いてるのを見て、ある意味で新鮮な感じがした。実際、ロイテリ菌をキーワードにメドラインサーチをかけると、4000近い論文がリストされる。このまま研究密度の格差が開き、臨床治験の結果がトップジャーナルに掲載されていけば、ロイテリ菌にプロバイオが席巻される可能性すらあるように思う。
ロイテリ菌が自閉症に効果がある
この菌を有名にしたのは、子供の夜泣を抑えるなど神経系への効果の存在だ。そんな中、2016年ロイテリ菌が自閉症スペクトラムのマウスモデルの社会性を回復させるという驚くべき論文が米国から発表され、私のブログで紹介した(http://aasj.jp/news/watch/5406 )。この論文では、肥満マウスから生まれたマウスが示す、ASDに似た社会行動異常が、腸管内のロイテリ菌の存在だけで説明できるという話で、しかもロイテリ菌がもともと自閉症に効果があると期待されているオキシトシン分泌を誘導して社会性を回復させることを示していた。
ただ肥満マウスから生まれた子供の社会行動異常は、ASDモデルとしてはあまりに特殊で、遺伝的なモデルも含め、さまざまなASDモデルでも同じことが言えるのか調べる必要があった。
今日紹介する論文は、同じテキサス・ベイラー医科大学からの論文で、まさに様々なマウス自閉症モデルを用いて、2016年の論文結果を確認し、ロイテリ菌の効果が様々なASDにも期待できることを示唆している(Sgritta et al, Mechanisms Underlying Microbial-Mediated
Changes in Social Behavior in Mouse Models of Autism Spectrum
Disorder(ASDのマウスモデルの社会行動の変化の背景にある細菌叢を介するメカニズム) Neuron 101:246, 2019)。
この論文では、Shank3Bという遺伝子が欠損したマウス、自閉症様行動の多発するBTBR系統の2種類の遺伝的モデルを用いて、ともに腸内でのロイテリ菌が低下していること、また行動異常をロイテリ菌を飲ませることで回復させられることを示している。一方、他の腸内細菌は社会性の異常とは全く相関しない。さらに、妊娠マウスにHDAC阻害剤を投与して誘導する、後天的自閉症にもロイテリ菌が効果を示すことも示している。この結果、少なくとも4種類の様々な自閉症モデルでロイテリ菌の症状をおさえる効果が確認されたことになる。
あとは、メカニズムを詳しく調べ、
社会行動異常を正常化する効果は全てロイテリ菌で説明できる。 ロイテリ菌はオキシトシン分泌促進を介して、この効果を発揮する。 この作用は中脳のドーパミン神経の興奮調節を介しておこる。 ロイテリ菌の腸内での作用は迷走神経の興奮を誘導して、オキシトシン分泌を誘導、その結果症状を改善させる。 を明らかにしている。
結果は以上で、2016年に紹介した時、結果が綺麗すぎてにわかには信じがたいと言ってしまった研究結果をさらに深めることができたように感じる。
だとすると、ぜひ実際のASDの人たちの社会症状を改善できないか確かめてほしいと思う。ClinicalTrial
Gov.を見ると、まだリクルートは始まっていないが、計画については登録されているので、期待できるように思う。実際ロイテリ菌はFDAで安全性が確認され、夜泣きの乳児にも使われてきたプロバイオティックスでおそらく治験へのハードルは低いと思う。そして早く、どのタイプのASDに効果があるのか、結果を出して欲しいと思う。
便の細菌叢移植によるASD治療
ASDを腸内細菌叢から治療する試みが進められていると最初述べたが、その例が先週Scientific
Reportsに掲載された(Kang et al, Long-term benefit of
Microbiota Transfer Therapy on autism symptoms and gut microbiota (細菌叢移植の自閉症症状と腸内細菌叢に及ぼす長期的効果)Scientific Reports 9:5821,https://doi.org/10.1038/s41598-019-42183-0 )。
オープンアクセスの雑誌で、詳細は論文を直接見ていただくとして、ここでは方法と要点だけを手短にまとめておく。
専門家により診断が確定した18人のASD(7ー17歳)の児童に、まず抗生物質ですでに存在している腸内細菌を叩き、その後下剤をかけて全て排出させた後、健康人の大便から分離してきた細菌をカプセルに入れて投与、この時胃酸を抑制して細菌叢が町へ到達できるように配慮している。ただ、大腸には届かないと考えられるので、一回内視鏡下で同じ菌を移植している。
この論文は治療後2年目の中間報告になるが、
消化管症状は6割の子供で著しく改善した。しかし4ヶ月目と比べると、少し症状が再発気味。 専門家による診断スコアを指標にしたASD症状もはっきりと改善が認められ、こちらは4ヶ月より2年目の方がさらに改善がはっきりしている。 消化管症状の程度と、ASD症状の程度は相関している。 が結果で、かなり有望な治療法になりうると結論している。
この論文では、ロイテリ菌の増減については言及されておらず、健常人の細菌叢という以外は、はっきりとした原因菌が特定できているわけでは無い。また、対照群を置いていないオープンラベル治験なので、偽薬効果を見ている懸念は払拭できない。したがって、ロイテリ菌も含め早期に、対照群を設定した治験を進めてほしいと思う。
とはいえ、個人的な勘だが、細菌叢からASDを治療する方向性は有望というだけでなく、ASD症状理解にもこの方面の研究が大きく寄与するのではと思っている。
2019年8月25日
実を言うと、小学校の頃学校から児童相談所に行くよう言われた覚えがある。当時は、児童相談が始まったばかりで、検査の理由は覚えていないが、ひょっとしたら授業に集中しないなどの傾向があったのではと思う。今でも一つのことに集中できず、同時にいくつものことを並行してやる癖があるので、ADHDと言われても仕方がないかもしれない。当時は自閉症スペクトラムやADHDなどの概念がはっきりしていなかったためか、その後特に指導を受けるというまでには至らなかった。
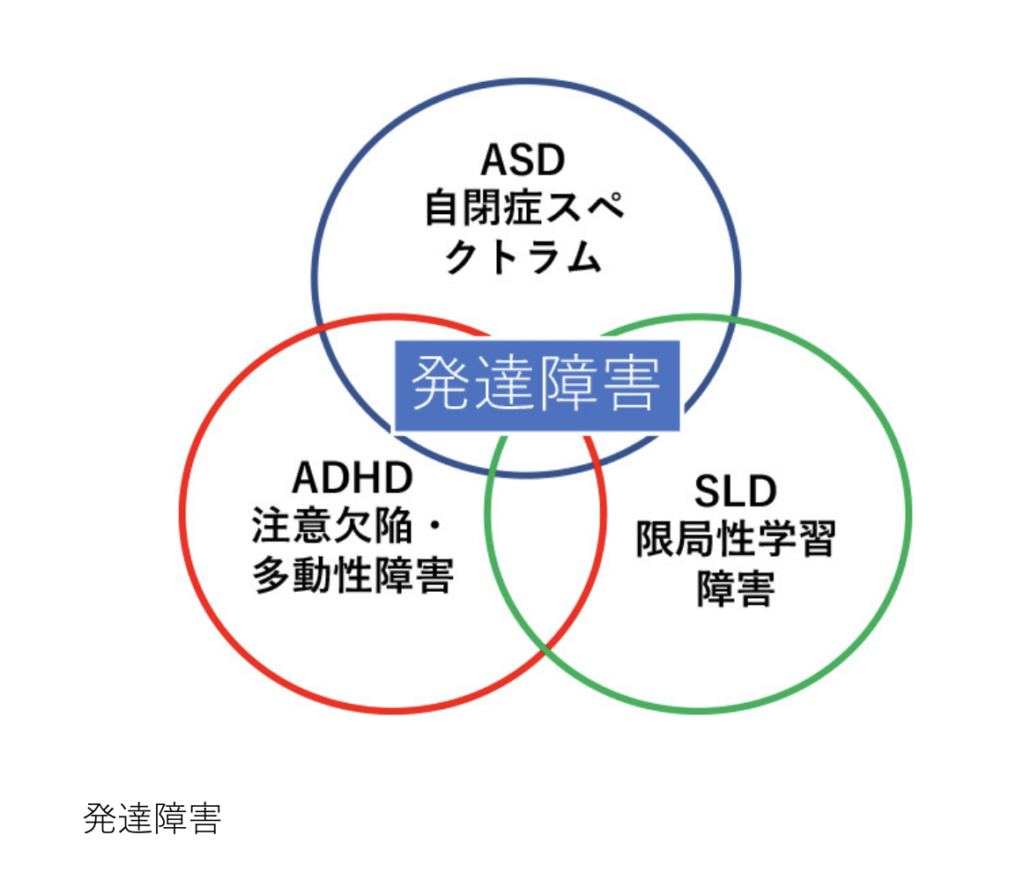
冒頭の図に示すように、発達障害は3つのカテゴリーに分けることができるが、症状は互いに重なり、完全に分けることは難しい。
この中のADHDは、一つのことに集中が難しく、動き回るなど行動を自分でコントロールできないなどの症状を示す時に付けられる診断名で、わが国でもADHD児童の数は増えており、全児童の5%近くに達しているのではないだろうか。
児童の場合向精神薬で済ますというわけにはいかないため、治療や指導に努力と時間がかかる。神戸で発達障害児を対象に診療を行っている今西先生のクリニックを見学させてもらったが、一人の児童に長い時間をかけて行動治療を行なっておられた。このためどうしても受け入れられる数に限りがあり、いまや新患の予約は3ヶ月以上待つ必要があるらしい。このように、ADHDを含む発達障害の個別治療には医師とスタッフの数が圧倒的に足りない。
三叉神経刺激療法
そこで期待されているのが、電気や磁気を用いて症状を和らげられないかという可能性だ。ADHDの治療として期待されているのが三叉神経刺激で、皮膚の外から三叉神経が支配する領域に微弱電流を連続的に流す治療法だ。実際、この治療はテンカンやうつ病に使われ効果を上げている。神経科学的メカニズムとしては、刺激によりノルエピネフリンやセロトニンが分泌されるためと考えられているが、人間で詳しく調べることは難しい。結果科学的に計画された臨床試験を繰り返し、効果を調べる以外この方法の評価は難しい。ADHD治療については、パイロット的に行われた臨床治験でいい成績が出ているが、最終判断にはよく計画された臨床試験が必要だった。
ADHDの三叉神経刺激治療の臨床治験
今日紹介するカリフォルニア大学ロサンゼルス校のグループからの論文は、この三叉神経刺激の治療効果を、臨床試験としては最も厳しい無作為化二重盲検試験で検証した研究でJournal of American Academy Child and Adolescent Psychiatryオンライン版に掲載された(McGough et al, Double-Blind, Sham-Controlled, Pilot Study of
Trigeminal Nerve Stimulation for ADHD (ADHD治療のための三叉神経刺激の二重盲検かつ偽処置群を対照にした試験研究)Journal of the American Academy of Child & Adolescent Psychiatry
in press, 2019:https://doi.org/10.1016/j.jaac.2018.11.013)。
この研究では、専門医の厳格な診察により診断されたADHD患者さんを最終的に62人リクルートし、無作為に三叉神経刺激群と非刺激群にわけている。三叉神経刺激は、ワイヤーで両側のこめかみにはる電極を通して刺激を与える装置を装着させ、2-3mA、120Hzの刺激を30秒ごとに流している。これを4週間続ける。偽処置群も基本的にこめかみに電極を貼るところまでは同じだが、実際の電流は出ない。実際、この程度の電流ではあまり何かを感じるというほどではないようだ。
さて結果だが、ADHD-RS(rating
scale)スコアと呼ばれる症状の重さを測る指標で見ると、最初の1週間で急速にスコアは改善し、あとは4週間まで緩やかに低下する。一方、偽処置群も最初の1週間は少し改善が見られるが、もちろん刺激群には及ばない。そして1週間以降はほとんど変化がなくなる。
面白いことに、脳波検査でほとんどの周期レンジで、脳波の活動が刺激群で高くなるが、偽処置群ではほとんど変化しない。このことから三叉神経刺激は神経活動を高めることができるのがわかる。しかしながら、パイロット研究では効果があるとされていた、実行能力や、睡眠の改善などは認められなかった。
この研究から得られる結論は以下のようにまとめられる。
このような機械刺激の治療研究では、常にプラシーボ効果を念頭におく必要がある。 三叉神経刺激は、臨床医が診断するADHD-RSスコアを中程度に改善することができる。 安全性は高い。 三叉神経刺激は大脳皮質まで投射路を通して活性化し、その結果として脳波の振幅が高まる。 医師による診断でははっきりとした改善が見られるが、親の印象では、刺激群も非刺激群もあまり改善したとは実感されていない。 厳密な臨床試験でも期待できる結果が出たという結論になる。今後この効果がどの程度続くのかなど、臨床試験が必要だが、自宅でも治療ができる点は大きく、期待したい。
ただ個人的に一番気になったのは、医師の診断でははっきりと改善が見られるのに、親の評価ではほとんど改善を認めていない点だ。この結果を軽々に解釈するのは問題があると思うが、ADHDの複雑さをうかがわせる臨床試験でもあった。
2019年8月25日
自閉症スペクトラム(ASD)のMRI研究は着実に進んでいる
これまでASDと診断された人たちの脳のMRI画像を、一般的な人と比べた研究については何度も紹介してきた。このような研究の基本には、なるべく早期に発見出来る客観的指標を探し、早期治療を可能にしたいという思いがある。さらに脳の成長に伴う変化を調べることで、ASDの脳回路のフレキシビリティーについても理解できる。このように、ASDのMRI画像は体を傷つけることなく得られるデータとしての重要性は高い。しかしASDがスペクトラム(広がりのある状態)として理解されているように、ASDの人たちの間でもMRI画像に現れる脳構造の変化は大きい。このため、一つのグループの研究結果がそのままコンセンサスとして認められると言うまでにはなかなか至らず、実際論文の間で結果が異なることはしばしばだった。このため、なんとかASD一般に認められるMRI画像の変化を特定し、研究から検査へと発展させようとする努力が続いている。
研究から検査へ
今日紹介するロッシュイノベーティブセンターを中心とするヨーロッパ各国が参加する研究チームの論文は、MRI検査について、専門家レベルでコンセンサスが得られるMRI画像変化を特定するko
とを目的に行われた研究で2月27日号のScience
Translational Medicineに掲載されている(Holiga et al, Patients
with autism spectrum disorders display reproducible functional connectivity
alterations (ASDの患者さんでは再現性のある脳の機能的結合性の変化が認められる)Science Translational Medicine
11:eaat9223(2019):http://stm.sciencemag.org/content/11/481/eaat9223)。
繰り返すが、この研究の目的は何か新しい指標を発見するための研究というより、これまでの研究を見直してASDのMRI画像に関して皆が一致できる変化を特定することにある。これを実現するため、ヨーロッパで進んでいる2-300人規模でASDと一般人を追跡し続ける研究のうち、まず3追跡研究をASDに特異的なMRI変化を特定するための探索に用い、またこれらとは独立して進んでいる3種類の同じような追跡研究を、探索により特定された変化を確認・検証する目的で使っている。また、調べる画像も安静時の各領域の機能的結合性を調べる方法に固定して、変化を探索している。よく読んでみると、一種のAI研究と言っていいが、わざわざ流行りの言葉を使わないところは好感が持てる。
結果はもちろんこれまでの研究と大きな違いはない。ただ、多くの画像を解析することで、ASDを特徴付ける変化が確かに存在すること、そしてこうして発見された変化の大きさを、効果量(effect size)として定量化できることを示している。
今回特定された変化は以下のようにまとめることができる。
1)MRI検査から、ASDの多くの人で、機能的結合が亢進している領域と、低下している領域を特定することができる。そして、これらの変化の効果量は、ASDの症状の強さと相関する。(これは検査への第一歩になる)
2)機能的結合が低下しているのは感覚領域と運動領域との結合が中心で、亢進しているのは前頭皮質と頭頂皮質をハブとする結合で、どちらも基本的には皮質間の結合に限られている。
3)これまでの研究で示唆されていた、皮質と小脳や脳幹との結合性の変化は確認できなかった。(といっても否定されたわけではなく、今後症状の詳細と相関させる方向でのAI研究が進むだろう)
4)感覚野と運動野の結合性の低下は、この2領域間内での結合の低下と同時に、この2領域と他の脳領域との結合が低下することで起こっている。(ASDの人たちが示す外界の刺激に対する閾値の低さに関わるような気がする)
5)脳の前頭葉、頭頂葉は、自発的に何かを実行するときに重要な機能を果たしている領域で、計画を立てたり、果敢に決断したりすることに関わる。この研究では、ASDの人たちではこの領域の結合が亢進していることが示されたが、コミュニケーションや日常生活での困難がこれらの領域の変化と関わっていると考えられる。(この領域に対する磁場や電流を用いた介入も行えるかもしれない)
6)ただ、これらの変化が原因か結果かは明確でない。実際、これらの変化の効果量は年齢が高いほどはっきりする。このことは、同じ変化が長期間維持されることを示すと同時に、この変化を強めていくモーメントが働いていることを示している。(早期診断に関しては、さらに研究が必要なようだ)
他にも多くの重要な点が指摘されていると思うが、以上6点が私にとっては最も印象的だった。
結論だけを見るとこれまでの論文とあまり変わるところはないが、多数の症例を調べていること、探索群と検証群に分けて、発見された指標が診断に使えるかを確認した点が大きい。今後はAIを用いてより迅速な診断が可能になるという期待が膨らむ。この結果が検査として定着し、治療に役立つことを期待している。
2019年8月25日
自閉症スペクトラム(ASD)の主症状は、社会的なコミュニケーションの困難と反復行動だが、これとともに半分の人たちで様々な対象に対する恐怖症がある。例えば、特定の場所を極端に嫌がったり、髭を生やした人だけを恐れたり、特定の動物を恐れたり、一種の脳のアレルギーとも言える反応だ。そこで、アレルギーで抗原に慣れさせて反応を抑える脱感作治療のように、恐怖の対象を思い出させて脱感作するCognitive Behaviour Treatment(CBT)治療法が試みられているが、想像することが苦手な子供はCBTによる治療は難しい。
この問題を解決するため、ニューカッスル大学のグループは、恐怖症の対象を映像で経験させて恐怖症を取り除く大掛かりなシステムを開発し、その効果を無作為化試験で確かめJournal of Autism and Developmental Disordersにオンライン出版した(Maskey et al, A Randomised Controlled Feasibility Trial of Immersive
Virtual Reality Treatment with Cognitive Behaviour Therapy for Specific Phobias
in Young People with Autism Spectrum Disorder(ASDの若者の特定の恐怖症を取り除く没入型バーチャルリアリティーを組み合わせたCBT治療の可能性を確かめる不作為化対照試験) Journal of Autism
and Developmental Disorders in press,
https://doi.org/10.1007/s10803-018-3861-x, 2019)。
タイトルからわかるように、この研究はBlue Room VREと名付けられ、医療用機器として特許化された360度全面に映像が映り音楽が流れる部屋と、その部屋で映写する治療用ソフトがセットになったシステムの治験研究だ。この部屋で実際に行われる治療の様子は英語ではあるがYouTubeに掲載されている。(https://www.youtube.com/watch?v=9U-rRC8jc28 )
この研究では、8-14歳のASDの児童32人をリクルートし、ASDであることを確認した上で、まず各人の恐怖症の対象を特定している。
実に様々な対象が恐怖症の対象になっており、ハチ、広い場所、エレベーター、犬、暗い場所、昆虫、見つめられること、天気の変化、風船、コウモリ、トイレ、車に乗ること、自動オモチャなど、驚くことにバナナまで恐怖症の対象になっている。
この研究ではそれぞれの対象に応じたビデオプログラムを作成し、Blue Roomで投射して治療に用いており、究極のテイラーメイド治療になる。例えば広場に恐怖を感じる子供には、そこに鳩が飛んでくるような設定で安心させるプログラムなど、どのようなコンテンツを作成するかが治療のカギになるように感じる。
治療では、CBTの訓練を受けたセラピストと一緒に部屋に入りゆったりと腰掛ける。最初は海の中をイルカが泳ぐといったリラックスする映像が映って、部屋の中でセラピストと会話することに慣れるセッションの後、各児童の恐怖症に合わせたプログラムを投射する。セラピストはこの画面を見ながら、CBTで行うのと同じように会話しながら恐怖症の対象に慣れさせる。
CBTだけとは異なり、実際の映像を見ながら反応を確かめながら慣れていくので、場面を想像する必要はない。セラピストも反応をみながら、画面をコントロールし、恐怖を取り除いていく。この様子を親は医師とともに室外のモニターで観察し、いつでも止めるよう指令することができる。このセッションを2回繰り返して治療は終わる。
効果の判断は、この治療とは無関係の医師が、治療を受けたかどうかも知らされずに行っている。論文で示されている診断スコアがどの程度の症状変化を意味するのか専門家でないのでわからないが、6ヶ月後に調べると40%近い子供に改善が認められた。一方、コントロールでは全く改善がない。また、治療を受けた後症状が悪化したケースは16例中1例だけでだが、コントロール群ではなんと15例中5名にも達する。これに基づき全般的にかなり高い効果があると結論している。
結果は以上で、12ヶ月目でも効果の見られた人の割合は変わっていないので、今後セッションを増やしたり、映写する映像を変化させたりすることでさらに大きな効果が期待できるような気がする。
ASD治療の第一歩は、普通の人にはない様々な恐怖症を取り除くことであることを考えると、他にも応用範囲は広いのではと期待する。しかし、誰もが考えそうなことを、しっかりと治療機器としてまとめてくる努力に感心した。
2019年8月25日
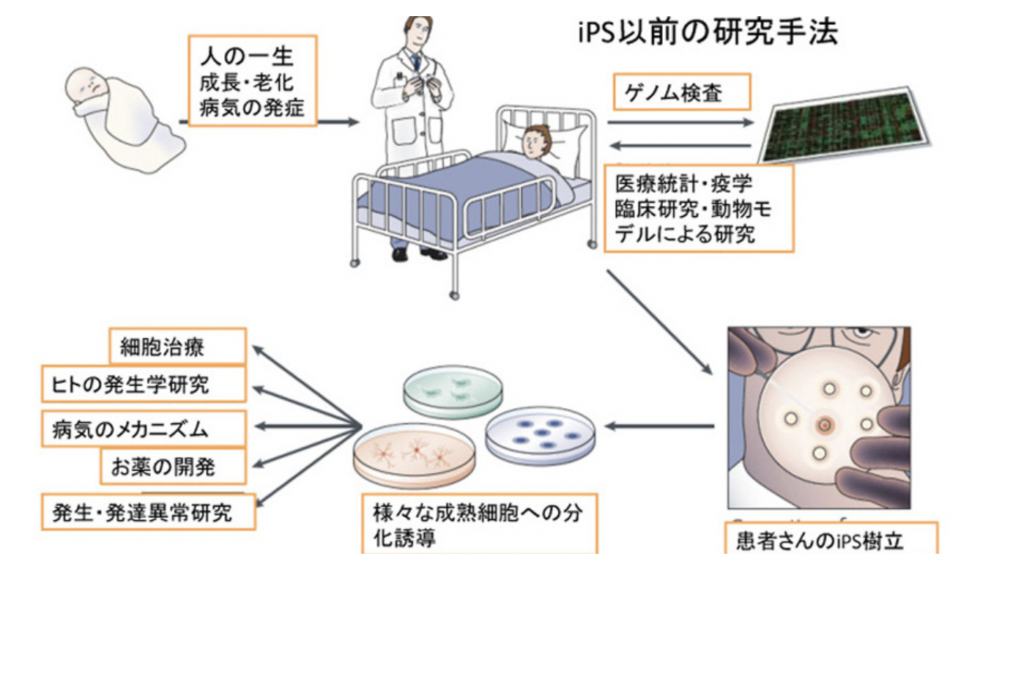
iPSが約束したこと
図は山中さんのヒトiPS樹立成功の論文が発表された時、月刊誌Nature Review Molecular
Cell Biologyに依頼され、米国の1型糖尿病財団の人たちと書いた総説( Nishikawa et al The promise of human induced pluripotent stem cells
for research and therapy(研究や治療に向けたヒトiPSの約束)Nature Review Molecular Cell Biology 9:725, 2008)を日本語に直して転載した図だ。iPSのおかげで、これまで難しかったヒトの細胞が自由に利用できるようになり、ヒトに関して様々な研究が可能になったことを紹介してる。しかし実を言うと、この時私の頭にあったのは、ほとんどが心臓・腎臓・血液といった身体の病気で、脳発達についてはあまりにも複雑すぎて、iPSの出番はないだろうと思っていた。
自閉症を細胞レベルで研究できる?
自閉症は人間の最も高次な脳の多様性として捉えることが出来るが、その背景には必ず多くの分子の非典型的行動があり、それをベースに細胞レベル、発生レベル、脳構造レベル、神経ネットワークレベルと、非典型性が拡大した結果生まれる多様性だ。このため、最終的に症状として表れた行動と、その行動を支配する神経ネットワークの非典型性の関連を現象的には明らかに出来ても、はっきりとした因果関係を示すのは簡単でない。症状に最も近い神経ネットワークですらこの状態なので、細胞レベル、さらには分子レベルとなると、因果性をはっきりさせることなど、夢のまた夢に近い。
しかし、どんな複雑な組織構築も個々の細胞の性質を反映して形成されている。従ってどんなに複雑な精神症状でも、分子、細胞、組織と何とか統合的に理解しようと、研究者は膨大な努力を払っている。この時、iPS由来の脳細胞が使えれば、分子レベルと組織や発生をつなぐ研究が、普通は使うことができない生きた脳細胞を使って研究できる。
米国ソーク研究所の長期的視野での研究
自閉症に限らず、高次の精神疾患の細胞レベルの解析にiPSを積極的に使っているのがソーク研究所のFred Gageのグループで、創意に満ちた面白い研究を続けている。私が2008年の総説を書いていた頃、Gage達は、1)類人猿のiPSを樹立して、人間とサルの神経機能の違いを研究する、2)統合失調症をはじめとする高次精神疾患のiPSを用いて、病気の分子生物学的、細胞学的背景を明らかにする、と壮大な計画を建てて研究を始めていた。その時私は、「iPSは樹立できても、そう簡単に高次脳機能の理解に進むとは思えない」と見ていたが、その後10年を経ると、両方のプロジェクトで多くの成果が上がりつつあり、未来が見える優れた研究グループであることがよくわかった。
iPSを用いた自閉症研究
今日紹介したい論文は、このCageらがiPSを用いて自閉症を解析した研究で、実に様々な問題が扱われており、iPSを用いた細胞レベルの研究でもこれだけのことが可能なのかと感心した(Schafer
et al, Pathological priming causes developmental gene network heterochronicity
in autistic subject-derived neurons(自閉症では文化のタイミングの異常で発生のネットワークの時間の同期生が失われる)Nature Neuroscience 22:243, 2019)。
すでに私のブログでも2回紹介したが(2017,6.11 &2017,2,18 )
一部のASD患者さんはMRIを用いて生後1年までに診断が可能だ。すなわち脳の一部の体積の増大を指標に診断ができる。この研究はこの早期に診断された患者さんを追跡するプロジェクトへの参加者の中から、脳の構造変化がハッキリと見られ、ASD発症を発症した8人からiPSを作成している。
精神症状だけに基づいてASDの患者さんからiPSを樹立するのではなく、発生過程での構造異常が確認された症例のiPSを使うことで、より細胞レベルの関与がわかりやすいようにした素晴らしい計画だと思う。
最初に調べたのは、脳神経細胞が出来るまでの発生過程に異常があるかどうかで、樹立したiPSを大脳皮質神経細胞へ分化させる過程での遺伝子の発現を正常と比べ、ASDの神経分化に時間的・質的ずれがあるかどうか調べている。
すこし専門的になるが、iPSをまず全ての神経系細胞に分化できる神経幹細胞(NSC)を誘導し、この細胞を起点に「ヨーイ・ドン」で分化を誘導し、14日間観察を続けている。この期間に分化してくる神経細胞だけを取り出して遺伝子発現を調べ、正常iPSとASD・iPSからの分化を比べている。
実験自体はあまりに膨大なので詳細を省くが、このiPS、NSC,そして分化細胞へと進む過程で、分化開始直後に発現量がすこし落ちてから、その後徐々に発現が上昇するパターンを示す一群の分子(TM1遺伝子群と呼んでいる)だけが、ASD神経分化課程でつねに発現量が高いことを見いだしている。
と言われても、一般の人には何が何だかよくわからないと思う。ただASDで異常が見つかる分子群には、例えば軸索伸長必要な遺伝子など神経の分化に関わる分子が多く、しかもこの変化に一致して、培養中の神経細胞が長い足を伸ばし、試験管内で複雑なネットワークを造ることから、神経ネットワーク形成がASDのiPSでは確かに変化していることがわかる。また、同じようなASD特異的変化は、神経細胞を立体培養して形成させた、小さな脳組織でも認められることを確認している。
治療可能性を探る
これだけでも面白いのだが、Gage たちは発見した現象の背景にある分子レベルの原因を発見するための努力を惜しまない。この結果、彼らが急に発現が変化することを発見したTM1遺伝子群の中から、発生上の変化に関わるキーとなる変異分子FBX03を特定している。そして、FBX03を正常NSCに導入すると、正常細胞の分化のタイミングが変わり軸索伸長能力が高いASD型に変化することを明らかにする。
さらに、Gage たちは治療可能性を探ろうと努力する。NSCから分化細胞への過程でASDの異常が現れるとすると、NSCをすっ飛ばしてiPSから直接分化神経細胞を誘導すればASD型の異常は起こらないはずだと着想し、この可能性を調べている。結果は期待通りで、iPSから直接分化したASDの神経細胞は、ASDの異常は見られなかった。
最後に、ASDでおこる異常分化誘導の前後で染色体の状態を調べ、ASDで見られた異常の多くがエピジェネティックと呼ばれている、遺伝子の使い方の変化によることを明らかにしている。
かなり専門的でわかりにくい話だと思うが、以上の結果をもう一度まとめると、ASDでは神経幹細胞から分化が始まる早い段階で、スウィッチが入って分化に関わる特定の遺伝子群で染色体の抑制が緩み、これらの遺伝子の発現量が上昇する。その結果、神経細胞の突起が長くなりすぎるなど発生異常が起こり、脳の構造変化が誘導されるというシナリオが示された。そしてこの異常シグナルをスキップできれば、ASD型の細胞変化は起こらない。またこの変化の鍵となる遺伝子FXOB3なども特定され、今後治療標的として研究が進むと期待できる。
広く深い知識に裏付けられ、これでもか、これでもかと実験が行われている研究だが、最も重要なメッセージは、やる気になればiPSで、複雑な過程の解析が可能であることが示された点だ。
GageはiPSを用いた細胞治療の実用化で世界をリードする神戸の高橋政代さん、京都の高橋淳さんの先生でもある。この二人を育てたことを足して考えれば、Gageの神経疾患治療への貢献度は他を寄せ付けないように思える。