「自閉症の科学」では、繰り返し繰り返しASDに関わる遺伝子変異の論文を紹介してきたが、これは21世紀に入ってこの分野の研究が急速に進展し、今も多くの論文が発表されつづけているからだ。しかもこれで十分というレベルには到底達しておらず、知識は今もアップデートされ続けている。これを裏返すと、それほどASDの遺伝的背景が複雑であることを物語っている。これまでの研究から見えてきたのは、ASD状態は、多くの遺伝子が合わさって形成される性格と同じような脳の多様性とともに、その多様性が最後に「異常」として表現されるために必要な遺伝的変異が組み合わさって形成されることで、この二つのタイプの変異の質が大きく異なっているという認識だ。
今日紹介したい論文は、ボストンのMITを中心に1万人以上のASDのゲノム配列を調べ、特にASDが異常として表現される遺伝子変異を特定しようとした探索研究だが、論文をいきなりそのまま紹介したのでは、おそらく医学部の学生さんでもすぐ理解するのは難しい内容だと思うので、まず遺伝子変異の質についての基礎知識から紹介してみたいと思う。
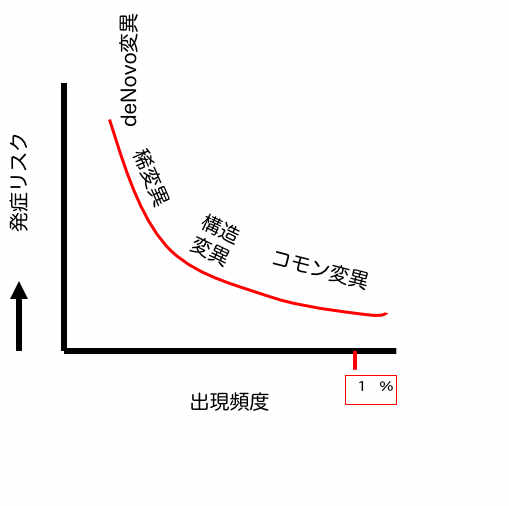
私たちの細胞は外界からのストレスがなくても、細胞が分裂するたびにDNAが複製され、そのたびに様々なタイプの複製ミスが生まれるようにできている。このような個人レベルのゲノムの違いが、環境要因に影響される遺伝子の使い方(エピジェネティックス)と合わさって一人一人の性質や性格の違いを生み出している。図に示すように、こうして生まれる遺伝子変異は、大きく頻度の比較的高いコモンバリアントと、稀にしか見つからないレアバリアントに分けることができる。この、コモン、レアを決めている要因が、遺伝子変異への選択圧力で、例えば個体の生存に関わる多くの変異は、子孫が残せないため集団内の頻度は必然的に低くなり、レアバリアントになる。一方、現在個人の病気の遺伝的リスクを調べるために提供される個人ゲノムサービスの多くは頻度が比較的高いコモンバリアントを調べる検査だ。例えば、身長などはこのようなコモンバリアントがいくつか合わさって決まることがわかっており、最近ではこのようなコモンバリアントの組み合わせから身長を推察することも可能になっている。要するに私たちが一般的な性質や性格と呼ぶものは、コモンバリアントの複雑な組み合わせからなるといっていい。
ASDも、コモンバリアント(CV)、レアバリアント(RV)の両面から調べられてきた。例えば脆弱性X症候群、RETT症候群など特定の遺伝子機能が失われるRVは、発達遅延とともにASD様症状を示すことが知られており、異常状態が発生させる過程を理解するために重要な変異だ。実際このようなRVは、動物に導入するとASDに似た症状を示すことが多く、ASDモデル動物として研究されている。ただ、発達障害のような目立つ症状が出る場合以外は、RVを発見することは難しく、調べるためには千人以上のゲノムを調べることが必要になる。
一方頻度の高いCVのほとんどは個体の生存に直接関わることは少なく、個々のCVは変異というものの、性質の大きな変化につながることはまずない。すなわち変異への選択圧は弱く、結果その変異が一定の頻度で維持されてきたと考えられる。個々のCVの影響は大きくないが、他の様々な変異と合わさることで様々な病気の発症に関わることも確かで、全ゲノムレベルでCVを調べる検査(GWAS検査)で疾患との相関を調べることでリスクを計算することができる。ASDについても多くの研究が行われ、100を超すCVがASDのリスク因子として相関することが明らかになっている。ASDと相関するCV がこれほど多く見つかったと言う事実は、ASDがまさに様々なタイプを包含するスペクトラム障害で、性格と同じようにCVの組み合わせで決まる脳の多様性を反映している根拠として考えられるようになった。
その後次世代シークエンサーの利用により、個人ゲノムのDNA配列を読むコストが急速に低下した結果、千人を越す人のゲノム配列を調べる研究が可能になり、自閉症という一枚のコインを、CV,RV両面から一体的に調べる研究が進み始めた。その典型が前回「自閉症の科学」で紹介した「父親の精子に見られる遺伝的変異のモザイク」(https://aasj.jp/news/autism-science/12266 )についての論文で、この研究では図でde Novoの変異として示した、両親、兄弟にはなく自閉症児本人だけにみられるRVを調べている。

さて、今日紹介したいMITを中心とする国際チームからの論文では1万人を越すASDについて、ゲノムのうちタンパク質に翻訳される部分(エクソン)を解読し、ASDだけに存在し、一般人には見つからないRVを探索している。RVを特定したい場合、対象が多ければ多いほど新しいRVを見つけることができる。これまでの研究では千人規模だったので、1万人規模にスケールアップすることでさらに稀なRVも見つけることができる。ただ、この探索には終わりはなく、次は10万人、その次は100万人と、すべてのASDリスクRVがリストできるまで研究は続くと思う。従って、この研究も中間報告として考える必要がある。
膨大な研究なので詳細は省いて、RVを調べることの意味を中心に以下にまとめてみた。
- 分子の構造変化につながるRVがASDでは3.5倍多く蓄積する傾向がある。逆から言うと、ASD発症には確かに分子機能の変化を伴うRVが関わっている。統計学的には、RVはASDで見られる変異の2%ほどで、50%以上はCV。
- RVの頻度は女性のASDの方が2倍高い。ASDは男性が圧倒的に多いことを考えると、この結果は不思議に思われるかもしれない。しかし、女性がASDを発症しにくいということは、逆に発症のためには男性より多くのRVが必要であることを意味し、これまで考えられていた様に、女性はASDになりにくい事実の裏返しと見ることができる。
- この研究では全体で102種類のASD特異的RVと特定されたが、そのうち60は新しく発見されている。即ち、対象の数を増やせばさらに新しいRVが発見できる可能性がある。
- ほとんどのRVは神経細胞で発現しており、ASD特異的RVp(53種類)と、他の精神疾患にも見られるRVn(49種類)に分けることができる。他の神経疾患でも見られるRVを持つ児童は、歩く時期が遅く、軽度の発達障害が見られる事から、RVpとRVnの機能は異なることが推察できる。
- RVの機能は、遺伝子発現調節に関わる分子か、シナプスなどの神経管結合に関わる分子に分けられる。また、101種類のRVは出生前の脳で発現が高い事から、神経発達に関わると推定される。
これ以外にも、いくつか面白い解析が示されてはいるが、あまりに専門的になるので割愛する。
要するに対象の数を増やすことで、ASD特異的RVを特定することができ、統計学的解析からこれらRVが確かにASD発症に関わることが証明できたと言える。
これまで自閉症と相関することが発見されたCVがあまりに多いため、ゲノムから新しい治療法を発見することは難しいのではと考えられてきたが、この脳の多様性が「異常」として表現されるために必要なASD特異的RVが明らかになることで、ゲノムからASD治療法を開発することも夢でないと思っている。



