多くの国で新型コロナウイルス感染の勢いが少し落ちてきたようだが、今日の時点でcovid-19でPubMedを検索すると、この病気(以後covid-19)に関する論文は6500で、最初の論文が今年の1月だったことを思うと、指数関数的に増殖中といっていいだろう。隠居していても論文を追うだけで、世界の医学者が一つの目標を共有しているのを感じられる。
特に最近感じられるのは、臨床や病理についての論文が増えて、徐々に症状からメカニズムまで頭の整理ができてきた点だ。整理がつくと新しい課題もわかってくる。そこで自分の頭を整理する意味で、時間軸に沿ってcovid-19感染症についてまとめてみることにした。
三密とか、social distancingなどはすっ飛ばして、感染してからを考えてみる。
最も重要なのは、感染がどこから始まるか?だが、よほどの濃厚感染でない限り、おそらく鼻粘膜が最初の入り口になるのだろう。以前紹介したように、SARS-CoV-2(V2)が感染するためにはホストの細胞にACE2とTMPRSS2が発現していることが条件になる。

4月23日にオンライン出版されたNature Medicine(上図)によると、この条件を満たす臓器は、鼻粘膜、肺、大腸、胆嚢で、例えば飛沫を吸い込んだとすると、ほとんどは上気道でトラップされることを考えると、鼻粘膜の分泌細胞や繊毛細胞が最初のウイルス増殖の場になると考えられる。
この可能性は、最近ドイツ・シャリテ病院がNatureに発表した、covid-19に罹患した9症例の詳しい検討からも裏付けられている。

この研究によれば、症状が現れてから5日程度は鼻粘膜のシュワブに最もウイルスが検出されており、その後10日にかけて減っていく。おそらく初期に嗅覚や味覚が失われるのは、この時期を反映しているのだろう。
少ない症例ではあるが、この研究で最も驚くのは、半分の患者さんがIgM,IgG抗体を7日までに作るようになり、14日までにはほぼ全員が抗体を作っている点だ。すなわち本来なら、ここで感染は収束してもいいことになる。ほぼ8割の人が、症状が出ても軽症で終わるというのはこれを反映している。
この研究でも2例が軽症の肺炎まで進んでいるが、残りはこの第一段階で回復している。重要なのは、抗体の量だけで第二段階の肺炎まで進むかどうかは予測できない点だ。何れにせよ、肺の感染が起こると、さらに長期間感染性のウイルスRNAが痰の中に検出され続ける。
一方肺炎期も含めて、便にもPCRでウイルスRNAが検出されるが、感染性のウイルスが全く検出できないことから、大腸や胆嚢に感染条件が揃っていても、ウイルスは上部消化管(おそらく胃で)不活化されるのだろう。
ここで最も知りたいのは、上部気道から肺への感染が広がる経路だが、おそらく気道を通ってと考えるのが一番自然だろう。この場合、血清中の抗体がまだ役に立たないことも十分考えられる。また、前の論文に戻ると、肺で感染条件を備えている細胞の比率は上気道と比べると極めて低いことがわかる。とすると、上気道を伝わってウイルスが伝播しようとしても、確率は高くないはずで、この時運悪く肺の分泌細胞に感染した人が2段階へと進むことになる。
鼻の細胞もそうだが、肺で感染条件が揃った細胞は、自然免疫にかかわる分子を発現していることから、ウイルスの刺激によりサイトカインやケモカインを分泌する。当然これが、重い肺の症状につながっているのだろう。悪いことに、V2はSARSと同じで、STAT1を抑制することで1型インターフェロンの転写を抑える仕組みを持っている。これはエボラウイルスも同じだ。このため、ウイルスを叩こうと自然免疫がより強い反応を起こして、重度のサイトカインストームを伴うARDSへと発展するのだと思う。
以前紹介したが、ARDS段階でもウイルスに対する抗体治療はかなり効果を示す(https://aasj.jp/news/watch/12765)。従って、肺で新しい細胞へ感染が続くことがARDS維持の大きな要因になっていると考えられる。さらに、抗体治療後かなり短期間でサイトカインストームも抑えられていることを見ると、ウイルス粒子自体が細胞表面状のTLRを介してサイトカインストームに寄与しているかもしれない。
肺炎段階は多様性が高く、重症ではあるがそれでも多くの患者さんは回復できる。問題はその中の一部の患者さんが、ショック状態を来して亡くなられることだ。これについては、重症の患者さんで、d-ダイマーと呼ばれるフィブリンの分解産物が高く、DICと呼ばれる血管内凝固が起こっていることがヒントになるだろう。そのため、マサチューセッツ総合病院では、抗凝固剤治療を入院時のルーチンとして行うべしというマニュアルを作っている。
これに加えて、個人的に気になるのが、最近続いているACE2の発現が見られない細胞へのコロナウイルスの感染だ。例えば、4月17日にチューリッヒ大学のグループがThe Lancetに発表した3例の剖検例では、全員で血管内皮へのV2の感染を確認している。この論文では低いレベルでもACE2が血管内皮に発現しているからだと結論している。
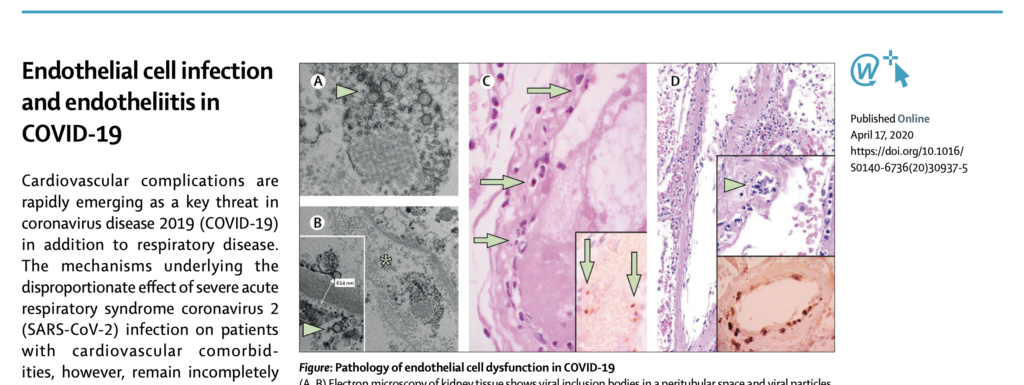
しかし、同じ4月17日The Lancetに中国のグループが発表した仮説は、他にも感染経路があることを教えてくれた。

この論文では、一部の人で病状が急速に悪化し、全身性ショックに至るメカニズムについて考察している。考察自体は断片的で、ウイルス敗血症という概念だけを強調した仮説だが、この中でウイルスが全身に広がるメカニズムとして、ACE2を発現しないT細胞やマクロファージにウイルスが感染していることを示した論文が引用されており、本当なら面白いと思った。
というのも、抗体によってウイルス感染が急速に悪化するケースが知られているが、一つの可能性はウイルスに結合した抗体が、マクロファージやリンパ球のFc受容体を結合して、これがウイルス感染を助ける可能性だ(これは想像しているだけで、エビデンスに基づいて言っているわけではない)。もちろん、直接貪食によって取り込まれることもあるかもしれない。しかし、一旦マクロファージやリンパ球にウイルスが取り込まれると、全身性の感染症へと発展してもいい。この経路ができてしまうと、肺炎と同時に着々と全身性感染の準備が整っていく。これはウイルスが血中に出てくるという単純なものではなく、ウイルス感染の拡大と、その結果としてのサイトカインストームが全身で起こるようになり、その結果としてDICによるショックが予想以上のスピードで起こるのかもしれない。
最後の段階は本当かどうかはわからない。今後、血球も含めたウイルス検査や、DIC予防などのデータが集まることで、可能性は確かめられるだろう。何れにせよ、これがcovid-19についての私の頭の整理だ。



