2020年度、2019年度決算報告書
5月28日 自閉症のゲノム研究3:発生過程での体細胞遺伝子変異を調べる(自閉症の科学47)
今回から少し難しい内容になりますがご容赦ください。
これまで、1)自閉症スペクトラム(ASD)特異的に見られる102個の遺伝子突然変異を特定した論文(https://aasj.jp/news/autism-science/15576)、そして、2)このリストの中の遺伝子変異が脳発生に関わっていることを、カエルやヒトiPSを用いて示した研究(https://aasj.jp/news/autism-science/15595)をとりあげて、最新のゲノム研究がASDにどう迫っているかを紹介してきた。
この2編の論文で研究された遺伝子の多くは、de novo変異と呼ばれ、親から伝わった遺伝子変異ではなく、多くは親の精子や卵子の発生過程、場合により本人自身の初期の発生過程で起こってきた変異で、これが脳ネットワーク形成に影響を及ぼし、ASD発症の決定的後押しをしていると考えられるようになってきた(図1)
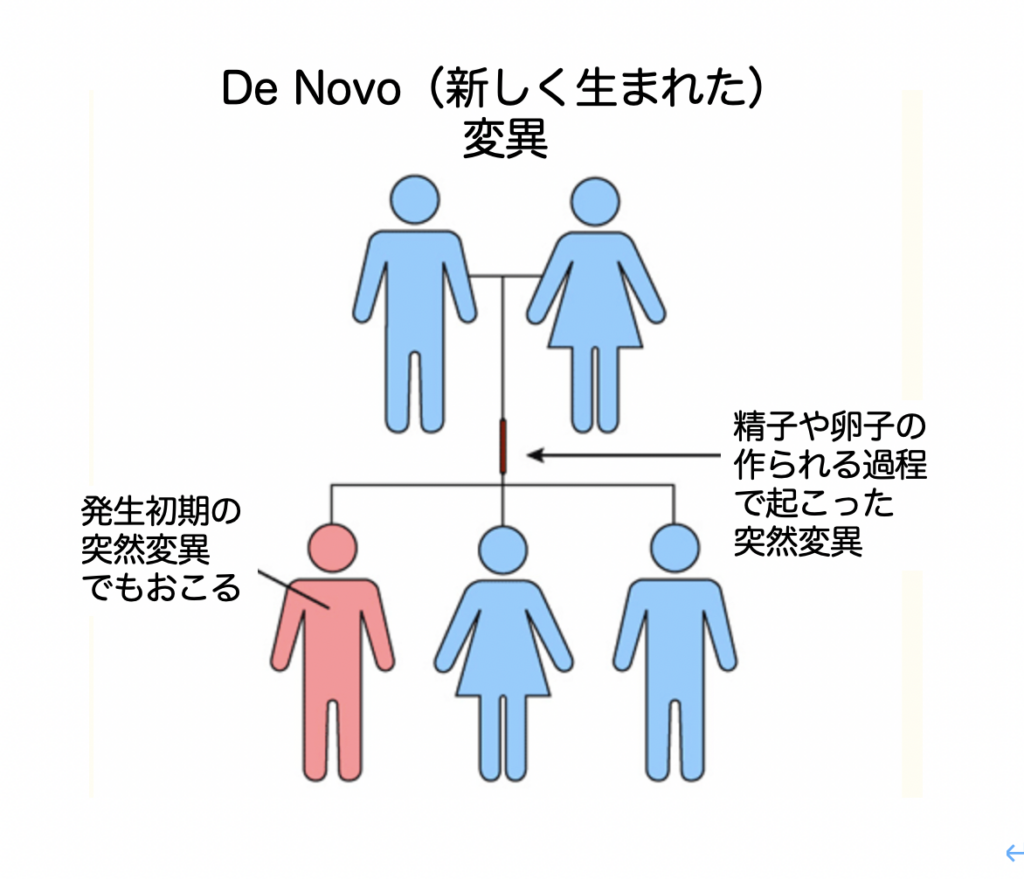
図からわかるように、このようなde novoの変異を特定するためには、ASD本人で見られた遺伝子変異が、親兄弟には存在しないという消去法を用いざるを得ない。逆に、de novoの変異が本当に発生していることを示そうと思うと、1)精子や卵子の発生過程、2)受精卵からの個体発生の過程に焦点を当て、ASDに関わるレア変異が起こっていることを示す必要がある。
ところが、例えば精子形成過程でASDに関わる変異が起こることは理論的には予想できても、実際に起こっていることをDNA解析で示すのは簡単ではない。というのも、もともとDNA解析には読み間違いが伴うため、何度も読み直してコンセンサスを取ることで、正しい配列を決めるように設計されている。例えば変異が1%の確率で見られるとしても、それを遺伝子解析時の読み間違いとして見落とす可能性があった。
幸いシークエンサーの精度が上がったおかげで、例えば200回繰り返し読んだ時、2%以上の頻度で現れる変異の場合は、読み間違えではないと認定できるようになってきた。これを利用して、ASD児の父親から提供を受けた精子ゲノムを解析し、父親の精子形成で発生した結果、子供に伝達されたde novoの変異を探したのが、最初に紹介する論文だ。

この研究では、ASD児を持つ8家族について、ASD児にのみ見られるde novo変異を912種類特定し、この変異をお父さんの血液や、精子で見つけることができるかを調べている。
もし変異がお父さんの発生途上で生じた場合は、精子だけでなく血液細胞にも見られる。一方精子だけに認められる場合は、精子の元の細胞が他の細胞から分かれた発生後期に変異がおこったと考えられる。一方、精子を作る元の細胞から精子細胞ができる場合にも変異は起こるが、これは頻度が低く、200回繰り返してゲノム配列を読んだ程度では見つけることは難しい。
事実特定されたde novoの912変異のうち、父親由来の染色体上の変異はほぼ半分の501個で、そのうち20種類が父親の精子あるいは血液で発見されている。すなわち、大半のde novoの変異では発生時期を特定できないが、少なくとも4%では、確かに父親の精子形成過程でde novoの変異が発生したことが確認されたことになる。さらにASD児に見られるのと同じ変異が、今回の調べた精子にも存在していることは、この変異が精巣内の精子を作る幹細胞に存在し、持続的に変異精子を作り続けていることを示している(このような状況を変異と正常のモザイク状態と呼んでいる)。
このような変異の多くは、ASD発症に重大な影響を及ぼす変異であることも確認しており、これまで2回にわたって述べてきたように、ASDの発症にde novo変異が大きな役割を負っていることが確認された。このように発生過程で起こった変異は、父親の精子として常に作り続けられるが、幸いほとんどはその頻度は低く、繰り返し子供に伝達されるリスクは低い。しかし今回特定された20変異のうち2変異は、それぞれ14.7%および8.9%という高い頻度のモザイクになっており、これほど高い頻度で存在すると、一定の確率で子供に伝達されることが予想される。
このような場合、同じ変異は精子だけでなく、血液でも見られることから、父親の発生初期過程で起こった変異で、多くの組織に同じ変異を持つ細胞が分布していることが予想できる。
これ以上詳しくは説明しないが、de novoの変異の一部は、親の生殖細胞発生過程のどこかで生じたもので、発生初期に発生した変異ほど、複数の子供に伝達される危険が高いことがわかる。以上の結果から、ASD児のde novoの変異を特定し、同じ変異が父親の精子(母親では同じ検査はできない)で見られる頻度を確かめることで、変異が子供に繰り返し伝達されるリスクがわかることを示唆している。
以上は通常の遺伝形式でなくても、de novoの変異が父親の発生過程で起こり、組織内で変異細胞のモザイク状態が形成されると、de novoの変異として子供に伝達されることを示している。もちろん父親だけでなく、母親の卵子形成過程でも同じことが起こっていい。
これに対し、父親の精子にも、母親の卵子にも、問題になるde novoの変異がなくとも、子供の初期発生過程でde novoの変異が起こり、それが脳細胞で発現して、ASD発症に寄与する可能性も存在する。
この可能性を調べたのがボストン小児病院からの論文だ。

ASDは高次脳機能に関わる状態なので、この研究ではASDと診断され、何らかの理由で亡くなった方59人の脳組織について、全ゲノムを250回繰り返し読むことで、子供の発生過程で起こったde novoの変異が、脳で働いてASDの原因になる可能性を調べている。この精度で遺伝子配列を読んだ場合、受精卵が5-6回分裂して32-64細胞に達するまでに起こった変異であれば、de novoの変異として検出できる。
ASD、正常を問わず一定の確率(一回の細胞分裂あたり2−3変異)でde novoの変異は生じる。変異をさらに詳しく調べると、正常人でも50%で、機能が障害される変異を持つ細胞が2%以上の確率で存在することもわかる。すなわち、正常の脳など存在しないことがわかる。
しかし、変異の性質を調べていくと、ASDの脳では、脳機能に関わる遺伝子の発現に関わる遺伝子の変異の頻度が多いことも明らかになった。すなわち、脳の発生過程でたまたまこのような変異が起こってしまうと、ASDのリスクが高まることを示している。結果、ASDの人を調べると、症状につながる変異の頻度が高まっていることになる。
以上が結果で、前回2回に分けて紹介したde novoの変異が、どのように発生するのかが分かってもらえたのではないだろうか。DNAシークエンサーの進展により、これまでほとんど不可能だったレベルのASDゲノム研究が可能になっているのをみると感慨が深い。
次回は、変異の中でも、特に最近注目されてきたTandem Repeat(縦列反復)のリスクについての論文を紹介する。
5月28日 少し変わったアルツハイマー病治療の可能性(5月24日 Cell Stem Cell オンライン掲載論文)
アルツハイマー病(AD)=βアミロイドという時代が終わり、Tau、炎症、細胞老化、Proteostasis, 幹細胞と数え切れないほどの治療可能性が現れ、AD研究分野は新しい収穫期に入ったように見える。例えばTauタンパクへの介入では、5月12月号Science Translational MedicineではTauに対するモノクローナル抗体治療でTauの蓄積を抑制できるとする前臨床および第一相の治験論文が発表されていたし、

5月26日には同じScience Translational MedicineにPAC受容体を活性化して、ポストシナプスに集まっているTauを除去して、ADを治療する可能性が示唆されていた。

実際にはAβに対する抗体治療開発から分かるように、これらの治療方法でも前臨床研究からの長い道のりが待ち受けていることが予想されるが、AD克服も夢では無いことが実感できる賑わいだ。
そんな中で今日紹介するオランダ神経科学研究所からの論文は、マイクロRNAを用いて神経前駆細胞から分化細胞までの過程を高めてADを治療しようとする、少し毛色の変わった研究で、5月24日Cell Stem Cellにオンライン出版された。タイトルは「Restoring miR-132 expression rescues adult hippocampal neurogenesis and memory deficits in Alzheimer’s disease(miR-132発現を回復させることで成人アルツハイマー病海馬での神経生成を正常化し記憶を回復させる)」だ。
このグループは最初からADで神経前駆細胞からの分化細胞の供給が低下していることに焦点を絞り、これを正常化する方法を探ってきており、その中でこの過程に影響の大きい分子の一つとしてmiR-132を見出してきた。
この研究ではまず、AD患者さんの海馬歯状回で、神経前駆細胞の増殖が低下していることを確認し、ADには分化した神経細胞の変性に加えて、分化細胞を供給する幹細胞システムの活性低下があることを確認している。
あとはアミロイド沈着が促進するADモデルマウスを用いて、miR-132は運動により神経細胞に誘導され、分化細胞の供給を高めるが、アミロイドの沈着が始まるとmiR-132の発現が抑えられることを示している。
次に、miR-132をマウス海馬でノックダウンし、マウスに運動をさせると、普通ならmiR-132の上昇と並行して起こる神経前駆細胞の増殖分化が抑制されることを示し、miR-132が神経細胞増殖に関わっており、生きたマウスで発現量をコントロールできることを確認している。
あとは、ADマウスモデルにmiR-132を注射することで、前駆細胞から分化細胞への増殖を高めることが可能であること、その結果マウスの認知機能の低下を抑えられることも示している。
他にも、試験管内で人間の神経細胞を用いてmiR-132の影響を調べたり、miR-132により、mRNAの発現がどう変わるかなどを調べているが、効果のメカニズムに迫るところまでは行っていない。
以上、しかし割と投与しやすく、比較的長期間効果を発揮できるRNAによる治療が、しかも細胞の供給を高めることで可能だとすると、変性を防ぎ、失われた細胞の供給を高める、新しいコンビネーション治療開発が可能ではと期待できる。



