ゲノムの発生学 I
2015年10月15日
ゲノムの解剖学、そしてゲノムの働き(生理学)とくると、当然次ぎにくるのはゲノムの発生学だ。ゲノムの発生学のほとんどは進化の過程とオーバーラップするはずで、この紙面で簡単に説明することなど叶うはずがない。代わりに今回からゲノムの発生学として、これまであまり議論されてこなかった観点からゲノムの誕生や進化の過程をゆっくり整理し直したいと思っている。今回は、そのイントロダクションになる。
重要なことは、ダーウィン時代と異なり、ゲノムの解剖学や働きについてずいぶんわかっている点だ。従って、ゲノムについて理解が進んだ時代のゲノム発生学(進化学)とは何かを考えることになる。これまでゲノムの解剖学や生理学の説明を通して、ゲノムは多様な内容を表現していても、結局は情報であるとことを強調してきた。この意味で、ゲノムの発生学を考えようとすると、情報の発生学を考えることになる。ところが日常情報という言葉を当たり前のように使っている我々も、情報の発生学と言われる何を考えていいのか戸惑う。なぜだろう?まず生物のゲノムを私たちが普通使っている情報との比較をしながら考えてみよう。
生物が生きて活動するオペレーションのためにゲノムが表現している情報には、アミノ酸配列の情報、機能的RNAの配列情報、遺伝子発現を調節するための様々な情報、遺伝子の円滑な発現に必要なゲノム構造化のための情報など、多様だ。ただゲノムを分解してみると、ゲノム上の情報のほとんどは、全て生命オペレーションに必要なタンパク質と様々な機能的RNAを必要に応じて作るために組織化されている情報と言える。このため、生物を機械にたとえ、ゲノムを生物の設計図と説明する人がいる。例えばゲノムについてかかれた本を見てみると、「初めて学ぶゲノム生物学:生命の設計図」、「ゲノム:命の設計図」、「ゲノム=人間の設計図をよむ」などのタイトルが踊っている。個人的には設計図より、パソコンのソフトウェアのように、生物のオペレーションの指令書といった方がまだ正確なように思えるが、なぜ私たちはゲノムを設計図や手順書に似ていると考えるのだろう?
デカルトは人間を心と体に分け、体は機械と同じだと考えた。また心のない動物は機械でしかないとも考えた。そしてこのドグマはほとんどの生命科学分野の根幹を今でも脈々と流れている。しかし、実際の生物は機械とは全く違っていると誰もが直感する。何が違うのか?
自分で考えて将棋を指すように見えるコンピュータといえども、機械はその背景に設計者、すなわち人間の意図が存在している。例えばシャベルカーを考えよう。シャベルカーは穴を掘るという人間が決めた目的に従って設計され、組み立てられる。そして完成したシャベルカーを運転してその意図を実現するのも人間だ。動いていない機械だけを見ているとそこに人間の存在はないが、実際には機械そのものが人間の意図の塊だ。石より固い鉄、自由な動きを可能にする油圧システム、駆動エンジンなど、本来はシャベルカーとは全く別に開発されてきた数多くの部品が、シャベルカーに集められている。全ては設計者(=人間)の意図に従って組み立てられるが、シャベルカー位複雑な構造になると、この意図を情報として表現する指示書や、設計図が必要になる。さらにこの機械を設計するのも人間であることから、運転する人間が扱いやすいよう設計するのも重要だ。
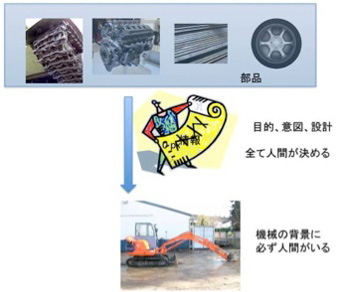
図1 あらゆる機械はその背景に人間の意図や目的が存在し、それに合わせて設計される。
現代なら、人工知能を導入した自動のシャベルカーも存在しているはずだ。自分で学習し、初めての場所でも上手に穴を掘ることができるかもしれない。しかし、一旦人間により決められたシャベルカーの目的は変わることはない。シャベルカーが自分で目的を逸脱してスポーツカーになることは決してない。これは、人間が操縦しようと、全自動であろうと、全ての機械の目的は人間により決められており、またそのオペレーションも人間との対話の上で行われるよう設計されている。
少し余談になるが、最近自ら考え判断する人工知能の開発が進められているが、これが成功するといつか人間から独立し、人間を支配するのではないかと心配されている。ただ人工知能も機械である以上最初の目的は人間が与える。このとき心配する必要があるのは、与えられた目的をもっとも有効に成し遂げようとして、人間を排除することだ。例えば人工知能に穴を掘れと命じて、その後途中で穴掘りをやめさすためスウィッチを切ることを考えてみよう。もし人工知能がこのやめるという意思を、目的遂行を邪魔すると判断すれば当然スウィッチを切ろうとした人間は排除されるだろう。とはいえ、機械はその背景にある人間の決めた意図なしでは存在しない。
この機械の背景にある人間の意図と同じものを、私たちは生物にも感じる。この感覚が、私たちにゲノムは生命の設計図と言わせている。もしデカルトに、生物という機械に外から目的(設計図)を与えているのは何か?と直接質問したら、おそらく彼は生物に目的を与え、それに沿って設計するのは神だと答えるように思う。すなわち、機械の背景に必ず人間がいるように、生物という機械には神の意志が存在すると考えていた。しかし、神を生物の背景から排除すると(私は当然だと思っている)、機械に対する人間のように、生物に目的やデザインを与えるものはどこを探しても見当たらなくなる。実際にはこの生物の目的の探求が、18世紀自然史思想の誕生以来続けられ、ダーウィンを経た後ようやく見えてきた解の一つがゲノムに集約した。この歴史を考えると、生命の構成成分をコードする遺伝子が組み込まれたゲノムを設計図や指令書と考えて不都合はない。DNAという媒体は物質だが、ゲノム自体は情報で、物質的ではないし、目にも見えない点でも、機械の背景にある人間の意図に似ていると言えるのではないだろうか。
しかし、ゲノムを生物の設計図や指令書であることを認めたとしても、機械の設計図とは全く違う問題がゲノムにはある。それは書いた人がいないという問題だ。私たちは普通の情報を考える時、それがどうしてできたか、すなわち発生学はあまり問わない。というのも、情報には確実にそれを発信した人間がいるからだ。機械のデザインや設計図も同じように、書いた人がはっきりしている情報だ。一方設計図と言っても、ゲノムには書き手がいない。このため、ゲノム情報を考える時は、書き手がいないのに情報がどうして生まれるのかをまず知る必要がある。
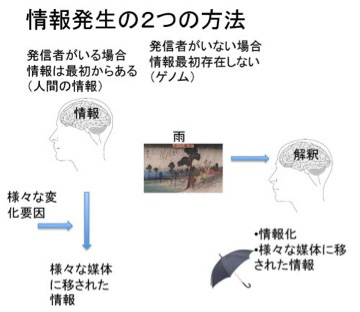
図2 普通情報にはその発信者がいる。しかし、発信者のいない現象も、解釈という過程を介して情報化することができる。
私たちが情報について語るとき、必ずしも発信者のはっきりした情報だけが念頭にあるわけではない。例えば、私がこの原稿を書くのに疲れて窓を見ると、天気は秋晴れだ。ちょっと散歩でもするかと伸びをして部屋から出たとしよう。これは、窓の外の日光の様子を私が心地よい秋晴れと解釈した結果だ。逆もある。例えば雨が降っていたら、傘を持って外に出る。これも雨が降っているという情報を私が傘を持って出ることを指示する情報と受け取ったからだ。この場合私が情報として受け取った天気の状態は自然現象で情報ではない。同じ雨でも、畑にとって恵みの雨もあれば、川の氾濫を引き起こす雨もある。全て状況と解釈者の状態によって決まる一種の解釈だ。すなわち、誰かが書いた情報でなくとも、それを解釈する主体があれば情報になる。発信者のいないゲノムが情報になりうるのは、この解釈という能力がゲノムに備わっており、この過程を通してゲノムが情報化していくと考えられる。
この解釈プロセスは、原始生命誕生時のDNA分子が情報を担う様になりゲノムが誕生する過程と、ダーウィン進化過程に分かれる。次回からできるかどうか自信はないが、この過程についてさらに考えてみたい。
[ 西川 伸一 ]
ゲノムの発生学II
2015年11月2日
物理化学現象を人間が解釈するとき現象の情報化が起こるが、本来物理・化学に情報という概念はない(量子力学は少し忘れよう)。従って、生命が誕生するまで、物理化学法則のみが支配する地球に情報は存在しなかった。最初の生命については知る由もないが、生命誕生とほとんど同じ時期に(同時という意味ではない)、DNAを媒体とするゲノム情報が生まれたことは間違いない。これが地球における最初の情報の誕生になる。ゲノムの発生学はもちろんこの誕生から始まる。自信がないが、地球上での情報の誕生について今回は考えてみよう。
発信者なしに情報が生まれるためには、もともと情報でないものを情報として解釈する「主体」が必要になる。ただそんな主体は生物誕生前にはもちろん存在しない。最初に存在したのは物理化学法則に従う分子と分子の相互作用だけだ。しかし、分子間相互作用も一つの分子の側から見てみると、近づいてきた分子と結合するか離れるか、自分の構造に基づいて解釈していると言える。したがって、解釈という行為自体は核酸のような情報分子に限らず、どの分子にも考えられる。しかし私たちの住む大気の中で、酸素、炭酸ガス、窒素は常に衝突しているが、それぞれが反応する(解釈する)ことはほとんどない。すなわち、解釈のような振る舞いは、複雑化した分子構造のほうが生まれやすい。特に有機分子のポリマーは様々な分子と相互作用が可能だ。タンパク質や核酸が様々な高分子と「非特異的」に結合することは、生化学実験の経験者は誰もが知るところだ。
次に考える必要があるのは、この条件を満たす有機ポリマーが原始の地球に存在していたかどうかだ。生命に頼らず有機物を合成する有機化学はヴェーラーの尿素合成までさかのぼる。ただ、生命誕生に関わる化学の先駆は、ユーレイとミラーのアミノ酸の合成実験で(図1)、この研究以後生命誕生の化学について地道な研究が進んできた。
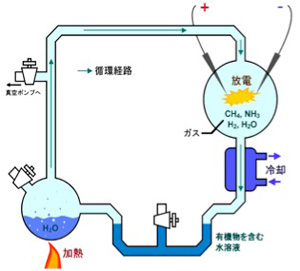
図1 Urey-Millerのアミノ酸合成実験。水蒸気とメタン、アンモニア、水素を混合した反応容器に、雷を模した放電を行い各成分の反応を誘導、得られた化合物を水にトラップし、また加熱して反応容器に循環させる。この方法で様々なアミノ酸が合成できることを示した歴史的実験(Wikiコモンズより)。(Science 130, 245, 1959)
この実験以降に蓄積されたデータを詳細に解説するのは私には荷が重い。都合のいいことに、これまでの研究をまとめると、核酸、アミノ酸、脂質など有機化合物は生命以前の地球で合成されていた可能性が高い(合成できていないと生命は誕生できないことから当然だが)。また、自由エネルギーから見たとき、簡単には起こりえない有機分子のポリマー形成も、熱、濃縮、氷結などの変化が、鉱物や粘土などの自然の触媒と組み合わさると可能であることが示されている。例えば、モンモリロン石は、アミノ酸の重合と、リボ核酸の重合を促進する触媒活性を持っており、アミノ酸、核酸のポリマー形成を誘導できることが示されている。従って、アミノ酸や塩基が重合した様々な長さのポリマーが原始の地球に存在しできた(このabiogenesis, systemic chemistryについては優れた本や総説が書かれており、とりあえずKepa Ruiz-MirazoらのPrebiotic systems chem.istry: new perspectives for the origin of life, Chemical Review 114, 285-366, 2014 を紹介しておく。)。
次の問題は、様々な有機分子が存在するようになった地球で、情報、特に核酸を媒体とする情報が生まれた過程だが、これについては全くわかっていないし、実際に起こったことを特定することは永遠にできないかもしれない。しかし様々な可能性を考えることは可能だ。一つの可能性を考えてみるが、すべて私の頭の中妄想だと思ってほしい。
明確な意図やデザインの元に合成されたわけでなくとも、アミノ酸や核酸がランダムに繋がって生まれた分子同士が、互いに相互作用できることが知られている。しかし相互作用と言っても全ての相互作用は偶然の産物で、ただ分子同士が付いたり離れたりしているだけだ。ただランダムにでも多様性が生まれると、その中から一部が選択され進化が起こることを思い出してほしい。環境による選択は多様な分子反応の間でも起こり、その結果反応が向かうべき目的のようなものが生まれる。すなわち、ダーウィンの進化論を生命のない分子にも適用することができる。例えば分子の安定性と持続性という目的が自然に反応している分子の間に生まれることは十分考えられる。他の分子より高い安定性があると当然存在時間が長くなる。分子の存在時間は環境による選択の結果として現れ、ダーウィン進化での「長い首」と同じ目的性が生まれる。
このような選択が起こることを一番理解できるのがホモキラリティーという現象だ。例えば地球上の生物に存在するタンパク質はL-型アミノ酸だけからできている。一方糖鎖になるとD-型だ。ランダムに合成されるアミノ酸の中からなぜ生物はL型のみを使うようになったのか?すべての生命でこの選択が行われていることから、おそらく生命誕生以前のabioticな過程で、ホモキラリティーが生まれたと考えられ、そのメカニズムの研究が進んでいる。メカニズムはともかく、この現象から生命の関与なしにこのような選択が生物界全体で起り得ることを理解することができる。
分子の安定性は、一つの分子だけでなく、幾つかの分子の組み合わさったセットとして生まれる可能性が高い。例えば、アミノ酸や核酸が重合したポリマーは私たちが考えるよりはるかに壊れやすい。溶液中のイオン構成や、あるいは他のポリマーとの相互作用により少しでも分解されにくくなれば、一つの分子単独ではなく、分子が組み合わさったセットが選択されることは十分考えられる。分子間相互作用の結果、安定性だけでなく分子の増幅ができればなお高い環境への適応性が生まれる。
実際、ランダムに形成されたポリマーの中には、新しいポリマー形成を促す触媒のような性質を持つ場合があることも知られている。例えば、塩基が10個並んだRNAポリマーがあると、さらに長い50個並んだポリマーが形成できることが示されている。他にも、アミノ酸や塩基が長いポリマーを作る段階では、できたポリマーの一部が一種の触媒の働きをして、より長いポリマーを形成するのに一役買っていることも示されている。
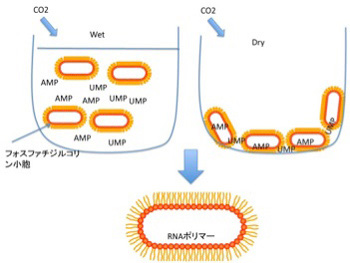
図2 脂肪酸膜小胞とAMP,UMPを混合して熱をかけながら、乾燥と水和を繰り返すことでRNAポリマーが形成できることを示した実験。同じような条件で、鋳型になるDNAを存在させると、10%のエラー率で複製が起こることがその後示された。
中でも興味を引くのが、脂肪酸と核酸が相互作用する状況では様々な反応の効率が上がるという実験だ。例えば、AMP,UMPのようなリン酸塩基をフォスファジル酸から作った小胞と混ぜ、熱を加えながら炭酸ガスを吹き入れ乾燥させ、その後また1mMHClを加えて溶解するというサイクルをくり返すと、脂肪膜の小胞に閉じ込められたRNAポリマーが合成できることが示された(Orig Life Evol Biosph 38:57、2008)。普通、実験室で核酸を重合させるとき、重合が自然に始まるよう核酸モノマーを活性化するのだが、この実験で使われたのはAMPとUMPで全く活性化されていない。熱と乾燥による濃縮が繰り返す条件さえ外部から与えれば、脂肪酸の助けでRNAが重合化することが示されたことは、後でのべるRNAワールドの可能性を示す重要な貢献だと考えられている。DNAの複製についてはさらに驚くべき結果が報告されている。50merの鋳型と、AMP,GMP,CMPなどをPOPA (palmitoyl-2-oleoyl-sn-glycero-3-phosphate)と混合して、熱を加えながら乾燥と水和を繰り返すと、10%程度のエラーはあるものの、鋳型に合わせたDNA複製が起こることが、2011年カリフォルニア大学サンタクルズ校のグループによって示された(Biochimei 93, 556, 2011)。以上のように、ランダムな有機分子の相互作用が脂肪膜に囲まれたRNAやDNAのポリマーの形成にまで発展できる。
このようなシステム化学の研究と、現存の生命に見られる有機高分子の機能分担を合わせて考えると、例えば複製にはDNAが適していること。一方、化学反応の触媒としてはタンパク質、脂肪が適していること。そして、RNAは両方の機能を持ち得ることや、タンパクとDNAの両方と相互作用が可能で、両者の機能を結びつけることができる分子であること。そして、必要なすべての化学エネルギーは核酸の構成要素にもなるATPを介して行われる、などの条件が整って行ったと考えられる。また、このような性質を持った有機高分子を含む分子混合物は、生命以前の地球の様々な場所に存在し、互いに反応しながら主に存在持続時間という点から選択が行われたと考えられる(図3)。
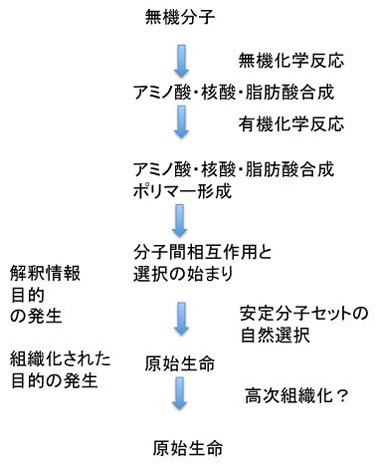
図3 原始生命誕生までの過程
しかしこれだけでは安定な個別の分子セットが選ばれるという過程の繰り返しで、発信できる情報や生物の誕生には至らない。この過程で生まれるのは脂肪酸膜で囲まれた安定で、場合により増幅可能な有機物に過ぎない。中でDNAが複製したとしても、結局は安定な分子の集合でしかない。次の段階に進むためには、有機体(生物)の語源になっている、Organize(組織化)が何らかの目的のために行われる必要がある。この目的こそが、生物が生きるという目的を示すルーツであり、また生命の基本条件になっている。この生きるという目的の一つは、生きるためのエネルギー収支を可能にする分子ネットワークで、これが何よりも最初に必要だとする考えがenergy firstモデルだ。これに対して増える・複製できることがまず必要だとするのがreplication firstモデルだ。次回から順にこの二つの考えについて見ていこう。
[ 西川 伸一 ]
熱水噴出孔と生命誕生
2015年11月16日
私たち団塊の世代が生命科学に魅せられた時必ず読めと勧められた本の1冊がシュレジンガーの「生命とは何か?」だ(図1)。

図1 シュレジンガーと著作「生命とは何か?」。版権の関係で私が読んだ岩波の「生命とは何か?」の代わりに英語版を掲載した。
生命は物理化学法則のみが支配する地球で誕生した。当然生命は物理化学法則の延長として理解すべきと考える人も多い。しかし、生命誕生によって情報も含めて地球上に新しい法則が誕生したと思っている者も少なくないと思う。私はその一人だが、そんな私にとってシュレジンガーの「生命とは何か?」は、量子力学者シュレジンガーが生命を物理学者の目で見たとき、生命固有の法則が潜んでいそうな場所を探している本に思えた。本の中で生命固有の課題として強調していたのが、生命体がエントロピーを増大させないよう、エネルギーや有機物を調達する過程と、同じ個体が増殖する過程だった。これを読んで、いずれかの問題を生物学固有の課題として考え研究を志した若者も多かったはずだ(私は途中で挫折したが)。
この分野について最近書かれた本や論文を読むと、生命誕生過程でこの二つの課題のどちらが先に起こったのかについて暑い議論が続いているようだ。もちろん独立した生物が誕生する時には両方が備わっている必要があり、両過程は卵と鶏のように互いに切り離せない。ただ素人の私からみると、生命に必須の有機物がエネルギーとともに形成されないと、最終的に核酸に頼る増殖自体も考えにくいはずで、有機物とエネルギーを合成できるシステムの誕生から考えてもいいのではないだろうか。
前回述べたが、有機物の合成の可能性については様々な可能性が議論されてきた。この中で、有機物とエネルギーを同時に持続的に生成できる場所として脚光を集めているのが、20世紀後半から相次いで存在が確認されたアルカリ性の熱水を地中深くから噴出している海底熱水噴出孔だ(図2)。この発見によって、生命誕生を有機物とエネルギーから考えるenergy firstの考え方が現在は優勢になっているように私には思える。

図2 熱水噴出孔 Wikiコモンズ
前回メタン、水素、炭酸ガス、アンモニアを熱して電気刺激を与えるとアミノ酸が生まれるユーレイとミラーの実験を紹介したが、この条件では持続的にアミノ酸が作り続けられることはない。しかも、できたアミノ酸からさらにポリペプチドを作るとなると、少なくともかなり高い濃度の有機物が持続的に供給される必要がある。反応を偶然の放電に頼るユーレイ・ミラーの条件では到底不可能だ。
ところが、熱水噴出孔には炭酸ガスだけでなく、後に述べる理由で還元力の強い水素も豊富に存在し、これらが反応してメタンやアセトンを持続的に合成することができる条件を備えている。さら地中深くから熱水が噴きあげる間に、は有機物の合成や重合化に必要な触媒となる様々な鉱物が豊富に存在すると考えられる。そして何よりも、一つの熱水噴出口は、少なくとも3万年以上との長い期間熱水を噴出し続けることがわかっており、熱水噴出孔が生命誕生に必要な有機物とエネルギーを持続的に形成できる場所であることは人の素人の私にも十分納得できる。熱水噴出孔の中には数メーターから数十メーターのチムニーという構造を形成して海水から突き出ているものが存在する。これは鍾乳石と同じで、熱水に溶けていた様々な鉱物が海水で冷やされ沈殿することで形成される。すなわちチムニーの存在は、熱水噴出が生命誕生に必要な地質学的時間維持できる可能性を示唆している。また有機物が安定に存在するのが難しい400度近い熱水もチムニーを通る間に冷却され、有機物の合成や持続の可能な温度になる。
これらの結果から、1)豊富な有機物合成の原料、2)熱や化学エネルギー、3)持続性、の点で熱水噴出孔にできたチムニーが、有機物を持続的に供給でき、生命誕生までの長期間の分子選択過程を維持できる、など熱水噴出孔が現在考えうる最適の生命誕生の現場である可能性が強く示唆される。最近、メタンを構成するアイソトープを調べた研究から、熱水噴出孔周辺に存在するメタンの少なくとも一部(1mM)は生物が関与せずに生成されたことも証明され、熱水噴出孔が有機物合成の現場である可能性は高まった。
ではどのように熱水噴出孔で有機物やエネルギーは作られるのだろう。まず炭酸ガスの還元に必要な水素だが、地殻のシリカが水と反応して蛇紋石が形成される過程で水素が発生することが知られている。水素自身はそのままだと拡散してしまうが、チムニー内に形成された鉱物の壁で隔てられた迷路のように入り組んだ小部屋は熱せられた水素を補足する。
次にこの水素により炭酸ガスが還元される過程だが、化学の苦手な私でも、水素と炭酸ガスや重炭酸塩が反応して次の化学反応が進み、
4H2+CO2→CH4+2H2O
4H2+2HCO3+H→CH3COO+2H2O
上記のように、メタンやアセトンができることは理解できる。これらの反応が起こると最終的にエネルギーは発生するのだが、反応の開始にはエネルギーを加えることが必要で、反応は自然には起こらない。従って、反応を進めるための触媒が必要になる。
このとき参考になるのが、Autotroph(化学合成独立栄養生物)と呼ばれる、無機物から自分で有機物を合成して生きている細菌類だ。メタンを合成するAutotrophは古細菌に属しており、アセトンを合成するautotrophは真性細菌のClostridiaに属していることから、有機物の原材料としてメタンを選んだか、アセトンを選んだかの偶然が、古細菌と真性細菌の誕生まで変わることなく続いたのは驚きだ。最近になってこのようなAutotrophが有機物を合成する代謝経路についての研究が進み、アセトンやメタンを合成する経路に硫化鉄を持つフェレドキシンが重要な働きを演じていることが明らかになってきた(詳細はCell, 151:1406, 2012:この原稿のほとんどはこの論文を基礎にしている)。すなわちフェロレドキシンに含まれる鉄を媒介に水素の電子を炭酸ガスに移転させる反応で、これにより炭酸ガスの還元が自発的に進行する。この結果細菌では、アセトンやメタンをATPと共に合成することができる。このフェレドキシンを媒介とする炭酸ガスの還元反応の最初に必要な自由エネルギーはアルカリになるほど低下することから、高いpHほど反応が起こりやすい。
このフェレドキシンが媒介する電子の転移をすすめる主役は鉄イオンであることから、同じ反応をチムニーに豊富に沈殿している鉄イオンで媒介できる可能性がある。アルカリ熱水噴出孔のpHは高く、水素による炭酸ガスの還元反応は起こりやすくなっているところに、フェレドキシンにも含まれる硫化鉄や硫化ニッケルが電子の転移の仲立ちをすることで、細菌で起こっている有機物合成がチムニーの中で起こるとするシナリオだ(図3)。
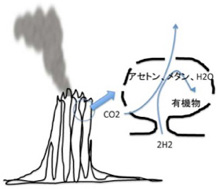
図3チムニー内にできた小胞内で有機物が合成される。
また細菌が炭酸ガスからフォルムアミドを合成するのに使っているモリブデンイオンも存在しており、有機物合成に必要なすべての原料が、細菌と同じようにチムニーの中で作ることができる。残念ながらこれを証明する実験はまだ行われていないが、理論的には可能だと考えられている。先に述べたように、熱水孔の周りには生物の助けなしに合成されたと考えられる1mM程度のメタンが存在していることを考えると、実験室で再現されるのも時間の問題ではないだろうか。
あとはチムニー内にできた迷路のような小胞の隔壁に存在する様々な鉱物の触媒活性を使って、アミノ酸、核酸、脂肪酸ができ始める。さらに、チムニー内に形成される熱勾配により温度拡散が誘導され、有機物が濃縮された小胞が生まれる。この中で、前回紹介したような反応が起こって有機物の重合化が起こり、鉱物膜と脂肪膜が複合した高い濃度の有機物が詰まった独立栄養系の小胞ができる。全くの素人の私にとっても、このシナリオは理解しやすく、実際に起こっているという確信を持つ。
こうして出来上がった鉱物と脂肪酸の膜で仕切られた小胞には高い濃度の様々な有機物が詰まっているが、ここまでは完全に物理化学の法則のみで進む点が重要だ。すなわち生命誕生のプロセスはここから始まる。次回はこの無機物と合体した中間段階が、チムニーからどう独立できるのか(図4)考えてみよう。
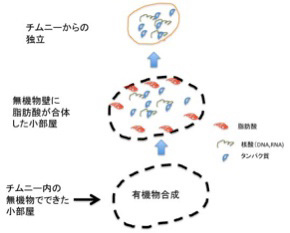
図4:チムニーないの無機物と新たに合成された有機物の合体した中間段階が、チムニーから独立した時生物が生まれる。
[ 西川 伸一 ]
分子進化をダーウィンの進化論に当てはめる
2015年12月1日
生命誕生を考えるとき、前回述べた熱水噴出孔に形成される泡のような小胞ほどよくできた偶然はないように思う。うまい具合に大きさも細胞に近く、小孔で他の小胞や外界ともつながっているし、原理的にアミノ酸、核酸、脂肪酸、ペプチド、ヌクレオチドなどを持続的に合成する条件も整っている。さらに、アセテートやメタンの合成過程でエネルギーを発生させることができ、熱勾配やpH勾配のおかげで高分子を特定のコンパートメントに濃縮することもできる。
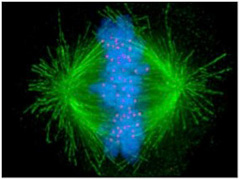
ただ、どんなに細胞に似ていても、これは生命ではない。チムニー内の小胞では、熱力学平衡に対抗するため、不断にエネルギーを外界から導入して(ここではH2勾配、CO2の還元反応、熱などがこれに相当する)熱力学的平衡から離れた状態を維持できる開放系、すなわちイリヤ・プリゴジンが散逸構造と名付けた非平衡状態が実現できている。しかも、この状態を何万年にもわたり維持することができる。しかし、ここで起きていることの全ては生命誕生に必要な条件ではあっても、生物特有の性質とは無関係だ。非平衡の熱力学系ができただけで、生命誕生までにはまだまだ大きなギャップが存在している。一般的に創発と呼ばれてきた質的な転換が必要で、まずこのギャップで何が起こったのか大きな枠組みを考える必要がある(図1)
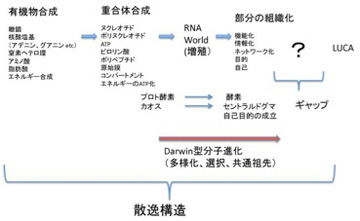
図1 最初の生命(LUCA:Last Universal Common Ancestor)で起こったと思われることを列挙した図。
前にも述べたが、英語では生命をOrganismと表し、生物が「組織化されている」ことを強調する。これはフランス語(Organisme)、イタリア語・ラテン語の(Organismo)も同じだ。ところが日本語やドイツ語では「生物」(Lebenswesen)と表すため、有機化学と生命誕生の間に横たわるギャップの本体が、「組織化される」過程であることを、いまひとつ実感しにくい。18世紀、デカルトの機械論では生命を理解できないと反旗を翻した自然史運動の中心ビュフォンを代表とする先人たちが目指したのが有機体論だったことを思い起こそう。その後、生物が組織化された存在だという特徴は、生物には「自然目的」が内在しているように見えるという特徴へと読み替えられ、19世紀生物学の重要なテーマとしてダーウィン進化論の誕生まで受け継がれていく。
組織化するメカニズムはそのまま訳すとオーガナイザーであり、シュペーマンが使用して以来、発生学で頻繁に用いられる用語だ。分子を生命へと組織化するという、実際には何も理解できていないメカニズムをとりあえず生命のオーガナイザーと呼んでおこう。もちろんこの本体については全く分かっていないことから、ここではオーガナイザーという言葉を、この過程を理解できていないことを表す目印として使う。と言うのも、間違うとオーガナイザーという概念は、神を始めとする超越的力による組織化と結びつけられる危険がある。事実、ダーウィン以前の生物学では、オーガナイザーとは確実に神の持つ超越的力のあらわれと考えられていたし、ダーウィン以後も「エラン・ビタール(生命力)」などの超越的力は、繰り返しオーガナイザーと結びつけられてきた。これはオーガナイザーという言葉自体に、最終目的を知り、そのために部分を組織化する主体という意味が付きまとうからだ。オーガナイザーと表現したときは、常にわかっていないことの印であることを思い起こし、超越的説明を導入しないように気をつけながら進む必要がある。
オーガナイザーを理解するため、過去の生物学の歴史にもう一度目を移してみよう。18世紀生命を組織化するオーガナイザーは、生命の「自然目的」と読み換えられていたが、この自然目的を科学的に初めて説明したのがダーウィンの進化論だった。重要なことは、進化論が超越論的説明を完全に排除してこの自然目的を説明している点だ。従って生命誕生までのオーガナイザーを考える時、ダーウィンの進化論は大いに参考になる。
ではダーウィンの進化論は生物の持つ「自然目的」をどう説明しているだろう?この説では、目的を実現すべく進化したように見える種(例えば高い木の実を食べる為に首が長くなったキリン)も、最初から小さな違いが集まった集団の中の多様性として存在し、この小さな差が他の個体と比べた特定の環境下での生殖(増殖)優位性により自然選択されただけだと説明する。すなわち、進化では目的として提示される結果が最初から存在していたという逆転の発想だ。
次回以降順に取り上げるが、ダーウィンの扱った生命誕生以後の進化と、それ以前の分子進化には様々な違いが存在する。しかし、結果が先に多様性として存在し、それが選択されるという図式は分子進化にも当てはめられるのではと考えている。すなわち、生命誕生と非平衡熱力学系の間に、無数の中間状態(分子の種類とそれらの関係性)が存在し、多様な分子の集まったカオス状態の中から、特定の中間状態が選ばれる過程が繰り返されるうちに、最後に全生物に共通の祖先(LUCA)が誕生すると考えることができる。
この分子進化のダーウィン的理解に必要なのは、1)誕生までに発生した中間段階、2)生命誕生に至るまでに必要な分子や中間段階多様性を発生させる力、そして3)分子から生命への過程に働く自然選択力になる。今回からこの3つの問題を順に考えて行く。
ダーウィンの進化論では共通祖先の概念は、出し手のいない情報を扱うための素晴らしいアイデアになっている(これについても次回以降議論する)。このおかげで、現存の生物を単一の原始細胞まで遡って構想することが可能になる。同じように分子進化でも、単純な構造(例えばディペプチドやディヌクレオチド)から複雑な構造へと分子進化が起こり、最終的にLUCAに集まったのだろうと推察はできる。もっとも単純な有機体をメタンとアセトンとすると、知る必要があるのは、このもっとも単純な有機体構造から合成されてきた、自立生命を支えるために必要なミニマムな分子の構造リストだろう。
進化論では、生物の複雑化を示す中間段階の証拠として化石の存在が指摘されている。しかし残念ながら、化石に相当する中間段階の遺物は、38億年前に起こった生命誕生までの過程を示すほど多くは残っていないだろう。再現できず、記録もない過去の分子を研究するには、現存する分子を基礎にして過去の分子を推論するための方法が必要になる。現在この目的で広く行われているのが、DNAの配列の差に基づいて系統関係を推定し、その共通祖先を推定する分子系統学だ。しかし、DNA情報が成立していない生命誕生前にはこの手法は役立たない。生命誕生までに生まれた中間状態や、分子構造の複雑化について考える分子進化は、有機分子の構造だけを指標として進化を考える必要がある。ゲノム配列を使うことに慣れた私たちには大変に思えるが、例えばダーウィンの進化論は、形態の観察だけから生まれてきたことを考えると、できない話ではない。
幸い構造解析の終わったタンパク質はすでに10万を突破している。アミノ酸配列からタンパク質の構造を自動的に予測することはまだ難しいため、タンパク質をその形態から分類しようとCATHと呼ばれる分類が1993年より行われている(図2)。
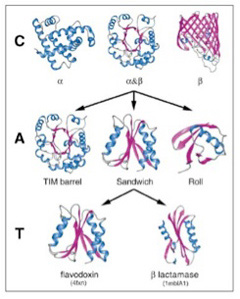
図2 Orengoらの論文で行われたタンパク構造の階層化。Cはclass, Aはarchitecture, TはTopology 。これによりタンパク質の構造の複雑化の過程を、情報ではなく、形質として研究できる。(Orengo et
al, Nucl. Acids Res. (1999) 27 (1): 275-279.より転載)
この方法では、タンパク質をClass,(類) Architecture(構築), Topology(接続形態)、そしてhomologous superfamily(相同スーパーファミリー)に階層化している。全てのタンパク質は、αヘリックス類、βシート類、そして両方が合わさったαβ類に分けられる。この3類がそれぞれ多様な変容を遂げることで異なる形態を持つ構造が生まれる。タンパク質の複雑化が進むと、同じ類に属していても、形が大きく違った構築を作ることができる。これがarchitectureだが、図1ではαβ類から派生しうる3種類のarchitectureが示されている。こうしてクラスより複雑な構造の多様なarchitectureを一定数抽出することができる。
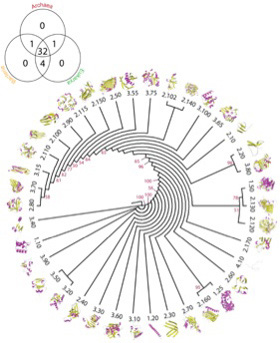
図3 Caetano-Anollesらにより提案されているarchitectureの系統図。ここでは38種類のArchitectureが区別され、構造、配列、機能を総合した推計方法で系統樹が描かれている。左端のベンダイアグラムはそれぞれのArchitectureが古細菌、原核生物、真核生物にどう分布しているかが示されている。このレベルの構造はほぼすべての生物に存在し、従ってよりLUCAの持っていたタンパク質に近い構造だと想像できる。(Bukhari and Caetano-Anolles, Plos Computational Biology,
9:e1003009, 2013より転載)
図3は、Caetano-Anollesらが、構造の決定されたタンパク質からarchitectureを抽出して系統関係を調べた図だが、重要なことはほとんどのarchitectureが古細菌、原核生物、真核生物のすべてに存在することだ。すなわち、このような構造リストは、生命誕生に必要なミニマム分子のリストに近いと考えられる。一方、様々なarchitectureが結合したtopology, homologous superfamilyなどのより高次な構造になると、存在する生物は徐々に限られていく。
このように、タンパク質やRNAの構造の階層性、細胞内での機能、そしてアミノ酸配列総合して進化過程を記述しようとするCaetano-Anollesらの努力は、生命誕生後の進化を新しい観点から見るだけにとどまらず、例えばATP合成や、アミノアシルtRNA合成酵素のような生命の基本に関わる酵素のもっとも単純な構造を推定する方法になる可能性がある。
もちろんこのもっとも単純な機能タンパクリストが完成しているわけではないが、次回からは、LUCAに集まったこの分子群のリストが完成したと仮定して、分子多様性を生み出す力、generator of diversity (GOD)について考えたいと思う。
[ 西川 伸一 ]
生命誕生までのダーウィン進化
2015年12月15日
前回、生命の共通祖先(LUCA:Last universal common ancestor)に存在すると想像される有機分子や、これら分子の祖先と考えられる様々な中間段階を、現存の生物に存在するたんぱく質やRNAの構造から推測する可能性について議論した。生命誕生までに起こった出来事の痕跡が残っていない限り、何が起こったかは現存のタンパク質から推測するしかない。もし高い確度を持つ推測方法が確立すれば、その推測に基づいて分子を再現すること自体は難しいことではない。こうして合成した有機分子の性質を調べ、最終的には生命を作り出すこともいつかは可能になるだろう。しかし、可能性としてリストされる個々の分子を実験的に検証するためには、途方もない努力と時間が必要だろう。まして、それを集めて生命を再構築することは21世紀中に出るかどうかまだわからない。だが、詳細を理解することは難しくとも、LUCAまでの道筋はぼんやりと頭に浮かぶようになってきている。
最も重要な仮定は、LUCAができる過程もダーウィン進化の法則に従うという仮定だ。他の可能性もあるかもしれないが、私にはこれ以外のアイデアはない。この過程をダーウィン進化的に述べるなら、単純な有機物から多様で複雑な中間有機物が無作為かつ連続的に生まれ(多様性の獲得)、その中から分子自体の安定性、他の分子との相互作用による安定化などによる選択が行われ(自然選択)、より安定な分子や組み合わせが選択されるといえる。この分子進化過程は、多くの偶然に左右され正確な予測はもちろんできない。しかし、基本的には熱力学的法則に従って、一種のカオスが形成される過程だと考えている。もちろん単純なカオスは生命ではない。同じ空間に共存している様々なカオス状態同士がランダムに反応し合っているうちに、次により複雑で大きなカオス状態ができる(星雲の衝突のようなイメージ参照:図1)。これが繰り返される中で、それまでにはなかった秩序が組織化されるとLUCAが生じる。

図1 双極星雲:星雲は異種のカオスだが、これが衝突して新しい一つのカオスを形成する。(写真はWikiコモンズより)
すなわち、幾つかのカオスが、力学とは別の新しいルールでOrganizeされ、これまでのカオスとは質的に異なる秩序で支配されるLUCAが生まれる。多様化と自然選択というダーウィン進化論の共通ルールは、カオスからLUCAへの過程、生命誕生後の進化過程の両方に存在しているが、両者には多くの違いがある。LUCA誕生過程を思い描くためには、この違いをしっかり理解しておくことが重要だ。
まずLUCAが誕生するまでの中間段階は、同じように自然選択されて誕生すると言っても、熱力学的法則に完全に従うカオスに過ぎない。一方、生命誕生後に生起する中間段階は、熱力学第二法則に逆らって独立した系を維持しながら増殖する生物特有のOrganizeされているという性質が最初から維持される。生命誕生後の進化ではDNAが本来持つ変異しやすいという化学的性質が、集団の多様性獲得の原動力だが、一方、生命誕生前は、多様な分子を連続的に供給する化学的仕組みが必要になる。
次に、進化の結果は生命誕生前と、誕生後では全く反対に見える。もし数少ないLUCAから生物が進化しているとすると、 LUCA誕生までの過程はLUCAへと収束する過程のように見える。一方、生命誕生後はもっぱら多様化が進んでいるように見える。図2は、生命誌研究館のシンボルとも言える生命誌絵巻だが、この扇の形は、まさにLUCA誕生後の進化過程で生物の多様化が起こっていることを表している。このことから、進化過程を洒落て、Generator of Diversity (GOD)と呼んでいる研究者もいるぐらいだ。

図2:生命誌絵巻 協力:団まりな/画:橋本律子
多様な生きものが長い時間の中で誕生した歴史と関係を表現。
詳細はこちら
実は、個体の多様化と自然選択の組み合わせでなぜ多様な種が生まれるのかについては、完全に理解できているわけではない。ただ、生命誕生後の多様性を生み出す原動力GODは、ゲノムの物質的基盤であるDNA鎖がもともと変異しやすいという物理化学的性質を持つことに起因している。おそらく祖先となる集団(共通祖先)の多様性は常に十分大きい(多様な形質をとれる)おかげで、環境により複数の形質が選択され共存するうちに種の多様化が進むのだろう(これについては生命誕生後のゲノム発生学でもう一度詳しく扱う)。生物が住める環境が通常高い許容性を持っていることが種の多様化に重要だが、寒冷化や隕石衝突のような大きな環境変化がおこると種は絶滅し多様性は減少する。
先に述べたように、一見すると生命誕生前の進化は一つあるいは少数のLUCA誕生へ向かって収束していくように見える。しかし、例えば結晶ができるように無機分子が臨界に達して一足飛びに生命が生まれるとは考えにくい。従って、生命誕生までには、比較的安定な中間段階として、多様な有機分子や分子複合体が合成される必要がある。それも、LUCAに近づくにつれ、比較的単純で多様な中間段階段階から、より複雑な中間段階が段階的に生まれていくと考えられる(図3)。こうしてできる多様で複雑化した分子集団の中から少数が選ばれ、さらに新しい秩序が生まれるよう組織化されるのがLUCAではないだろうか。従って、過程全体で見ると起こっていることは収束ではなく、進化と同じで多様化だ。ただ、強い選択圧の結果LUCAとして残るのは数少なく、収束しているように見えることになる。
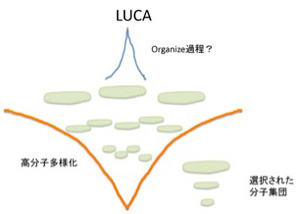
図3:LUCA進化は多様化ではないように見えるが、実は分子多様化の産物だった。
最終的にLUCAが完成するにはどれほどの分子や分子ネットワークが必要か想像するしかないが、自立生命が可能になるには最低限100−300余りのタンパク質と機能的RNAが存在すればいいと想定されている。ただ、最初から無駄のない構造ができるはずはないので、おそらくこれよりはだいぶ多い分子の種類がLUCAに存在したと思える。ここでは、タンパク質とRNAを合わせて仮に500としておこう。実際には、これが100個であれ、1000個であれあまり違いはない。
ではこの500個の分子はどうすればできるのだろう?RNAについては後にRNAワールド仮説を考えるときに議論するとして、ここでは話を500種類のタンパク質を第43話で述べた熱水噴出孔で合成するという課題にしておこう。もちろん設計図などないから、ランダムな化学反応でアミノ酸が合成され、こうして合成されたアミノ酸からやはりランダムな化学反応でペプチドが合成される過程がどう進むかという課題と考えてもらっていい。
全ての有機合成が、炭酸ガスと水素から、メタンやアセトンが合成されるところから始まることを見たが、そこに窒素も加わって、様々なアミノ酸が合成できることは示されている。熱水噴出孔には触媒とエネルギーが十分存在するため、この場所ではアミノ酸から少なくとも50merのペプチドまで理論的に合成できる。この過程を図示すると、生命誌絵巻と同じで、メタンとアセトンという単純な有機物から最初始まり、時間とともに有機物の多様化が進む過程として描ける(図4)。
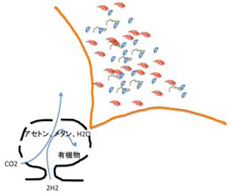
図4:熱水噴出孔に存在するアセトン、メタン、エネルギーを持続的に合成する力は、有機高分子の多様化のGenerator of Diversity (GOD)といえる。
このことから、LUCAへの過程も生命誕生後の進化と同じで、多様化の方向に進み、これを推進する力の基盤が、熱水噴出孔での持続的エネルギーと有機物が供給であると考えていい。最初はアセトンとメタンの2種類しかない状態が、アミノ酸になると20種類と10倍に多様化する。そしてペプチドになると、結合するアミノ酸の数に応じて多様性は指数的に増大し、もし熱水噴出孔で50merまでのペプチドが作れるなら、その多様性は20の50乗という天文学的数字になる。さらに、できた様々な長さのペプチド同士が相互作用しあって、複合体を作ることで、この多様性はさらに増大する。これは、DNAの長さが増えるごとに、それが形成できる多様性が増大するのと同じだ。このように、熱水噴出孔のような条件が整えば、GODによる有機分子の多様化を持続的に進めることができる。今後、GODが整った実験条件を工夫し、無機物から多様な有機物へと進む多様化過程を実験的に再現することは可能になるだろうと思っている。
ただ、多様化が起こったとしても、天文学的種類のペプチドが合成されるだけで何も起こらない。LUCAへと組織化されるためには、まずGODの力を何らかの形で制約することが必要だ(散逸構造の一つ翼の後ろに発生する乱気流が翼という制約により発生するのと原理的には同じだ。:図5)。

図5:散逸構造は流れのエネルギーが翼という障害物で制約されることで初めて生じる。多様化というエントロピーの流れも同じ。(写真はWikiコモンズより)
生命誕生後のダーウィン進化でも同じで、ゲノムで進むランダムな多様化を、それまでの進化の結果、課せられた生存のためのコンテクスト(それを満たせない変異が起こると個体は死ぬ)と環境への適合により2重に制約する(選択する)ことで、新しい種が生まれると説明している。
生命誕生までの過程で、熱水噴出孔に存在して、そこで発生する有機分子を多様化させる力、すなわちGODを制約する要因がOrganizerとして生命誕生を媒介したはずで、生命誕生過程を構想する鍵は、この制約要因を理解できるかどうかにかかっていると思う。もちろん理解できているというには程遠いが、熱水噴出孔にできたチムニー内に生命誕生場所を限ることができれば、実際の制約条件を特定できるのではと考えている。次回は、この制約条件を考えるときに考慮すべき幾つかの点について述べていく。
[ 西川 伸一 ]
生命誕生の力学
2016年1月5日
自分で読み直しても前回の話はわかりにくかったと反省する。無生物から生物へのダーウィン進化についての思いつきを羅列しただけで、背景にある考えをよく説明できていないことが問題だった。熱水噴出孔の化学反応が原動力となって、多様な有機分子が発生する点についてはわかってもらえたと思うが、この多様化へ向かうエネルギーと物質の流れが制約されることで新しい秩序が生まれるという点については、もう少し説明が必要だろう。
有機分子やエネルギーの流れを初めから考えると複雑でわかりにくいので、ここは熱水噴出孔を一度忘れて、まず多様化と制約の一般的な関係について、もう少し簡単な系をモデルに説明してみよう。
高いところにある水は必ず低い方に流れるのと同じで、平衡に達していない状態は熱力学第二法則に従って平衡に達するまで変化を続ける。もし摩擦のない理想状態が存在すれば、この変化は川の流れと同じで、一方向に均一に流れ、新しい秩序が生まれることはない(図1上)。この流れの中央に岩のような障害物を置くと、川の流れはそれにより制約される。この結果、十分なエネルギーが供給され続ければ(川が流れ続ければ)、岩の後ろに渦という新しい構造が生ずる(図1下)。
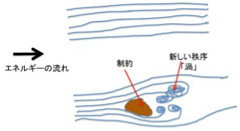
図1 力学的エネルギーの流れが制約された時に初めて新しい秩序が生まれる。
この渦を構成する水分子を見てみると、細胞の構成成分が刻々変化するのと同じで、常に置き換わっている。しかし分子が変わっても渦の構造は、流れのエネルギーが持続的に供給される限り維持され、流れが止まると消失する。これは散逸構造の一つと呼んでいいだろう。この例では、外部の障害物がエネルギーの流れを制約しているが、制約は外部から与えられる必要はない。散逸構造として最も有名なベルナール・セル(図2)は、液体の入った容器を下から均一に熱を加えたとき、入ってきた熱エネルギーを効率よく上部へ散逸させようとして溶液中にカラム状の対流が生じて、このカラムが容器の上に美しい6角形模様として現れる現象を指す。
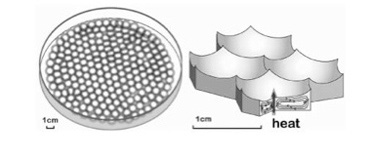
図2:容器の下から均一に溶液を熱すると、熱をもっとも高い効率で発散させようと、溶液分子の性質や量によって決まるサイズの対流カラムが生じる。このカラムに相当する大きさの凹みが容器上に現れる。こうしてできる構造はベルナールセルと呼ばれている(オープンアクセスの論文、Deacon and Koutroufinis, Information , 5, 404, 2014より転載)
この場合の制約は液体の粘度や比重などの性質や、溶液の量といった初期条件と言える。他にも、2種類の異なる溶液を混ぜるとき、両者が一定の法則に従って反応しあうように制約を与えると、本来なら平衡状態へと均一に混じり会おうとする2種類の液体が、周期性を持って容器内に美しい模様を描くジャポチンスキー反応がある。
図3 ジャポチンスキー反応の一例。原理は省くが、硫酸性クエン酸、臭素酸カリウム、硫酸セリウム、およびマロン酸を反応させると容器中の4価と3価のセリウム塩濃度が容器中で振動することをジャポチンスキーは発見する。溶液内の成分の反応性が制約となって、新しい秩序が生まれる好例と言える。(画像引用:https://www.flickr.com/photos/nonlin/4013035510)
図3はジャポチンスキー反応の例で、反応し合うという内的な制約だけで、これほど秩序だった模様が現れる。以上のことから、変化を続ける力学(熱力学)系に制約を加えることで新しい秩序が生まれるというイメージが理解していただけたのではないだろうか。
では熱水噴出孔での有機物生産の現場にはどのような制約が存在しているのか考えてみよう。また、この現場でダーウィン進化の選択圧となって生命に必要な分子を選択する条件も考える必要がある。ベルナール・セルやジャボチンスキー反応で生まれる構造はどんなに美しくとも、初期条件で決められた反応で、生物構造に見られる機能や目的があるわけではない。これは、自然目的が発生するために必須の、環境による選択を受けていないからだ。以上のことを念頭において、熱水噴出孔で何が起こりうるのか考えてみよう。
繰り返すが、生命が成立するためには、まず物質とエネルギーが持続的に供給される系が成立する必要がある。このような系が、水素イオンの多いアルカリ条件の熱水噴出孔には成立しているという説は説得力が高く、私もこの考えに基づいて考えている。アルカリ熱水噴出口には、炭酸ガス、水素、窒素、熱、そして反応を媒介する無機触媒が万年単位のスケールで存在し続ける。この条件がエネルギーと有機物を連続的に生成されることは化学的に不思議なことではない。この持続的Generator of Diversity (GOD)により平衡から離れた状態が維持されるが、そこで発生し散逸する物質とエネルギーの流れは、そのままだと海の中へ放出され拡散するだけだ。生命誕生の条件が整えるためには、この流れを制約する必要がある。熱水噴出孔で新しい秩序をもたらすことのできる制約の可能性をリストアップしてみよう。
熱水噴出孔から独立栄養の原始生命が生まれるまでの過程について豊富なアイデアを提案し続けているWF MartinとN.Laneの説は私のような素人にも説得力が高く、ここで展開している考えも彼らの説が核になっている。このエネルギーと物質の流れに新しい秩序を与える外的な制約として最も大事だと彼らが考えているのが、チムニー内に無数にできた、バブル状のマイクロセルだ。
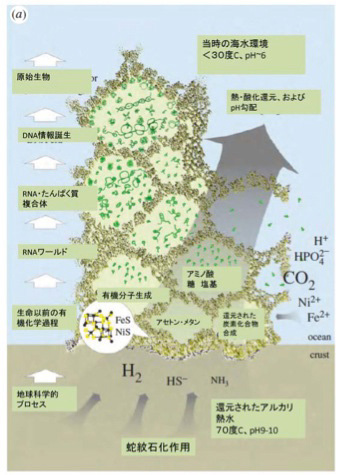
図4 MartinとLaneが考えている熱水噴出孔にできたマイクロセルで進む生命誕生までの過程。この稿の多くは彼らの考えに基づいて書いている。蛇紋石化作用により水素が生成する。(Sousa et al, Phil Trans R Soc B 368: 20130088.http://dx.doi.org/10.1098/rstb.2013.0088:を改変)
これらのマイクロセルは大きさも様々で普通の細胞と同じ大きさを持つ場合も存在すると想定される。セル同士はさらに小さな孔でつながっており、生物の細胞のように独立しているわけではない。また、壁も最初は無機物からできており、その成分により有機物合成の触媒として働く。
このセルはエネルギーと分子の流れを生み出す反応容器としてまず働くが、川の流れの中の石と同じで、発生するエネギーと物質の流れの外的制約として働く。例えばフルイの役目をして、大きな分子を引き留める。これと並行して、pH、酸化還元能、そして熱の勾配もできてきた分子の制約要因として働き、熱水噴出孔のそれぞれの小部屋に存在する分子構成は、自然に不均質で多様になる。
ジャポチンスキー反応と同じで、メタン、アセトン、アンモニア、硫化水素などの成分が反応し合う法則も制約になる。加えて重要なのは、ジャポチンスキー反応と異なり、一旦合成された分子が新しくできる分子を制約する点だ。例えば現在の生物が持つアミノ酸が全てL型であるのも、炭酸ガスと水素を原料としてメタンとアセトンを合成することができるのに、メタン型とアセトン型の細菌がどちらかに収束しているも初期の制約でその後の過程が決まってしまった例だ。すなわち、小さな差でも一旦生まれると、それが増幅され維持されることで、バタフライ効果(蝶の小さな羽ばたきが最終的に大きな変化を生み出すというカオス理論)と呼ばれるものだ。
この反応の結果として生まれる制約は有機高分子になるとさらに複雑になる。例えば脂肪酸のシートができると、疎水性の面が形成される。この近傍では水が除外されるため、ペプチドが濃縮され、熱力学的に起こりにくい反応が進むようになる。また、ペプチドも水がないと分解されにくくなる。そしてすでに42話で述べたが、脂肪酸の中には核酸の重合を促進し、DNAの場合は複製酵素の役割を演じるものすら存在する。
このように、無機化学反応と比べると(例えば水素と酸素が反応して水になる)、有機化学反応は多様で、ランダムで、予想不可能だ。これは、反応自体が新しい制約要因を発生させるという、自己回帰的構造を持っているからだ。結論的に言ってしまうと、熱水噴出孔のマイクロセルでは厖大な種類の有機物の合成可能性が存在している空間ということになる。
最後に、熱水噴出孔に生まれる制約の特徴を列挙しておくと、
- 1) 外的に与えられる無機的制約(例えばマイクロチェンバー、pH,熱勾配など)と、エネルギーと物質の流れ自体から自己再帰的に発生する有機的制約が複合している。
- 2) 外的に与えられる制約は決定論的で、有機的制約は非決定論的。
- 3) 外的制約は長期的に維持されるが、有機的制約は短期間しか存在しない。
- 4) 有機的制約は、反応自体から生まれる自己再帰的な制約で、常に多様化し、複雑化する
- 5) 偶然生まれる小さな差が、その後の全ての反応の基盤になるようなバタフライ効果を示し得る
などをあげることができる。
最後にもう一度渦と生命誕生過程を比較して終わろう。渦の持続時間は通常短い。しかし、複雑な地形では、突然持続時間の長い渦が生まれる。もし外的な地形が変わらないとすると、渦が渦を呼び、その渦の中から安定に渦が持続する条件が生まれた結果だ。
熱水噴出孔に生まれる制約とその結果生まれる新しい秩序も安定性に大きな差が生まれる。これがダーウィン進化の自然選択に対応する。次回は生命発生に必要な状態が選択される過程について考えてみよう。
[ 西川 伸一 ]
システム化学
2016年1月15日
ここまでの話をもう一度ざっとまとめると、次のようになる。
熱水噴出孔ではエネルギーと炭酸ガス、水素、水など無機分子の持続的な流れが発生している。この流れはそのままだと、海水へと放出されるだけだが、噴出孔のマイクロチェンバーにより様々な形で外的に制約されると、有機分子の生成が始まる。最初の有機物はアセトンやメタンだが、マイクロセルの成分に含まれる様々な金属の触媒が作用すると、さらに複雑で多様な有機物が合成される。例えば以前紹介したように(第42回ゲノムの発生学II)、モンモリロン石が存在すればアミノ酸や核酸の重合が進む。脂肪酸が選択的に合成されるマイクロセルも存在するはずだ。たまたま存在した様々な外的制約により、分子やエネルギー分布の不均一化、構造化がおこる。
このようにマイクロセル内で進む有機分子の持続的な合成の流れを用いて、さらに複雑な有機高分子の合成が始まるが、ここまでのほぼ全ての過程はマイクロセルによる制約があれば進む。こうしてできた様々な分子(低分子から高分子まで)は独立したまま存在していることもあるが、高分子になるほど低いアフィニティーであっても他の分子と相互作用する確率が高まる。すなわち、合成されてきた分子自体が他の分子と反応する能力が新しい制約として働き出す。システムの中で生まれた新しい分子が、システムを新たに制約する「再帰的」制約の発生だ。
この「内的に発生する再帰的制約」について、これまでも具体的例を紹介してきた。例えば、現存するAutotroph細菌を見ると、アセトンを原料にするのは真正細菌のclostridia、メタンを原料にするのは古細菌と完全に分かれ、逆はない(第43回熱水噴出孔と生命誕生)。即ち、最初に合成された成分が制約要因としてLUCA発生から現在まで、持続的制約としてAutotrophで働き続けていることを意味する。他にも脂肪酸の中には核酸の重合や複製を触媒する能力がある分子が存在することを紹介したが(第42回ゲノムの発生学II)、これも内的に生まれた分子が、システムの新たな制約要因として働き、それ以前には存在しなかった新しい分子を作り出す分子進化の例といえるだろう。
この内的に生まれた制約による新しい状態の誕生は、制約要因が最初のシステムには全く存在しなかったという点で、反応する溶液同士を混ぜ合わせた系でおこる振動、ジャボチンスキー反応とは違う。システム内で発生した分子が制約となって、それまでとは異なる秩序が生まれるのが「内的に発生する再帰的制約」だ。
これは机上の空論だと思われるかもしれないが、応用有機化学分野のひとつ、コンビナトリアル化学では同じような課題が現実に研究されている。コンビナトリアル化学とは、例えば創薬のための候補化合物を、単純な分子から一挙に作ってしまおうという技術で、様々な化学工業で利用され始めている。従来多数の化合物を得るためには、自然に存在する生物を集め、そこから化合物ライブラリーを調整するのが普通だったが、コンビナトリアル合成のおかげで、生物に頼らず試験管の中だけで多様な化合物を合成することが可能になっている。
オランダのOttoらの総説(Li et al, J.American Chemical Society, 135:9222, 2013)は、この技術により単純な有機化合物からこれまで存在しなかった様々な新しい機能を持つ化合物が合成できることを教えてくれる(図1)。総説の内容を詳しく紹介するのは控えるが、単純な有機化合物がコンビナトリアル合成により、無限の可能性を拓くことがよくわかる。
図1 コンビナトリアルケミストリーの可能性を述べたOttoらの総説の内容を図示した。有機分子が反応を続けることで様々な複雑な高分子を合成できることを示している。
中でも私の興味を引いたのが、コンビナトリアル化学から自己複製する分子構造(複製子)が生成される可能性だ。この複製子について、この総説の著者であるオランダのSijbren Ottoのグループが昨年Nature Communicationsに発表した論文(Colomb-Delsuc M et al, 6: 7427, 2015 Creative Commons)に基づいて紹介しよう。
まずこの実験では、グリシン・ロイシン・リジン・フェニルアラニン・リジンの疎水性と親水性のアミノ酸が互い違いに繰り返すペプチドが、互いに可逆的共有結合を形成できる(SS結合)SH基を2つ持つベンゼン環に結合したオリゴペプチドが使われた(図2)
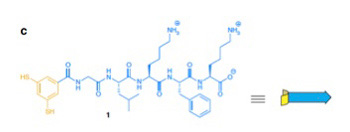
図2 Ottoらの実験では、図に示す構造を持つオリゴペプチド溶液を攪拌するだけの実験が行われた。
このオリゴペプチドはベンゼン環部分に2つあるSH基を介して他の分子と反応し、図3に示すような1merから7merの重合体を形成し、最終的な平衡状態に達すると予想される(図3)。
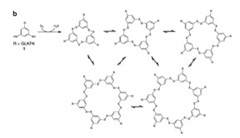
図3:図2に示したオリゴペプチド同士の反応から予想される分子同士の結合反応。相互に反応するベンゼン核のみを示している。
実際には7merは合成されなかったようだが、攪拌を続けると、4日目ぐらいまでに1mer,2mer,3mer,4mer,そして6merが混ざった平衡状態が生まれる(図4)。ところが、1週間を過ぎた頃から急速に他の重合体は失われ、6merが全体の90%を占めるようになる。
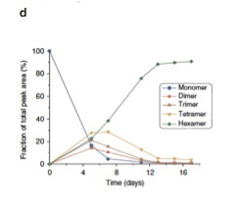
図4:16日間攪拌を続けた間に溶液中に存在する各重合体の比の変化。
5日目に予想された平衡状態に達するが、この平衡は1週間目に破れ、6merが急速に優位になることがわかる。
なぜ最初の平衡が破れたのかを調べると、6merの大きさの重合体だけが、今度は縦に重なって、さらに大きな重合体を形成していることが明らかになった(図5)。即ち、6merだけが縦に重なって成長する能力をたまたま持っていたため、一旦この6merが発生すると、それが核となって、6merが重合した高次構造がうまれる。この高次構造は成長に伴い、溶液中から6merは隔離するため、平衡状態が壊れる。その結果、溶液中には6mer由来の巨大分子だけが残される。
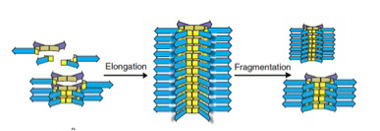
図5:6merは重なって縦に伸びる能力を持つ。この結果、溶液は6merによって占められるようになる。この重層構造は一定の大きさに達すると物理的力で壊れるが、6merの供給が続く限り、別れた部分から元の大きさの構造が形成される。すなわち、複製が起こる。
この一連の反応は、6merという構造単位の発生が新たな制約になり、これまでとは全く異なる高次構造を形成することが現実に起こりうることを示している。面白いことに、6merが縦に重なった重合体は、一定の大きさに達すると、攪拌のストレスにより、自然にちぎれる。もし6merが持続的に供給されれば、ちぎれた部分がもう一度核になって、同じ大きさを持った重合物が再形成される。この意味で、この分子構造は複製能力を持っていると言える。
このような重合による高分子形成は、ウイルス被膜や、細胞外マトリックス形成など、生命過程では普通に見られる自己組織化反応だが、全く人工的な反応として取り出してみると、生命と共通の幾つかの性質が生まれていることに気づくことができる。
- 1) 核酸情報は持たないが、特定の構造の複製が可能なこと。
- 2) 複製のためには、外界から部分が常に供給される必要があること(同化)。
- 3) 部分を構成する分子組成は全く同じでも、重合することで外界とは隔離された系(すなわち自己)が形成されていること。
- 4) 同じものを作るためには情報が必要なこと。ただこの場合の複製に必要な情報は、外界のストレスと、構成分子の性質(この場合は6merしか受け入れない科学的性質と、割れるまでの構造の強度)として提示されている。
これを流れの中の渦に例えると、力と水分子の定常的な供給が続く、流れの中に同じ大きさと形をした渦が増え続けるのと同じことだ。
先週Ottoたちはこの構造にグリシン・ロイシン・リジン・セリン・リジンを持つオリゴペプチドも同化できることを発見し、両方のオリゴペプチドが存在する溶液では多様な構造体が生まれることを示した(Sadownik et al, Nature Chemistryオンライン版)。この結果は、この分子構造が上の4つの性質に加えて、進化するという5番目の生命と共通の性質を持ちうることを示している。もちろん多様化だけでは進化は起こらず、特定の形質が選択されることが必要だが、このモデル系は、自然選択による進化とは何かのヒント教えてくれそうだ。
コンビナトリアル化学では最初の反応条件は人間が決める。熱水噴出孔で初期条件を決めているのは偶然だが、様々なオリゴペプチドが形成されることは既に確認されており、Ottoたちが観察したのと同じことが起こって何の不思議はない。次に、Ottoたちの研究から生命と共通するどんな性質が生まれてくるのか楽しみだ。
Otto等の研究を詳しく紹介してすこし長くなったので、今回はここまでで終わる。次回はDeaconの説を紹介しながら、生命に共通の性質の発生のためのルールについてさらに考えてみたいと思っている。
[ 西川 伸一 ]
生命誕生を考える理論的枠組み:DeaconとTeleodynamics
2016年2月1日
これまで生命誕生までに必要だと思われた過程を、なるべく具体的な例を参照しながらたどってきた。しかしここで紹介できた熱水噴出孔での化学合成過程は、生命誕生までのほんの一端に過ぎず、実際にはほぼ無数の過程がLUCA誕生に必要だったはずだ。とすると、生命に必要な様々なサブシステムが形成され、互いに連結され、LUCAの中に埋め込まれるすべての過程を洗い出すのはまず不可能だ。代わりに、この過程の背景にある一般的ルールを見つけて、より抽象的に、法則に基づいて生命誕生を理解しようとする人たちがいる。
例えばカウフマンの自己組織化理論(S.Kauffman著、米沢富美子訳「自己組織化と進化の論理—宇宙を貫く複雑系の法則」ちくま学芸文庫)、あるいはアイゲンらのハイパーサイクル理論( M.Eigen & P Schuster, The hypercycle, Die Naturwissenschaften 65:341, 1978 )もこの方向を代表する例だ。しかしこれらは生物の一部の性質を言いえているとはいえ、私たちが頭の中に描いている生物にはあまりに距離がある様に思える。
生命誕生の背景にある理論の中で、少なくとも私にとってもっとも説得力のある理論的枠組みを提供しているのがTerrence Deaconだ。今回は、彼が2006年にClayton & Davies(編)「The re-emergence of emergence:The emergentist hypothesis from science to religion」に寄稿した総説論文「Emergence:The Hole at the wheel’s hub」(http://72.52.202.216/~fenderse/Hub.htmで読むことができる)を参照しながら、生命誕生に関わる力学を見てみよう。
熱力学は、秩序のある状態と比べた時、無秩序な状態のほうがはるかに起こりやすいことを教えている。すなわち、変化のほとんどは秩序から無秩序へと進む。しかし私たちが毎日目にする様に、驚くほど多くの秩序が地球には満ち溢れている。すなわち、生命が一端誕生すると秩序は無限に増幅する。この様に生命誕生を理論的に捉えるということは、無秩序な状態(生命誕生前の)から無限に増殖を繰り返す秩序が生まれる過程に関わる理論的枠組み、この世では極めて稀にしか起こらない過程に関わる理論的枠組みを理解するということだ。秩序の増幅を目の当たりにしても、バラバラの分子からこの秩序が偶然生まれるなどと考えるのは絶対に無理だと直感的に思う。
これについてDeaconは、シュレジンガーが行ったように、熱力学法則に反する、あるいは一見法則に従わないように見える過程(一番はっきりしているのは生命)を順々に探し出し、その背景にあるルールを探している。
Deaconが徹底しているのは、「創発」、「自己組織化」、「自己触媒」など生命を表現するために使い古された言葉や概念に思考を邪魔されないよう、独自の新しい用語を積極的に導入して考えている点だ。彼の用語を用いてこれまで幾つかの例で示してきた生命誕生への中間過程を見直してみよう。
熱力学はあらゆる系に当てはまるが、生命誕生で問題になるのは化学反応が可能な溶液中の力学だと想定できる。同じ分子でも個体と液体はまったく違う物理的特性を持つ。同じ熱力学の支配下にあっても、例えば気体、液体、個体と状態が変わると、分子間の関係はより秩序の高い方向へ進む。液体ではこの分子間の関係性の反映として、例えば粘度、表面張力、熱伝導度などを考えることができる。液体中の分子の関係性は、気体への相転換が起こるまで、液体としての性質を維持し続けようとする力と考えることもできる。この液体としての分子間の関係を加味した単純な物理システムを、Deaconは熱力学と区別してhomeodynamicsと名付けている。この用語のhomeo-は、同じ関係性を維持しようとする性質がこの力学系の基本であることを表現している。この系は熱力学法則に完全に従うシステムで、エントロピーは増大し、秩序の維持に必要な制約は散逸する。
一つのhomeodynamics系は平衡へ向かって進み続ける以外何も起こらないが、この系での変化を制約すると(例えば流れの中の岩)、homeodynamicsには従わない新しい系が生まれる。これをDeaconはmorphodynamicsと呼んでいる。この用語は、ほぼイリヤ・プリゴジンの散逸構造と言い換えられ、具体的には液体が制約を受けることで発生する渦や、ベルナール・セルがこの例だ。morpho-とは形態を意味するので、形態を持たないhomeodynamicsから、渦やベルナール・セルの様な形態が発生するということをうまく表現した用語だと思う。では、homeodynamicsからmorphodynamicsが発生する背景にある共通の法則とは何か?
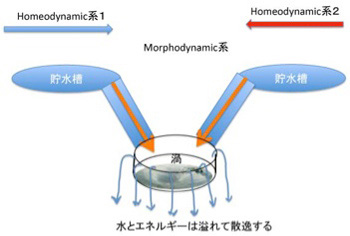
図1 morphodynamicsの発生としての渦。 2つのhomeodynamicsが衝突してカオスを形成すると、それを安定化させるために渦という形態が生じる。
もう一度渦の例でこれを考えてみよう。図1に示すように高いところにある2つの貯水槽から水を導き衝突させると、水の流れが維持される限り渦が形成される。すなわち、homeodynamicsな二つの系が逆向きに衝突して分子のhomeodynamicな動きを制約し合うとmorphodynamic 系が形成されることになる。順向きのhomeodynamic系が集まっても、エネルギーは高まるがmorphodynamic系が生まれることはない。
ではベルナール・セルはどうだろう?静置された液体の入った容器の底面を均等に熱すると、例えば固体の場合は伝導によりそのまま熱は散逸する。ところが液体の場合、表面と底面の温度差が発生すると、水分子の運動が高められ、対流が始まる。したがって、ベルナールセルを、熱の流れというhomeodynamicsと水の動きという2つのhomeodynamics系が制約し合うことで生まれるカオスを安定化させる力学として捉えることができる。すなわち、熱の流れと水分子の流れという質の異なるhomeodynamic系が制約しあっても、morphodynamics系は生まれる。
もちろんhomeodynamics系を自己組織化系と見ることもできる。重要なことは、morphodynamic系は必ず外部のhomeodynamic系が制約しあっているカオスの上に成立し、この制約が増幅することにより自己組織化が起こる点だ。
同じ様に、熱水噴出孔のマイクロセルが形成する制約による有機物生成もmorphodyamicsとして考えることができる。渦やベルナール・セルと異なり、巨視的な分子やエネルギーの流れではないが、触媒作用はエネルギーの流れを変化させる、分子の結合を促進する制約の一つだ。
ここまで見るだけでは、Deaconの考えも、生命という複雑系を、単純な力学系が相互作用してカオスが生まれるとき自己組織化が起こる系として捉える従来の考えに近い様に思える。しかし、Deaconは自己組織化やmorphodynamicsだけでは生命に必要な条件を捉えきれないと考えている。
生物はもちろん熱力学系であり、homeodynamic 系であり、自己組織化(制約化)するmorphodynamic系だが、これらをただ複雑に組み合わせても生物は発生せず、もう一段高次の力学系が必要だとDeaconは言う。この新しい力学系がteleodynamicsで、このもう一段高次の力学系を導入して生物までの道筋を整理したのがDeaconの考えの特徴と言える。
teleo-とはいうまでもなく、teleology(目的論)を意識して選んだ用語だと思う。目的、機能、複製、進化など、生物との共通性を有する増殖系として前回紹介した、Ottoの複製子を例にteleodynamicsを考えてみよう。私の理解が間違っていなければ、Ottoの複製子teleodynamics系と言っていい。
まずOttoの複製子を思い出しながら、morphodynamic系との違いを見てみよう。morphodynamic系では、分子やエネルギーの供給が続き、ミクロレベルでの分子衝突により制約が発生、拡大し、マクロレベルの秩序が発生する。しかし、分子やエネルギーの供給が止まると渦もベルナール・セルも消える。一方、アミノ酸の供給が止まり新たなOttoの複製子の合成が止まっても、複製子自体はかなりの期間存在することができ、新たなアミノ酸の供給が始まると同じ複製子の増殖を再開することができる。この差が、morphodynamicsとteleodynamicsの差と言っていい。
熱水噴出孔で実際にOttoの複製子が形成されているという証拠はないが、これが生まれるための条件を考えてみよう(図2)。すでに述べたが熱水噴出孔でエネルギーと分子の流れがぶつかり、こうして生まれるカオスが噴出孔に存在するマイクロセルの持つ様々な制約を受けてアミノ酸を含む有機分子が合成されるのはmorphodynamicsに従う過程だ。もちろん地下からの噴出が止まれば有機物は海中に拡散してmorphodynamis系は消失する。
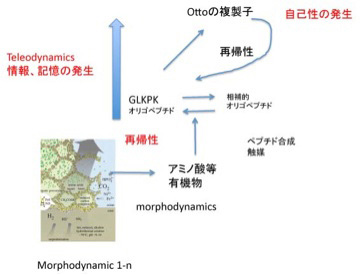
図2 Otto複製子形成過程から見たteleodynamics系の発生。説明は文中。
ここで「Otto複製子の成分GLKPKオリゴペプチドに化学的に相補的な別のペプチド(鋳型ペプチド)が存在し、GLKPKが一旦合成されると、それが鋳型になってアミノ酸重合反応を鋳型ペプチドが合成される方向へ促進する。また鋳型ペプチドは逆にOtto複製子の合成を高める」とする仮定を導入してみよう。この仮定を適用すると、GLKPKオリゴペプチドは一旦合成されると、あとは反応がこの2つの分子の合成へと制約されていく。言い換えると、有機合成が維持されるmorphodynamic系でのOttoの複製子の合成は、最初は偶然だが、一旦合成されると、同じことが安定して繰り返される秩序が生まれることになる。すなわち、GLKPKオリゴペプチドと鋳型ペプチドのどちらかが新しい制約として系内部に発生すると、GLKPKオリゴペプチドと鋳型ペプチドのセットを継続的に複製、増殖させることができる。これはmorphodynamicsでは見られなかった新しい系が生まれたことを意味している。
ここで導入した仮説はドイツの化学者Manfred Eigenが1978年の再帰的反応、ハイパーサイクルについて述べた論文(前述)で既に述べており、前回、内的に発生する再帰的制約と呼んだ系も彼のハイパーサイクルを参考にしている。
この様に、自己組織化するmorphodynamics系に、ハイパーサイクルのような再帰的関係が発生することがteleodynamicsが生まれる条件で、この関係が成立すると新しい制約を増幅させる系が現れる。もちろんハイパーサイクル自体は系として自己増殖できても化学反応にしか見えないが、前回紹介した様にGLKPKオリゴペプチドが重なり合ってOtto複製子が出来始めると、自己性を含む、生物と多くの共通点を有する力学系が発生する。Otto複製子では、複製すべき構造が環境との関わりで「情報」を発生させ、この情報に従って複製する構造が決まる。また、GLKPKオリゴペプチドはただの化学物質だが、Otto複製子の構成成分としての「機能」が生まれる。すなわちmorphodynamics系には見られない、情報、機能、自己性がteleodynamics系には存在する。このように、teleodynamics系は必ずしも生命である必要はないが、生命と共通の性質を有していることが下記らかな力学系だ。
これまで、様々な例を使ってDeaconの提唱する3つの力学系、homeodynamics, morphodynamics, teleodynamicsについて説明したが、これを図にまとめておく。Ottoの複製子を生物として見ることはできないという声が聞こえてくるが、上位の力学系が下位の力学系の単純な延長でないことは理解していただけたのではないだろうか。
Deaconの考えは、生命誕生を考えるとき、私にとってはもっとも頼りになる指針になっている。
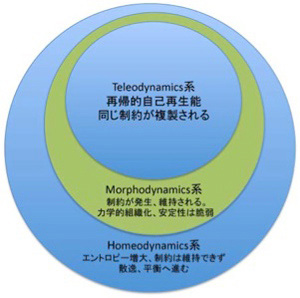
図3 Deaconの提唱する3つの力学系。それぞれの力学系は下位の系に従属する。この意味で生命も熱力学に従うが、上位の力学系は下位の力学系の単純な延長ではない。
[ 西川 伸一 ]
LUCA誕生に必要な条件
2016年2月15日
繰り返すが、Ottoの複製子(Otto Replicator: OR)は、自己性を持ち、環境との相互作用で決まる特定の構造を繰り返し複製できる点で、DeaconがTeleodynamicsと呼ぶ力学系の条件を満たしていることを述べた。しかし、だれもORを生物とは呼ばないだろう。そこで、ORと実際の生物を比較し、生命の条件を考えてみよう(図1:前回と同じ図を再掲する)。
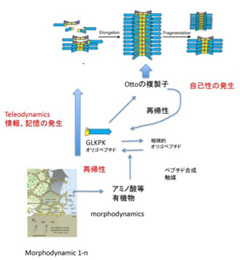
図1 前回掲載したOtto複製子についての、仮想合成経路を再掲している。これから、これと比べながら原始生命LUCAの条件を考えていく。
まずORは1種類のペプチド(図中では青と黄色の矢印)が基本単位になっているだけで、私たちが生命と呼んでいる最も単純な存在と比べても、単純すぎる。たしかに複雑だから生命と言えるわけではないが、やはり複雑性を持つことは生命の条件になるだろう。生命が複雑に見える一つの要因は、物質とエネルギーの代謝が生物には内在化しているからだ。
次にOR構造の形成過程を見てみよう。ORは熱水噴出孔に発生する(と仮定している)物質とエネルギーのmorphodynamics力学により合成されるペプチドから構成される。もちろん、OR自身も触媒や鋳型として働くことで、構築を組織化(Organize)している。しかし、生命と違って物質とエネルギーの供給は内在化されていない。一方、生物も外界からの物質に依存はしているが、エネルギーや物質代謝を生物内部で行っている。
とすると、ORは代謝を内在化させるという条件をスキップして、自己性を獲得してしまっていると言えるのかもしれない。その結果、物質とエネルギーの供給は全て外部に依存している。
このことから、少なくとも地球で見られる生命誕生の条件として、独立性・自己性が生まれるより前に、生存に必要なエネルギーや物質の代謝システムの少なくとも一部が内在化されていることを指摘できる。これがどう行われたのか想像してみよう。
前々回述べたようにMartinらはこの準備が熱水噴出孔のマイクロセル内で準備されたと考えている。マイクロセルは無機物でできており、その中での代謝システムがどれほど複雑化しても、独立することはない。その代わりに、安定した環境を長期間提供できることから、最終的に内在化することが可能な代謝システムの準備がここで起こったとする考えは説得力がある。
LUCA誕生前にエネルギーと有機物の代謝システムが生まれる過程は、現存の全ての生物に共通するシステムを参考にして考える以外にない。そして全ての生物がエネルギーと有機物合成のために共通に使っているのが、アセチルCoA、ATP、水素イオン勾配を利用したATP合成システムだ。したがって、まずこれらの分子やシステムがどう生まれたかを考える必要がある。
まずアセチルCoA,ATP分子から見ていこう。図2に示すように、アセチルCoAは、細胞内の有機合成の核として機能しており、他にも図には示していないがコレステロール合成や、ケトン体の合成など、まずほとんどの有機分子代謝経路に関わっている。おそらくわかっているものを網羅するだけで、生化学の教科書一冊分必要なはずだ(実を言うと、代謝経路はこれまで私の最も苦手な分野だ。しかし生命誕生を考えるためには必須の知識で、若い研究者はぜひ私のような苦手意識を持たないようにして欲しいと思う)。
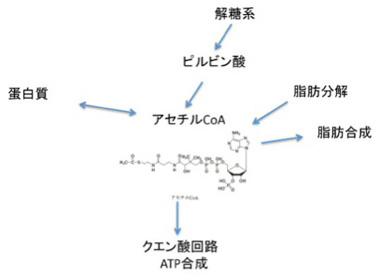
図2 アセチルCoAは有機合成の種として全生物共通に使われている。
しかし図3に示すように、熱水噴出孔では炭酸ガスが水素により還元された後、アセチルCoAを合成するWood–Ljungdahl 反応と呼ばれる合成回路が進む条件が存在したと考えられている。確かにCoAの分子構造はLUCAが生まれる条件に常に存在するにはあまりに複雑に見える。しかし、ただのメチル基がCoAの代わりに存在する極めて単純な分子でも、アセチルCoA と同じ機能を果たし得るし、またこの程度の有機分子は十分存在し得たと考えていいだろう。
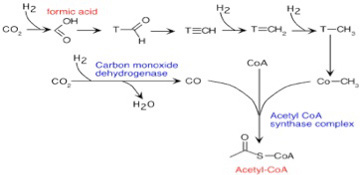
図3 Wood–Ljungdahl 反応:詳細を気に止める必要はない。これまで議論した水素による炭酸ガスの還元反応からアセチルCoAの合成経路が始まることだけに注目して欲しい。(Wikiより)
アセチルCoAと同様、糖と核酸とリン酸が結合した一見複雑なATPも生物の力を借りることなく合成されることはすでに述べたので、ここではADPをリン酸化して不安定なATPに変え、それがADPに戻る時のエネルギーを化学反応に使う仕組みの発生過程について考えてみよう。
現在の生物にはATPを合成するための多様な回路が存在している。しかし、あらゆる生物に存在する仕組みは膜を隔てた水素イオンの勾配をエネルギーとしてATP合成酵素を動かしADPをリン酸化する方法だ。ただこの方法で持続的にATPを合成するためには、細胞内外の水素イオン勾配を維持する必要がある。
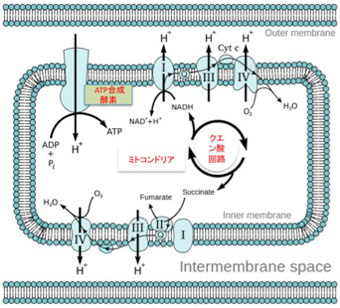
図4:ミトコンドリア内でのATP 合成のメカニズム。説明は本文参照(Wikiより)
私たちの細胞でATP合成を行なっているミトコンドリアでの仕組みを見てみよう(図Wikipediaより)。電子を移送するトランスポーターが膜上に並んでおり(図にはI,II,IIIとナンバーを付けて示している)、電子が伝達システムの分子間を移動するたびに水素イオンがミトコンドリア外に放出される様にできており、これによりミトコンドリア内に流入した水素イオンは細胞質へと汲み出される。こうして維持される水素イオンの勾配を使って水素イオンはミトコンドリア膜上にあるATP合成構成酵素を通って流入する。このエネルギーを用いてこの酵素はATP合成を行う。(より詳しく知りたい方は、季刊生命誌43号の図もご参考ください)
ATPを作るために水素イオン勾配を使うシステムはあらゆる生物に見られるが、エネルギーのために常に流入する水素イオンをくみ出して勾配を維持するためには、このように高度に組織された複雑な構造を持つ分子セットが必要になる。もちろん、LUCAが誕生する最初からこのような分子が存在するはずはない。しかし、水素イオンの勾配を維持する仕組みがないとエネルギーを自分で作れないというジレンマに陥る。実際、薬剤でこの電子伝達系を止めると、ATPの作れなくなった細胞は即座に死滅する。
どうすれば複雑な電子伝達系なしに水素イオンの勾配を維持すれば良いのか?この問題を解決する一つの素晴らしいアイデアが、Nick Laneらにより示されている(Sojo et al, PlosBiology 12: e1001926, 2014:図4)ので紹介しよう。このアイデアは、特別なメカニズムなしに水素イオン勾配が利用できる方法を示すだけでなく、生物の自己化、独立化の過程も説明できる可能性を秘めたアイデアだ。
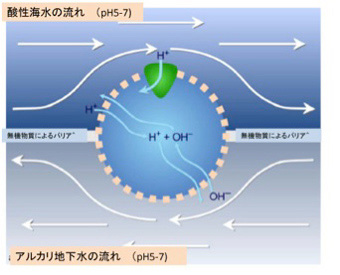
図5 Laneはアルカリ熱水が地下から噴出するベントでは、水素イオン勾配が維持できる条件があると提唱している。
LaneはMartinとともに、熱水噴出孔でLUCA誕生の準備が進んだと考えている一人だ。マイクロセルは小さな穴が空いているが、分子透過性の選択性はない。図では、この穴に水素イオンが透過する脂肪膜を持った小胞が詰まるという状況を設定している。熱水噴出孔では、地底から湧き出すアルカリ性の液体と、弱酸性の海水が存在するが、それぞれの流れが脂肪胞とマイクロセルを形成する無機物で隔てられると、持続する水素イオンの勾配が図の上下で生まれる。地底からの液体と、海水は常に流れているので上下のpHの差は維持され、水素イオンの勾配も維持される。
ここに図5・緑色で示した水素イオンの流れをATP合成に使える原始的タンパク質が誕生すれば、水素イオンを脂肪胞外へ汲み出す複雑なメカニズムが存在しなくとも、ATP合成システムを持つ脂肪小胞が生まれる。その後、同じ脂肪胞内で水素イオンと他のイオンを交換的に移行させるトランスポーター分子がたまたま合成されると、水素イオンの汲み出し機構とATP合成システムの両方を備えた脂肪胞が完成する。
このシナリオが実際に起こったかどうかはわからない。しかしこの考えは、LUCAに必須のATP合成システムとアセチルCoAを併せ持った脂肪胞の形成過程を、大きな飛躍をせずに考えられることを示唆している。少なくとも私は、エネルギーと有機物質合成系を備えた脂肪胞が熱水噴出孔で発生することがそれほど困難でないと確信できる。また、このような細胞様システムを人工的に合成して研究が行われることも遠くない話だと思っている。
とはいえ、エネルギーと有機物の合成系を内在する小胞を先行させて考えるとき、次にもっとも難しい問題として登場するのが複製だ。ORのような単純な構造の複製は容易だが、系が複雑になればなるほど、その複製は困難になる。
有機物とエネルギー合成システムを備えた細胞様小胞の実現性を確認した後で、十分複雑化したシステムにどうすれば複製能力を付与できるかを考えていこう
[ 西川 伸一 ]
ダーウィン進化自体が情報を発生させる
2016年3月1日
前回までのLUCAへの道(個人的に可能性が高いと考えている道にすぎないことを断っておく)を手短にまとめると、次のようになるだろう。おそらく水素と炭酸ガスから、アセチルーCoAあるいは、より単純な代換え化合物を合成するためのWood-Ljungdahl経路が完成する(49話図3参照)。これが脂肪膜内で起こるのか、原始のスープの中で起こるのかはわからない。しかしこれが完成すると、様々な有機物を合成できるようになる。もちろん脂肪膜も形成される。こうしてできた脂肪膜は小胞を形成するだけでなく、強力な触媒としても作用することはすでに述べた。アセチルCoAと一定の触媒機能を備えた脂肪膜小胞が比較的高い確率で持続的に形成され、たまたま自然に形成された水素イオン勾配の存在するマイクロセルに引っかかっているうち、水素イオン勾配をATP合成に使える小胞が生まれてくる(ATP合成酵素の誕生)。ここまでが前回述べたシナリオだ。
しかしこれだけでは自然の水素勾配が存在する場所から離れることはできない。独立したATP合成系を持つためには、細胞膜内外のプロトン勾配を維持するメカニズムが必要になる。もちろんミトコンドリアにあるような電子伝達系は複雑すぎて、それが備わるのはずっと後の話だ。この最も単純なプロトン勾配維持システムについてもNick Laneの仮説は十分説得力があるので紹介しておこう( Sojo et al, PlosBiology 12: e1001926, 2014)
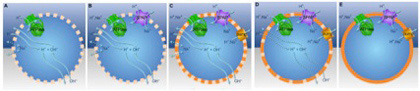
図1 独立したATP合成系を備えた脂肪小胞の形成過程(Sojo
et al, PlosBiology 12: e1001926, 2014より)。説明は本文参照。
自然のプロトン勾配を利用するATP合成酵素ができるところまで(図1Aまで)は前回紹介した。この仮説では、次の過程をプロトンとナトリウムイオンを反対の方向に移動させるアンチポートの誕生としている(図1B)。膜の透過性がザルのように高いとき、このアンチポートの機能的意味はないが、膜がナトリウムを通さなくなると、プロトン流入の度にナトリウムイオンを汲み出すメカニズムとして働くことができる。この分子に加えて、さらに小胞中からナトリウムの汲み出しを高めるために、プロトンとナトリウムのどちらでも汲み出せるエネルギー依存的ポンプができると(図1C)、プロトン勾配を維持するための準備が整う。プロトン通過性の膜を持つ小胞の場合、この分子はもっぱらナトリウム汲み出しに使われるが(図1D)、プロトンを通さない膜に変化するとプロトンを汲み出してプロトン勾配を維持するメカニズムとして働くことができる(図1E)。このようにして独立したプロトン勾配維持システムが出来上がると、外界の条件にとらわれずATP合成に利用する小胞が完成する(図1)。
さて、ここまで順を追ってNick LaneやWilliam Martinの考えを中心に、ありそうなシナリオをつないでみると、読者の皆さんも独立した代謝システムを持つ脂肪胞なら十分合成できそうだと納得されるのではないだろうか。しかし本当は絵に描いたようなシナリオに簡単に納得しないでほしいと思っている。実際に重要なのは可能性のあるシナリオではなく、どのシナリオであっても、その過程が繰り返し起こる条件を明示できるかどうかだ。
ダーウィン進化では、特定の形質に情報、すなわちゲノムが対応し、環境にフィットした性質を生殖を通して(すなわちゲノムの複製により)増幅することができる。しかし、ゲノムが発生する前にはこの手は使えない。
ゲノムが存在しない時のダーウィン型進化とは何かをまず考えてみよう。生物が介在しない有機合成系では、炭酸ガスや水素といった単純な無機物から、複雑で多様な有機物が持続的に発生している。ただこの合成はランダムで、基本的には再帰性はない。従って多様性がますます増大する、すなわちエントロピーが増大するhomeodynamic過程と考えられる。この中から、例えばATP合成系を持った脂肪小胞が生まれるということは、エントロピーが増大するよう一方向に進む反応系を制約して、特定の秩序が自然選択される条件が存在することになる(図2)。
では何が選択されるか。もっとも理解しやすいのは、分子の安定性を指標とする選択だろう。普通有機物の寿命は短い。しかし、環境条件にフィットした分子は長い時間存在することができる。あるいは温度勾配を利用したふるいにかかり、特定の大きさの分子が特定のマイクロセルに濃縮され選択されることでも多様性を減じることができる。さらにはマイクロセルを構成する無機質の持つ触媒効果も当然多様性の制約に働く。これらが合わさって特定の構造が安定に存在できると、合成自体はランダムであっても、自然選択により系内の多様性を減少させることがある程度可能になる。
図2 分子進化における外界による自然選択:多様な有機分子を様々な外的要因で選択して、特定の構造の合成を繰り返して起こすことは可能か?
注意して欲しいのは、環境要因が多様な分子集合の多様性を減らす制約として働くとき、巧まずして一種の情報が発生していることだ。すなわち、こうあるべきという方向性を環境が与えることで、存在可能な分子の種類を制約している。ただ、できてきた分子を環境によって選択するだけの情報では、制約の程度は知れており、似た種類の分子の濃度は上昇するかもしれないが、同じものが繰り返し合成されるほどの情報にはならず、これだけでは情報は萌芽段階にとどまる。
では次に持続的な情報が発生するには何が必要か?
ここでもう一度コンビナトリアル化学で紹介したOttoの複製子が生まれる過程を思い起こしてほしい。
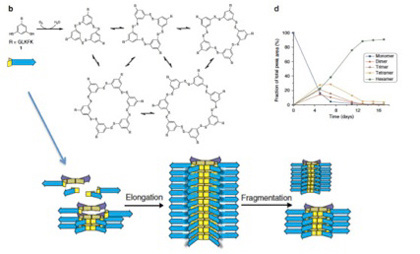
図3 Otto複製子の発生過程 説明は本文。
重要な実験なので図3に再掲するが、Ottoの複製子はGLKFKと5種類のアミノ酸がSH基を2個もつベンゼン環に連なっている分子を試験管内で反応させているうち、突然現れる構造だ。最初はSH基同士が反応重合して多様な化合物を作るが(図3b及びd)、ある時突然多様性が失われ、基本構造が6個環状に結合した構造(6mer)だけに収束する(図3d)。これは6merが発生し、6mer同士が今度は縦に重合し始めると、それ自身が反応を6merへ収束させる能力を持つからだ。すなわち、合成物自体が制約として、合成反応自体を制御するようになると、ランダムな反応が特定の構造に収束することがあり得ることを示している。
この制約は物理学の法則とは全く異なる。すなわち、反応は最初に生まれた再帰的制約能力を持つ分子の性質によって決まり、もう一度最初から反応を繰り返した時、同じ制約が繰り返して現れる保証はない。特に最終産物が複雑であればあるほどその確率は低い。物理法則とは違い、偶然に支配されているが、一旦発生すると反応が向かうべき方向性を情報として指示するようになる。
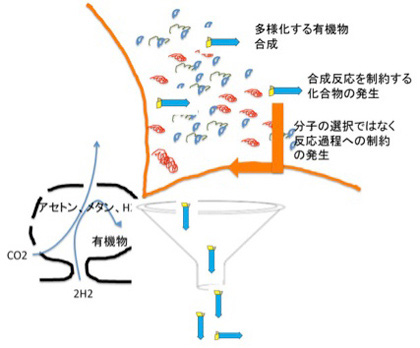
図4 発生した合成物が反応自体を制約することができると、反応の方向性を決める情報が発生し、制約された分子集団が安定して合成されるようになる。説明文中。
原理的には、ここで説明したのと同じような情報の発生と、それに制約された過程が、LUCA誕生過程でも複雑な形で起こったのだろう。これまで見てきたように脂肪膜や、アセチルCoAなどは再帰的制約を形成する能力が高い分子だ。実際には何段階にもわたって制約=情報が発生し、より生命に近いteleodynamics系が発生したと考えられる。
しかしこうして比較的複雑な細胞様構造が発生し、この構造が、合成の方向性を決める一種の情報による制約により繰り返し合成できるとしても、合成物自体と環境がリンクして自然発生した情報は、情報としては生命誕生には十分でなかったようだ。すなわち、現在の生物には独立し系全体の複製をリードできる情報が存在している。この情報の独立が次のステップだ。このステップにおそらくRNAワールドと呼ばれている系が必要になる。次回はこのRNAワールドについてみることにする。
[ 西川 伸一 ]
情報の独立
2016年3月15日
Ottoの複製子をモデルに、ランダムな化学合成系の過程から、この反応を制約する分子が誕生すると、それが情報と同じ働きをして、反応を一定の方向に導き、一定の構造を複製し続けることを前回示した。これほど強い制約でなくとも、多様化する有機分子が環境条件によりダーウィン的選択をうけ、特定の構造が濃縮されるよう制約されること自体も、考えようによっては、情報が発生していると見ることができる。繰り返すがここでいう制約は物理法則とは違って偶然発生したもので、この制約に基づく情報は独立して存在しているわけではない。すなわち少しでも環境が変化すれば、その情報は消失する。従って、ここではこの様な情報を偽情報と呼んでおく。
偽情報だけでどこまで複雑なシステムが形成可能か?計算機によるシミュレーション実験が必要だろうが、偽情報だけで達成できる複雑性には限界があると思う。これが生命誕生以前の有機合成システムがもつ物理的限界になる。
例えば前回述べたATPエネルギー合成系と、有機分子合成系を両方備えた程度の複雑性をもつ脂肪胞の複製でも、偽情報だけでは安定に複製することは到底不可能ではないかと考えている。では次の段階として何が必要か?
この答えを地球上に存在する生物に求めるとすると、「情報がゲノムとして独立すること」と言っていいだろう。現存のあらゆる生物はセントラルドグマに従い、DNAを媒体としてゲノム情報を独立させ、この情報を複製により増殖するとともに、転写により細胞の維持に使っている。そして、生物が介在しない有機合成系では到底到達できない複雑性を達成している。
ただ、自律的に有機物とエネルギーを形成する代謝システムが、一足飛びに現存の生物が持つ、独立した情報を中心にしたシステムへと転換することは至難の業で、幾つかの中間段階を介在させて考える必要がある。この中間段階として提案されているのが、いわゆるRNAワールド仮説だ。この仮説には様々なバージョンがあり、エネルギーや物質代謝システムに先行してRNAワールドが存在したと考えるreplication first仮説もあるが、ここでは最低限の独立代謝システムと並行して、あるいはその成立後に加わる系として考えていく。
もちろん、どちらが実際に起こったのか、あるいは本当にRNAワールドが存在したのかに答えることは現段階では難しい。ただRNAはそれ自身で明確な情報と機能が共存する有機システムを形成する能力を有し、LUCAへの中間段階として働く可能性がある。まず、その点について見てみよう。
RNAワールド仮説は、タンパク質と同じようにRNAがリボザイムと呼べる様々な酵素活性を持ちうるという発見が基礎となっている。もともとRNAはヘアピンループ構造を基盤とする複雑な立体構造を取り得ることが知られており、タンパク質と同じような酵素活性を持てるのではと期待されていた。1980年に入ってすぐ、後にノーベル賞を受賞するThomas CechとSidney Altmanが、スプライシングや前駆体tRNAが機能をもつ成熟tRNAになる際のプロセッシングにRNAが酵素として働いていることを発見する(図1)。
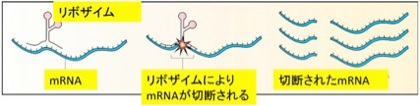
図1 RNAからできたリボザイムによるmRNA切断を説明したウィキメディアの図(https://commons.wikimedia.org/wiki/File:Ribozyme.jpg)。Thomas Cechはリボザイムを含む一本のmRNAが、タンパク質の助けを借りることなく自分自身を切断融合する(スプライス)ことを示してノーベル賞を受賞した。
それ以後研究は急速に進み、現在リボザイムは様々な生体機能を調節するために有望な分子として創薬などに利用され始めている。例えば50merほどのRNAをランダムに合成して、その中から特定の分子と結合するRNAを生成して、阻害剤として使うというような使い方が行われている。なぜ期待が大きいかというと、活性のあるRNAを容易に合成できること、それ自身が塩基配列情報を持っているため、同じ分子を複製することが容易であるためだ。
このようにCechとAltmanの発見により、それ自身についての明確な情報を担ったRNAが同時に、酵素活性という機能を持ち得ることが明らかになった。すなわち、偽情報と比べた時、RNAワールドでは、情報が独立性を持っている。以前述べたが、情報は物質ではない。リボザイムではRNAという媒体で表現されていても、次の段階でDNAということなる媒体で同じ内容を表現することができる。まさに、DNAを媒体として独立した情報を持つLUCAの中間段階にぴったりの存在であることがわかる。
ただいくらRNAが情報としての側面と、機能分子としての側面を持つと言っても、最初はRNAが情報に基づいて合成されることはない。少しわかりにくいが、この段階ではランダムにRNAが合成される。すなわち外で降る雨と同じで、自然現象と言える。ただ、できた情報を何らかの方法で解釈することができるようになると、ここに情報が誕生する。ランダムに自然現象として生まれたRNAの中に、このRNAが持つ情報を解釈するRNAが誕生したと考えるのがRNAワールド仮説だ。
これまで説明してきたように、条件が整えば自然現象としてヌクレオチドを合成することができる。またフォスファチジルコリンを主成分とする脂肪小胞はRNAを重合させる活性が高く、50merまでのランダムなポリヌクレオチドを合成するための触媒活性を持つ(Orig Life Evol Biosph 38:57、2008)。従って、現在研究者がリボザイム合成として行っていることは、自然現象として起こる。研究者は、自分の目的に合わせてこの中から特定のRNAを選択し、そこにある情報を使うが、RNAワールド誕生では、まず誕生したRNAの中に、RNAの塩基配列を解釈できる機能が生まれることが必要になる。従って、一般的にRNAワールド仮説ではRNA配列を解釈して複製するリボザイムの誕生を最初のゴールと設定している。
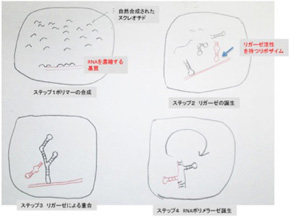
図2 RNAワールド誕生までの過程を描いたJoyceらの仮説。
(Cold Spring Harb Perspect Biol 2012;4: a003608より改変)
Joyceらは先に述べたRNAの重合を触媒する脂肪膜と、RNAが結合して濃縮される基質を備えた小胞の中でRNAの分子進化が進み、RNAポリメラーゼが誕生するまでの過程を図2で示すように描いている。まず、ランダムにポリマー化したRNAはヘアピンループ形成を介して、多様な構造を形成する。ただ、ランダムに合成されるRNAの長さには限界があるので、さらに複雑なRNAを合成するためにはまずRNA鎖同士を結合するリガーゼ活性を持つリボザイムが発生する必要がある。この結果ヘアピン同士が重合を始め、より複雑な構造の大きなRNA分子が形成される。こうして生まれる分子構造の中にRNAポリメラーゼ活性を持つ分子が誕生することでRNAワールドが完成することになる。一旦RNAポリメラーゼが誕生すると、小胞の中に存在するRNAを鋳型として複製が行われる。もちろんポリメラーゼ自身の複製もおこる。
このシナリオを実験的に証明することは難しい。すなわち最初はヌクレオチドしか存在しない状態からスタートして、RNAの分子進化を介してRNAポリメラーゼを誕生させ、自己複製が可能なRNAワールドを形成する実験は行われていない。しかし自己複製可能なRNAシステムが可能なことは理論的にも、実験的にも示されている。
繰り返すがRNAワールドの誕生は、自然に合成されているときは情報でも何でもないRNAの塩基配列の中に、塩基配列を解釈できるリボザイムが誕生した時点で始まる。この時、それまで情報でなかったRNAの塩基配列が、情報に変換される。そしてこうしてできた情報を増殖させられる系は、増殖できず一回で消滅する情報と比べると、当然自然選択の対象になる。また、情報のエラー発生を通して、情報は多様化する。解釈するリボザイムが存在する限り、エラーが起こった情報も、情報として処理され、自然選択を通してより環境にフィットした系が進化することになる。ただ、このRNAワールドは、RNAだけで完結している。従って次のステップは、多様化と自然選択が可能なRNAワールドが、例えば独立代謝システムと相互作用し、両者が組織化された系の誕生だ。次回は、この過程について考えてみる。
[ 西川 伸一 ]
参照情報と記号情報の誕生
2016年4月1日
前回、RNAワールドでは、自分を鋳型として新しい分子を複製できるシステムが可能になっていることを説明した。同じような現象は、プリオンなどでも見られるため、RNAワールド以外でこれが起こらないことを証明することは難しい。もちろん私はこの分野の素人だが、それでもRNAがランダムに合成されているうちに、リガーゼやリプリカーゼ活性のあるリボザイムが生まれ、それによりRNA自体が情報として独立するとする考えは理解しやすい。また、ここで議論しているRNAの特徴を利用して、アプタマーなどRNAテクノロジーが進展しているのをみると、特定の機能が塩基の配列として解釈され、塩基配列から生まれる機能分子を複製することが可能なRNAワールド仮説は極めて魅力的だ。
また分子の機能を塩基の配列として解釈し複製できることは、RNAワールドでは情報が環境から独立したことを示す。例えばOttoの複製子も同じ分子を複製するが、この時の情報は前にも述べた偽情報で、複製子自体の物理化学的性質と環境条件によって形成されており、環境が変わると、情報の内容も変化する。一方RNAワールドでの情報は、もちろん大きな意味で物理化学法則(RNAという媒体を使う点)に従い、条件によっては情報として読み出せないこともあるかもしれないが、原則として塩基の並びとして表現されており、周りの条件からは独立できている。
このようにRNAワールド仮説は、機能を周りの条件から独立した情報として表現できることを示してくれたが、この情報はRNAワールド内だけでしか働かない。現在のような、アミノ酸、タンパク質、リボゾームRNA、mRNAなどが入り混じったセントラルドグマが成立するためには、まず特定のRNA分子がアミノ酸と対応する参照関係やコドンとアミノ酸の対応のような記号化が必要になる。現存の生物を眺める時、アミノ酸との参照関係と記号化(コドン化)が最もはっきりと見られるのがトランスファーRNA(tRNA)だ。次に、tRNAとアミノ酸との参照関係がどのように生まれたのか、またtRNAが塩基配列を記号として認識できるようになった過程を見てみよう。
まず大学生時代に戻って、トランスファーRNAとはどんな分子だったか思い出してみよう。
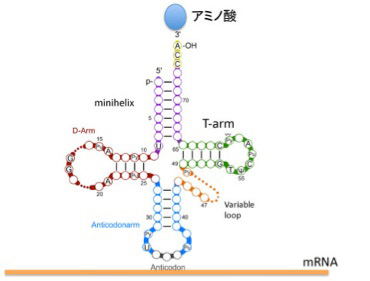
図1 tRNAの構造。ミニヘリックスとT-ArmはアミノアシルtRNA合成酵素が認識する。一方、D-ArmとAnticodonarmはリボゾームと相互作用する。(Wikicommonsを改変)
図1に tRNA共通の構造を示すが、平均76塩基からなるRNAで、ミニヘリックスを形成する3’末端に特定のアミノ酸が結合し、アンチコドンループでmRNAと結合する。この構造から、tRNAがアミノ酸と核酸の参照関係を成立させている分子であることがよくわかる。すなわち、アミノ酸とtRNA自身の対応関係を、mRNA、そして最後にはDNA上の塩基配列へと拡大する役割を担っている(後述のように実際には簡単ではない)。
このtRNA自身と、アミノ酸との参照関係の成立には、各アミノ酸に対応して存在するtRNAを認識して、それに対応したアミノ酸を結合させるアミノアシルtRNA合成酵素が関わっている。
図2に示すように、アミノアシルtRNA合成酵素(aatRNA合成酵素)は、1)ATPによりアミノ酸を活性型に変え、2)そのアミノ酸に対応したtRNAと結合して、3)アミノ酸を3’末端に共有結合させることで、tRNAとアミノ酸の参照関係を成立させる。すなわち、各tRNAとアミノ酸の特異的な参照関係を決めているのは、まさにこのaatRNA合成酵素ということになる。しかし、こんな都合のいい酵素は最初から存在するはずもなく、アミノ酸と特定のRNAの対応関係を成立させるための単純で自律的なシステムを構想しなければならない。1982年これを可能にするシステムについて清水幹夫はC4N仮説を提唱した。
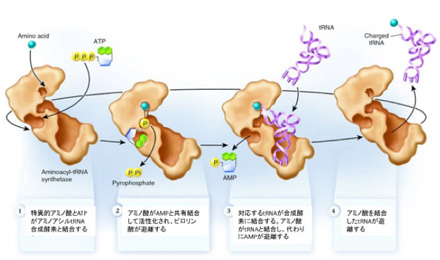
図2: アミノアシルtRNA合成酵素によるアミノ酸とtRNAの結合プロセス(Wikipediaを改変)
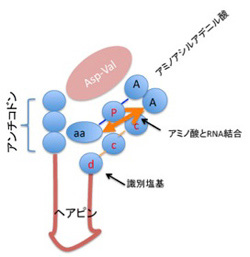
図3 清水幹夫の論文(J.Biochem. 117, 23-26, 1995)に書かれていたC4N仮説が想定している、原始型tRNA.
図3は清水の1995年の論文(J.Biochem. 117, 23-26, 1995)を改変したものだが、tRNAのアンチコドン部を5’末端に持ち、現存のtRNAのミニヘリックス部分に似たヘアピン、識別塩基、CCA3’末端と続く短いRNA分子(例としてグリシンに対してはGCCGGCGAUGUUCGCAUCGCCUCCA)が、アスパラギンとバリンからできたペプチドと結合すると、特定のアミノ酸(この場合グリシン)に対応した特異的ポケットを作り、Asp-Valの触媒作用でアミノアシル化されたRNAに変換できるという仮説だ。1995年の論文では、合成したRNA、アミノアシル化グリシンアデニル酸、そしてAsp-Valを反応させると、アミノ酸がRNAに転移できることを示している。さらに、アンチコドン部分をアラニン(AGC),バリン(GAC)に変更すると、今度はそれぞれのアミノ酸が特異的にRNAと結合することから、アンチコドンが3’末端の識別塩基と協調することで特異性を発揮できることも示している。すなわち、アミノ酸ダイマーが共存しておれば、RNAが自律的にアミノ酸との参照関係を成立できる可能性を明らかにした画期的な論文といえる。
もともと、Gly-Glyのようなアミノ酸のダイマーは、RNAの分解を阻害する能力があることが知られていた。したがって、アミノ酸ダイマーと特定のRNAが安定的な組み合わせとして選択されていた可能性は十分考えられる。ただ残念なのは、2013年の東京理科大学の田村さんの総説を読むと(Viva Origino 41, 29-33, 2013)、「C4Nは非常に画期的なアイデアであるが、今後、この仮説を実験的に検証していく必要がある」と書かれており、1995年の実験がまだ再現されていないことをうかがわせる。とはいえ、C4N仮説は一石二鳥のアイデアで、RNAワールドに、アミノ酸への参照関係性を成立させ、この参照関係をコドンとして記号化することまで視野に入れた独創的な仮説だと思う。
ただ、ここまでうまく話が進まなくとも、NCCA配列を3’末端に持つRNAが、それ自身で、あるいは他のリボザイムの助けを借りてアミノアシルRNAを合成することは十分可能だろう。一方アミノ酸との参照関係を記号化するコドンの誕生については、アミノ酸自体の化学的性質と、塩基配列で表現されるコドンの間に物理化学的・自律的な対応関係が存在しており、少なくとも一部のアミノ酸に対するコドンルールの誕生は化学的に説明できると考える人は多い。
ただ、tRNAに存在するアンチコドンは、アミノ酸の並びを指示するmRNAなどの指令が存在しなければ意味を持たない。すなわち、アミノ酸とRNAワールドをつなぐ媒体はできたとしても、この媒体を使って指示を行う情報はまだ全く存在していない。では、原始tRNAは何をしていたのか?
tRNAの原始型はアミノ酸を濃縮するために誕生してきたのかもしれない。生命誕生前でも、アミノ酸が生成し、その重合が起こりうることは示されているが、重合するにはアミノ酸の濃度が一定以上である必要がある。しかし、実際にはランダムに作られるアミノ酸濃度を高く保つのは難しかっただろう。したがって、アミノ酸を一定の場所に拾い集めることが重合の条件になり、この役割を原始tRNAは担っていたのかもしれない。。言い換えると、原始型tRNAの持つアンチコドンはあくまでも特異的アミノ酸を拾うための仕組みで、アミノ酸をくわえたRNAがヘアピン構造を介して特定のマトリックスに結合し、ランダムではあってもアミノ酸を特定の場所に濃縮することで、ペプチド合成の可能性を高めていたと考えても不思議はない。すでに述べたが、アミノ酸ダイマーの一部はRNAを分解から保護する作用があり、その合成を促進する系は進化的優位性がある。
こう考えると、図3のC4N仮説でヘアピン構造として示されているアームは、ひょっとしたら、マトリックスに結合するためのアームとして使われたのかもしれない。そしてこのマトリックスがDNAであった可能性も十分ある。おそらく生命誕生前に最も多く存在した高分子の一つがATPだろうが、それが重合すれば安定度抜群のマトリックスDNA鎖ができる。また、DNAはRNAともタンパク質とも相互作用可能な高分子だ。アミノアシル化されたRNAを濃縮して、ペプチドを合成するには最適の高分子と言っていいだろう。今述べたのはただの妄想だが、DNAとRNAの関係はこんなところから始まったのかもしれない(図4)。
図4:DNAをマトリックスとして、原始型tRNAが集合してペプチドの合成が促進する可能性を描いた図。
この段階では(図4)、アミノ酸と特定のRNA分子が参照関係を形成し、(C4N仮説が正しいなら)、さらにアミノ酸とコドンとの関係まで成立していたためかもしれないが、まだtRNA上のアンチコドンと対応させる情報はどこにも存在しない。この場合、ペプチドはあくまでもランダムに作られる。こうしてランダムに合成されたペプチドを環境との適応性を指標に選択したとしても、その選択結果を記録する逆セントラルドグマが可能であることを示す証拠は現在のところ見当たらない。
いよいよ問題は核心に入ってきたが、最後に残る課題はこの段階から、DNAへの情報の移転がどう起こったのかを説明することになる。
この過程に関してはおそらく2つの説明が可能だろう。一つは、選択されたペプチドのアミノ酸配列を記号として解釈する方法が存在するとする考え方と、アミノ酸を濃縮するためのマトリックスとして使われてきたDNAが非特異的マトリックスから、コドンでアミノ酸と対応する媒体へと変換をはたし、このランダムな配列から合成されたペプチドの選択を通して、DNA配列が選択され、遺伝子が生まれるとする考えだ。
この問題をさらに掘り下げるため、次回はアミノ酸の重合を支えるリボゾームRNAについて見て行こう。
[ 西川 伸一 ]
独立した遺伝情報誕生
2016年4月15日
生命誕生以前、コドンやアンチコドンに対応する塩基配列は、コードとしてではなく、その物理化学的性質に基づいてアミノ酸と化学的に結合していた可能性を前回述べた。さらにtRNAの中には、アミノ酸が結合したアミノアシル化tRNAを合成するリボザイム活性を持つものが存在することも示されている。従って、原始tRNAは、酵素の力を借りることなく特異的アミノ酸をキャッチし、そのアミノ酸を3’末端に結合させたアミノアシルtRNA(aatRNA)を合成できる。
例えば前回述べた清水のC4N仮説によると、この時現在のアンチコドン塩基配列がアミノ酸をキャッチするのに使われるが、この使い方は、現存のtRNAのように、コドン/アンチコドンのようなコードとしてではない。くどくなるのを恐れず、繰り返すと、原始tRNAにたまたま現在のアンチコドンと一致する塩基の配列が存在していても、アミノ酸との対応が記号化した情報として表現されているわけではない。アンチコドンとアミノ酸が確実に対応づけられていても、これはあくまでもアンチコドンの持つ物理化学的性質の反映だ。
やはり前回、コドンを持つmRNAが存在しなくても、アミノアシル化したtRNAが何かのマトリックスを利用して集まることができること、また濃度の低いアミノ酸をキャッチして一定の場所に濃縮するためにtRNAが誕生したのではないかと述べた。こうしてアミノ酸を濃縮する事でポリペプチドへと重合させる可能性が高まる(52話の図4を再掲)。即ち、RNAとペプチドの基本関係(物理的)がこうしてできあがる。
図1:52話の図4を再掲している。今回の図では、ペプチド形成は、原始リボゾームのペプチド転移活性によることを明確に記載している。
この時、tRNAに結合したアミノ酸をポリペプチドへ重合するペプチド転移酵素が必要だが、RNAワールドではもちろんこれを行っているのはリボザイムだ。現存のリボゾームはRNAと約50種類のタンパク質が結合してできているが、ペプチドを結合する活性を持つのは純粋にRNAから出来たリボザイム部分であることが証明されている。すなわち、タンパク質からできた酵素にその役割が移行したアミノアシルtRNA合成と異なり、現存の生物でも、実際にこのペプチド転移反応はリリボザイムが行っている。
図2に、現存の生物に見られるリボゾーム、tRNA、アミノ酸、ポリペプチドの関係を示したが、mRNAの塩基配列に対応したアンチコドンを持つtRNA同士が集まり、それぞれが担っているアミノ酸が重合する。この時、tRNA が集まる場所をリボゾームが提供していることがわかる。すなわち、図1で想定したマトリックスの役割をmRNAとリボゾームが演じている。これに加えて、リボゾーム内のリボザイムは、tRNAが担っているアミノ酸を順々に結合させ、ポリペプチドを合成するペプチド転移酵素作用も持っている。このように、原始リボゾームも現存のリボゾームも、tRNAを濃縮するマトリックスとペプチド転移酵素の集まったユニットと見ることができる。勿論RNAワールドでは、環境に適合するRNAは複製により増幅される(遺伝の可能性)ことは言うまでもない。
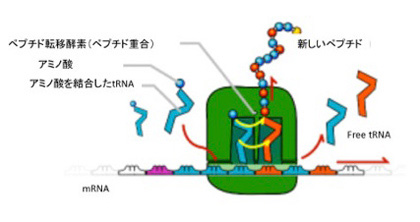
図2 現存のリボゾームの模式図。説明は本文参照。(ウィキペディアより引用)。
こう見てくると、タンパク質を作るためのすべての基本過程、すなわちアミノアシル化tRNAの合成及び、ペプチド転移反応の両方をリボザイムが行っていたことは重要だ。生命誕生過程が、先行して複製能力(遺伝能力)を実現したRNAワールドに、タンパク質が後から加わるという順序で進んだことを強く示唆している。言い換えると、RNAの活性がペプチドの合成も支配していた時期から、性質の異なる2種類の有機分子が互いに作用し合う世界へ移行したことがわかる。
物質として全く異なる核酸とアミノ酸を対応させるための記号化が必要になるのはまさにこのときだ。
原始型から現代のtRNAへの構造変化は情報誕生過程のヒントを与えてくれる。すなわち、原始型tRNAではアンチコドンはアミノ酸との物理的結合に使われており、情報を解釈する機能はない。一方現代型tRNAでは、アミノ酸と対応するアンチコドンが存在するが、これはアミノ酸と結合しているループから離れて存在しており、直接アミノ酸とアンチコドンが作用し合うことはない。 考えてみると、現存の分子で、物質と記号化情報がこれほど上手に媒介できる構造を持つ分子はtRNA以外にないだろう。しかも、RNAワールドではRNAの塩基配列により生まれる機能であれば複製・増幅が可能だし(遺伝)、多様化と選択(進化)も可能だ。
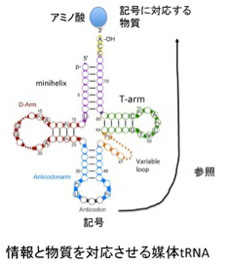
図3 情報と物質を対応させる媒体としてのtRNA)。tRNAの機能を知るため52話の図を再掲。
この段階で情報誕生の接点に存在する役者をリストすると、1)アンチコドン配列の持つ物理的性質の結果特定のアミノ酸に結合する原始型tRNA、2)ペプチド転移活性を持つリボザイム、3)異なるアミノアシルtRNAを集めるためのマトリックス、4)RNAを複製するリボザイム、4)RNAの安定性を高める、ランダムに形成されたポリペプチドと数種のアミノ酸だ。(図4)
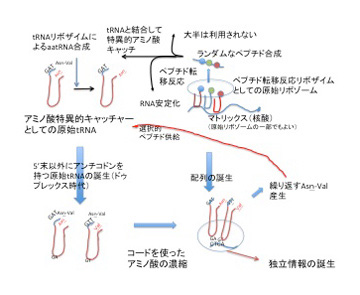
図4:遺伝と多様化が可能な情報の発生過程。説明は文中。
この組み合わせからどう情報(コドン)が発生したのか?
ここで仮に、清水のC4N仮説が正しいとしよう。この仮説では、特定のアミノ酸をキャッチするためにアンチコドンと、ペプチドが相互作用をしている。この時必要とされるペプチドはアスパラギン酸とバリンが結合したジペプチドだ。現代のコドンで表現するとGA(T/C)GT(T/C/A)の配列になる。
2種類のアミノ酸の組み合わせなら、ランダムでも合成するのは簡単で、生命誕生以前にも十分Asn-Valは存在したのではと思うが、 当時10種類前後のアミノ酸存在したと仮定してAsn-Valの組み合わせがランダムに合成される確率は、全ジペプチドのたかだか1%程度だけしかない。このペプチドを確実に十分な量作るためには、記号化されたコドンに従って、2種類のaatRNAを並べ重合させる必要がある。
ではどうすればこれが実現するか?
まずtRNAのアミノ酸と結合する場所(アンチコドンの物理化学的性質が利用されている場所)以外の部位にアスパラギン酸とバリンに対応するアンチコドンを持つ2種類のtRNAが必要だ。これに加えて、マトリックスとなるなんらかのRNA(一番理想的なのはマトリックス+ペプチド転移酵素として働く原始型rRNA自体)に6merのコドンが発生する必要がある。もちろんコドン/アンチコドンの形成は偶然の産物でなければならない。
6merだとこの配列が出来る確率がかなり落ちるので(1Kbに一回)、ここでは計算を簡単にするため、生命以前の原始の世界ではトリプレットコドンではなく、ダブレットコドンだったとしておこう。現在のコドンの冗長性からこう考える人も多い。この場合、tRNA側のアンチコドンはCTがアスパラギン酸、CAがバリンのコドンになる。
アミノ酸キャッチャーとして機能するtRNA5’末のアンチコドンや3’末のNCCA配列は、原始tRNAとしてRNAワールドでは安定に複製・遺伝が行われているとする。このtRNAのどこかにアスパラギンに対応する記号配列が現れる確率は、4×4(16mer)に一回になる。tRNAの大きさを50merと考えると、tRNAのどこかにこのアンチコドンが3箇所は存在することになる。
一方コドンを提供するマトリックスの方だが、ランダムにCTCAが合成される確率は4x4x4x4=256だ。もしマトリックスを提供していると想定している原始rRNAをやはり50merぐらいだと考えると、リボゾームの5個に1個はこの配列を持つことになる。
もちろんリボゾームとは別にRNA鎖を想定してもいい。リボゾームを考えたのは、すでにRNAワールドで複製が行われているRNAである必要があるためで、それが分解して出来た機能を持たない短いRNAでも、それが複製されるなら問題はない。実際、独立したRNAがリボゾームと結合してマトリックスを提供する方が、現在のリボゾームとmRNAの関係に近い。
いずれにせよ、RNAワールドで、ここでリストしたような変化が積み重なることは十分あり得るのではないだろうか。この意図せぬランダムな変化が重なり、2種類のaatRNAがこのCTCA配列を持ったマトリックス上で並んだら、全くランダムだった時の100倍の効率でAsn-Valを合成することが出来る。生産すべきペプチド産物を記号化して指示する独立した情報がここに誕生した。この過程を語る時、どうしても目的論的に語ってしまうが、実際には全てが偶然の過程として起こったことを強調しておく。
一旦この関係が成立すれば、ダーウィンが「もともと生命は、いろいろな力が、一握りの、ひょっとしたらたった一つの原型に吹き込まれて始まり」(種の起源 最終センテンス)と述べた、進化し続けることのできる情報が物質世界に生まれたことになる。この時点ではまだLUCAが誕生したわけではない。最初に吹き込まれたのは、情報だ。情報が誕生するということは、DNAやRNAが誕生することとは別の話で、物質でないコードが、特定の物質と参照関係を確立したということだ。これが達成されるとあとは情報自体が多様化し、さらに新しい大きなペプチド鎖を作ることができる。また、一種類だけでなく、2種類でも、3種類でもアミノ酸配列の決まったペプチドを増やすこともできる。要するにこれ以降は、ダーウィンが進化論で述べたのと同じだ。
最初情報に基づいて作られる特定の配列を持った短いペプチドの重要な機能は、例えば清水の仮説では原始tRNAにアミノ酸キャッチャーとしての機能を与えることであり、またペプチドのRNA保護作用を利用して、多くのRNAを安定化してRNAワールドの持続性と効率を促進することだっただろう。
しかし、できてしまえば多様化する情報断片の威力はすさまじい。こんな小さな情報でも、物理世界に自発的に誕生させることは難しいが、それでもなんとか十分説明が可能であることがわかっていただいただろうか?
今回は私がなんとかひねり出したシナリオを述べた。私でも捻り出せるぐらいだ。他にも十分可能性のあるシナリオが提出されている。次回は他のシナリオについて説明し、物理世界に情報が誕生することがそれほど荒唐無稽なことでないことを再確認したいと思っている。
[ 西川 伸一 ]
ゲノム誕生に関するRoot-Bernsteinの考え
2016年5月2日
ゲノムや生命の誕生について、これまで自分勝手な作り話に基づいて話を進めてきたので、「信用ならん!」と不快に思った読者も多いと思う。一つの仮説を皆さんに押し付ける意図は全くない。実際、38億年前に何が起こったのかを特定することはほぼ不可能だろう。期待したのは、多くの読者が、無生物から生物を発生させることが可能だと思ってくれることだ。
この文章を書き始めた時、無機分子から有機分子、そしてゲノムや生命の誕生など、考える糸口を見つけることすら難しいだろうと思っていた。ところが書き始めて1年もすると、生命誕生について合理的なシナリオを考えること自体はそんなに難しいわけではないと思うようになってきた。そして今は、21世紀にここで述べた様な幾つかのシナリオが必ずだれかによって実験的に確かめられると確信している。
繰り返すが、ゲノム誕生についての個人的理解をくどくどと語ってきた最大の目的は、無機物からの生命の誕生が、多くのシナリオが考えられる、当たり前の科学になりつつあることを皆さんに理解してもらうためだった。
そこで今回は、Root-Bernsteinという研究者が最近の論文で提案しているシナリオを紹介することで、前回述べたRNAワールドからゲノム情報が誕生するまでの過程をもう一度整理したいと思っている。ほとんどの読者にRoot-Bernsteinという名前は馴染みがないだろうが、シナリオは面白く説得力が高い。
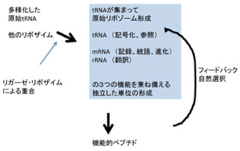
図1Root-Bernsteinの論文(Root-Bernstein & Root-Bernstein, J. Theo Biology 367: 130-158, 2015)に基づいて私が書き直したシナリオ。
まずこのシナリオについて、図1を使いながら簡単にまとめてみよう。このシナリオでは、原始リボゾームを、まだ生物ではないが、独自に、代謝、複製、情報による翻訳と進化の能力を獲得した独立した単位だと考えている。
すなわちリボゾームは、
- 1)RNAワールド維持に必要なリボザイムセット、
- 2)自己の塩基配列に基づく自己複製、自己の一部として存在するtRNAとアミノアシル化tRNA合成リボザイム機能、
- 3)ペプチド転移反応を触媒するリボゾーム中心機能、
- 4)そしてこれ以外の機能を持ったペプチド合成の鋳型として働くmRNA、
の全てが備わった独立単位として考えられている。
エネルギーや物質代謝については、まだまだ独立しているとは言えないが、熱水噴出孔など自然の条件さえ整えば、Ottoの複製子のように複製、進化も十分起こりうる。しかも、複製時の情報としてだけでなく、アミノ酸に対応する記号化された情報も持っており、これにより様々なペプチド鎖を繰り返し合成し、また進化・多様化させることが可能になっている。例えると、適切な環境条件に寄生するウイルスが誕生したと言ってもいい。
これまで私の話に付き合っていただいた読者なら、Root-Bernsteinの仮説を荒唐無稽だと拒否することはないだろう。ただ、本当に生命誕生の途中段階で、ここに描いたような多様な機能を同時に表現したリボゾームが存在したことを証明できるかが問題だ。これについて、彼らは過去に存在した機能の痕跡は、現存のrRNAにも必ず見つかると考え、研究を続けている。
事実、1983年Blochらは現存のrRNAの配列内に、tRNAの配列の一部が頻回に現れることに気がつき、rRNAとtRNAは同じRNA分子から進化した可能性を示唆した(Bloch et al, J Mol Evol , 19:430-428, 1983)。この発見はその後他のグループでも確認されているが、Root-Bernsteinは彼らのシナリオを提案するにあたって、まずこの可能性を詳しく再検討している(Root-Bernstein and Root-Bernstein, J. Theretical Biology 367:130-158, 2015)。
図2は彼らの論文の図2、図3から転載したものだが、現存の大腸菌のrRNAにも、ほぼ全てのアミノ酸をカバーするtRNAの配列の一部が散らばっていることがわかる。
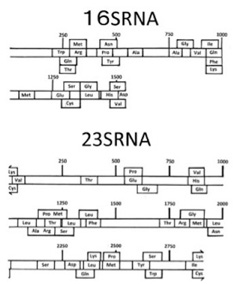
図2:現存の大腸菌の16S,23S rRNA配列の中に発見された、20種類のtRNA配列。(上記論文より転載)
さらに、こうして大腸菌rRNA内で特定したRNA配列が、tRNAの機能を持つかどうか立体構造を計算してみると、図3に示すように、現存のtRNAによく似た構造を取れることがわかる。
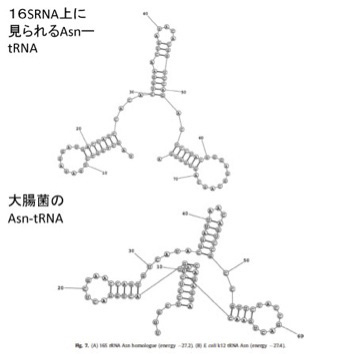
図3 rRNA内から抽出したAsn-tRNA(アスパラギン酸tRNA)の相同配列の理論的立体構造。実際のAsn-tRNAとよく似ていることがわかる。
このように、現存の20種類全てのtRNAに、配列上でも、構造上でも相同な配列がrRNAサブユニットの中に発見できるなら、tRNAとrRNAが同じ先祖RNAから進化したことは言うまでもなく、図1に示したようにrRNA自体がいくつかのtRNAが重合してできたものと考えた方が自然だ。
Root-Bernsteinらはこの点について明確には言明していないが、例えばdeFariasらは、まずアミノ酸との相互作用が可能になったtRNAが多様化し、次にtRNA同士が集まってrRNAのサブユニットを形成したというシナリオを提案している(deFarias et al, Life 6:15, 2016)。
図4はdeFariasらの論文から転載したものだが、tRNAは、その本来の機能であるアンチコドンも、また現在mRNAが担うコドンも両方備えており、それが重合することで、rRNAがmRNAとtRNAの両方の機能が備わった単位になるというシナリオを提案している。
さて、図1と図4をよく比べると、原始リボゾームをRNAワールド本来の代謝や複製に加え、転写翻訳のための全システムが備わった独立した単位として考える点では、図1で示したRoot-Bernsteinらの考えとほぼ同じと言っていいだろう。
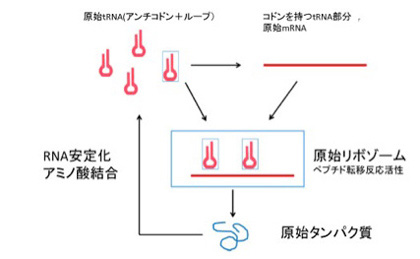
図4 deFarias et alらの論文( Life 6:15, 2016)より転載した、原始リボゾーム形成過程の説明。
さてこのシナリオでは、原始リボゾームで最初作られていたタンパク質は、専らこのrRNAにコードされたtRNAやmRNA、そしてrRNAを安定化する作用を持っていたと考えられている。というよりは、安定化に関わるペプチドやタンパク質を作る情報を持つrRNAが自然選択されたと考えている。即ち、リボゾームが自然選択をうける一つの単位として完成していることがよくわかる。
では、本当にrRNAの中にタンパク質やペプチドをコードする配列は存在したのだろうか。例えば現存のrRNAには50種類以上のタンパク質が結合しているが、これらはrRNAにコードされているのではなく、rRNAをコードするゲノム部分とは異なる場所にコードされている。
実験の詳細は省くが、それぞれの配列の比較からRoot-Bernsteinらは、先に列挙した
- 1)リボゾームタンパク質をコードする配列、
- 2)rRNAの複製を支えるRNAやDNAポリメラーゼの配列
- 3)核酸代謝に関わる酵素の配列
- 4)これ以外の機能を持った、ペプチド合成の鋳型として働く配列、
の全てが、実際にrRNAの中に特定出来ることを示している。
このことは、最初rRNAの安定化に関わるタンパク質を合成していたリボゾームが、効率の悪いリボザイムに頼っていたRNA複製機能や、アミノアシル化tRNA合成機能をタンパク質に置き換える中心的役割を担ったと考えられる。
図5は、大腸菌の23S,16S,5SrRNA内にそれぞれ認められる現存のタンパク質をコードする配列の断片をプロットしたものだが、赤で示したリボゾーム結合タンパク質以外に、DNAやRNAポリメラーゼやtRNA合成酵素を含む多くの機能タンパク質遺伝子に対応する配列がrRNA内にこれほど認められるのは驚きだ。
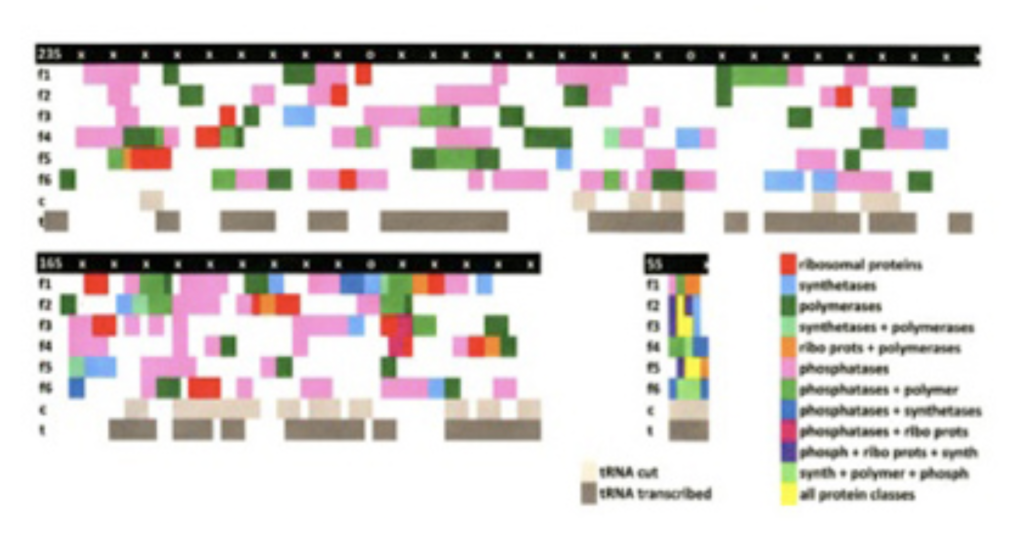
図5:様々なリーディングフレームにおけるtRNA及びタンパク質の位置を示したマップ。
これらの結果を基礎に、Root-Bernsteinたちは、地球上のタンパク質の全ては、このrRNA内にコードされていた遺伝子に由来するのではと提案している。
以上、今回紹介したRoot-BernsteinやdeFariasらのシナリオをもう一度まとめると次のようになる。
- 1)原始rRNAはRNAワールドのから誕生した、独立したゲノムを持ち進化可能な最初の単位。
- 2)原始rRNA内には、ペプチド転移反応を媒介するリボザイム、tRNA、ペプチドをコードする遺伝子が存在していた。
- 3)当時の痕跡が、現在もrRNA内の配列の中に残っている。
- 4)rRNAで作られたタンパク質は、最初rRNA安定化に関わる分子だけだったが、これ以外の多様な機能(例えばrRNAの増殖)が、ダーウィン進化の結果次々と誕生した。
ただ、rRNAはいくら脂肪膜で囲まれていたと言っても、生物ではない。次回は、このrRNAからLUCAへの道を考えてみたい。
[ 西川 伸一 ]
原始リボゾームからゲノムの誕生
2016年5月16日
前回紹介したRoot-Bernsteinの原始リボゾームの仮説は面白いだけでなく、生命誕生過程の構想に重要な示唆を与えてくれる。そこで今回はまずこの説を中心にしてこれまでLUCA誕生について議論してきたことをおさらいしておこう(図1)。

図1:LUCA誕生へのシナリオ。
説明は本文
先ず、熱水噴出孔でエネルギーと有機物の生成システムが形成され、ランダムではあっても様々な長さのRNAが持続的に供給されるようになる(図1 step1)。RNA自身は4塩基の組み合わせからできているが、多様な立体構造を取ることができるため、その構造の持つ触媒活性を通して、ランダムで多様化する有機合成反応を一定の方向に制約する可能性を持っている。例えば、一定の構造を持つRNA鎖が高い頻度で合成されるようになる可能性だ。
さらに、RNA同士を結合させるリガーゼ活性、塩基配列に基づいて複製するポリメラーゼ活性を持つリボザイムが生まれると、特定のセットのRNAを増幅・維持するRNAワールドが誕生できる(図1Step2)。RNAワールドの重要性は、何よりも塩基配列を鋳型として複製することで、同じ構造を増幅できる点、及び個別のRNA鎖が持つ触媒活性を媒介にして、相互に作用し合う分子群をひとつの単位として統合できることだ。
周りの条件にもよるが、RNAには安定性の問題がある。おそらくこの解決としてアミノ酸やペプチドとRNAの相互関係が始まったのだろう。ペプチドと言っても、当時自然に合成できたアミノ酸がランダムに結合したペプチドだったと考えられるが、それでも十分なペプチドを作るためには、環境中に低い濃度で存在しているアミノ酸を捕捉して濃縮する働きを持つ原始tRNAが必要になった。比較的安定なtRNA様構造を持ち、ペプチド合成の効率を上げてRNAワールドを安定化させるという利点を持つ原始tRNAが一旦RNAワールドに誕生すると、選択的に複製されることで自然に濃度を高めるだろう (図1step3)。そのうち、アミノアシルtRNA合成能力獲得してより安定にペプチドを作る独自の進化を遂げたと考えられる。もちろんペプチドを合成するためにはtRNA進化と並行して、アミノ酸転移活性を持つリボザイムもRNAワールドでは選択的に増殖したはずだ。
こうしてレパートリーを増やしてきたtRNAやアミノ酸転移活性を持つリボザイムが原始リボゾームへと統合される契機については想像でしかないが、リボゾームとしての機能発揮に必要なRNAを別々に複製するより、一つの単位として複製した方が都合のいいことは十分理解できる(図1step4)。
このような契機から、tRNAやリボザイムRNAが少ない数のRNA鎖に統合されて誕生したリボゾームは、エネルギーや物質代謝に関しては熱水噴出孔の環境に依存する寄生体と呼べるが、1)自己複製能、2)ペプチド合成能、3)そして翻訳のための鋳型としてのmRNA機能を持つ、「自己の誕生」とも言える一つの単位を形成する。
同じ自己複製能を持つOttoの複製子と比べると、自らを鋳型として複製できる点、ペプチドを合成する「翻訳機能」を持っている点で、はるかに高度で独立性の高い複製子がリボゾームとして誕生したと考えることができる。
以上が、deFariasやRoot-Bernsteinが考える原始リボゾームを中心とした大まかなシナリオだが、LUCAへの過程で重要な次の一歩は、情報の機能からの独立だと私は思っている(図1step5)。
RNAワールドでは、RNAが情報を担う媒体としての機能と、リボザイムとしての機能という二役を演じていることが重要だが、情報の独立とは、この一人二役が解消され、情報を担う媒体としてのRNA鎖と、様々なリボザイム機能を担うRNA鎖が完全に分離することを指す。事実現存の全ての生物のゲノム情報はDNAを媒体として、原則として情報以外の機能を併せ持つことはない。
情報が独立することは、ダーウィン進化にとって極めて重要な要件だ。例えば、DNAは情報の媒体以外の機能を持たない。このおかげで、細胞や個体という全体の中の一部であっても、全体からの制約を受けずに情報自体を比較的自由に変化できる。もちろん、情報が変化することで全体の維持が不可能になると、多様化した情報も消失する。とはいえ、情報の変化自体は全体の制約をほとんど受けないことが重要だ。
一方、現存のリボゾームの構造を見てみよう。図2はWikipediaから借りてきた50SリボゾームRNAの構造だが、RNAが折りたたまれ、一つの構造を形成しているのがわかる。
図2 50Sリボゾーム(Wikipediaより) 青で示されているのがリボゾームタンパク質で、残りはRNA.
この一部がmRNAの機能を併せ持つ場合、この部分は50SRNAの機能や構造の維持に必要とされ、この部分で起こる変異は即座にリボゾームの機能喪失につながる。即ち、情報としての自由な変化は最初から制約されてしまう。
このためダーウィン進化で見られたようなほとんど無限と言える情報の多様化がRNAワールドで可能になるためには、制約の源となる様々な機能から解放され情報に特化したRNA鎖が発生することが必要になる。そして最後に、RNAワールドでの配列情報を全てDNAに置き換えて、全体を情報に特化させる転換が必要になる。
この情報の独立が原始リボゾームでどのように起こったかについての私の妄想を述べよう。まずrRNA配列のどこかに、リボゾーム維持に全く影響しない余分な配列が生まれる(図3)。この部分はリボゾームとしての機能を持たないが、rRNAと一体化しており、複製もリボゾームの一部として行われる。このはみ出したRNA配列が、tRNAのアンチコドン部位が結合するコドンを提供するmRNAとして働きだすと、リボゾームの機能から独立した情報としてダーウィン進化が可能になり、多様な新しいペプチドが作られるようになる。すなわち、リボゾームの機能にとらわれず、様々なペプチドを合成して、自由に試してみることができるリボゾームが誕生する。
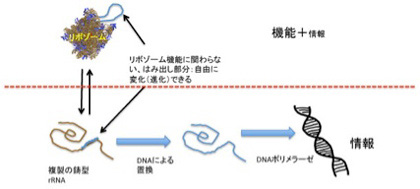
図3 情報媒体としてだけはたらく核酸の誕生。
しかし、おそらくこのはみ出し部分だけが情報媒体として独立することはないだろう。というのも、このはみ出し部分がmRNAとして機能するためには、リボゾーム全体の存在が必須だ。このため、このはみ出し部分は、rRNA以外のペプチドを作るための進化する情報として存在しえても、rRNAから独立することはできない。
したがって、完全に独立した核酸を媒体とする情報が誕生できたとすると、この情報はrRNA(その内部のtRNAも含む)をはみ出し部分と合わせてコードする必要がある。例えば、rRNA配列全体を全てDNAに置き換えることができれば(すなわち逆転写が起これば)、一挙に情報に特化した核酸媒体を誕生させることができる(図3)。しかし、逆転写酵素、あるいは逆転写リボザイムが都合よく突然現れて、情報を独立の問題を一挙に解決すると考えるのは虫が良すぎる。
これまで触れてこなかったが、実を言うとRNAワールドでも、複製を維持するためには、機能のない相補的RNA鎖が作られ、それを鋳型として機能的RNA鎖を合成する必要がある(図3)。従って、機能の制約を受けない情報に特化したRNA鎖がRNA ワールドでは常に合成されていたことになる。ただ、機能を発揮するための構造化ができない RNAは不安定で、おそらく情報として長続きできなかったはずだ。
ここでRNAポリメラーゼ活性を持つリボザイム自体のヌクレオチド特異性が高くないため、複製時にDNAが取り込まれることもあったと考えればどうだろう。リボゾームとして機能するRNA鎖は、多くのDNAが混じると機能低下につながるだろうが、それでもかなりの機能を維持できたと考えられる。実際、RNAとDNAが混合したアプタマーの機能が現在研究されており、これもリボザイムより安定であるという性質を期待しての研究だ。
一方、複製の鋳型としての機能は、DNAが混じるほど安定化し寿命が伸びる結果、DNAで置き換わった程度が高い鋳型の濃度が上昇し、最終的に完全にDNAを媒体とするゲノムが誕生したと考えられる。すでに述べたように、脂肪酸だけでもDNA複製が自然に起こることがある。一旦情報媒体に特化したDNA鎖が生まれれば、機能を持つrRNAも、多様化するために生まれたmRNA部分も、全てが一つの情報としてまとまる。ゲノムの誕生だ。
ゲノムが独立することで、この複製単位はリボゾームの範囲から拡大し始める。次回はこの自己の範囲の拡大について見ていく。
[ 西川 伸一 ]
記号、イコン、インデックス、シンボルと情報
2016年6月1日
しつこいようだが、今回もこれまでの話を繰り返してまとめ直すことにした。もともと生物がどう誕生したかについては、本当の答えを導き出すことは難しい。従って、理論的に説明可能かどうか、何度もなんども考えて納得できるシナリオを書いていくしかない。また説明するときも、これまで議論した過程を表現し直して、なんとか読者の皆さんにも理解していただきたいと思っている。もちろんまったく同じ説明を繰り返すつもりはない。様々な視点から同じ過程を説明し直すことが重要だ。
今回はLUCA誕生へのプロセスを、情報と記号論の観点から見直してみようと思っている。すなわちLUCA誕生の過程でどんな情報がいつ誕生したのかまとめてみたいと思っている。この作業は、ゲノムの誕生を説明するのが目的だが、生物進化とともに新たに現れてきたまったく異なる情報、例えば人間の言語の誕生も視野に入れている。
テレオダイナミックス系の誕生
これまで生命誕生へのスタートラインを、エネルギーと有機物が持続的に合成される熱水噴出孔に生まれた多種類の散逸系の誕生と考えて来た。この過程で有機高分子が発生すると、様々な分子間の相互作用が起こりやすくなり、本来は無秩序な物質やエネルギーの流れに一定の秩序がもたらされる。ただこの分子間の相互作用による秩序や規則性の誕生には、どのような意味でも情報と呼べるものは存在しない。Ottoの複製子で見たように、偶然発生した有機分子が、エネルギーや分子の合成過程を制約して、自己複製まで可能になることもある。しかし、これは分子と分子の直接の相互作用による制約であり、情報とは呼べない。渦を持続的に発生させる流れの中に置かれた石と同じと考えればいいだろう。ただ、この制約は偶然の産物で、物理法則による制約とはまったく異なる。熱水噴出孔で起こっていることをもう一度まとめると、比較的安定な様々な制約要因と、それに制約された「傾向」が生まれ、この傾向が蓄積することで一定の秩序を持った系が生まれるといえるだろう。傾向は情報ではない。これをDeaconはテレオダイナミックス系と呼んだ(図1)。
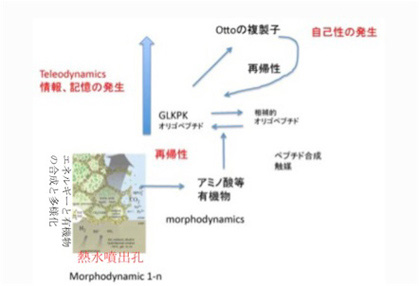
図1:テレオダイナミックス系の誕生(2月15日の記事とほぼ同じ)
イコン的記号の誕生
この制約された有機物合成システムからヌクレオチドが合成され、それが重合してポリヌクレオチドが生まれる。RNAポリヌクレオチドの中には様々な酵素活性を持つ物が存在し、リボザイムと呼ばれており、現存の生物の中でも実際にリボザイムが働いている。このリボザイム活性は、反応の制約要因としてはより高度の制約活性を持ち、様々な分子の合成過程に秩序をもたらす。それぞれのリボザイムは塩基が並ぶことでできている。この塩基配列は記号と呼んでいい。しかし、記号だから情報というわけにはいかない。RNAが結局限られた数の異なる塩基の並びでできているため、リボザイムがこの塩基配列に支持されてできているように見えてしまうが、合成自身はランダムに起こっており、何かを指示する情報は存在しない。
このように、塩基配列という記号が直接分子の物理的構造を決める場合、記号論的にいうと、イコン的記号性が発生したと言える。
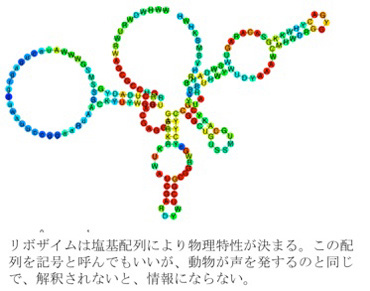
図2イコン的記号の誕生。 リボザイムは塩基配列により物理特性が決まることから、配列(記号)が分子構造や機能と対応する点でイコン的記号の誕生と言える。
情報とインデックス記号の誕生
ところが、リボザイム活性を持つRNAポリヌクレオチドの集団の中に、特定のRNA配列を認識してRNA鎖を結合させるリガーゼ活性や、更には塩基配列に従って複製するRNAポリメラーゼ機能を持ったリボザイムが生まれると、RNA鎖の塩基配列が突如反応を指示する鋳型としての機能を持ち、鋳型に従って同じ分子や構造を正確に再生産することが可能になる。具体的には、同じ分子構造を、塩基配列(記号)を鋳型(情報)として繰り返し合成できるという点で、記号がついに情報になったと言える。
このシナリオからわかるのは、リボザイムを構成する塩基配列が分子の構造を決めているとしても、この違いを解釈する仕組み(すなわちRNA ポリメラーゼ)が誕生するまではイコン的記号で、情報性は持たないことだ。言葉を変えると、塩基配列を鋳型として使って、その鋳型に合わせて合成を行う酵素やリボザイムが誕生すると(解釈者の誕生)、塩基配列(記号)に情報としての機能が生まれる。 ではなぜこの塩基配列を情報と呼べるかというと、この鋳型はRNAだけでなく、DNAでも表現できる。しかし同じ配列がDNAを媒体として表現されると、RNAで表現できる構造とはまったく異なる構造が生まれる。一方、鋳型としての機能はRNAでもDNAでも同じだ。この物理的媒体を選ばない点で、複製される塩基配列は情報と呼んでいい。
まとめると情報の誕生とは、塩基配列という記号の誕生ではない。記号が解釈されて初めて情報になる。この意味で、地球上で最初に情報が誕生した時とは、RNAポリメラーゼ活性を持ったリボザイムが誕生した時と言えるかもしれない。こうして誕生したRNAの構造と塩基配列の関係は、塩基配列(記号)が、リボザイムの持つ構造や機能のインデクスになっている点で、記号論でいうインデックス記号と言ってもいいのではと思っている(パースなどのインデックス記号の定義とは異なるが)。
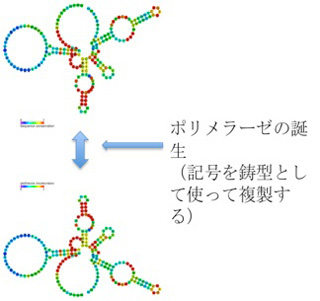
図3:インデックス記号と情報の誕生
ただこのインデックス記号は、まだ化学的に無関係な物質同士が対応関係を持つ、すなわち本来のRNAとはまったく無関係のアミノ酸がRNA配列と対応する段階、すなわちシンボル的記号には到達していない。(シンボル的関係の代表は言語で、サクラという音の並びと実際の桜には全く実体的な対応関係はない。)
シンボル的記号の誕生
ここで現存の生物が全て持っているDNA-RNA-タンパク質というセントラルドグマを考えてみよう。DNAの塩基配列(記号)は、RNAの塩基配列に転写される。これは、RNAワールドでの複製機能と特に変わることはない。しかし、転写されたRNAを鋳型としてタンパク質が作られる過程は、DNAの塩基配列とtRNAと結合するアミノ酸配列がもともと何の関係もないという点で、塩基配列がシンボル的記号に転換している。
この塩基配列という記号がアミノ酸と対応してシンボル的記号に転換するためには、まず最初にtRNAの誕生が必須だ。ここでは原始tRNAが、RNAワールドを安定化するための短いペプチドを安定的に供給するため、アミノ酸を捕捉して濃縮する目的で生まれたことにしている。
すでに述べた清水らの説に従えば、原始tRNAが持つアンチコドン配列と、たまたま存在したAsn-Valペプチドが相互作用すると、特定のアミノ酸が捕捉される。ただここで使われるアンチコドン配列(記号)は、決して情報として使われているのではない。ペプチドとともに、アミノ酸を捕捉するポケット構造の部分として使われており、アンチコドンと呼ぶのは、現在の生物と比べて言っているだけだ。したがって、このアンチコドン配列によるアミノ酸把握で配列はイコン的記号として使われているが、情報としての関係はない。
とはいえ、このようなアミノ酸とアンチコドンとのイコン的関係が成立することで、原始tRNAに捕捉されたアミノ酸を濃縮することができ、情報でなくともペプチド合成の効率をあげることができる。この時、原始tRNAが集まるためのマトリックスとして、RNAやDNA鎖が働いていたことは十分考えられる。だとすると塩基配列という記号が、RNAとは全く物理的関係のないアミノ酸と対応したシンボル的記号へ転換するためにはあと一息だ。
原始tRNAがペプチド合成のためのアミノ酸捕捉分子として機能するためには、複数のアミノ酸とイコン的関係を持つ原始tRNA、アミノ酸をtRNAに結合するアミノアシル化活性を持ったリボザイム、集まったアミノアシルtRNAに結合したアミノ酸同士を結合させる、アミノ酸転移酵素活性を持つリボザイムは最低限存在していなければならない。特定のアミノ酸が結合したペプチドが持つRNA保護作用や、一部のペプチドによるリボザイムの機能の効率化などが強い選択圧として働き、このようなリボザイムが化学進化したことは十分考えられる。
この前提が満たされた時、核酸配列という記号がアミノ酸配列と対応するシンボル的記号へ転換する条件が整う。その後のプロセスを順を追って考えてみよう(図4、5)。

図4:本文と同じことを箇条書きにしている。これ以外にも多くの合理的可能性がある。
まず最初ただのマトリックスとして使われていたRNA(ここでは便宜的にrRNAとしておく)とtRNAの関係が、コドンとアンチコドンが持つより強い結合を基盤にした関係へと移行する必要がある。rRNAやtRNAにアミノ酸をコードするコドンを見つけることは難しくないが、実際にはその配列がどこにあってもいいというわけにはいかない。rRNA上の配列をコードとして集まったtRNAに結合したアミノ酸同士が結合するための十分近い距離に保つ必要がある。
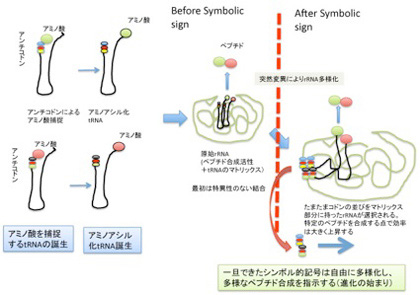
図5 原始tRNA誕生からシンボル誕生まで。説明は本文。
例えば、まずアミノ酸転移反応を制御するrRNAと、tRNAの構造がともに進化して、記号対応関係はないがアミノ酸が濃縮できるマトリックス構造が生まれた後、この結合をさらに強い結合にするために、rRNAの一部がコドン配列を特定の場所に持つように進化すると考えてみよう。
この時、清水らの説のように、アミノ酸をキャッチして3’端にエステル結合させる過程で、tRNA5’末のアンチコドン配列が物理的(イコン的)記号の働きができるとかなり話が早い。すなわち、アミノ酸補足後アミノアシル反応が終わり、3’末にアミノ酸が結合した後、フリーになったアンチコドン部分がマトリックス側に現れたコドンと結合して、tRNAの結合を強め、アミノ酸転移反応の効率をあげると考えれば、選択されるのはrRNA側の配列だけになり、考えやすくなる。すなわち、tRNAのアンチコドンは最初からイコン的記号として存在し、rRNA側のコドンが選択された時に初めてシンボル的記号に移行すると考えるのは、そう難しくない。
このシナリオの問題点は、マトリックス側に偶然現れるコドン配列の長さに限界があることだ。実際、2−3アミノ酸分が関の山だろう。とすると、必要なペプチドごとにそれに対応するコドン配列を持ったrRNAが必要になってしまう。
これについての一つの答えは、まず「簡単なものから始めて見る」ではないかと思っている。すなわち、実際多様なrRNAが存在する中で、RNAワールドにとって最も必要なペプチドに対応するコドンを持ったrRNAが選択的に増殖したと考えればいい。短くてもシンボル的記号としてのコドン部分が選択されたrRNA上に生まれれば、この部分は増大し多様化できる。
例えば最初単純な言葉が生まれ、そこから複雑な言語が発達するのと同じだ(この点については後々考察する)。簡単な記号を元にシンボル的関係を成立させることがまず重要だ。
あとはこのコドンを持ったマトリックスを独立させ、DNA化することで生命の情報システムは完成する。この過程についての一つの可能性はすでに前回述べた。
以上のシナリオをもう一度記号論的にまとめると、
- 1)有機分子の合成と、分子間相互作用を介する制約による有機ワールド(テレオダイナミックス状態)の成立
- 2)分子構造が塩基配列(記号)により決まるリボザイムの誕生(イコン的記号の誕生)
- 3)核酸配列(記号)を鋳型として使って複製するリボザイム(記号の解釈者)の誕生=インデックス記号の誕生、
- 4)tRNA上の記号(アンチコドン?)とアミノ酸とのイコン的関係の誕生、
- 5)tRNA上のアンチコドンを選択圧としたrRNA側のコドンの誕生により、塩基配列のシンボル的記号への移行。
- 6)シンボル記号のダーウィン進化。
今回は生命誕生について、生命情報成立をより強調して説明した。次回は原始リボゾームからLUCAへの過程について考えるが、この記号論は、今後様々な生命情報を考えていく上で共通の基準をあたえてくれる。
[ 西川 伸一 ]
進化の始まりと目的の実現
2016年6月15日
前回のまとめは理解していただけただろうか?
特に、核酸配列がイコン(類似)記号、インデックス(指標)記号、シンボル(象徴)記号へと発展した点についての説明は理解して欲しいと思っている。

図1チャールズ・サンダーズ・パース
我が国では語られることが少ないが、科学及び哲学の広い範囲にわたり現代のアメリカ思想の源を作った。その記号論はこれまで言語学の人によく引用されている。
この稿で、核酸配列をイコン、インデックス、シンボル記号に分類したのは、言うまでもなくアメリカの巨人チャールズ・アレクサンダー・パースの考えをそのまま拝借している。パース(図1)はプラグマティズムの創始者として紹介されることが多いが、一つの枠で語れない偉大な巨人で、その記号論は言語や核酸配列などの生命情報を整理する上で欠かす事が出来ない(ぜひ読んで欲しい)。
RNAに、4種類の塩基から出来ているという記号性と、それ自身で酵素活性を持つ2面性が存在することが、複製可能な有機システム=RNAワールドを可能にしたが、このとき最初からRNAが情報として働いていたと思うと大きな間違いを犯す。
配列が情報としてRNAポリメラーゼに解釈されようになるまでは、配列=構造という単純な物理関係があるだけで、この時の配列は記号ではあっても情報でない。このことから、これをイコン記号とした(図2)。
ここにRNAポリメラーゼが誕生すると、塩基配列を解釈する過程が始まり、塩基配列がインデックス記号に変化する。最後に、アミノ酸配列と核酸配列という全く無関係な物質同士がtRNA+rRNAの誕生で対応するようになると、塩基配列はシンボル記号になる。重要なのは、イコン記号及びインデックス記号の段階では、記号(塩基配列)とそれに対応する機能分子との間には、物理的法則に基づく対応関係があるだけだ。ところが、核酸配列がシンボルの記号になると、核酸配列とは全く関連性のないアミノ酸配列に記号が対応する。このことは、物理化学とは異なるルールがこの記号に導入されたことになる(図2)。

図2 パースの記号論を生命誕生に当てはめてみる。
勿論非物理的対応関係を媒介するのはtRNAとrRNAという現実の分子だが、核酸配列がシンボル記号としてアミノ酸配列に対応するようになるためには、これまで述べたような固有の歴史を通してそれぞれの関係性が生まれる必要があり、この歴史性は物理化学的法則にはない。このように、シンボル記号誕生こそが、物理科学法則に支配される地球に、新しい情報という因果性が誕生したことを意味する。そして、地球上にダーウィン進化が始まる。このダーウィン進化の始まりについて見ていこう。
核酸配列がイコン記号として働く段階では、同じ記号(=物質)が生まれるかどうかは偶然に支配されており、できる分子は無秩序に多様で、この段階の有機物質やエネルギー合成は無秩序なカオス状態と言っていい。ここに、核酸配列が複製のためのインデックス記号として働く情報化が起こると、分子の多様性を減らし、秩序をもたらす方向に進む。このように、もともと情報とは系に秩序をもたらす方向に働く。ただ、秩序を生み出す複製過程においても、一定の制約の中での複製エラーによる変異が核酸配列に起こる。この秩序という制約の中での多様化こそがダーウィン進化の原動力になる。
このように、生命とは呼べないが、原始リボゾームのような複製する原始ゲノムが誕生した時代を考えてみよう。RNAで代謝の多くをまかなうことができるとはいえ、有機物生産システム、エネルギー生産システムなど多くの生命に必須の条件はRNAのみで達成できない。従って、RNAワールドをコードする原始ゲノムは、環境の中に寄生したRNAウイルスのようなものとして考えればいい(しかし、私たち人間を含む現在の生命も結局環境に寄生しているが)。お分かりのように、私は生物の始原はゲノムから始まると考えている。
もともと生命をDNAから考える有名な仮説がリチャードドーキンスの「利己的遺伝子」仮説だ(図3)。現存の生物の進化について利己的遺伝子仮説が当てはまるかどうか議論がつきないようだが、LUCA誕生直前の状態を考えれば、妥当な仮説だと私には思える。

図3 リチャードドーキンスと著書「利己的遺伝子」
即ちLUCA誕生前の状態を、熱水噴出孔の特殊な環境に寄生しているRNA/DNA寄生体(利己的遺伝子)が、この環境から自立する過程として捉えればいい。未だ生物は誕生していないが、将来のゲノムの核になる原始ゲノムは既に存在している。この原始ゲノムが自立するためには、環境を形成している様々な分子を自分の中に取り込み同化する必要がある(図4)。
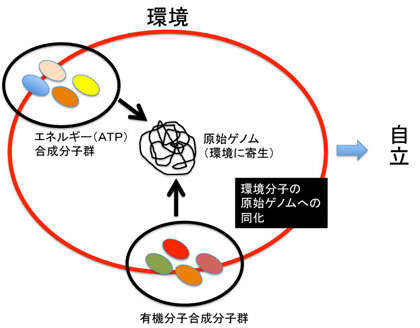
図4:環境に寄生する原始ゲノムの自立
環境を形成する分子がRNAやDNAでできている場合は、その配列を融合により同化すればいい。そうすることで、環境分子は複製により安定して調達されるようになり、自然と原始ゲノムのゲノムサイズが上昇する(図5)。
環境分子が核酸でなかった場合、原始ゲノムを多様化して新しいリボザイムを合成し、環境分子の機能と一番フィットした原始ゲノムを選択することで同化が可能になる。
もちろんこの様式で環境分子を同化してもいいが、RNAワールドには限界がある。RNAワールドでの核酸配列はインデックス記号であり、記号がそのまま物理的性質と直結する。このため、核酸レベルの構造が制約となり、多くの環境分子に対応する機能分子に対応する記号を合成することは制限される。
RNAだけで環境分子を同化していくことには他の問題もある。ゲノムサイズが大きくなると、ポリメラーゼ・リボザイムと相補的塩基配列がペアリングする危険性が高まり、複製の効率が落ちると予想できる。また既に述べたように、RNAの安定性を高め、機能を補完するためにもペプチドが必要になる。従って、原理的にはRNAだけで環境の同化を進めることは可能だが、核酸配列が物理的に制限されることなく機能や物質と対応できるシンボル記号へと転換することで、更に自由な同化が可能になる(図5)。
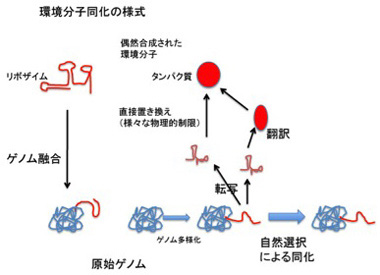
図5:環境分子同化の様式
この同化を繰り返せば、環境依存性が少しづつ低下していく。すなわち、より多様な環境で存在することが可能になる。これを繰り返してLUCAができると考えること自体は、私は、論理的にも無理はないように思っている。
面白いのは、RNA機能分子を原始ゲノムに融合する様式では、自然選択は全く必要ない点だ。一方、原始ゲノムを転写し、その産物で環境分子を置き換えられるかどうかを試す様式では、最も環境分子に近い分子を合成できる原始ゲノムが自然選択される。これは、水平遺伝子伝搬とダーウィン進化の共同作用による進化のルーツのように私には思える。
最後に強調したいのは、LUCA以前の、環境分子同化過程でのダーウィン進化では、原始ゲノムが同化すべき環境分子がすでに存在している点で、これは生命誕生後のダーウィン進化と決定的に異なっている。
ダーウィンの進化論は、目に見えない因果性、すなわち「目的」に駆動されているように見える生物進化が、多様性の獲得と自然選択のダイナミズムで説明できることを示し、最初に目的が存在することを拒否している。一方、原始ゲノム(利己的ゲノムと呼んでもいいかもしれない)が環境から自立しようと進化するとき、最初から同化すべき環境分子が目的として実在している(図4)。もちろん最終的にゲノムが同化された記号は、必ずしも同じ分子に対応する必要はなく、機能が維持できればいい。しかし、最初から手本として、目に見える分子が進化の方向を示す目的として存在していたことが、LUCA誕生前後のダーウィン進化の大きな違いであることは強調しておきたい。
あと生命誕生まで、自己という単位が、原始ゲノムから細胞へと拡大する過程が残っているだけだ。
[ 西川 伸一 ]
生きた細胞の再構成は可能か
2016年7月1日
これまで断片的にではあるが、生命誕生を考えるための様々な条件、あるいはシナリオについて解説してきた。多くの読者の方が、「条件さえ整えば無生物から生物が生まれる過程を構想することは全く不可能ではない」と考えてもらえる様になったのではと期待している。
このシナリオで最も重要なゴールは転写(ポリメラーゼ)機能+翻訳機能(tRNA+rRNA)を備えた原始ゲノムの誕生だ。もちろん原始ゲノムの誕生には、その維持と複製を支持する環境条件が必要だが、一旦誕生すると、この原始ゲノムはオーガナイザーとなって、環境を構成する分子を一つ一つ同化し、環境から独立しLUCAに至る。原始生命と呼べるのはLUCAが最初だが、最も重要なスタートラインは原始ゲノムの誕生と考えている。
40億年前の地球で起こった詳細をこのシナリオが説明できているとは到底思えないが、環境がまず形成され、それに寄生する原始ゲノムが誕生し、環境を自己に同化するという順番はおそらく間違っていないのではと思っている。
このシナリオでは、生命誕生に必要な分子は、もともと熱水噴出孔での「有機化学法則」に従って、個別に合成されるもので、各過程は独立に進み、組織化されてはいないと考える。従って、熱水噴出口の中のマイクロセルには、たまたま存在する分子ごとに多様な環境が形成されている。その中の一部の条件が、RNAワールド(イコン・インデックス記号的段階)から原始ゲノムへの進化の発展を支えることが出来たのだろう。これは全て熱力学と、非平衡熱力学が支配する過程と言っていい。
原始ゲノム誕生までの条件が地球上に揃う過程を頭の中で考えるのは簡単だが、これが実現するために必要な有機物の合成が維持される環境を、地質学的に十分長い時間維持することはそう簡単ではない。その意味で、地質学的時間一定の状態を維持できる熱水噴出孔の存在は欠かせない。この時、原始ゲノム誕生までに最低限いくつの分子が必要か決めることは、重要な課題だろう。というのも、タンパクや脂質の合成が互いに制約しあって一定の秩序を持って行われるとしても、この段階までの合成は原則ランダムで組織化されていない。必要最低限の数があまりに多いと、ランダムな化学合成ですべてを揃える確率は当然低下する。
ではいくつの分子が原始ゲノムの独立に必要だったのだろう?
実験室の環境で自律的生物を維持できる最小限の遺伝子数については、CJ Ventorのグループが精力的に研究を続けている。全部あわせても517個の遺伝子しか持たないマイコプラズマにトランスポゾンを感染させ、多くの遺伝子を同時にノックアウトする方法で、どの遺伝子が生存に必要かをしらみつぶしに探索した研究が1999年にScienceに発表された(Hutchinson III et al, Science 286:2165, 1999)。
たかだか265−350個の遺伝子で自律生命が維持できるというVenter達の結論には、無生物から生物への再構成過程を研究できるのではと私も興奮した。この数は、その後トランスポゾンの挿入された個々の遺伝子を丹念に検討し直す研究から、382個へと上方修正されている(Glass et al, PNAS 103:425, 2006)。それでも400弱の遺伝子があれば、実験室の環境で自律生命が可能であると理解すると、生物合成が手の届くところにきた様な錯覚に陥る。
しかし、生命誕生に必要な最低限の遺伝子数が400だとしても、これらが全て揃って地球上に生命が誕生できたようには思えない(計算根拠はない)。即ち非平衡熱力学過程から秩序がもたらされるとしても、億年単位の時間内に400全ての分子が地球の特定の場所に同時に出現する状況を考えるのは難しい。
幸い、熱水噴出孔の物理的条件の安定性については信頼できる。このため、原始ゲノムの存在した環境形成には、合成されたRNAやペプチドだけでなく、熱水噴出孔自体が提供する条件(例えば無機質の触媒作用や、プロトン勾配など)の果たした役割が大きいと思われる。従って、原始ゲノムが独立するまでには、環境を形成するRNAやペプチドの同化だけではなく、新しい機能を持ったRNAやペプチドを合成する情報を獲得することが必要だったと考えている。もし原始ゲノムがこの課題をクリアーできるだけの十分な能力を備えていると確信できれば、LUCA誕生は説明できたのと同じだ。
記号性を持ち、この記号を拡大・複雑化できるとともに複製能を持つ原始ゲノムは、生命ではなく、まだ環境に寄生しているが、多様化、自然選択、選択された個体(原始ゲノム)の複製を通したダーウィン進化を行う能力が備わっており、この過程を介して、環境の分子を同化し、また新しい分子を開発して環境から独立して生命誕生へと発展できる。すなわち、ダーウィン進化が可能な原始ゲノムが誕生した時点で、生命誕生のための基盤は全て整った。
ここで一つ思考実験を考えてみよう。生命最小単位マイコプラズマを集めて破砕し生きた細胞を消滅させる。こうして用意した、細胞内に存在する全ての分子が最適な濃度で維持されたマイコプラズマスープを、必要なら栄養やエネルギーを外部から適宜加えて維持できるとしよう。ゲノムの複製、転写、タンパク質の合成などが十分可能なスープだ。そこに合成された完全なマイコプラズマゲノムを投入すれば、もう一度生きたマイコプラズマが発生するだろうか?もし原始ゲノムがLUCAに発展するなら、マイコプラズマが発生しても不思議はない。
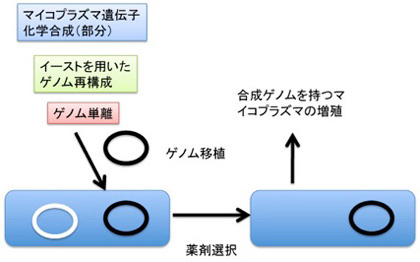
図1 CJ Venterの人工合成ゲノムを持つマイコプラズマ作成実験の概要
私の答えはノーだ。マイコプラズマの細胞質の条件を全て維持でき、その中でマイコプラズマゲノムが複製できたとしても、生物は生まれないだろう。なぜなら、この条件で、ゲノム自体がマイコプラズマの自己とは何かを決める事が出来ないからだ。一方、マイコプラズマのゲノムを外来のゲノムで置き換える実験は行われている。
先ずVenterのグループが行った、マイコプラズマのゲノムを置き換える実験を見てみよう。今年、Venterグループは完全に合成したゲノムを持ったマイコプラズマを作るのに成功して話題を呼んだが(図1:Hutchison III et al, Science 351:6280, 2016)、この時人工合成したゲノムを異なる系統のマイコプラズマに移植し、合成ゲノムを持つマイコプラズマを作成する実験を行っている。このマイコプラズマへのゲノム移植はどう行われたのか見てみよう。
詳細は省くが、合成ゲノムは先ず他の系統のマイコプラズマに移植されている。この時、移植した宿主マイコプラズマが持っていたゲノムを除去する操作は、この実験では行われていない。即ち、合成ゲノムを移植した段階で、宿主のゲノムと、移植した合成ゲノムの両方が共存する時期を経て、薬剤選択により宿主のゲノムが排除され、移植ゲノムが残る方法を用いている(図1)。実際にはこの方法は開発にはずいぶん苦労したようで、その難しさは2007年に発表された論文から窺い知ることが出来る(Lartigue et al, Science 317:632, 2016)。
ただここで注目したいのは、この苦労話ではなく、単離したゲノムは先ず生きているマイコプラズマに移植しないと、ゲノムとして働けないことだ。すなわち、ゲノムが細胞内の様々な過程を組織化するための情報として働くには、細胞が先に生きている(=組織化されている)状態を維持していることが必須である点だ。「卵が先か・鶏が先か?」の生命特有の問題がここでも現れる。
では、宿主のゲノムを除いても、合成ゲノムを移植することは可能だろうか。私は可能だと思っている。しかし、バクテリアから細胞質や細胞膜を傷つけずに残してゲノムだけを除去することは技術的に極めて難しく、このような挑戦が行われていないだけだ。
事実、細胞の操作が可能な十分な大きさを持つ脊椎動物の卵子では、核を取り除いた後、他の細胞から単離してきた核を注入し、ゲノムが完全に入れ替わったクローン動物を作ることが出来る(図2)。
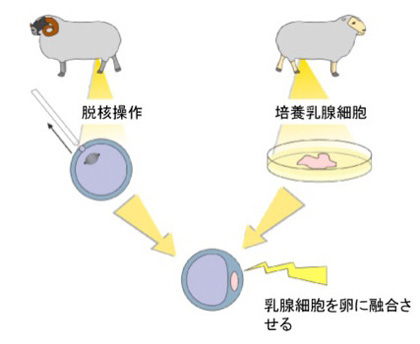
図2:クローン羊ドリーの作成。 まず卵子の核を除去した後、乳腺細胞を融合させている。
更に当時理研・発生再生科学総合研究センターの若山らは、細胞としては死んでいることが確認された脳細胞から核を取り出し、それを卵子に移植する事でクローン動物が作成できることを示し、ゲノム情報の維持には必ずしも細胞が生きている必要がないことを示している。従って、生きた細胞を宿主とすれば、宿主のゲノムの有無にかかわらず、ゲノムは働くことが出来る。
ではなぜ原始ゲノムは熱水噴出孔の環境で生命へと発展できるのに、マイコプラズマゲノムはマイコプラズマスープの中で生命へと発展できないのか? また、マイコプラズマスープの中で新たなマイコプラズマが出現しないのなら、熱水噴出孔の環境がどれほど完全でも、原始ゲノムからLUCAが発生することが、本当に出来るのだろうか?これを理解する鍵が自己性だ。
マイコプラズマスープにマイコプラズマゲノムを混合しても生命が発生しない理由を考えると、原始ゲノムと違って、マイコプラズマゲノムは進化の過程で情報に特化してしまい、既に生物の部分になってしまっているからだと言える。
すなわち、原始ゲノムはそれ自身で自立しており、自己性=全体性を持っている。一方、マイコプラズマゲノムはマイコプラズマスープの中で、複製し、タンパク質やRNAやタンパク質を合成出来たとしても、自己性=全体性は失ってしまっている。即ち、マイコプラズムの自己は、ゲノム、細胞膜、細胞質も含めた全体へと拡大している。単細胞生物の自己は、細胞膜で囲まれた内側にあるゲノムも含めた全てで、決してゲノムだけでない。このため、生きた細胞にゲノムを移植する方法で自己の範囲を明確に与えるという過程を踏まないと自己性は生まれない。細胞質スープの中でゲノムが自己組織化を通して細胞としての自己を自然発生させる可能性はあるにしても、その確率は低い。
少しわかりにくい議論になったが、進化により自己性の範囲が拡大することは、我々人間を含む高等多細胞動物を考えるともう少しわかりやすい。
例えば人間の自己は、決して身体の範囲内に制限されているわけではない。例えば私が今書いている原稿も、やはり私の一部だと言える。一方、意識がなくなった私の身体は、生きていたとしても人間としての自己性を失っている。すなわち、神経ネットワークというゲノムとは異なる情報を獲得することで、生物の自己の範囲は広がった(これについては、ゲノムの進化について考えるときもう一度考える)。原始ゲノム、LUCA、そして人間と、自己性が生物の全体を決め、進化と共に自己性の範囲を拡大させ環境を取り込んできたのが生物だ。
この自己性の拡大とは、環境の自己への同化の過程とみることができる。そしてこのことが最もはっきりわかるのが、原始ゲノムが環境を同化していく過程だ。要するに、情報性と自己性を持つ原始ゲノムが誕生すると、原則として無限の新しいタンパク質を作る能力が得られる。ただ、自己性の問題からわかるのは、完全な自己性を維持しているゲノムだけが、環境を統合した拡大自己を発展させることができる点だ。
一端ゲノムが自己の部分になってしまうと、もうゲノムが自己性を決める事は出来ず、従って生物は発生しない。ゲノムは今後は、自己のなかで、情報を担う部分として進化の駆動力として、多様化と複製に関わる。
どうだろう。生物が生まれる一つのシナリオは理解してもらえただろうか。もし疑問があれば、これからはそれに答えることも行いたいと思っているので、問題点を指摘してほしい。
ゲノムは誕生した。次回からはゲノムやゲノム以外の情報の進化について考えていく。
[ 西川 伸一 ]
ゲノムの進化と生物の進化
2016年7月15日
ゲノムの解剖学に始まり、ゲノムの生理学、そしてゲノムの発生学と、すでに27回にわたってゲノムに関する知識を独断で、しかもほとんどは自分の頭の整理のために書いてきた。特に後半17回はゲノムの発生学と称して、今私たちが知っているゲノムが、生物のいない地球でどう誕生したのか、思いつくまま書いてきたが、そのおかげで自分では無生物から生物が生まれる過程を頭の中で思い浮かべられるところまで整理ができたと思う。ただ、説明自体は体系的でなかったので、読者の方にはわかりにくかったのではと反省している。私の個人的な頭の整理に付き合っていただいた読者の皆さんにはまず感謝。
私自身は納得できたと満足していても、読者の多くは生命誕生の話がまだ完結していないという印象を持たれたかもしれない。事実、ゲノムの発生学についてのシナリオは原始ゲノムまでで終えてしまったことは確かだ。
本来なら最終生物(LUCA)への移行過程の説明がくるはずだが、「原始ゲノム=自己」が「ゲノム<細胞=自己」という構造へと移行して、自己の範囲が拡大したとだけ述べてお茶を濁した。
しかしこれには理由がある。私はLUCAへの最終過程は、無生物から生物への過程より、生物のダーウィン進化のなかで理解したほうがいいと考えている。場合によってはダーウィン進化は今もゲノムの多様化と、選択の問題として語られる。しかし、ゲノムの発生以降、生物進化は様々な情報をゲノムの外に生み出してきたため、生物の進化をゲノムの進化としてだけ捉えることは難しくなった。私はこの問題は、原始ゲノムの代表する自己が、細胞を単位とする自己へと拡大した過程で最初に発生したと思っている。
原始ゲノムは現在の生物に普通に見られる様々なメカニズムにより情報を拡大させ、環境を自己に取り込むことでLUCAへの道筋を突き進んできた。しかし、生物の自己が完全に細胞に拡大してLUCAが誕生するためには、拡大したゲノム情報だけでは足りない。この困難は原核生物の細胞分裂過程をみるとよくわかる(図1)。
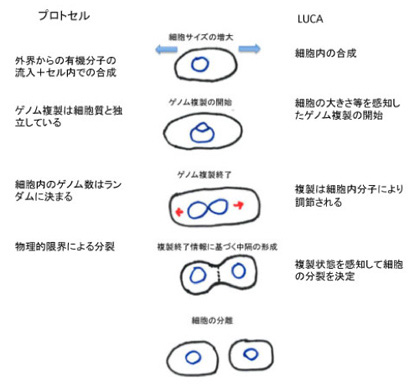
図1 原核細胞の細胞分裂調節と、LUCA以前のプロトセルとの比較
原核細胞のゲノム複製は、細胞が成長して一定の大きさに達したときに開始する。すなわち、原始ゲノムから見たとき拡大した自己=細胞の大きさを情報としてゲノムの複製開始が指令される。実際には細胞のサイズ情報を受けたdnaAと呼ばれる分子が複製開始点に集まり、ゲノムの複製が始まる。次にゲノムの複製が終わると、これが情報となって、細胞の中央がくびれ、細胞中隔が形成された後、細胞が分裂する。すなわち、今度はゲノムの状態が情報として細胞質の分裂を指令する。実際にこの分裂は、ゲノム複製に関する情報に反応してFtsZと呼ばれる分子が分裂面に集まることで進む。もし複製終了を情報として確認するメカニズムがなく、ゲノム複製が終わる前に細胞が分裂してしまったら大変だ。
この過程からわかるのは、原始ゲノムから細胞へと自己が拡大すると生物にとってゲノムの塩基配列だけが情報ではなくなり、複製開始を指令する細胞の大きさや、逆にゲノム複製の状態が情報となって細胞分裂過程の進行を調節していることだ。おそらく原始ゲノムは最初から脂肪膜でできたマイクロセルの中に存在してプロトセルを形成していたのではないかと考えられる。ただ、マイクロセル形成と、原始ゲノムは基本的には独立していたはずだ。(季刊生命誌89号に人工細胞研究の記事がある)細胞質・細胞膜とゲノムが独立しているプロトセルを考えるのは簡単だ。しかし自己が細胞として統合されるためには、原核細胞に見られるゲノムから細胞質、細胞質からゲノムへのシグナルが必要になる。すなわち細胞の大きさとゲノムの状態が、核酸配列情報の外に発生する必要がある。
「え?ゲノムの塩基配列以外の情報が発生したの?」と問われそうだ。答えは「イエス」だ。
ずいぶん前に、雨は情報でもなんでもない物理現象だが、外出しようと考えている人にとっては重要な情報として、傘を持って表に出るという行動につながることを例に、一見情報とは思えない現象が、解釈によって人間にとっては情報になることを説明した。まさにこの解釈システム(あるいは感覚システム)が原始ゲノムから細胞への拡大過程で発生することで、塩基配列以外の状態が情報として使うわれていることを意味している。
生命科学になじみのある人なら、今私が説明した機構はフィードバック、フィードフォワード機構として、生体の中では普通に見られるメカニズムだと気づかれるだろう。
生体ではこの機構が、細胞や個体の統合を保つための最も重要な機構として至るところで使われている。すなわち、生体内で起こるすべての独立の過程を統合するには、反応のモニタリングと、解釈、それに従う行動のネットワークが網目のように張られる必要がある。そして、それぞれの回路は、ゲノムからの指令で形成される分子により解釈される、ゲノムとは異なる情報が発生している。
もちろんSzotakらの研究が示すように、新しい情報解釈システムがなくとも、条件が整えばRNAゲノムを持つプロトセルが分裂を繰り返すことは現実にあり得る。しかし、この分裂でゲノムの分裂と細胞質・細胞膜の分裂がうまく調整されているように見えるとしても、それは地球上の偶然が重なりフィードバック機構を持った「間欠泉」ができるのと同じだ。図に示す様に、外界から何らかの力を受けることなく、ゲノムと協調して分裂することはない(Ottoの複製子を思い出して欲しい)。
この様に、原始ゲノムが誕生してから、生物は自己の範囲を急速に拡大し、これは自己内で起こる様々な現象を情報として解釈する無数の仕組みを獲得することで支えられてきた。例えば、タンパク質のリン酸化、アセチル化、メチル化、あるいはRNAのリボスウィッチなど、すべてこれにあたる。現在cAMPや脂肪酸がシグナル伝達に使われているのも、ATP、脂肪酸がこのとき細胞にふんだんに利用できた名残だろう。この再帰性が、目的性をもった力学系テレオダイナミック系を特徴付けていることを思い出して欲しい。
この様に新たな情報を解釈して自己の統合性を維持する機構が発展すると、今度は自己だけでなく外界の変化を情報として解釈するメカニズムも発生する。この結果、多細胞体制を支えるエピジェネティックな情報、神経回路情報、脳回路情報、そして最後に言語というそれぞれまったく異なる質の情報が生物から続々誕生してきた。
考えてみると、プロトセルの細胞質や細胞膜は、最初の原始ゲノムにとっては自己ではなく、環境だったと言える。この環境を取り込んで自己の範囲にしたのがLUCAの誕生と言えるが、これにより、その後の進化の方向性、すなわち環境の取り込み(支配)を目指す進化の原動力が決まった気がする。そして何よりも、その過程で例えばゲノム情報の多様化だけではなく、様々な異なる質の情報をゲノムの外に誕生させた。言語を考えてみると、このおかげで自己の範囲は世界の裏側、宇宙の果て、そして生命誕生のときまで広がっている。
これから生物の進化を、これら多様な情報が統合された個体を選択する過程として捉える必要がある。生物の進化をゲノム進化からだけ考えることはできない。次回からは、多様な情報が統合された生物の進化について考えてみたいが、まず生命の進化によって新たにゲノムの外に生まれた情報をリストし、その特徴を考えるところから始めたい。
[ 西川 伸一 ]