自閉症の科学50で紹介したように、解剖学的にも組織学的にも、脳にほとんど変化が見られない自閉症スペクトラム(ASD)も、よく調べるとシナプス抑制機能を持つ介在ニューロンの数が減少しており、これが神経興奮が起こりやすい状態の原因で、例えば振幅の短い脳波(γ波)の上昇や、同時的な神経興奮(ひどい場合はてんかん)を起こしている可能性が指摘されている(https://aasj.jp/news/autism-science/18807)。
このことは、ASDの理解に、介在ニューロン発生過程の理解が欠かせないことを示しているが、興奮ニューロンと比べると介在ニューロンの発生についてはわからないことが多い。幸い、2月に入ってから介在ニューロンの発生に関わる優れた論文を論文ウォッチで3編も紹介した。そこで、これら3編の論文をもう少しわかりやすくして、まとめて説明することにした。また、このまとめについては明日(2月17日)4時から岡崎さんとYouTubeで詳しく解説する予定にしているので、是非聞いていただきたい(https://www.youtube.com/watch?v=a2s2uRRN0r8)。
わかりやすく説明すると言ったものの、どうしても専門論文の紹介なので、その内容を十分楽しむためには基礎知識が必要になる。まず最低限の知識として、興奮ニューロンと介在ニューロンの発生の差について図を使って確認しておこう。
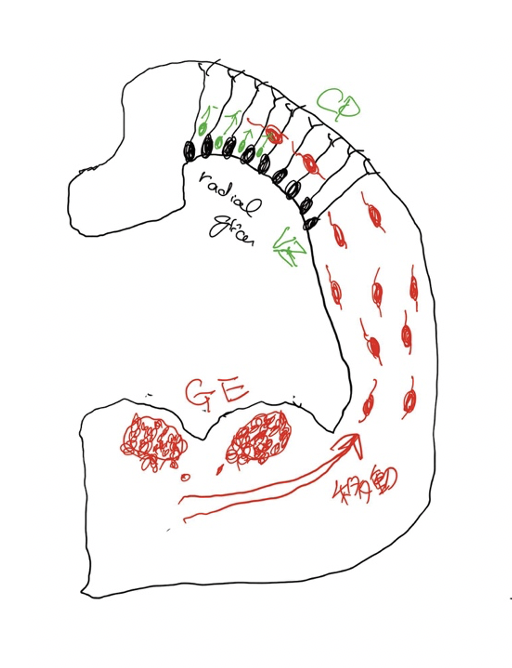
このつたない図は、発達中の脳を輪切りにしたものだ。図の上部は最も新しく進化してきた新皮質と呼ばれる部分に相当し、ここに存在する神経細胞(黒で描いている)がラディアルグリア細胞(RG)で、脳皮質を形成する主役だ。この細胞は増殖を続けて皮質神経を生産する幹細胞の働きがあり、皮質興奮ニューロンは全てRGに由来している。RGは皮質の脳室側から皮質側まで突起を伸ばしており、分化を始めた神経のレールの役割も果たし、皮質の神経層を形成する。
中間部の旧皮質に続いて、腹側に存在するのがganglion eminence(GE)で、脳室に飛び出しているのでeminence(突起)と名付けられ、外側(LGE)と内側(MGE)、およびこの図には示していない尾側(CGE)に分けられる。介在ニューロンはこのGEで増殖分化し脳全体へ移動して分布する。さらに、誕生後も一定期間介在ニューロンのリクルートが続くことが知られている。
実験動物では、これらの過程はよく研究されているのだが、人間の発生については様々な制限がありわかっていないことが多い。と言うのも、様々な細胞が混在する組織の中で未分化な介在ニューロンを特定することが困難なためだ。
この問題を、MGEで増殖する未熟介在ニューロンを特定する分子マーカーを用いて解決し、14週から39週までの人間の胎児脳内で介在ニューロンが増殖分化する様子を詳しく観察したのが1月28日にScienceに発表されたカリフォルニア大学サンフランシスコ校からの論文だ。

このような研究が可能なのは、死亡した胎児脳組織の利用が許されているからで、LGEとMGEでは異なる介在ニューロンが造られていること、そしてMGEでは未熟な介在ニューロンの幹細胞が細胞塊を形成して細胞を作り続け、この塊を離れた細胞が分化を始めて脳内に移動する様子が克明に記述されている。
重要なのは、周りの組織の密接な指示に従って増殖・分化する興奮ニューロンと異なり、未熟介在ニューロンは細胞集塊形成が始まると独自に増殖環境が出来る点で、この塊から離れることで、自動的に細胞分化と移動が始まるシステムができあがっている。
このことは、未熟介在ニューロンを生きた幹細胞のマウス胎児脳へ移植する実験で、明確に示すことが出来る。ヒト胎児組織から未熟介在ニューロンを取り出し、胎児脳に移植すると、移植されたマウスが生まれてからも1年以上生き残り、生後90日目まではマウスの脳内で増殖し続けることが示されている。さらに、マウス脳内でも増殖細胞の塊から離れた細胞が分化し移動することも観察できる。
この発見は、ASDでの介在ニューロン機能を調べる将来の研究にとって重要だ。もしASDで介在ニューロンの発生に変化があるとすると、未熟な介在ニューロンさえ手に入れば、その変化を細胞レベルで研究できる可能性が生まれた。個体を分子レベルで研究するためには、細胞レベルの実験系が欠かせない。
この研究ではヒト細胞のマウス脳への移植が方法として用いられたが、試験管内オルガノイド培養(脳組織と似た立体培養)を用い、介在ニューロン発生をて再現することも可能だ。このことを示すのが、つぎに紹介するオーストリア科学アカデミー研究所からの論文だ。

最初の論文では、正常発生でも、未熟介在ニューロンはあたかもガンのように自律的に増殖していることが示された。これは発生過程と発ガン過程が紙一重であることを教えてくれる。2番目の論文は、mTOR と呼ばれる細胞内代謝の核になる分子の活性が上昇することで、介在ニューロンのもつ自律的増殖能力の抑制が効かなくなり、結節性硬化症として知られる多発する良性腫瘍が生まれることを示した重要な貢献だ。
結節性硬化症とは、mTORの機能を調節するTSC遺伝子が片方の染色体から失われることで、胎児や乳児の全身に様々な良性腫瘍が発生する遺伝病だ。脳内では上衣下巨細胞性星細胞腫(舌を噛みそうな専門用語なので気にしないで読み飛ばして)と呼ばれるグリア腫瘍とともに、皮質内に結節が発生する。患者さんは腫瘍だけでなく、ASD症状やてんかんを発症することが知られており、結節性硬化症でも介在ニューロンの発生異常が背景にあるのではと疑われていた。腫瘍形成については、TSC遺伝子の機能が失われることで腫瘍が発生する典型的ガン抑制遺伝子欠損による腫瘍で、TSCの発現が低下し、mTORが過剰に活性化することで、腫瘍が発生すると考えられている。
この研究の目的は、まず結節性硬化症でおこる皮質内結節(Cortical Tuber)を試験管内で再現することだ。この目的のために、著者らはTSC2遺伝子が半分欠損している2人の患者さん由来iPSを樹立。オルガノイド培養法を用いてiPSから脳組織を誘導し、患者さんと同じ皮質内結節が形成されるか調べている。このとき患者さんのiPS細胞の遺伝子変異を、クリスパー遺伝子改変技術を用いて正常化し、コントロールとして用いている。これにより、遺伝的に多様な人間とはいえ、一つの遺伝子だけに着目してその機能を調べることができる。
結果だが、培養開始後90日目まで、TSC2欠損の影響はほとんど見られないが、オルガノイドの成熟が徐々に進み110日目になると、TSC欠損グループでは結節性の増殖が高まることが明らかになった。さらに結節の細胞の性質を詳しく見てみると、ほぼ全てが先の論文で紹介した3つのGEのうち尾側GE(CGE)で増殖する未熟介在ニューロン(CLIP)に対応することが明らかになった。すなわち、介在ニューロンが皮質に移動しても増殖を続けることで皮質内結節が発生する。
正常の介在ニューロンが元々高い増殖力を有することはすでに見た。しかしこのように高い増殖力があっても皮質内結節は発生しない。なのに、mTORの活性を抑えるTSCの発現が半分になるだけで皮質内結節が100%起こってしまうのかについては次のように説明される。
未熟介在ニューロンでは増殖に必要な高いmTOR活性を維持するため、もともとTSCの発現が低く抑えられている。すなわち、腫瘍と紙一重の状況にある。そこに片方の染色体のTSCが欠損してしまうと、CLIPのmTOR発現はさらに高いレベルに変化し、腫瘍性結節が形成されることになるわけだ。
以上、これまで謎の多かった結節性硬化症の皮質内結節の由来が明らかにされ、これがCGE由来介在ニューロン発生過程異常として理解できるようになったことは、ASDの理解にも重要なヒントになる。
- まず結節性硬化症の患者さんで、皮質内結節とともにてんかんやASDが高発することは、ASDが介在ニューロンの発生異常に起因することを示している。
- 患者さんではmTORの活性がさらに高まった結果、脳内で作られる未熟介在ニューロンの数は増えていると思われるのに、生まれてきた患者さんでは、てんかんのように介在ニューロンの活性低下が起こっている。すなわち、いくら未熟介在ニューロンの数が増えても、正常分化が起こらないと介在神経欠乏になる。
- TSC欠損の影響は他の介在ニューロンに見られてもいいのに、CGE由来介在ニューロンだけで異常が見られることは、介在ニューロンの発生過程が多様であることを示しており、ASDを理解する上でも、介在ニューロン分化の多様性を頭に置いておく必要がある。
ただ、試験管内の実験系がそのまま人間のASD発生過程を反映できるかはまだまだ分からない。これらを裏付けるかのような研究が、最後に紹介したいハーバード大学からの研究だ。

欠損すると巨頭症の様な脳の発生異常とともにASDを併発することが知られている3種類の遺伝子、SUV420H1、ARID1B、CHD8に着目し、これら遺伝子欠損に見られる共通の障害を脳のオルガノイド培養を用いて調べた研究で、2月10日Natureにオンライン掲載された。
この研究が注目した3種類の遺伝子は、遺伝子発現を調節するクロマチンの調節に関わる遺伝子で、TSCのように直接細胞増殖に関わる遺伝子ではない。しかし、欠損すると巨頭症などの発生障害とともにASDを発症する。すなわち、ASDを発症させる共通の発生異常が起こると考えられる。
研究の目的は、ASDにつながる共通の発生異常を再現し、メカニズムを解析することだ。このために、それぞれの遺伝子を、同じiPS細胞株で欠損させ、欠損細胞の脳オルガノイド培養を行い、そこで見られる異常を調べている。
人間の脳のオルガノイド培養と簡単に述べているが、この研究でもなんと6ヶ月以上、人間の胎児発生と同じぐらいの時間をかけた培養で、大変な努力だ。
詳細は省いて結論だけを述べると、
- 3種類の遺伝子が関わる過程は異なってはいるが、最終的にはオルガノイドの中のGABA抑制性細胞の比率を増加させる点で共通している。
- オルガノイド内の抑制性ニューロン増加を反映して、オルガノイド中の興奮神経の活動が抑制される。
この結果も、ASDに介在ニューロン発生異常が存在するという点では共通だが、少なくともオルガノイドの中では、介在ニューロン優性の現象、すなわちニューロンの興奮抑制が起こっているという点で、以前このHPで紹介した(https://aasj.jp/news/autism-science/18807)、ASD児の脳を典型児と比べると、抑制性ニューロンの数が低下しており、脳が過興奮の状態にあるとする結論と異なっている。
詳しくは調べていないが、SUV420H1変異の児童でもてんかんを発症することが知られており、時間がたつと抑制ニューロン優性から、欠乏へと変化する可能性はある。
また介在ニューロンの過剰、欠乏の両方で同じASDやてんかん症状が出ると考えることもできる。実際、MECP2遺伝子の欠損(Rett症候群)と過剰のMECP2重複症は、ともにASDとてんかんを示す。 このように、発生過程と、実際の患者さんでの脳までにはまだまだわからないことは多い。しかし抑制性介在ニューロンはASDの重要な標的細胞として確立したことは確かだ。



