2020年10月21日
焦点を絞らず論文を読んでいると、よくこんなことを考えるなと感心する、想像もしなかった着眼点の研究に驚かされることが多い。今日紹介するバルセロナの医学生物学研究所からの論文はそんな例で、細胞内に形成されている脂肪滴が、代謝の調節だけでなく、細菌感染の第一線防御機能として働いていることを示した研究10月16日号のScienceに掲載されている。タイトルは「Mammalian lipid droplets are innate immune hubs integrating cell metabolism and host defense (哺乳動物の脂肪滴は細胞の代謝とホストの防御を統合するハブとして働く)」だ。
一般的に着眼点がユニークな研究は最初から仮説に基づいて進められる。この研究では細菌感染の代わりにマウスにLPSを投与、これにより自然免疫と脂肪代謝変化を誘導した後、肝臓の脂肪滴を取り出し、そこに存在するタンパク質を大腸菌の培養に加えて、細菌毒性をまず調べている。
結果だが、LPS投与により肝臓での脂肪滴の数は上昇するとともに、大腸菌を殺す活性が高まっている。また、脂肪を取り込ませて脂肪滴の数が増えた人のマクロファージと大腸菌を混合培養した場合も、同じ様に大腸菌を殺す活性がある。この時大腸菌を取り込んだマクロファージを見ると、大腸菌の周りに脂肪滴が近づいて接着していることを確認する。以上の様に、自然免疫が活性化されると脂肪滴がまず細菌の防御の第一線として働くという仮説が確かめられたことになる。
次に脂肪滴による細菌毒性の分子機構を探索すべく、定量的質量分析を用いてLPSで活性化した脂肪滴と、正常の脂肪滴を比べると、驚くべき数の分子発現が変化していることを示している。この様に多くの分子が変化する場合、結局個人の好みで焦点を絞る必要があるが、このグループは脂肪代謝と自然免疫が持つ矛盾点、すなわち脂肪はミトコンドリアの酸化的リン酸化を高めるが、自然免疫では嫌気的解糖が進むというこれまで結果に着目し、細菌の感染は脂肪滴とミトコンドリアとの関係を断つことで、この両方の課題を克服しているのではと仮説を立て、LPS投与により起こる代謝変化がこの可能性を支持していることを確認した後、ミトコンドリアと脂肪滴を繋ぐ重要な分子PLIN5に着目して研究を進めている。
結論ありきの論文だが、結果は見事で、LPS刺激によりPLIN5の発現が低下し、その結果ミトコンドリアと脂肪滴との接着が低下する。このLPSによる脂肪滴とミトコンドリアの接着の減少はPLIN5を強制的に発現させると消失する。逆に、PLIN5発現が高いと、バクテリアと脂肪滴とのコンタクトが減る。
この変化に呼応して、PLIN2が脂肪滴に発現することで、以前紹介したViperin(https://aasj.jp/news/watch/13949 )や抗菌ペプチドcathelicidinなど自然免疫誘導時の細菌毒性に関わる様々な分子が脂肪滴表面に集まってきて、ミトコンドリアから離れた脂肪滴が抗菌オルガネラへと変換することを示している。
結果は以上で、ミトコンドリアも細菌の一種と考えると、元々細菌とコンタクトして代謝を助ける役割を持っていた脂肪滴を、感染時に臨機応変にリプログラムして、抗菌オルガネラに帰るという面白い話だ。ただ読んでいて、結論へと導かれる気がするのも事実で、感動したという話にはなりにくい。
しかし、先日紹介した細胞の形態を核が感知するという話も、この論文も面白いと読んでみた研究がスペインからの論文だと知ると、研究にも民族性があることを感じる。
2020年10月20日
腸内細菌叢が直接自律神経系を刺激して、中枢神経系に影響を及ぼすことは、一般的に認められる様になっているが、腸管はこの様な自律神経系の支配とともに、神経堤から移動してくる、粘膜下のマイスナー、筋層のアウエルバッハ、腸管固有神経叢の支配を受けており、これらも当然腸内細菌叢の影響下にあると考えられる。
今日紹介するロックフェラー大学からの論文は腸管各領域の腸管固有神経叢を分子マーカーで詳しく分類し、それぞれの集団と腸内細菌叢との関係を調べた力作で10月16日号のScienceに掲載された。タイトルは「Microbiota-modulated CART + enteric neurons autonomously regulate blood glucose (腸内細菌叢により変化したCART陽性腸管神経は自発的に血糖を調節する)」だ。
この研究では、腸管固有層の神経叢の領域による多様性を手がかりに、この多様性に腸内細菌叢が関わるかどうかの検討から始めている。まず、生体内で新たに転写が始まった遺伝子の転写を神経特異的に調べる方法を用いて、特に神経ペプチドの発現の違いなどで特定できる局所的な多様性が存在し、この多様性のかなりの部分が、局所の細菌叢の量や質の違いによって決まっていることを突き止める。
加えて、細菌叢が存在しないと腸管固有神経自体の数も低下することがわかった。この神経細胞減少は、細菌叢移植により元に戻ることから、細菌からのシグナルが神経細胞の生存に必要で、このシグナルがないと細胞死のエフェクターCasp11依存性に、神経細胞が死ぬことを確認している。そして、この一部は、腸管を出て肝臓や膵臓の自律神経とシナプス結合を有することを発見する。
この様にして、各領域の腸管固有神経特異的な分子マーカーを確立したあと、回腸の固有神経細胞が発現しているCART遺伝子座を操作し、細胞特異的に刺激やが可能なマウスを作成し、腸管固有神経を外的に興奮させる実験を行なっている。驚くことに、CART陽性神経興奮が続くと、血糖が上昇し、インシュリン分泌の低下が見られること、そしてこれは腸管固有神経から腸管外へと伸びたシナプス結合により、肝臓での糖新生が調節されているためでであることを明らかにしている。
逆に、腸管固有神経細胞維持に必要な細菌叢を抗生物質投与で除去すると、腸管神経細胞が減少し、この結果肝臓への刺激伝達が欠損するため、血糖の低下が見られることを確認している。しかし、細胞死に関わるCasp11が欠損したマウスでは神経細胞死が起こらないため、血糖の低下は起こらないことも明らかにしている。
以上が結果で、細菌叢はその腸管固有神経細胞の維持と多様化に大きく関わっており、特に回腸のCART陽性神経細胞は、興奮により肝臓での糖新生を高めることで、血中のグルコースレベルを維持しているとするシナリオを提案している。少し複雑だが、腸内固有神経細胞というニッチを標的にした面白い力作だと思う。
2020年10月19日
トランプ大統領が、リジェネロンのCov2に対するモノクローナル抗体投与を受け急快復したことを宣伝しているが、快復者からの抗体による治療論文などから判断すると、本当に2〜3日で症状がほとんど取れる場合があることは理解できるし、おそらくモノクローナル抗体を用いた治療治験でも同じような結果が出ていることを背景に、投与に踏み切ったのだろう。折しも、FDAがエボラウイルス感染症に対する最初の治療法として、やはりモノクローナル抗体を認可したという報告が出ていた。実際、レムデシビルも参加したエボラウイルス感染症の治験で有効とされたのがモノクローナル抗体だけだったことも記憶に新しい(https://aasj.jp/news/watch/11936 )。
このようにモノクローナル抗体に対する期待は高いが、更に高い効果を持つ抗体治療が可能であることを示す論文がロックフェラー大学Fc受容体研究の大御所Ravechの研究室から10月8日号のNatureに掲載された。タイトルは「Fc-optimized antibodies elicit CD8 immunity to viral respiratory infection (Fc領域を至適化した抗体はウイルスによる呼吸器感染に対するCD8免疫を誘導できる)」だ。
この研究では、致死量のインフルエンザウイルスを感染させたマウスにモノクローナル抗体を投与して、その治療効果を確かめる単純な実験系を持ちいている。この時、インフルエンザに対するモノクローナル抗体を、抗原特異性はそのままに、4種類のFc受容体に対する結合活性が違うようにFc部分を操作した人工抗体を作成して比べることで、抗体治療時のFc受容体の活性の差を調べている。更に、実験には全てヒトFc部分を持つ抗体を用いており、これに対応するマウスの方のFc受容体も、全てのマウスFc受容体を人のFc受容体で置換え、また発現パターンも人に近づけたマウスを用いることで、マウスでの研究結果がすぐに人間に応用できるよう計画されている。
驚くべき結果で、FcγRIIaに対する結合活性が高い抗体を4時間前に前もって投与していたマウスは全例生存したが、同じ中和活性を持つ抗体であるにもかかわらず、FcγRIIaに対する結合活性が低いFcを持つ抗体では半分以上のマウスが死亡し、更にFc受容体と全く反応しないFcの場合は、全く効果が見られないことが明らかになった。また、結合する抗原決定基を変えて同じ実験を行っても、結果は全く同じである事を確認している。
おそらく、試験管内の感染実験で中和活性を調べれば、差はほとんどないと考えられるので、生体内での抗体の抗ウイルス活性は、中和活性だけで単純に決められないことを示唆している。
では、この差が生まれるメカニズムは何か?感染の場である肺について様々な細胞の性質を比べ、FcγRIIaに高い結合活性を持つ抗体を前投与した場合のみ、CD40を発現した成熟した樹状細胞が肺で上昇していること、そしてその結果肺内に多くのCD8陽性細胞が誘導されることを発見した。すなわち、FcγRIIaが感染時に存在することで、まずウイルスと結合した抗体がFcγRIIa を発現するDC1樹状細胞を活性化し、その結果CD8キラー細胞がウイルスに対して誘導できることを示している。
以上の実験は全て感染前に抗体を投与する設定で行っているが、抗体による感染の悪化ADEの可能性を確かめるために、感染後3日目に抗体を投与する実験も行い、やはりFcγRIIaとの結合を高めたFcを持つ抗体だけがマウスを投与量依存的に治すことが出来ること、また基本的にはADEの発生は見られないことなどを明らかにしている。ただ、感染が成立した後の抗体投与量は、予防的に効果がある量の20倍必要であることも示している。
以上、全てインフルエンザウイルス感染モデルでの研究だが、
まず、抗体の治療効果はウイルス感染を中和する活性だけで決まらない事。 Fc受容体の活性化により、初期から感染局所でキラー細胞が誘導され、ウイルス増殖抑制に大きく貢献すること。 予防的抗体が、感染を防ぐだけでなく、抗原による細胞性免疫に誘導して、ホストの免疫を誘導するのに役立つ事。 例えば、低容量の抗体を投与した後に弱毒化ウイルスワクチンを投与するプロトコルも考えられること。 など、抗体による感染症の治療を考える時学ぶ点は多かった。
もちろんいくらヒトの遺伝子に置き換えているからといって、マウスモデルの研究でこの結果をそのまま人間、更にはCovid-19に当てはめることはできないが、免疫系の複雑さを示すとともに、抗体に様々な問題が存在しても、それを改善していくための多くの知識が蓄積していることがわかった。
2020年10月18日
我々の細胞は押し合い圧し合いのラッシュアワー状態で存在しており、その中で自分の位置を全体に合わせてうまく変化させ、スペースを埋める必要がある。この外的な圧力を感知して細胞の形態を変化させるメカニズムについてはほとんどわかっていない。
今日紹介するスペイン・バルセロナの国立光学研究所からの論文は細胞をひしゃげさせたときに核で始まる細胞の活性化を細胞学的に解明した研究で10月16日号のScienceに掲載された。タイトルは「The nucleus measures shape changes for cellular proprioception to control dynamic cell behavior (核が細胞の形態変化を測って細胞運動の動態をコントロールする固有の受容感覚として働く)」だ。
細胞生物学の典型的プロの仕事で、適切なパラメーターを使って細胞を適切に見ること、細胞内の調節機構に熟知して、適切に阻害剤を選んで分子経路を明らかにすること、そして細胞自体を厳密にコントロールする技術を持つこと、と三拍子が揃っている。
もちろん課題も明確で、細胞を圧縮したときミオシンIIの活性化を媒介とする細胞形態の変化が起こるメカニズムの解明だ。
研究ではミオシンIIを可視化した細胞を用いて細胞に圧縮操作を加えたとき、ミオシンIIが活性化され細胞の収縮活性が高まる。この速やかで長く続く変化が、核が引っ張られ、核内膜が展開することと相関することを発見し、この核膜に始まる細胞運動の活動活性化過程を解明している。
分子阻害剤を駆使した経路研究が詳細に行われているので、全てをすっ飛ばして結論をまとめると以下の様になる。
細胞が圧力を受けて核内膜が展開すると、これを感知してphospholipase A2(cPLA2)が核膜と結合して、一種のカルシウム依存性のメカのセンサーを作る。 PLAにより合成されるアラキドン酸によりミオシンIIが活性化される。 この核の形態の変化は、小胞体と核膜が接近してSTIM-Orai分子が濃縮されることによる、細胞内のカルシウム濃度の上昇と強調しており、これにより受動的な形態変化を、他の原因、例えば細胞が膨大するといった変化を区別して、細胞活動とリンクさせる。 まとめてしまうと結論は簡単になったが、実際には知識がないとなかなかついていけない、しかし細胞の形態を考える上で重要な発見だと思う。
2020年10月17日
光遺伝学や、光を使った神経記録により、脳科学は大きく変革した。ただ、このシステムで明らかになるのは、基本的には神経ネットワークの詳細で、このネットワークの活動を維持し調節している分子機構は、別の方法で探す必要がある。従って、神経ネットワークに関わる分子機構の解明には、ある行動に関わる神経を特定し、その遺伝子発現から機能と相関する分子候補を特定し、CRISPRなどを用いたreverse遺伝学で分子と機能の相関を詰めていくのが現代の方法だ。
と思っていたら、ロックフェラー大学のグループが、非近交系のマウスの機能的変化を捉えて分子を調べる古典的なForward遺伝学を近代的脳科学と組み合わせた面白い論文を発表したので紹介する。タイトルは「A Thalamic Orphan Receptor Drives Variability in Short-Term Memory (視床のリガンドが特定されていない受容体が短期記憶の多様性を発生させる)」だ。
この研究では5種類の純系マウスと、野生種を系統化した3系統をそれぞれ掛け合わせて得たF2をランダムに交配して得た非近交系マウス100個体についてT字迷路を用いた短期記憶テストを行うと、期待通り検査成績が大きく変動している。あとは、人間集団で行なうゲノム検査と同じGWAS検査を行い、スコアと相関するSNPを探した結果、5番染色体のSmart1と呼ぶ多型座を特定することに成功する。
次にこの多型が記憶力を反映しているか確認したあと、この多型の本体を明らかにする段階に入るが、人間とは違って脳組織での遺伝子発現をそれぞれの多型で調べることが簡単なので、まずSmart1遺伝子座に存在する遺伝子の、各脳領域での遺伝子発現と記憶力の相関を調べ、最終的にSmart1座に存在し機能的に記憶力と最も相関する遺伝子としてGpr12として知られる、リガンドは特定されていないG共役型の受容体を特定する。
さらに、Smart1座の多型により、Gpr12の視床での発現量が2.5倍の差があり、発現が高いほど記憶力が良いことを確認する。
あとは、迷路行動中のカルシウム流入を様々な領域で調べる回路解析を行い、Gpr12の発現量と相関して、記憶の獲得および維持過程での視床と皮質の興奮の同調性が高まることを明らかにしている。神経生理学的実験から、Gpr12がグルタミン誘導性のカルシウム反応を高めることが示されており、おそらく神経の活動閾値をGpr12が調節し、前頭皮質と視床の回路を同期させているのだろう。
以上が結果で、形質の差を見つけて、その遺伝的背景を特定することで、正常過程の解析からだけではわからない機能を明らかにするforward遺伝学が今も役に立つことを示した面白い研究だと感じた。今後Gpr12の発現や機能を標的にすることで、記憶障害治療にもつながるのではと期待している。
2020年10月16日
以前、 論文紹介で「脊髄損傷治療の大きなステップ」と、ローザンヌ大学からNatureに報告された、硬膜外電気刺激をコントロールして脊髄損傷患者さんの運動機能を取り戻す方法の開発について紹介した (https://aasj.jp/news/watch/9166 )。慢性の脊髄損傷患者さんが、5ヶ月程度の比較的短いリハビリは必要だが、自分で歩行できるようになったという研究で、そこで示されたビデオ映像( https://static-content.springer.com/esm/art%3A10.1038%2Fs41586-018-0649-2/MediaObjects/41586_2018_649_MOESM8_ESM.mp4 )は衝撃的だった。
この記事では、この技術を開発した研究者たちが大学からスピンオフして、GTXmedicalという会社を立ち上げ、2024年の認可を目指して、来年から治験をはじめること、またこの技術がFDAの画期的デバイスとして認められたことを報告している。
いよいよ慢性期の脊髄損傷を対象にした治療法の治験が行われることになり期待したいが、我が国でもはやく治験ができることを期待したい。
2020年10月16日
ダウン症候群は21染色体の数が3本に増えることによる病気で、知能の発達遅延とともに、様々な身体症状を伴う。この様に病気の原因がはっきりしていても、発症メカニズムは複雑でまだまだわからないことは多いが、トリソミーによるタンパク質合成の変化で細胞内にストレスがたまり、変性や炎症が起こることが引き金になっているのではと考える研究者は多い。その結果、直接このストレス反応を標的にした薬剤治療の可能性も示唆されてきた(https://aasj.jp/news/watch/11744 )。
今日紹介するイタリア工業研究所からの論文はマウスモデルではあるが、ダウン症候群の神経症状の一部がミクログリア異常活性化により誘導され、この過活性を是正することで症状を改善させる可能性を示した研究で12月9日号のNeuronに掲載される予定だ。タイトルは「Rescuing Over-activated Microglia Restores Cognitive Performance in Juvenile Animals of the Dp(16) Mouse Model of Down Syndrome (過剰活性化されたミクログリアを是正することでマウスダウン症モデルDp(16)の認知機能を改善できる)」だ。
このマウスで使われたのは人間の21番染色体に相当するマウス16染色体の一部を重複させたモデルマウスで、ダウン症では110〜150遺伝子が重複するのに対して、113種類の遺伝子が重複しているモデルで、炎症やミクログリアに関わる遺伝子はほぼ全て共通して重複している。
この研究では最初からダウン症による脳内のミクログリアの変化に注目して研究を行い、様々な指標で見たときにダウン症モデルマウスの脳内ミクログリアが過剰活性していること、そして1型インターフェロン刺激下流の分子を中心に発現が上昇していることを発見する。
そこでミクログリアの数を減らす目的でCSF-1の機能を阻害する薬剤を投与すると、脳内のミクログリア数が低下するとともに、シナプスのスパイン形成が正常化し、並行して認知機能も改善することを示している。
ただ闇雲にミクログリアを除去するというのは問題が多いので、次にこれまでも示唆されてきた炎症を抑えるCox2阻害剤acetaminophenでミクログリアの活性を抑えられないか調べ、acetaminophen投与でミクログリアの活性化が抑制され、認知機能も改善することを示している。
元々acetaminophenはCox2を抑えて、炎症メディエーターであるプロスタグランディンを抑えるのだが、この研究では炎症だけでなく、ミクログリアのメカのセンサーTrpV1にも働いてミクログリア特異的に活性化を抑える可能性も示している。
そして、acetaminophenの作用メカニズムがインターフェロン刺激によるサイトカインの発現抑制、それによるスパイン形成阻害の解除などを介していることを示しているが、詳細は省いていいだろう。また、この効果は決してDp(16)モデルに限らないことも示している。
以上、ダウン症の認知障害の一部を、ミクログリアの活性化を抑制することでh治療する可能性が示され、薬剤の候補としてCox2阻害剤とともに、TrpV1阻害剤が特定できたことがこの研究のポイントだ。では、実際のダウン症の認知機能低下の治療は可能なのだろうか?
この研究では成人後のダウン症の剖検例を調べ、確かにミクログリアの活性化が起こっていることを確認し、副作用の問題さえ克服できれば、大人になった後でもミクログリアを標的として認知機能低下を治療できる可能性を示唆している。
今後、発達期の介入も含めて、ミクログリアを標的にするダウン症治療の薬剤治療が開発されることを願う。
2020年10月15日
今回の新型コロナウイルス・パンデミックでは、メディアやSNSを舞台に、医師や科学者たちの様々な議論が飛び交い、現在もマスクやPCRについての議論が続いている。しかし、この議論から本当に新しいコンセンサスが生まれるかどうかは疑問で、例えばBMJ Global Health に発表された南カリフォルニア大学からの論文では、CNNを贔屓にするアメリカ人は、Foxニュースを贔屓にするアメリカ人よりマスクを着用し、手洗いも頻回にすることが示されている。すなわちこれらの問題に関する考え方が、米国の大統領選挙では政治的立場の象徴として国民を二分している。
私個人の意見を問われれば、最終的に何が正しいかどうかきめるためには、皆が合意できる科学的エビデンスが必要だが、それがはっきりしない以上、原理的に良いと思われることはその効果に限界があっても、なんでもやればいいと思っている。例えばウイルス感染は確率問題で、それぞれの地域に存在するウイルスの流通量により、感染確率や感染時のウイルス暴露量が影響される。とすると、自分の感染は予防できなくとも、他の人にうつさないという点で、私の飛沫の一滴でもマスクで吸収できれば(実際にはもっと多く吸収できる)流通ウイルス量の減少に貢献できると思っている。PCRも同じで、連日検査を受けていた(実際には簡易検査だったようだが)トランプが感染してしまったとしても、確定診断の方法がない以上、希望者にはいつでも検査ができるようにするしかないと思う。要するに、いいと思えることはなんでもやればいい。
同じことは、政策レベルの判断でも言える。よく言及されるのが、スウェーデンと他のヨーロッパ諸国の比較だろう。最新号のScienceにコレスポンデントの一人Gretchen Vogelが「Sweden’s Gamble」という記事を発表した。
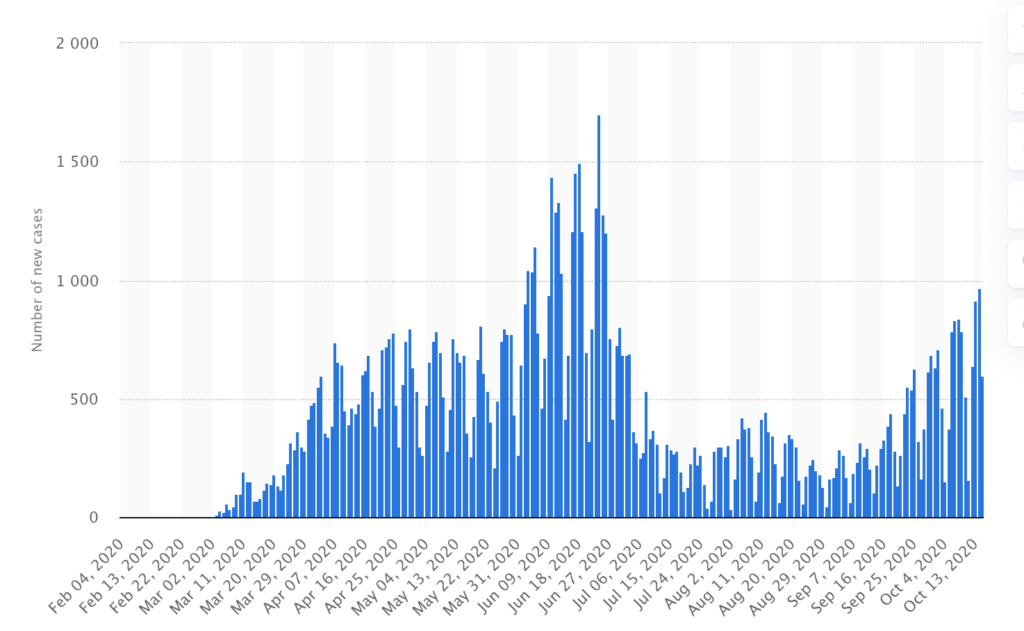
皆さんもご存知のように、スウェーデンは新型コロナに対して、他のヨーロッパ諸国のようにロックダウンなどの過激な感染防御措置をとらずに、個人の自主性に任せる政策を貫いた。図はSTATISTAと呼ばれるサイトから転載したスウェーデンの感染者数の変移だが(https://www.statista.com/statistics/1102193/coronavirus-cases-development-in-sweden/ )
ロックダウンなど厳しい措置を取ったヨーロッパ各国と比べて、感染者が一方的に増えたわけではなく、第一波、第二波と同じような経過をとっている。強いていえば我が国のパターンに近い。ある意味でロックダウン政策の無力を示すことになるが、この政策は本当に成功したと言っていいのかと、Vogelさんはスウェーデンでこの政策に反対の声を上げ続けた科学者を紹介しながら、疑問を投げかけている。
この記事でも、スウェーデンの最初のピークで多くの死者、特に高齢者の死亡例が発生したことは、反省されるべきではと指摘している。そして、ここに書かれた実態をより詳しく分析した研究が先週Nature Communicationにオープンアクセス論文として発表された。
スウェーデンは医療記録がしっかりしており、今回のパンデミックで死亡した各個人のデータが保存されている。この研究では、スウェーデンでの第一波のピーク時、5月7日までにCovid-19で亡くなった全症例を詳しく調べ、年齢、性別、そして様々な社会的階層の指標との相関を調べている。これまで指摘されていたように80歳以上の死亡率が42.5%と高い。しかしこれほどではないにしても我が国の80歳以上の死亡率は28.5%で、医療制度などの違いで高齢者の致死率が高いという一般傾向がすこし拡大したと考えてもいい。
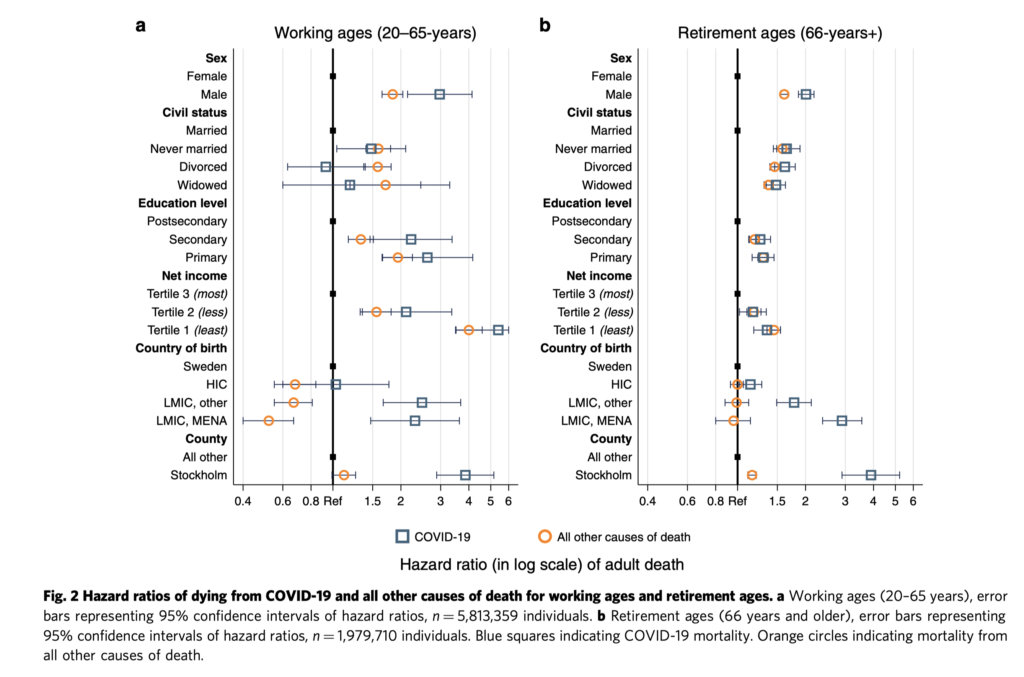
この論文の最大の驚きは以下の図に凝縮されている。
図右は高齢者の死亡率で、Covid-19と他の理由による死亡を比べると、経済格差や教育格差との相関にそれほどの違いはなく、老後のケアは貧富の差なく行き届いていることを示している。
ところが現役世代で見ると(左図)、教育格差、経済格差が高い死亡リスクに直結しており、今回の新型コロナ感染がスウェーデン社会の問題を浮き彫りにしていることがわかる。すなわち、現役世代ほど格差が激しい。同様に、世代を問わず、移民の死亡リスクが高いことは、移民が本当の意味でスウェーデン社会に溶け込めていないことを示している。
以上のように、一つ一つの政策には必ず光と影があり、感染状況を把握するパラメータが限られている以上、感染機会をできるだけ減らすことを目標にしてその時その時の政策を決める以外に方法がない。従って現時点で一番重要なことは、できるだけ多くの記録を残して、この論文のように後から評価できるようにすることだと思う。是非新型コロナウイルスがあぶり出す我が国の社会問題を冷静に分析してほしいと思う。
2020年10月15日
私たちの脳の中で自然に発生している周期的な興奮が存在し、重要な機能を果たしていることが続々明らかになってきた。例えば聴覚野に発生している30Hzの興奮周期が一種のメトロノームの様な働きをしていることを示した論文を以前紹介した(https://aasj.jp/news/watch/13898 )。さらに、この様な周期的興奮が一定の領域で同期して起こるだけでなく、領域内を波の様に伝播するケースも見つかってきた。
今日紹介するソーク研究所からの論文はマーモセットの中側頭葉に存在する視覚領域に見られる上部から下部にかけて周期的に伝播する興奮の波の機能について調べた研究で10月7日号のNatureにオンライン掲載された。タイトルは「Spontaneous travelling cortical waves gate perception in behaving primates (自発的に伝播する皮質の興奮波は行動中のサルの知覚の閾値を決める)」だ。
この研究は最初から感覚野全体を伝播する興奮の波が存在し、これが感覚の敏感さを決めているという仮説を確かめるというコンセプトを証明するために計画されている。従って、最も重要なのはこの自発的興奮波の存在をキャッチすることになる。
まず中側頭視覚領域をカバーするクラスター電極を生きたマーモセットに設置し、一本一本の神経細胞活動を記録するとともに、電極の周りのシナプス電流を測ることで、一定の領域の一種の脳波を同時に記録できる様にしている。この一定の領域の電圧を同時記録するのは難しい課題だった様だが、極めて複雑な神経活動の組み合わせの中から、広い周期に渡って興奮を統合することで、見事に中側頭を上から下に伝播する波をとらえることに成功している。
この波の山と谷で各神経の興奮スパイクをカウントすると、波の山で高く、谷で低いという関係が確認でき、この波がそれぞれの領域の神経の興奮の閾値を決めていることがわかる。すなわち、この領域の神経の閾値は、自発的に発生する興奮波により決められていることがわかる。
以上を確認した上で、コントラストが低く感知が簡単でないサインが視覚に現れた時、そちらに視点を移せるかどうかを調べている。この時サインがどの神経細胞を興奮させるかの位置関係が決まっているので、サインが現れた時興奮する神経は波の山にあるのか谷にあるのかわかる様に実験が組まれている。結果は期待通りで、波の山に対応する神経が存在する時に、よりうまく認識できる。
この結論を確かめるために、認識の成功確率を対応する神経が波の位置から予想できるかなど様々な実験を繰り返しているが割愛していいだろう。要するに、自発的に中側頭視覚野に発生する興奮の周期的伝播により、局所の神経細胞の興奮閾値が決められ、興奮性が高いと感覚は研ぎ澄まされ、興奮性が低いと感覚は鈍るという話になる。
この興奮の波はミエリン化していない神経伝達の速度と一致しているので、おそらく皮質神経をつなぐ水平軸索により伝播すると考えられ、新皮質共通の特徴と言える様だ。しかし、なぜこの様な感受性のアップダウンの波が必要なのか、そこが一番知りたい。
2020年10月14日
新型コロナウイルス(CoV2)に対する抗体反応に関するデータが集まってきだした時、多くの研究者が「免疫反応が普通とは違うな」と感じたと思う。まず発症後の血中抗体価を調べると、IgMとIgGがほぼ同じ様な時間経過で検出される(https://aasj.jp/news/lifescience-easily/13057 )。さらにスパイクタンパク質に対して使われた抗体遺伝子を見ると、多くがgerm line型で、突然変異の蓄積による成熟過程が見られない(https://aasj.jp/news/watch/13476 )。そして、分離された抗体のなかにかなりの比率で自己組織に反応する自己抗体が存在する(https://aasj.jp/news/watch/13963 )。
最初論文を読んだ時、いずれの特徴も新型コロナウイルスに対する抗体が出来やすい良い傾向ではないかと思っていた。しかし、この背景にCoV2に対する異常な免疫反応様式があることを示す同じ趣旨の論文が相次いで発表され、免疫の複雑さに驚くことになった。
最初はハーバード大学からの論文で筆頭著者はKanekoさんでおそらく日本の方だろう。
この研究では新型コロナ感染により死亡した患者さんの剖検時に採取した胸部リンパ節と脾臓組織を調べ、「胚中心」と呼ばれる構造が欠損していることを発見する。「胚中心」とは、記憶T細胞とB細胞が、特殊な樹状細胞の周りに集まり、抗原に対する高い親和性を持つ抗体を産生する細胞へと進化するとともに、抗体のクラスのスイッチが起こる重要な場所だ。
そこで、抗原に対する高い親和性の抗体を作る記憶B細胞進化に必要な細胞や分子の発現を調べると、Bcl6を発現するB細胞がほとんど消失していることを発見する。また、これと呼応して胚中心で働くやはりBcl6を発現するfollicular helper T (Tfh)も欠損することがわかった。すなわち、B細胞だけでなく、胚中心での過程に必要なヘルパーT細胞まで欠損していることがわかった。
胚中心形成に影響するサイトカインの発現を調べるとTNFαの発現が上昇しており、おそらくウイルス感染によるサイトカインストームにより過剰発現したTNFαにより、Tfhの分化が抑制されるためではないかと推察している。
しかし、最初に述べた様に、重傷者でもIgGクラスの抗体が検出できるのはなぜか?リンパ節にはクラススイッチを調節する分子AIDを発現するB細胞も存在し、胚中心なしにB細胞の一定の成熟が進んでいることが窺える。しかし、胚中心外でT細胞に反応しているB細胞を詳しく調べると、IgDとTNF受容体を発現しない、ウイルス感染や自己免疫病でよく見られるB細胞がクラススイッチ抗体を産生していることを突き止めている。また、Tfh分化が抑制されたため、Th1細胞の数がリンパ節で増えており、これがB細胞の成熟を助けていると考えられる。
最後に、リンパ節や脾臓での観察を、様々なステージの患者さんの末梢血に流れてきたB細胞で確認しているが、説明は割愛していいだろう。
要するに、CoV2感染によるサイトカインストームでTNFα発現が上昇すると、胚中心が形成されず、異常な形でT/B相互作用が起こるため、長期の免疫記憶は成立しづらく、しかもこの様な状況でウイルスに対する抗体を作り続けることで、自己免疫反応の危険にも晒されるという恐ろしい話だ。
この結果を重傷者と軽傷者の末梢血B細胞を詳しく比較することからバックアップしたのがエモリー大学からの論文で、10月7日号のNature Immunologyに掲載された。
長くなるので詳しくは紹介しないが、末梢血のB細胞を詳しく調べると、ICUで治療を受けた患者さんでは、濾胞外で分化しT細胞と相互作用するIgD陰性、TNF受容体陰性(この研究ではさらに詳しく分画している)のB細胞と、抗体産生B細胞が増加し、そのパターンが自己免疫病の一つSLEと酷似していることを示している。
また、クラススイッチは進んでいるが、ほとんどがgerm line型のV遺伝子を使っており、突然変異の数が見られないことは、これまでの研究と一致している。また、胚中心を経ずに濾胞外で作られた抗体はたしかにCoV2の中和活性を持つだけでなく、軽症者より強い活性が見られるが、同時にSLE患者さんと同じで自己反応性の抗体産生細胞が除去されていない、すなわち免疫寛容がうまくいっていない。
以上、局所でのウイルス感染によるサイトカインストームにより胚中心形成が抑えられ、その結果自己免疫病で見られる様式の抗体産生が始まる。これにより確かに中和抗体が作られるが、この型の反応が続くことで自己反応性の抗体も作られ、全身の炎症拡大に寄与することを、両論文ともに示している。他の説明もあるかもしれないが、頭の中で渦巻いていた新型コロナウイルスに対する抗体反応についての疑問の多くがともかく解消した。
このように、この結果は、CoV2に対する抗体反応の特殊性を示すこれまでの多くの論文を説明してくれるだけでなく、少なくとも重症者は、正常な免疫記憶が成立しない可能性を示唆する。しかし、TNFなどが局所リンパ節で過剰生産されるメカニズムがわかれば、ウイルスに対する免疫反応を正常に戻してやれる可能性を示唆するとともに、感染により免疫ができないからといって、ワクチンが有効でないという思い込みは間違いであることを示唆する。すなわち、ワクチンの方が正常な免疫を誘導する可能性が示唆された。この自己免疫型B細胞の存在を調べることは、ワクチンの評価にとっても重要な検査になったと思う。
新型コロナ感染はヒトの免疫学の研究を一段と進めていることが実感できた。