2022年2月19日
ゲノムや年代測定のみならず、現在考古学や歴史学に、様々な科学的手法が導入され、思いもかけない視点から、文化に新しい光が当たりつつある。
今日紹介するベルギー・アントワープ大学を中心とした国際グループからの論文は、まさにそんな例で、中世の英雄や騎士の物語についての本の科学的生態学を通じて、その本を読んでいたそれぞれの地域の文化を、新しい視点で眺めた論文で、2月18日号のScienceに掲載された。タイトルは「Forgotten books: The application of unseen species models to the survival of culture(忘れられた本:文化の生存に発見されない種についての生態学モデルを適用する)」だ。
例えばアーサー王と円卓の騎士などは有名な例で、最初は口伝えで伝承されてきたが、中世に入って書籍の形で伝わるようになった。当時の書籍は貴重なものだったとは言え、様々な形で消失が続き、現在は図書館や文書館、そして個人のコレクションとして残存している。当時の文化を知りたい歴史学にとっては、これからも新しい本が現れるのかは重要なことだが、どこまで探索を広げれば新しい本が現れるのかを科学的に予測することはこれまで行われてこなかった。
この研究では、生態学でサンプリングをした後、今後さらに新しい種が発見できるのかを予測する方法を用いて、現在図書館などに収集された書籍の数、多様性、地域的分布、そして書籍の状態から予測しようとした研究で、Scienceレベルとして高いかどうかは疑問だが、着想は面白い論文だ。
生態学的モデリングや統計学は苦手な方なので、方法はすっ飛ばして結論を紹介すると、次のようになった。
1)思いのほか残存率が高く、まだ新しい本や書類が発見される可能性は高いこと。
2)ただ、残存率の地域差は大きく、最も低いのは英語圏の本で、最も残存率の高いのはドイツ語圏の本で、その差は2倍を超えている。その中間にオランダ語圏やフランス語圏が入っている。(ドイツが書かれたものを大事にするのはよく分かる。一方、英国の憲法が不文憲法であるというのもこの結果を見ると腑に落ちる)
3)アイルランドやアイスランドでは、文書の分布が極めて均一で、本が地域隅々にまで届いていたことを示す。この2カ国を除くと、他の国では分布の均一性は大きく低下している。
面白いと思ったのはこのぐらいだが、新しい本の発見可能性を計算すると言うより、世俗の本をサンプリングして、その生態学を知ることで、各国の文化が浮き上がることの方が面白いと思った。
2022年2月18日
4EPSは、チロシン、クマリン酸、ビニルフェノール、4EPを経て合成されるが、一つの細菌が全ての酵素を持つ可能性は低い。そこで、4EPまでの酵素を持つ2種類の細菌を組みあわせて、無菌マウスに投与すると、少量ではあるが血中に4EPSが見られるようになる。さらに、一つの細菌が発現する酵素の量を変化させたりと、遺伝子操作を加えると、高いレベルの4EPSが血中に現れるようになる。
異常のモデル実験から、おそらく複雑な細菌叢の中で、各細菌中の酵素を順番に使いながら腸内で4EPが合成され、これが体内で硫化反応を受け4EPSに変化すると考えられる。
後は、こうして腸で合成された4EP由来4EPSの脳への影響を、様々な方法で調べている。まず全体の脳活動を調べると、4EPSは活動を低下させる。その結果、領域間の結合性も低下する。
後は、細胞レベルでの4EPSの効果を調べ、オリゴデンドロサイトの成熟を阻害し、結果ミエリン形成が低下することを示している。また、これにより、いくつかの行動テストで、不安神経行動が高まることを示している。
以上が結果で、腸内細菌叢にしっぺ返しを食らうことを示す典型的論文だ。ただ、このような物質が脳細胞の成熟を抑制する研究などは数限りなく存在する。従って、腸内細菌叢から持続的に4EPが供給されることを示したことがこの研究の全てだと思う。また、腸内細菌叢をうまく利用すると、多くの慢性暴露実験も出来るかもしれないと思った。
4EPとはどんな分子なのかちょっと気になって、ググって見ると、なんと酵母により合成され、ワインや醤油のアロマの素になっているようだ。とすると、ほぼ毎日ワインのお世話になっている私は、細菌叢に頼らず暴露されていることになる。しかし、幸い今のところ、気楽に人生を楽しめている。さて、この研究をどの程度深刻に受け止めればいいのか、悩ましい。
2022年2月17日
今回のCovid-19パンデミックで、ワクチンの重要性のみならず、目指すべき要件が整理され、新たな開発競争が始まっている。今回はmRNAワクチンが一人勝ちに見えるが、免疫の質や方向を決める可能性という面では、他のモダリティーも捨てがたい。
特に次々と現れる変異体に対して対応できるワクチンは、ワクチン開発第二ラウンドとして熾烈な競争になっている。一つの方法は投与方法で、スパイクだけでなくいくつかのウイルス抗原を経鼻投与するワクチンで、T細胞免疫を高める方法(例:Cell,2022: https://doi.org/10.1016/j.cell.2022.02.005)の報告が相次いでいる。
もう一つの方法はタンパク質抗原に組みあわせるアジュバントの開発で、粒子状にしたサポニンベースのワクチンについては昨年紹介した(https://aasj.jp/news/watch/18463 )。
今日紹介するハーバード大学からの論文は、真菌壁のマンナンの2種類の物性的性状を同時に用いることで、異なる自然免疫を動員し、最終的に広いスペクトラムを有する中和抗体を誘導できることを示した研究で2月17日号のCellに掲載された。タイトルは「An adjuvant strategy enabled by modulation of the physical properties of microbial ligands expands antigen immunogenicity(微生物のリガンドの物理的性質を変化させるアジュバント戦略は抗原の免疫原性を広げる)」だ。
現在使われているアジュバントでも、粒子化することは最も重要な要件で、これにより樹状細胞へ取り込まれる効率が上がる。この研究では、カンジダ菌のマンナンが水溶性のままだと注射部位の炎症を全く起こさないにもかかわらず、リンパ節に速やかに移行して、リンパ節内で自然免疫反応を起こすことに注目した。
この自然免疫メカニズムを調べると、マンナンはNK細胞を中心に、Dectin-2/FcRγを刺激し、下流でNIK、 RelBを刺激することで、インターフェロン依存性遺伝子が誘導され、リンパ節内特異的に自然免疫反応が起こることを明らかにしている。
これは、水溶性のマンナンでの結果だが、これをアラムと混ぜて一部を粒子状にしてアジュバント効果を調べると、今度は、皮膚反応も高いDectin-1を入り口とする異なる刺激経路を活性化することが明らかになった。
実際にはアラムで粒子化しても、残りは水溶性のまま残るので、これに抗原を加えたワクチンは、両方の経路の自然免疫を利用できることが示された。そこで、二つの経路を用いる効果を調べるため、CoV2スパイクタンパク質を混ぜて免役し、現在利用されている他のアジュバントと比べると、誘導できる中和抗体量はどれも同じで有ることが分かった。
しかし、新しいマンナン+アラムワクチンでは、受容体結合ドメインや、ペプチド抗原など、抗体の誘導しにくい抗原に対する抗体を誘導することが出来、その結果ピンポイントの抗原決定基に対する抗体を誘導しCoV2だけで無く、CoV1やMERSの感染まで予防できる抗体を誘導できた。
T細胞免疫を考えると、ワクチンの抗原は当然大きい方がいい。一方、抗体による予防効果を考えると、多くの変異体でも保存されている場所を狙う方が良い。ただ、小さな抗原ではうまく抗体が誘導出来なかった。
この問題を、新しいアジュバントは解決できる可能性を示した。すなわち、抗原決定基をピンポイントで免役して、どのサルベコウイルスにも効果がある広いスペクトラムの抗体を誘導できるワクチンが出来る可能性が示された。さて、第二ラウンドの競争はどうなるか、私たちとしては競争が激しいほどうれしい。
2022年2月16日
自閉症の科学50で紹介したように、解剖学的にも組織学的にも、脳にほとんど変化が見られない自閉症スペクトラム(ASD)も、よく調べるとシナプス抑制機能を持つ介在ニューロンの数が減少しており、これが神経興奮が起こりやすい状態の原因で、例えば振幅の短い脳波(γ波)の上昇や、同時的な神経興奮(ひどい場合はてんかん)を起こしている可能性が指摘されている(https://aasj.jp/news/autism-science/18807 )。
このことは、ASDの理解に、介在ニューロン発生過程の理解が欠かせないことを示しているが、興奮ニューロンと比べると介在ニューロンの発生についてはわからないことが多い。幸い、2月に入ってから介在ニューロンの発生に関わる優れた論文を論文ウォッチで3編も紹介した。そこで、これら3編の論文をもう少しわかりやすくして、まとめて説明することにした。また、このまとめについては明日(2月17日)4時から岡崎さんとYouTubeで詳しく解説する予定にしているので、是非聞いていただきたい(https://www.youtube.com/watch?v=a2s2uRRN0r8 )。
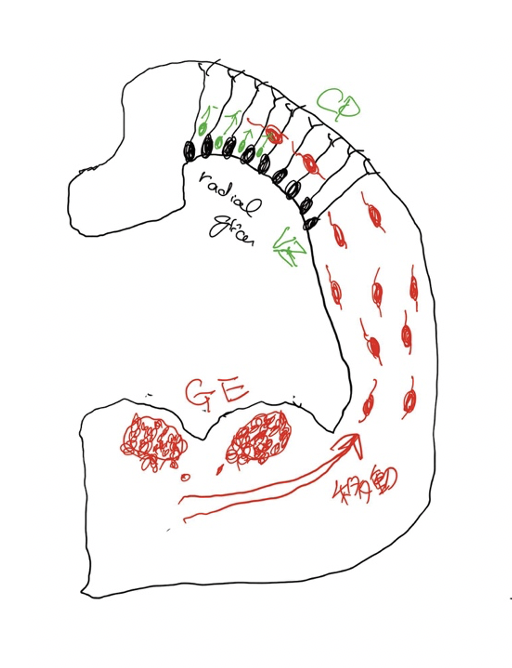
わかりやすく説明すると言ったものの、どうしても専門論文の紹介なので、その内容を十分楽しむためには基礎知識が必要になる。まず最低限の知識として、興奮ニューロンと介在ニューロンの発生の差について図を使って確認しておこう。
ganglionic eminence(GE)と介在ニューロン このつたない図は、発達中の脳を輪切りにしたものだ。図の上部は最も新しく進化してきた新皮質と呼ばれる部分に相当し、ここに存在する神経細胞(黒で描いている)がラディアルグリア細胞(RG)で、脳皮質を形成する主役だ。この細胞は増殖を続けて皮質神経を生産する幹細胞の働きがあり、皮質興奮ニューロンは全てRGに由来している。RGは皮質の脳室側から皮質側まで突起を伸ばしており、分化を始めた神経のレールの役割も果たし、皮質の神経層を形成する。
中間部の旧皮質に続いて、腹側に存在するのがganglion eminence(GE)で、脳室に飛び出しているのでeminence(突起)と名付けられ、外側(LGE)と内側(MGE)、およびこの図には示していない尾側(CGE)に分けられる。介在ニューロンはこのGEで増殖分化し脳全体へ移動して分布する。さらに、誕生後も一定期間介在ニューロンのリクルートが続くことが知られている。
実験動物では、これらの過程はよく研究されているのだが、人間の発生については様々な制限がありわかっていないことが多い。と言うのも、様々な細胞が混在する組織の中で未分化な介在ニューロンを特定することが困難なためだ。
この問題を、MGEで増殖する未熟介在ニューロンを特定する分子マーカーを用いて解決し、14週から39週までの人間の胎児脳内で介在ニューロンが増殖分化する様子を詳しく観察したのが1月28日にScienceに発表されたカリフォルニア大学サンフランシスコ校からの論文だ。
このような研究が可能なのは、死亡した胎児脳組織の利用が許されているからで、LGEとMGEでは異なる介在ニューロンが造られていること、そしてMGEでは未熟な介在ニューロンの幹細胞が細胞塊を形成して細胞を作り続け、この塊を離れた細胞が分化を始めて脳内に移動する様子が克明に記述されている。
重要なのは、周りの組織の密接な指示に従って増殖・分化する興奮ニューロンと異なり、未熟介在ニューロンは細胞集塊形成が始まると独自に増殖環境が出来る点で、この塊から離れることで、自動的に細胞分化と移動が始まるシステムができあがっている。
このことは、未熟介在ニューロンを生きた幹細胞のマウス胎児脳へ移植する実験で、明確に示すことが出来る。ヒト胎児組織から未熟介在ニューロンを取り出し、胎児脳に移植すると、移植されたマウスが生まれてからも1年以上生き残り、生後90日目まではマウスの脳内で増殖し続けることが示されている。さらに、マウス脳内でも増殖細胞の塊から離れた細胞が分化し移動することも観察できる。
この発見は、ASDでの介在ニューロン機能を調べる将来の研究にとって重要だ。もしASDで介在ニューロンの発生に変化があるとすると、未熟な介在ニューロンさえ手に入れば、その変化を細胞レベルで研究できる可能性が生まれた。個体を分子レベルで研究するためには、細胞レベルの実験系が欠かせない。
この研究ではヒト細胞のマウス脳への移植が方法として用いられたが、試験管内オルガノイド培養(脳組織と似た立体培養)を用い、介在ニューロン発生をて再現することも可能だ。このことを示すのが、つぎに紹介するオーストリア科学アカデミー研究所からの論文だ。
最初の論文では、正常発生でも、未熟介在ニューロンはあたかもガンのように自律的に増殖していることが示された。これは発生過程と発ガン過程が紙一重であることを教えてくれる。2番目の論文は、mTOR と呼ばれる細胞内代謝の核になる分子の活性が上昇することで、介在ニューロンのもつ自律的増殖能力の抑制が効かなくなり、結節性硬化症として知られる多発する良性腫瘍が生まれることを示した重要な貢献だ。
結節性硬化症とは、mTORの機能を調節するTSC遺伝子が片方の染色体から失われることで、胎児や乳児の全身に様々な良性腫瘍が発生する遺伝病だ。脳内では上衣下巨細胞性星細胞腫(舌を噛みそうな専門用語なので気にしないで読み飛ばして)と呼ばれるグリア腫瘍とともに、皮質内に結節が発生する。患者さんは腫瘍だけでなく、ASD症状やてんかんを発症することが知られており、結節性硬化症でも介在ニューロンの発生異常が背景にあるのではと疑われていた。腫瘍形成については、TSC遺伝子の機能が失われることで腫瘍が発生する典型的ガン抑制遺伝子欠損による腫瘍で、TSCの発現が低下し、mTORが過剰に活性化することで、腫瘍が発生すると考えられている。
この研究の目的は、まず結節性硬化症でおこる皮質内結節(Cortical Tuber)を試験管内で再現することだ。この目的のために、著者らはTSC2遺伝子が半分欠損している2人の患者さん由来iPSを樹立。オルガノイド培養法を用いてiPSから脳組織を誘導し、患者さんと同じ皮質内結節が形成されるか調べている。このとき患者さんのiPS細胞の遺伝子変異を、クリスパー遺伝子改変技術を用いて正常化し、コントロールとして用いている。これにより、遺伝的に多様な人間とはいえ、一つの遺伝子だけに着目してその機能を調べることができる。
結果だが、培養開始後90日目まで、TSC2欠損の影響はほとんど見られないが、オルガノイドの成熟が徐々に進み110日目になると、TSC欠損グループでは結節性の増殖が高まることが明らかになった。さらに結節の細胞の性質を詳しく見てみると、ほぼ全てが先の論文で紹介した3つのGEのうち尾側GE(CGE)で増殖する未熟介在ニューロン(CLIP)に対応することが明らかになった。すなわち、介在ニューロンが皮質に移動しても増殖を続けることで皮質内結節が発生する。
正常の介在ニューロンが元々高い増殖力を有することはすでに見た。しかしこのように高い増殖力があっても皮質内結節は発生しない。なのに、mTORの活性を抑えるTSCの発現が半分になるだけで皮質内結節が100%起こってしまうのかについては次のように説明される。
未熟介在ニューロンでは増殖に必要な高いmTOR活性を維持するため、もともとTSCの発現が低く抑えられている。すなわち、腫瘍と紙一重の状況にある。そこに片方の染色体のTSCが欠損してしまうと、CLIPのmTOR発現はさらに高いレベルに変化し、腫瘍性結節が形成されることになるわけだ。
以上、これまで謎の多かった結節性硬化症の皮質内結節の由来が明らかにされ、これがCGE由来介在ニューロン発生過程異常として理解できるようになったことは、ASDの理解にも重要なヒントになる。
まず結節性硬化症の患者さんで、皮質内結節とともにてんかんやASDが高発することは、ASDが介在ニューロンの発生異常に起因することを示している。 患者さんではmTORの活性がさらに高まった結果、脳内で作られる未熟介在ニューロンの数は増えていると思われるのに、生まれてきた患者さんでは、てんかんのように介在ニューロンの活性低下が起こっている。すなわち、いくら未熟介在ニューロンの数が増えても、正常分化が起こらないと介在神経欠乏になる。 TSC欠損の影響は他の介在ニューロンに見られてもいいのに、CGE由来介在ニューロンだけで異常が見られることは、介在ニューロンの発生過程が多様であることを示しており、ASDを理解する上でも、介在ニューロン分化の多様性を頭に置いておく必要がある。 ただ、試験管内の実験系がそのまま人間のASD発生過程を反映できるかはまだまだ分からない。これらを裏付けるかのような研究が、最後に紹介したいハーバード大学からの研究だ。
欠損すると巨頭症の様な脳の発生異常とともにASDを併発することが知られている3種類の遺伝子、SUV420H1、ARID1B、CHD8に着目し、これら遺伝子欠損に見られる共通の障害を脳のオルガノイド培養を用いて調べた研究で、2月10日Natureにオンライン掲載された。
この研究が注目した3種類の遺伝子は、遺伝子発現を調節するクロマチンの調節に関わる遺伝子で、TSCのように直接細胞増殖に関わる遺伝子ではない。しかし、欠損すると巨頭症などの発生障害とともにASDを発症する。すなわち、ASDを発症させる共通の発生異常が起こると考えられる。
研究の目的は、ASDにつながる共通の発生異常を再現し、メカニズムを解析することだ。このために、それぞれの遺伝子を、同じiPS細胞株で欠損させ、欠損細胞の脳オルガノイド培養を行い、そこで見られる異常を調べている。
人間の脳のオルガノイド培養と簡単に述べているが、この研究でもなんと6ヶ月以上、人間の胎児発生と同じぐらいの時間をかけた培養で、大変な努力だ。
詳細は省いて結論だけを述べると、
3種類の遺伝子が関わる過程は異なってはいるが、最終的にはオルガノイドの中のGABA抑制性細胞の比率を増加させる点で共通している。 オルガノイド内の抑制性ニューロン増加を反映して、オルガノイド中の興奮神経の活動が抑制される。 この結果も、ASDに介在ニューロン発生異常が存在するという点では共通だが、少なくともオルガノイドの中では、介在ニューロン優性の現象、すなわちニューロンの興奮抑制が起こっているという点で、以前このHPで紹介した(https://aasj.jp/news/autism-science/18807 )、ASD児の脳を典型児と比べると、抑制性ニューロンの数が低下しており、脳が過興奮の状態にあるとする結論と異なっている。
詳しくは調べていないが、SUV420H1変異の児童でもてんかんを発症することが知られており、時間がたつと抑制ニューロン優性から、欠乏へと変化する可能性はある。
また介在ニューロンの過剰、欠乏の両方で同じASDやてんかん症状が出ると考えることもできる。実際、MECP2遺伝子の欠損(Rett症候群)と過剰のMECP2重複症は、ともにASDとてんかんを示す。 このように、発生過程と、実際の患者さんでの脳までにはまだまだわからないことは多い。しかし抑制性介在ニューロンはASDの重要な標的細胞として確立したことは確かだ。
2022年2月16日
樹状細胞(DC)は組織に定着して抗原を補足したあと、移動してリンパ球に抗原を提示する役割がある。この時ランゲルハンス細胞のように皮膚組織からリンパ組織まで移動する細胞もあるし、リンパ組織内で抗原を捕まえた後、濾胞まで移動してそこに定着する濾胞DCまで存在する。例えば皆さんが注射しているmRNAワクチンは直説所属リンパ節の濾胞DCに取り込まれることが知られている。このように、樹状細胞の機能発現には移動や定着の調節が重要だが、そのメカニズムはまだまだわかっていないことが多い。
今日紹介するカリフォルニア大学サンフランシスコ校からの論文は、脾臓に存在する2型樹状細胞(DC2)の脾臓内での定着のメカニズムを詳細に至るまで解明した素晴らしい研究で2月11日号のScienceに掲載された。責任著者のJason Cysterは個人的にも知っているが、彼らしいさすがと思える論文で久しぶりに彼を思い出した。タイトルは「CD97 promotes spleen dendritic cell homeostasis through the mechanosensing of red blood cells(CD97は赤血球の機械センサーとして働いて脾臓の樹状細胞ホメオスターシス維持を促進している)」だ。
脾臓は骨髄と同じで血管が組織に開いており、これにより出来た細胞を再び血中へ送る造血組織としての働きが出来る。また、血中に流れてくるバクテリアなど粒子抗原を補足するためにもこの構造は重要で、そのため類洞と呼ばれる領域には樹状細胞が並んでおり、Gα13やArhGEF1分子シグナルが類洞のDC2維持に必須であることが推定されていた。
この研究ではまずGα13シグナル経路が欠損すると、DC2が類洞に維持できないことを確認した後、Gα13と共役している受容体をクリスパーノックアウトを用いてスクリーニング。最終的にCD97を特定している。
このCD97は面白い分子で、G共役型の受容体によく見られる自分で自分を活性化する自己活性化型受容体だ。タンパク質が発現するとN末が切断されたあと、自己活性化出来る部位をカバーする。このカバーを引き剥がすと、自己活性化部位が受容体を活性化することでシグナルが入る。
この発見が研究のハイライトで、後は、カバーを剥がすシグナル、定着のメカニズム、定着の必要性、そしてCD97を発現させるシグナルを丁寧に実験的に明らかにしている。膨大なデータなのでシナリオだけを箇条書きで紹介する。
1)CD97の発現はIRF4と呼ばれるインターフェロン反応性因子により調節されており、炎症状態を感知してDC2を脾臓に待機させる役割がある。
2)CD97は、Gα13シグナルを活性化し、細胞骨格に働くことで、DC2の血中への移動を抑えており、このシグナルが低下すると、DC2は脾臓を離れる。
3)DC2上のCD97刺激は、赤血球が発現するCD55により媒介される。すなわち、赤血球上のCD55と結合したCD97のN末カバーは、赤血球が流れるため引き剥がされる。その結果自己活性化部位が露出し、CD97が活性化される。
4)このシグナルが欠損して脾臓DC2の数が低下すると、粒子状抗原に対する反応が低下する。
まとめてしまうとこれだけだが、実際には赤血球がCD97カバーを引き剥がす実験や、DC2の移動についての体内でのライブイメージング、さらには赤血球の流れの必要性を調べるための脾臓血流遮断実験など、さすがJasonと思える研究だ。しかし、このようなメカノセンシングが必要な状況は数多くあるだろう。今後の発展が期待できる。
2022年2月15日
男女の差だけでなく、性ホルモンが様々な行動を支配しているのは、誰もが実感するところだ。思春期、更年期、月経周期、妊娠など、様々な状況で気分や行動が変化する。これは限られたホルモンに対する神経細胞の違い、すなわち神経細胞の遺伝子発現の違いによる、細胞や神経細胞ネットワークレベルの変化に起因するのだが、これほど多様な感情や行動変化が、どの細胞でどの遺伝子により誘導されているのかを調べるのは簡単でない。
今日紹介するスタンフォード大学からの論文は、これまでの研究で、オスメスの差や発情周期に関わることが知られている分界条床核、扁桃体、視床前核、そして視床下部副内側部(以後VMH)での、オスメス、あるいは発情周期での遺伝子発現の違いを特定し、特にそれぞれの条件で発現の違いが大きい神経細胞を特定して、それぞれの神経の性行動への関わりを調べた研究で、2月17日号のCellに掲載された。タイトルは「A functional cellular framework for sex and estrous cycle-dependent gene expression and behavior(性と発情サイクルによる遺伝子発現と行動の変化を規定する機能的細胞の枠組み)」だ。
それぞれの領域でのオスメスの遺伝子発現の差、およびメスの発情期での遺伝子発現の差を、リボゾームと結合した現在翻訳中のRNAの発現を調べた後、今度はsingle cell RNAseqを用いて遺伝子発現の差がどの細胞に現れるのか調べている。
ともかく1500近い遺伝子が性や発情期に応じて変化する。今後、これら遺伝子の機能と行動への関わりを機能的に調べることが重要になるが、この論文ではまず手始めとして、発症に強い性バイアスがある自閉症と相関が認められている遺伝子リストと比べ、209種類のASDリスク遺伝子の中の39種類が、性による発現レベルの変化が見られることを示している。ただ、これ以上の解析はされていない。
この研究ではそれぞれの遺伝子の機能について調べるより、これら遺伝子の発現の差が強く反映されている細胞を特定することに集中して、最終的に分界条床核のタキキニン分泌細胞、およびVMHのタキキニン受容体陽性細胞を特定、この神経機能を遺伝子操作を用いて抑える実験を行い調べている。
分界条床核のタキキニン陽性細胞は全てGABA介在ニューロンで、遺伝子発現のオスメスの違いが大きいが、発情期による違いはほとんどない。この神経を遺伝子操作で特異的に抑えると、オスはメスへの指向性を失い、生殖行動や、オス特有の攻撃性が失われる。
VMHのタキキニン受容体陽性細胞は、グルタミン酸作動性興奮ニューロンで、この神経興奮を遺伝子操作で抑えると、発情期の性行動が抑えられ、相手を拒否する確率も高まる。一方、タキキニン陰性細胞の興奮を抑えると、母親としての攻撃性が消失することが明らかになった。
主な結果は以上で、この研究から、メーティングや、子育てに重要な行動が、たった一種類の細胞により支配されることが明確に示された。今回は性別や発情期で大きな遺伝子発現の差がある細胞のみを選んで調べているが、程度はまちまちだが、他にも多くの細胞が特定されている。先は長いが、まだまだ面白い男女のさがわかるのではと期待している。
2022年2月14日
最近新型コロナウイルス感染に関する研究は、疫学を別にすると、スピード重視で、大変な実験をやっているなという実感が得られる論文は少ない。ただ、これらの実験はどうしても現象論にとどまり、感染の将来を予測出来るぐらいの研究となると、要求されるレベルが違う。
今日紹介するFred Hutchinson癌研究所からの論文は、トップジャーナルに溢れる新型コロナウイルス関連の論文の中でも、力作としては群を抜いており、新型コロナウイルスが進化してきた過程を、スパイクとACE2との結合という機能的側面から検討した研究で2月3日Natureにオンライン掲載された。タイトルは「ACE2 binding is an ancestral and evolvable trait of sarbecoviruses(ACE2結合性はサベルコウイルスの祖先が持っていた進化可能性の高い形質)」だ。
一般に分子進化の研究というと、遺伝子配列決定で終わる。ただ選択による進化を考えるためには、それぞれの変異体の機能を詳しく見る必要がある。この研究では、45種類のサルベコウイルスのスパイクにあるRBD領域をクローニング、酵母の表面に発現させ、ヒト、ジャコウネコ、センザンコウ、マウス、そして4種類のコウモリのACE2との結合を調べている。
45種類のサルベコウイルスは、Cov2型、Cov1型、アジア型、そしてアフリカ/ヨーロッパ型(AE型)に分けられるが、Cov1、Cov2、AE型にはいずれかのACE2に結合性が見られる。一方、アジア型はどのウイルスも全くACE2に結合しない。この機能解析から、おそらくサルベコウイルスの先祖はACE2結合性を有し、アジア型が分かれたときにACE2結合性が失われたことを示唆している。
これを確かめるため、現在有るウイルスの配列から先祖の持っていた配列を推定する方法を用いて、サルベコウイルス全体の祖先、Cov1,Cov2, アジア型3系統の祖先、そして3系統それぞれの祖先配列を割り出し、さらに先祖型遺伝子を再構成して、ACE結合性を調べている。結果は予想通りで、サルベコウイルス全体の祖先型はコウモリのACE2に結合、そして三系統祖先型はヒト、センザンコウ、コウモリ2種のACE2に結合することがわかった。
一方アジア型先祖はどのACE2とも反応せず、Cov1から分かれた後で、ACE2への結合性を失ったことが証明されたが、この配列から一部のアミノ酸配列を欠損させると、ヒトACE2への結合が回復することも示している。
以上のことから、コロナウイルスがサルベコウイルスへ進化する前に、コウモリのACE2への結合を獲得し、その後変異を繰り返しながら感染するレパートリーを変化させていったことがわかる。
このように、ACE2結合性は、かなりの多様性を発生させられる余地のある配列を持つことが予想されるが、これを確かめるため、再構築されたそれぞれの先祖方を含む14種類のACE結合サイトの可能なアミノ酸配列を全て変異させた、各1500種類の変異配列を再構成し、それぞれの動物のACE2と結合を調べる膨大な実験を行っている。結果は、Cov2,、Cov1型ではほとんどの変異がタンパク質として再構成でき、レパートリーや親和性の異なる結合性を示すことを明らかにしている。すなわち、まだまだ様々なタイプの受容体結合性が進化可能であることを示している。
また、普通人間のACE2とは結合しないAE型も、変異が入ると弱いながらも結合力が発生することも示している。さらに、最近になって発見された新しいAE型や、さらに新しい型に属するサルベコウイルスもACE2に結合することを示している。
結果は以上で、サルベコウイルスの受容体結合ドメインとACE2との結合性がダイナミックに変化しうることが再認識され、今後も様々な新しいウイルスが感染症として現れる可能性が高いことがよくわかる、将来に向いた優れた研究だと思う。
今後はスパイクだけで無く、メインプロテアーゼのような分子の進化を調べて、感染後の治療可能性も調べる必要があると思う・新型コロナウイルスに対してはスピード感を持って必要な情報を得ることが出来るようになっているが、今後はこの論文のような将来に備える研究が重要になる。
2022年2月13日
私たち日本人にはあまりなじみがないが、今回のパンデミックが始まるまで、世界的にはエボラウイルス感染が最も注目を集める感染症の一つだった。私たちも、ウガンダ旅行を計画しているちょうどその頃、コンゴ国境地域でエボラウイルス感染が起こったことを聞いた。感染症の性質上ほとんど旅行には問題ないと勝手に決めて、結局ウガンダ旅行を強行したが、国境の検問を厳しくするのか、山岳地帯に行進していく軍隊も目にした。
このとき、なぜエボラウイルス(EV)感染が繰り返し起こるのか気になった。症状の強さから考えて、感染が続いておれば気づくはずだ。とすると、動物が媒介するか、あるいは無症状のまま感染が維持される可能性があるということだ。
実際、今日紹介する米国陸軍研究所からの論文を読むと、感染者から回復した男性の精液にはウイルスが長期間維持されていたのが報告されており、また快復後再発するケースもあるようだ。この研究では、回復して血中からウイルスが消えた後、どこにウイルスが隠れているのか、感染実験に使ったサルを用いた研究で2月9日Science Translational Medicineに掲載された。タイトルは「Ebola virus persistence and disease recrudescence in the brains of antibody-treated nonhuman primate survivors(抗体治療を受け快復したアカゲザルの脳でエボラウイルスは維持され、再発を起こす)」だ。
米国ではエボラ治療実験が、多くのサルを用いて行われているようだ。この研究では、米軍感染症研究所で、モノクローナル抗体治療の効果を確かめるために用いたアカゲザルを、快復後30日間健康状態がそのまま維持されるか調べた後、安楽死させ、全身にウイルスが残存していないか調べている。
結論はシンプルで、36匹の快復サルのうち、7匹は血中のウイルスが検出されなくなったものの、脳内にはウイルスが存在し、様々な細胞が浸潤する炎症も起こっている。さらに、一例では再発により死亡することも示された。すなわち、多くは完全に回復するが、一部の例では、特に脳にEVが残存している。
ウイルスゲノムが複製された側の遺伝子の存在を調べることでウイルスが複製されているかを調べると、ゲノムとともにアンチゲノムも同時に検出できることから、潜在期間中もウイルスの複製が維持されていることを示している。重要なことは、このような快復後の感染は、脳以外では見られず、脳で感染が持続している点だ。
ではどの細胞にウイルスが感染しているのか、より詳しく見てみると、ほぼ全てが脳室細胞とCD68陽性のマクロファージであることがわかる。このように、脳室周囲のマクロファージが主にウイルスリザバーのとして機能する理由を探るため、ウイルスを感染させ、病気が発症したとき、脳のどの細胞がウイルスに感染するのかを調べている。その結果、病気進行中は脳脊髄液を作っている脈絡膜の血管内皮に感染していること、しかし脳内には感染がないことを確認している。
以上の結果から、EV感染によって病気が進行すると、脳脈絡膜の血管内皮にまでウイルス感染が波及し、この内皮からマクロファージがウイルスを取り込み、その後レザバーとしてウイルスの緩やかな増殖を維持させるというシナリオだ。
おそらく多くのケースでは、T細胞免疫が誘導されて脳内でもウイルス産生細胞が除去されるのだろうが、サルで確実に遷延感染があることを示す結果は重要だ。徐々に治療法が確立してきていることを考えると、感染者の定期的フォローアップの重要性を示している。
翻って、コロナでも同じような遷延感染があるかどうかは調べる価値がある。特にマクロファージが感染している例は多く報告されているので、脳についても今後機会を捉えて調べていくことは重要だと思う。
2022年2月12日
P53遺伝子欠損は、最もよく知られた発ガンの条件で、多くのガンで欠損が見られ、また遺伝的欠損を持つ家系では様々なガンの発生率が上昇する。これは、p53が多様な遺伝子に働く転写因子として、DNA修復、細胞周期調節、そして細胞死調節と、発ガンに深く関わる細胞活動に関わっているからだが、最近になって老化や細胞競合など、さらに重要な機能に関わることが明らかになっており、研究のしがいがある底が深い分子だ。
今日紹介する英国・ブリストル大学からの論文は、MDCKと呼ばれる細胞生物学で最も使われている細胞株を用いて、p53が上皮細胞層が損傷を受けたとき、上皮層から真っ先に飛び出して、残る上皮を誘導し、上皮層の修復を行うリーダー細胞を誘導する分子であることを示した研究で、読んでみると上皮層の修復が老化と密接に関わることがわかる面白い論文だった。タイトルは「p53 directs leader cell behavior, migration, and clearance during epithelial repair(p53はリーダー細胞の行動、移動、そして上皮修復後の除去に関わる)」で、2月11日号のScienceに掲載された。
上皮が傷害されたとき、辺縁全体が上皮間質転換を起こして対岸に向かって移動すると勘違いしていたが、実際には辺縁に存在する細胞の中からリーダー細胞が自然発生し、これが対岸へ移動しながら上皮修復を主導するらしい。
著者らは、上皮修復をビデオで観察し、リーダー細胞には2核細胞が多いなど、細胞周期の異常が見られることから、p53の発現が上昇しているのではと思いつく。そしてp53の発現を調べてみると、予想通りリーダー細胞ではp53の発現が上昇していることを発見する。この発見が研究の全てで、p53が特定されると後は研究は自動的に進む。
とはいえ、細胞学ならではの自由な実験が行われている。例えばp53の発現がリーダー細胞誘導の十分条件であることを示すために、ラベルしたMDCK細胞にp53を過剰発現させ、それを正常上皮細胞培養に加えると、上皮層の辺縁でしっかりリーダー細胞として働くことを、ビデオを用いて示している。
もちろんクリスパーを用いる遺伝子操作は自由自在だし、分子阻害剤も培養だと使いやすい。それらを組み合わせて培養し、行動を観察できるので、様々な可能性をテストできる。その結果、以下のシナリオが実験的に示されている。
上皮損傷の場合、細胞へのストレスがp38MAPキナーゼを解する経路で、p53を誘導する。 p53が誘導されると、細胞周期阻害因子p21が誘導される。 p21によりCDKが阻害されることで、細胞周期が止まるとともに、移動やインテグリンの発現など、リーダー細胞へと分化が進む(実際CDK阻害剤でもリーダー細胞が誘導される。 ただ、p53はp21を発現させればお役御免ではなく、修復が完成した後、必要がなくなったリーダー細胞を上皮層から除去する、最後のお役目がある。 以上が結果で、リーダー細胞誘導には、まさに私たちが細胞老化として知っているプロセスが全て関わっていることがよくわかる。そこで、リーダー細胞の身になって結論をまとめると次のようになる。
細胞社会にストレスが加わると、老化細胞が出現して、社会が修復される方向に導く。そして社会が修復され役目が終わると、自ら消え去っていく。これは人間社会で高齢者に求められている役割とも重なる。細胞の実験では、p21がそのまま発現し続けると、リーダー細胞が社会の中でのさばって、上皮層を乱すことが示されているが、同じような細胞にならないよう、私たち老人に様々なことを思い起こさせる、少し寂しくなる論文だった。
2022年2月11日
我が国に限らず、今世界中でいわゆる激甚自然災害といえる災害が増加しているように思う。以前から、このような災害に見舞われた方々が、精神的な苦しみだけで無く、身体的にも様々な変調に見舞われるため、対策が求められている。以前から、この変調は早まった老化によるという説得力のある説が存在するが、災害は予告なく襲ってくるので、その前後で必要なデータがとれている研究は少ない。また、人間の場合、遺伝的、環境的にあまりにも多様性が大きく、純粋に災害による影響を抽出することは簡単でない。
今日紹介するワシントン大学からの論文は、定期的に血液検査が続けられてきた、プエルトリコにある小さな島に住むアカゲザル集団を、巨大ハリケーンが島を襲った前後で比べることで、この問題にチャレンジした研究で2月7日米国アカデミー紀要にオンライン掲載された。タイトルは「Natural disaster and immunological aging in a nonhuman primate(サルに見られる自然災害による免疫老化)」だ。
写真で見ても本当に小さな小島に生息するアカゲザルの生態調査を続けていたというのがこの研究の全てだと思う。サルにとっては迷惑なことだが、観察する人間にとって、この島をハリケーンマリアが2017年に襲ったことは、思いもかけず災害の影響を調べるチャンスになった。
このハリケーンは、島の緑を50%以上奪ってしまうほどのもので、ハリケーンに襲われている時間だけで無く、サルのその後の生活自体に、長く続く様々な問題をもたらせたと考えられる。
この島には1800頭あまりのサルが常時生息しており、そのうち400頭あまりは個体識別され、定期的に血液検査が行われている。これまでの検査結果を、サルの年齢ごとにプロットすると、例えば自然免疫に関わる分子のように年齢とともに上昇するものと、翻訳やheat shock proteinのように年齢とともに低下する分子が存在し、年齢と比例して増加、あるいは低下することがわかっていた。これらの変化は人間を含む多くの動物で確認されている変化だ。
島がハリケーンに襲われた後サンプリングできた100頭あまりのサルについて、ハリケーン前後でこれらの指標を検査すると、老化によって上昇する分子の発現は上昇し、また老化に応じて低下する分子は低下していることが明らかになった。
それらの値から計算してみると、サル年齢で1.8歳、人間に換算するとなんと8歳前後老化が早まったことを意味し、自然災害とそれに続く大きな環境変化が老化を早めることが明らかになった。
以上が結果で、地道な生態観察からしか出来ない研究があることを示すいい例だが、この数字を見ると、激甚自然災害の医学を進める重要性を再認識する。